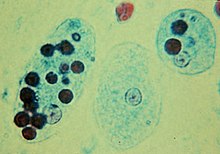
식세포증
PhagocytosisPhagocytosis (from Ancient Greek φαγεῖν (phagein) 'to eat', and κύτος (kytos) 'cell') is the process by which a cell uses its plasma membrane to engulf a large particle (≥ 0.5 μm), giving rise to an internal compartment called the phagosome.그것은 세포내막증의 한 종류이다.식세포를 하는 세포는 식세포라고 불린다.
다세포 유기체의 면역 체계에서, 식세포증은 병원균과 세포 부스러기를 제거하는 데 사용되는 주요 메커니즘이다.그리고 나서 섭취한 물질은 파고솜에서 소화된다.박테리아, 죽은 조직 세포, 그리고 작은 광물 입자들은 모두 식세포화 될 수 있는 물체의 예이다.몇몇 원생동물들은 영양분을 얻기 위한 수단으로 식세포증을 이용한다.
역사
식세포증은 캐나다 의사 윌리엄 오슬러에 의해 처음 발견되었고, 후에 엘리 메츠니코프(1880,[1] 1883)[2]에 의해 연구되고 명명되었다.
면역 체계에서
식세포증은 선천적인 면역 방어의 주요 메커니즘 중 하나이다.그것은 감염에 반응하는 첫 번째 과정 중 하나이며 적응 면역 반응의 시작 분기 중 하나이기도 합니다.대부분의 세포들이 식세포작용을 할 수 있지만, 일부 세포들은 주요 기능의 일부로 식세포작용을 수행한다.이것들은 '전문 식세포'라고 불린다.식세포증은 무척추동물에도 [3]존재하며 진화적으로 오래되었다.
전문 식세포
호중구, 대식세포, 단구, 수상세포,[2] 골아세포 및 호산구는 전문 식세포로 분류할 수 있다.처음 세 가지는 대부분의 [3]감염에 대한 면역 반응에서 가장 큰 역할을 한다.
호중구의 역할은 감염 시에만 혈류를 [3]순찰하고 많은 수의 조직으로 빠르게 이동하는 것이다.그곳에서는 식세포에 의한 직접적인 살균 효과가 있다.섭취 후 호중구는 병원균의 세포 내 살인에 효과적이다.호중구 식세포는 주로 Fc receptors 수용체를 통해 이루어지며 수용체 1과 3을 보완한다.호중구의 살균 효과는 미리 형성된 과립에 존재하는 분자의 큰 레퍼토리에 기인한다.이들 과립에서 제조된 효소 및 기타 분자는 콜라겐화효소, 젤라틴화효소 또는 세린단백질화효소, 미엘로페르옥시다아제, 락토페린 및 항생제 단백질과 같은 단백질이다.이것들을 파고솜에 탈과립시키는 것은 높은 활성 산소종 생성(산소 버스트)을 수반한다.[4]
단구, 그리고 그것들로부터 성숙하는 대식세포는 조직을 통해 이동하기 위해 혈액순환을 남깁니다.거기서 그들은 상주 세포로 [3]휴식 장벽을 형성한다.대식세포는 만노스 수용체, 스캐빈저 수용체, Fcγ 수용체에 의한 식세포증을 개시하고 수용체 1, 3, 4를 보완한다.대식세포는 수명이 길고 새로운 리소좀을 [3][5]형성함으로써 식세포증을 지속할 수 있다.
수지상 세포는 또한 조직에 상주하며 식세포증으로 병원균을 섭취한다.그들의 역할은 미생물을 죽이거나 제거하는 것이 아니라 적응 면역계의 [3]세포에 항원을 제시하기 위해 미생물을 분해하는 것이다.
수용체 개시
식세포증에 대한 수용체는 인식된 분자에 의해 두 가지 범주로 나눌 수 있다.첫 번째 옵소닉 수용체는 옵소닌에 [6]의존합니다.이러한 수용체 중에는 결합 IgG 항체의 Fc 부분을 인식하는 수용체, 퇴적된 보체 또는 수용체, 세포 또는 혈장 기원의 다른 옵소닌을 인식하는 수용체가 있다.비광음속 수용체에는 렉틴형 수용체, 덱틴 수용체 또는 스캐빈저 수용체가 포함된다.일부 식세포 경로는 병원체 관련 분자 패턴(PAMPS)에 부착하여 활성화되는 패턴 인식 수용체(PRR)의 두 번째 신호를 필요로 하며, 이는 NF-δB [2]활성화를 유도한다.
Fcγ수용체
Fcγ 수용체는 IgG 코팅 표적을 인식한다.인식되는 주요 부분은 Fc fragment입니다.수용체의 분자는 세포 내 ITAM 도메인을 포함하거나 ITAM을 포함하는 어댑터 분자와 관련된다.ITAM 도메인은 식세포 표면에서 핵으로 신호를 전달합니다.예를 들어 인간 대식세포의 활성화 수용체는 FcriRI, FcriRIIA, FcriRII이다.[5]Fc receptor 수용체 매개 식세포증은 '식세포 컵'이라 불리는 세포의 돌출 형성을 포함하고 호중구의 [4]산화적 폭발을 활성화한다.
보체수용체
이러한 수용체는 혈장 보체의 C3b, C4b 및 C3bi에 코팅된 표적을 인식한다.수용체의 세포외 도메인은 렉틴 유사 보체 결합 도메인을 포함한다.보체 수용체에 의한 인식은 추가 신호 없이 내부화를 일으키기에 충분하지 않다.대식세포에서 CR1, CR3 및 CR4는 목표물의 인식을 담당합니다.보체 코팅 타깃은 [5]돌기 없이 식세포막에 '침입'함으로써 내부화된다.
만노스 수용체
만노스 및 푸코스와 같은 다른 병원체 관련 당은 만노스 수용체에 의해 인식된다.8개의 렉틴 유사 도메인이 수용체의 세포외 부분을 형성한다.만노스 수용체에 의해 매개되는 섭취는 분자 메커니즘에서 Fc receptor 수용체 또는 보체 수용체 매개 식세포증과 [5]구별된다.
파고솜
액틴-미오신 수축계통에 의해 물질의 흡수가 촉진된다.파고솜은 물질의 식세포작용에 의해 형성되는 세포소기관이다.그런 다음 식세포의 중심체 쪽으로 이동하고 리소좀과 융합되어 식세포를 형성하고 분해로 이어집니다.서서히 식중독이 산성화되어 분해효소를 [2][7]활성화한다.
분해는 산소에 의존하거나 산소에 의존하지 않을 수 있습니다.
- 산소의존성 열화는 NADPH와 활성산소종의 생산에 따라 달라진다.과산화수소와 미엘로페르옥시다아제는 할로겐화 시스템을 활성화시켜 차아염소산염의 생성과 박테리아 [8]파괴로 이어진다.
- 산소 비의존성 분해는 리소자임과 같은 효소와 데펜신과 같은 양이온성 단백질을 포함하는 과립의 방출에 따라 달라집니다.다른 항균성 펩타이드는 락토페린을 포함한 이러한 과립에 존재하며, 이는 박테리아에게 불리한 성장 조건을 제공하기 위해 철분을 분리한다.히알루로니다아제, 리파아제, 콜라게나제, 엘라스타제, 리보핵산가수분해효소, 디옥시리보핵산가수분해효소 같은 다른 효소들 또한 세포사망으로 [4][5]이어지는 필수 미생물 생체분자의 분해를 예방하는 데 중요한 역할을 한다.
백혈구는 식세포증 동안 시안화수소를 생성하며, 몇 가지 다른 독성 [9][10][11]화학물질을 생성함으로써 박테리아, 곰팡이, 그리고 다른 병원체들을 죽일 수 있다.
Treponema pallidum, Escheria coli 및 황색포도상구균과 같은 일부 박테리아는 몇 가지 메커니즘에 의해 식세포증을 피할 수 있다.
아포토시스 중
아포토시스 이후에, 죽어가는 세포들은 대식세포에 의해 주변 조직으로 흡수될 필요가 있다.아포토시스 세포의 특징 중 하나는 세포 표면에 칼레티쿨린, 포스파티딜세린(플라즈마막 내층), 아넥신 A1, 산화LDL 및 [12]변화된 글리칸과 같은 다양한 세포 내 분자의 발현이다.이러한 분자는 포스파티딜세린 수용체와 같은 대식세포 표면의 수용체 또는 트롬보스폰딘 1, GAS6, MFGE8과 같은 수용성(자유 부유성) 수용체에 의해 인식되며, 그 자체가 대식세포의 다른 수용체(CD36 및 α-v 베타-3in 등)에 결합한다.아포토시스 세포 클리어런스의 결함은 보통 대식세포의 식세포 장애와 관련이 있다.아포토시스 세포 잔여물의 축적은 종종 자가면역 장애를 야기한다. 따라서 식세포증의 약리학적 강화는 특정 형태의 자가면역 [13][14][15][16]장애를 치료하는데 의학적인 잠재력을 가지고 있다.
프로테이터의 경우
많은 원생동물들에게 식세포증은 영양의 일부 또는 전부를 공급하면서 먹이를 주는 수단으로 사용된다.이것은 흡수에 [citation needed]의해 일어나는 삼투압 영양과는 구별되는, 식육 영양이라고 불립니다.
- 아메바와 같은 일부에서는 동물의 식세포와 같이 대상 물체를 의사동물로 둘러싸면서 식세포증이 일어난다.인간의 경우 아메보아 엔타메바 조직용해균은 적혈구를 식세포화할 수 있다.
- 섬모충은 [17]식세포증에도 관여한다.섬모세포에는 세포세포증(cytostome) 또는 구강(口ost)이라고 불리는 식세포증(phagocytosis)이 일어나는 세포 내에 특수한 홈이나 방이 있다.
식세포 면역세포와 마찬가지로 생성된 식세포는 소화효소를 포함한 리소좀(식품포)과 결합되어 식세포를 형성할 수 있다.음식 입자는 소화될 것이고, 방출된 영양소는 다른 [18]대사 과정에서 사용하기 위해 세포로 확산되거나 운반된다.
혼합 영양은 식영양 영양과 광영양 [19]영양을 포함할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Ambrose, Charles T. (2006). "The Osler slide, a demonstration of phagocytosis from 1876: Reports of phagocytosis before Metchnikoff's 1880 paper". Cellular Immunology. 240 (1): 1–4. doi:10.1016/j.cellimm.2006.05.008. PMID 16876776.
- ^ a b c d Gordon, Siamon (March 2016). "Phagocytosis: An Immunobiologic Process". Immunity. 44 (3): 463–475. doi:10.1016/j.immuni.2016.02.026. PMID 26982354.
- ^ a b c d e f M.), Murphy, Kenneth (Kenneth (2012). Janeway's immunobiology. Travers, Paul, 1956-, Walport, Mark., Janeway, Charles. (8th ed.). New York: Garland Science. ISBN 9780815342434. OCLC 733935898.
- ^ a b c Witko-Sarsat, Véronique; Rieu, Philippe; Descamps-Latscha, Béatrice; Lesavre, Philippe; Halbwachs-Mecarelli, Lise (May 2000). "Neutrophils: Molecules, Functions and Pathophysiological Aspects". Laboratory Investigation. 80 (5): 617–653. doi:10.1038/labinvest.3780067. ISSN 0023-6837. PMID 10830774.
- ^ a b c d e Aderem, Alan; Underhill, David M. (April 1999). "Mechanisms of Phagocytosis in Macrophages". Annual Review of Immunology. 17 (1): 593–623. doi:10.1146/annurev.immunol.17.1.593. ISSN 0732-0582. PMID 10358769.
- ^ 면역 체계, 피터 팔햄, 갈랜드 사이언스, 제2판
- ^ Flannagan, Ronald S.; Jaumouillé, Valentin; Grinstein, Sergio (2012-02-28). "The Cell Biology of Phagocytosis". Annual Review of Pathology: Mechanisms of Disease. 7 (1): 61–98. doi:10.1146/annurev-pathol-011811-132445. ISSN 1553-4006. PMID 21910624.
- ^ Hemilä, Harri (1992). "Vitamin C and the common cold". British Journal of Nutrition. 67 (1): 3–16. doi:10.1079/bjn19920004. PMID 1547201.
- ^ Borowitz JL, Gunasekar PG, Isom GE (12 Sep 1997). "Hydrogen cyanide generation by mu-opiate receptor activation: possible neuromodulatory role of endogenous cyanide". Brain Research. 768 (1–2): 294–300. doi:10.1016/S0006-8993(97)00659-8. PMID 9369328. S2CID 12277593.
- ^ Stelmaszyńska, T (1985). "Formation of HCN by human phagocytosing neutrophils--1. Chlorination of Staphylococcus epidermidis as a source of HCN". Int J Biochem. 17 (3): 373–9. doi:10.1016/0020-711x(85)90213-7. PMID 2989021.
- ^ Zgliczyński, Jan Maciej; Stelmaszyńska, Teresa (1988). The Respiratory Burst and its Physiological Significance. pp. 315–347. doi:10.1007/978-1-4684-5496-3_15. ISBN 978-1-4684-5498-7.
- ^ Bilyy RO, Shkandina T, Tomin A, Muñoz LE, Franz S, Antonyuk V, Kit YY, Zirngibl M, Fürnrohr BG, Janko C, Lauber K, Schiller M, Schett G, Stoika RS, Herrmann M (January 2012). "Macrophages discriminate glycosylation patterns of apoptotic cell-derived microparticles". The Journal of Biological Chemistry. 287 (1): 496–503. doi:10.1074/jbc.M111.273144. PMC 3249103. PMID 22074924.
- ^ Mukundan L, Odegaard JI, Morel CR, Heredia JE, Mwangi JW, Ricardo-Gonzalez RR, Goh YP, Eagle AR, Dunn SE, Awakuni JU, Nguyen KD, Steinman L, Michie SA, Chawla A (November 2009). "PPAR-delta senses and orchestrates clearance of apoptotic cells to promote tolerance". Nature Medicine. 15 (11): 1266–72. doi:10.1038/nm.2048. PMC 2783696. PMID 19838202.
- ^ Roszer, T; Menéndez-Gutiérrez, MP; Lefterova, MI; Alameda, D; Núñez, V; Lazar, MA; Fischer, T; Ricote, M (Jan 1, 2011). "Autoimmune kidney disease and impaired engulfment of apoptotic cells in mice with macrophage peroxisome proliferator-activated receptor gamma or retinoid X receptor alpha deficiency". Journal of Immunology. 186 (1): 621–31. doi:10.4049/jimmunol.1002230. PMC 4038038. PMID 21135166.
- ^ Kruse, K; Janko, C; Urbonaviciute, V; Mierke, CT; Winkler, TH; Voll, RE; Schett, G; Muñoz, LE; Herrmann, M (September 2010). "Inefficient clearance of dying cells in patients with SLE: anti-dsDNA autoantibodies, MFG-E8, HMGB-1 and other players". Apoptosis. 15 (9): 1098–113. doi:10.1007/s10495-010-0478-8. PMID 20198437. S2CID 12729066.
- ^ Han, CZ; Ravichandran, KS (Dec 23, 2011). "Metabolic connections during apoptotic cell engulfment". Cell. 147 (7): 1442–5. doi:10.1016/j.cell.2011.12.006. PMC 3254670. PMID 22196723.
- ^ Grønlien HK, Berg T, Løvlie AM (July 2002). "In the polymorphic ciliate Tetrahymena vorax, the non-selective phagocytosis seen in microstomes changes to a highly selective process in macrostomes". The Journal of Experimental Biology. 205 (Pt 14): 2089–97. doi:10.1242/jeb.205.14.2089. PMID 12089212.
- ^ Montagnes, Djs; Barbosa, Ab; Boenigk, J; Davidson, K; Jürgens, K; Macek, M; Parry, Jd; Roberts, Ec; imek, K (2008-09-18). "Selective feeding behaviour of key free-living protists: avenues for continued study". Aquatic Microbial Ecology. 53: 83–98. doi:10.3354/ame01229. ISSN 0948-3055.
- ^ Stibor H, Sommer U (April 2003). "Mixotrophy of a photosynthetic flagellate viewed from an optimal foraging perspective". Protist. 154 (1): 91–8. doi:10.1078/143446103764928512. PMID 12812372.
외부 링크
 Wikimedia Commons의 식세포증 관련 매체
Wikimedia Commons의 식세포증 관련 매체- 미국 국립 의학 도서관 식세포증(MeSH)