면역글로불린 M
Immunoglobulin M| 면역글로불린 M | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (펜타머) | |||||||||||||
 | |||||||||||||
| 단백질형 | 항체의 | ||||||||||||
| |||||||||||||
면역글로불린M(IgM)은 척추동물이 생성하는 여러 종류의 항체(면역글로불린이라고도 한다) 중 하나이다.IgM은 가장 큰 항체로 항원에 대한 초기 노출 반응에 나타나는 최초의 항체다.[1][2]그동안 연구된 인간 등 포유류의 경우 항체생산을 담당하는 플라스마블라스틱이 상주하는 비장이 특정 IgM생산의 주요 현장이다.[3][4]
역사
IgM에 대한 연구는 1937년 폐렴구균 다당체로 초면화된 말들이 분자량 99만 [5]달톤으로 전형적인 토끼 γ글로불린보다 훨씬 큰 항체를 만들어냈다는 보고에서 시작되었다.[6]그 큰 크기에 따라, 새로운 항체는 원래 γ-매크로글로불린으로 언급되었고, 이후 용어로는 "매크로"를 IgM-M으로 지칭하였다.정상 면역글로불린의 V 영역은 매우 이질적이어서, 매우 다양한 전염성 미생물로부터 보호하는 그들의 역할을 반영하고 있으며, 이러한 이질성은 IgM의 상세한 구조적 분석을 방해했다.이후 동질 IgM의 두 가지 출처가 발견되었다.첫째, 일부 다발성 골수종 환자들이 생산한 고분자량 단백질은 종양에서 생산되는 mac-매크로글로불린으로 인식되었고, 종양은 그것이 생산하는 IgM의 클론이기 때문에 동질성이라는 것을 이제 우리는 알고 있다.[7]1960년대에는 생쥐에 면역글로불린 생성종양(플라스마시토마)을 유도하는 방법이 개발되어 IgM(재검토[8])을 비롯한 다양한 이소형의 균질 면역글로불린의 원천을 제공하기도 하였다.최근에는 조직 배양에서 공학적 면역글로불린 유전자의 발현을 이용하여 특정 교대로 IgM을 생성하여 관심 특징에 대한 분자 요구사항을 식별할 수 있다.
구조
면역글로불린은 가벼운 사슬과 무거운 사슬을 포함한다.라이트 체인(light chain 또는 κ)은 ~220개의 아미노산으로 이루어진 단백질로, 가변 영역인 VL(약 110개의 아미노산 분절)과 상수 영역인 CL(역시 약 110개의 아미노산 길이)으로 구성되어 있다.IgM의 µ 헤비 체인은 약 576개의 아미노산 단백질로 가변 영역(VH ~110개의 아미노산), 뚜렷한 4개의 상수 영역(Cµ1, Cµ2, Cµ3, Cµ4, 각 ~110개의 아미노산) 및 20개의 아미노산의 "테일피스"를 포함한다.µ 헤비 체인은 5개의 아스파라긴 잔류물에서 올리고당을 함유하고 있다.마우스와 인간 IgM에 대한 올리고당은 NMR, 렉틴 결합, 다양한 크로마토그래픽 시스템, 효소 민감도(검토) 등[9] 다양한 기법으로 부분적으로 특징지어져 왔다.각 사이트의 과두당 구조는 세부적으로 다르며, 우세한 과두당 - 생물연차, 3년차, 고만두 - 사이트 간에 차이가 있다.
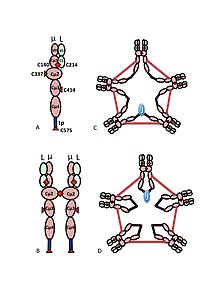
A) 가변(VH, VL) 및 상수 영역(Cµ1, Cµ2, Cµ3, Cµ4tp; CL) 도메인을 포함하는 µL 헤테로디머(Halfmer라고도 함)µ 체인 사이의 이황화 결합을 중재하는 사이스테인은 붉은 화살촉으로 표시되므로, 시스테인 이황화합물은 붉은 이중 화살촉(빨간 다이아몬드)으로 나타난다.
B) IgM "모노머"(µL)2.Cµ2 도메인 사이의 이황화 결합은 빨간색 이중 화살촉으로 표현된다.
C, D) J 체인 함유 IgM 펜타머의 2가지 모델로서, 다양한 시기에 다양한 출판물에 등장.(B)에서와 같이 Cµ2 도메인 사이의 이황화 결합과 Cµ4t 도메인 간의 이황화 결합은 빨간색 이중 화살표로 표시되며, Cµ3 이황화 결합은 긴 이중 화살표로 표시된다(명료성을 위해).연결성, 즉 µ 체인의 체인 간 이황화 결합은 전기 연결성처럼 표시된다.(C)에서 Cµ3 이황화 결합은 Cµ4tp 이황화 결합과 병렬로 µ 체인 결합하고, 이 이황화 결합은 Cµ2 이황화 결합과 직렬로 µ 체인 결합한다.(D)에서 Cµ2 및 Cµ4t 이황화 결합은 µ2 및 Cµ4tp 이황화 결합과 병렬로 결합되며 두 유형은 모두 Cµ3 이황화 결합과 직렬로 µ 체인 결합한다(출판사와 저자의[10] 허가를 받아 재현).
IgM의 복합체 구조는 그림 1에 도식적으로 나타나 있다.그림 1A는 L로 표시된 하나의 라이트 체인, µ로 표시된 하나의 헤비 체인으로 구성된 "헤테로디머"를 보여준다.무거운 사슬과 가벼운 사슬은 이황화 결합(빨간 삼각망으로 퇴적)과 비동축 상호작용에 의해 모두 함께 고정된다.
그림 1B는 Cµ2 도메인에서 이황화 결합에 의해 연결된 두 개의 µL 단위를 보여준다. 이 (µL)2 구조는 면역글로불린 G(IgG)의 구조와 어떤 면에서 유사하기 때문에 IgM "모노머"라고 종종 언급된다.
침전 속도와 전자 마이크로그래프에서의 외관을 근거로 IgM이 대부분 "펜타머", 즉 5개의 "모노머"[(µL)2]로 구성된 고분자이며, 원래 그림 1C와 1D의 모델에서 Cµ3 영역과 꼬리 조각 사이에 이황화 결합을 가지고 묘사되었다.[11][12]또한 pentamic IgM은 세 번째 단백질인 J 체인을 포함하고 있다.J 체인(접속용 J)은 고분자 IgA와 IgM의 공칭 결합 성분으로 발견되었다.[13][14]J 체인은 작은(약 137개의 아미노산), 산성 단백질이다.그림과 같이 J 체인은 테일피스에 시스틴이 포함된 이황화 결합을 통해 두 개의 µ 체인을 결합한다.[15]
고분자 IgM 형성을 위한 분자 요구사항
처음에는 중합체 면역글로불린 형성에 J 체인이 중요할 것으로 예상되었고, 실제로 IgA의 중합은 J 체인에 강하게(그러나 절대적으로) 의존한다.[16][17]대조적으로, 중합체 IgM은 J 체인이 없을 때 효율적으로 형성된다.[18][19]
인간과 쥐 IgM의 지배적인 형태는 펜타머다.이에 비해 개구리의 IgM(제노푸스)은 육각형,[20][21] 뼈의 물고기의 IgM은 4각형, 수각형 물고기(상어)의 IgM은 5각형이다.[22][23]마우스와 인간 IgM에서 펜타머의 우세함에도 불구하고, 이러한 IgM이 육각형으로도 존재할 수 있다는 것은 명백했다.[24][25]재조합 DNA 표현 시스템을 사용한 후속 연구에서는 J 체인이[18] 부족한 세포에서 IgM을 생산하거나 꼬리 부분에 시스테인이 부족한 µ 헤비 체인으로 IgM을 생산하여 J 체인의 결합을 막는 조건에서 헥사머가 생쥐 IgM의 주요 형태임을 나타냈다.[26][27]요약하면, 헥스아메리카 IgM은 결코 J 체인을 포함하지 않는다; 펜트아메리카 IgM은 J 체인을 포함하거나 포함하지 않도록 형성될 수 있다.[28]
µ와 µ 헤비 체인의 중요한 차이점은 헤비 체인 간에 이황화 결합을 형성하기 위한 시스테인의 가용성이다.γ 헤비 체인의 경우, 유일하게 경첩에 있는 사이스테인에 의해 띠간 결합이 형성되며, 이에 따라 각 chain 체인은 다른 하나의 chain 체인에만 결합된다.대조적으로 Cµ2 및 Cµ3 도메인과 테일피스 각각은 다른 µ 체인과 이황화 결합을 형성하는 시스테인을 포함한다.Cµ2 도메인의 시스테인은 단수 IgM(µL)2의 형성을 중재한다.포함된 시스테인과 함께 꼬리부분은 고분자 면역글로불린 형성에 필요하고 충분하다.즉, µ 헤비 체인의 꼬리 부분을 삭제하면 고분자 IgM 형성을 방해한다.[29]반대로 꼬리 부분을 포함하도록 변형된 heavy 헤비 체인을 발현하는 세포는 고분자 IgG를 생성한다.[30][31][32]
Cµ3 도메인에서 시스틴의 역할은 더욱 미묘하다.그림 1C와 1D는 펜트아메리카 IgM의 가능한 모델을 나타낸다.이러한 모델에서 각 µ 체인은 두 개의 다른 µ 체인을 바인딩하도록 설계된다.그러나 어느 모델도 고분자 IgM의 구조를 완전히 설명할 수는 없다.예를 들어, 그림 1C의 모델은 Cµ2 도메인 사이의 이황화 결합이 이황화-결합 고분자 IgM을 만드는 데 필수적이라고 예측한다.그림 1D의 모델은 Cµ3 도메인 사이의 이황화 결합이 필수적이라고 예측한다.사실 이황화합물, 중합체, IgM은 세 개의 사이스틴 중 어느 하나라도 없는 경우에도 여전히 만들어질 수 있다.각 µ 체인이 두 개의 다른 µ 체인과만 상호작용하는 모델의 맥락에서, 이러한 결과는 일부 분자가 그림 1C와 같고 일부는 그림 1D와 같다는 것을 시사한다.단, µ 간 체인 본딩을 위한 세 개의 사이스테인이 가용성은 µ 체인이 각각 그림 2와 같이 세 개의 다른 µ 체인을 결합할 수 있음을 시사한다.같은 맥락에서, 그림 2C는 J 체인이 Cµ3 도메인의 사이스틴에 의해 다른 µ 체인에 결합되지 않는 µ 체인에 결합한다는 증거를 반영하는 J 체인 함유 펜타머 모델을 제시한다.이러한 모델과 다른 모델, 즉 정규 모델과 비정형 모델 모두 다른 곳에서 논의된다.[27][33]
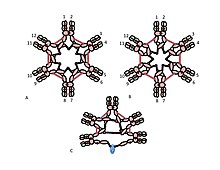
A, B) 이 그림들은 헥사메리카 IgM에서 µs사슬 이황화 결합의 가능한 많은 모델들 중 두 가지를 나타낸다.그림 1과 같이 Cµ2 이황화 본드와 Cµ4tp 이황화 본드는 빨간색 이중 화살표 헤드로 표시되며, Cµ3 이황화 본드는 긴 이중 머리 화살표로 표시된다.두 모델 A와 B 모두에서 각 유형의 이황화 본드(Cµ2-Cµ2; Cµ3-Cµ3; Cµ4tp-Cµ4tp)는 다른 모델과 직렬로 µ 체인을 결합한다.이러한 모델과 다른 모델을 구별하는 방법은 참조문서 [28]에서 논의한다.
C) 이 펜트아메리카 IgM의 표현은 J 체인이 Cµ3 이황화 결합을 통해 연결되지 않는 µ 체인에 어떻게 결합될 수 있는지를 보여준다.
Pentameric IgM은 일반적으로 폴리머당 단일 J 체인을 포함하는 것으로 표현되지만, 실제로 J 체인 스토이치측정 측정치는 폴리머당 1 J 분자에서 폴리머당 3 J 분자에 이르기까지 다양하다.[34][35][36][37]범위가 넓은 것은 불완전한 방사선 처리 또는 부정확하게 오우치터론 선을 정량화하는 것과 같은 기술적 문제 때문일 수 있다.그러나 이러한 변동은 IgM 준비물의 이질성에 기인할 수도 있다. 즉, 다양한 준비물은 J-함유 및 J-결핍 폴리머의 내용에서 상당히 차이가 있었을 수 있다.
µ 상수 영역의 3차 및 2차 구조
µ 체인의 상세한 3차원 구조에 대한 통찰력을 얻기 위해 개별 Cµ2, Cµ3, Cµ4tp 도메인을 대장균에서 별도로 생산한 후 침전률, X선 결정학, NMR 분광학 등 다양한 방법으로 분석하였다.다른 면역글로불린의 경우와 마찬가지로, µ 헤비 체인의 영역은 7개의 가닥으로 구성된 β-시트 위에 있는 특성을 가지고 있으며, 영역 내 이황화 결합에 의해 안정화된다.전체적으로 IgM 상수 영역은 "무스룸형" 구조를 가지고 있는데, Cµ2-Cµ3 도메인은 버섯의 머리와 유사한 디스크로, Cµ4tp 도메인은 짧은 줄기처럼 돌출되어 있다.[38]
함수
IgM은 몇 가지 다른 생리적 분자와 상호작용한다.
- IgM은 구성요소 C1을 결합하고 고전적인 경로를 활성화하여 항원의 opsonization과 cytolyis를 유도할 수 있다.
- IgM은 내장 루멘과 같은 점막 표면과 모유에 IgM을 가져오는 과정에서 다림문글로불린 수용체(pIgR)에 결합한다.이 바인딩은 J 체인에 따라 달라진다.[39]
- IgM을 결합하는 두 개의 다른 Fc 수용체인 Fcα/µ-R과 Fc µ-R이 검출되었다.fcα/µ-R은 pIgR과 마찬가지로 고분자 IgM과 IgA를 결합한다.fcα/µ-R은 내분포를 중재할 수 있으며, 내장에서의 표현은 점막 면역의 역할을 시사한다.Fcµ-R(이전의 Toso/Faim3)은 IgM을 독점적으로 결합하고 IgM 결합 항원의 세포 흡수를 중재할 수 있다.[40]녹아웃 생쥐에서 해당 유전자의 불활성화는 표현형을 발생시키지만, 이들 수용체의 생리적 기능은 여전히 불확실하다[41].
면역반응 조절
동물에게 그들의 항원과 함께 주사되는 특정한 면역글로불린은 이 같은 항원에 대한 항체 반응에 영향을 줄 수 있다.[42]1차 면역 후 생성된 내생 항체는 부스터 면역에 대한 항체 반응에도 영향을 미칠 수 있어 생리학적 조건에서도 유사한 효과가 발생함을 시사한다."규제" 효과는 긍정적이거나 부정적일 수 있다.즉 항원의 종류와 항체의 등유형에 따라 그 효과는 항체반응의 억제나 강화가 될 수 있다.이러한 효과는 유전성(외국인) 적혈구(적세포)에 대한 면역과 관련된 실험을 통해 잘 나타난다.예를 들어 IgG를 유전성 적혈구들과 함께 투여할 때, 이 조합은 적혈구 특이 항체 반응의 거의 완전한 억제를 야기한다.이 효과는 Rh-음성 산모들이 태아 Rh-positive erythrocytes에 면역되는 것을 막기 위해 임상적으로 사용되며, 그 사용으로 신생아의 용혈성 질환 발생률이 현저히 낮아졌다.[43]IgG의 효과와 대조적으로 항원 특이 IgM은 특히 큰 항원의 경우 항체 반응을 크게 향상시킬 수 있다.[44]따라서 적혈구 특이 IgM을 적혈구와 함께 동물(인간 포함)에 주사할 때 적혈구만을 투여할 때보다 적혈구에 대한 훨씬 강한 항체반응이 유도된다.여러 줄의 증거는 IgM이 그것의 강화 효과를 위해 보완을 활성화할 능력이 필요하다는 것을 나타낸다.즉 IgM 매개 증강은 성분 C3를 보완하기 위해 고갈된 동물이나, 보완 수용체 1과 2를 보완하지 못한 돌연변이 동물에서는 발생하지 않는다.마찬가지로 보약을 활성화할 수 없는 돌연변이 IgM도 면역 반응을 강화하지 않는다.IgM 매개 강화에 대한 가능한 설명은 B 림프구가 IgM 항유전성 복합체를 포착하고 이 복합체를 효율적인 면역 반응이 발생하는 비장의 영역으로 이동시킨다는 것이다.IgM은 면역 반응에서 초기에 생성되기 때문에 항체 반응의 시작에 중요할 수 있다.
합성
세균선 세포(sperm과 난자)에서 결국 면역글로불린을 암호화할 유전자는 기능적 형태가 아니다(V(D)J 재조합 참조).헤비 체인의 경우 V, D, J로 표시된 세 개의 세균선 세그먼트가 서로 연결되고 µ 헤비 체인 상수 영역을 인코딩하는 DNA에 결합된다.초기에 B 세포는 µ와 Δ 헤비 체인을 모두 표현한다; 각각 동일한 V 영역을 갖는 이 두 헤비 체인의 공동 표현은 대체 스플라이싱 및 대체 폴리-A 추가 사이트에 의존한다.다른 이소형(異所形, and, α)의 표현은 면역글로불린 등급 전환이라고 하는 다른 형태의 DNA 재배열로 영향을 받는다.[45]
임상적 유의성
IgM은 인간의 태아에서 발현된 최초의 면역글로불린(약 20주)[46]이며, 계통생성적으로 가장 먼저 발달한 항체다.[47]
IgM 항체는 감염 과정 초기에 나타나며, 대개 추가 피폭 후 더 적은 범위에서 다시 나타난다.IgM 항체는 인간의 태반을 통과하지 않는다(이소형 IgG만 해당).
IgM의 이 두 가지 생물학적 특성은 감염병 진단에 유용하게 쓰인다.환자 혈청에서 IgM 항체를 입증하면 최근 감염을 나타내거나 신생아의 혈청에서 자궁내 감염(예: 선천성 풍진증후군)을 나타낸다.
장기이식 후 항기증자 IgM의 개발은 이식 거부와 관련이 없지만 보호 효과가 있을 수 있다.[48]
정상 혈청의 IgM은 사전 예방접종이 없는 경우에도 특정 항원에 묶이는 경우가 많다.[49]이 때문에 IgM은 때때로 "자연항체"라고 불려왔다.이러한 현상은 자연적으로 발생하고 있는 약하게 교차 작용하는 항원에도 감지할 수 있게 하는 IgM의 높은 탐욕 때문일 것이다.예를 들어, 적혈구 A와 B 항원에 결합하는 IgM 항체는 박테리아나 식물 물질에 존재하는 A와 B와 같은 물질에 노출되어 어릴 때 형성될 수 있다.
igM항체는 수혈 대상자가 혈액형과 맞지 않는 혈액을 받으면 적혈구의 뭉침(agglutation)을 주로 담당한다.
뮤 체인의 돌연변이는 자가 열성 아그마글로불린혈증을 유발한다.[50]
IgM이나 드물게 IgG의 존재는 슈니츨러 증후군을 진단하기 위한 의무 기준 중 하나이다.[51][52]
참고 항목
참조
- ^ "Immunoglobulin M". The American Heritage Dictionary of the English Language (Fourth ed.). Houghton Mifflin Company. 2004. ISBN 978-0618082308.
- ^ Alberts, B.; Johnson, A.; Lewis, J.; Walter, P.; Raff, M.; Roberts, K. (2002). "Chapter 24". Molecular Biology of the Cell (4th ed.). Routledge. ISBN 978-0-8153-3288-6.
- ^ Capolunghi, F.; Rosado, M. M.; Sinibaldi, M.; Aranburu, A.; Carsetti, R. (2013). "Why do we need IgM memory B cells?". Immunology Letters. 152 (2): 114–20. doi:10.1016/j.imlet.2013.04.007. PMID 23660557.
- ^ Williams, N.; O'Connell, P. R. (2008). "Chapter 62". Bailey & Love's Short Practice of Surgery (25th ed.). CRC Press. p. 1102. ISBN 9780340939321.
- ^ Heidelberger, M.; Pedersen, K. O. (1937). "The molecular weight of antibodies". Journal of Experimental Medicine. 65 (3): 393–414. doi:10.1084/jem.65.3.393. PMC 2133497. PMID 19870608.
- ^ Kabat, E. A. (1939). "The molecular weight of antibodies". Journal of Experimental Medicine. 69 (1): 103–118. doi:10.1084/jem.69.1.103. PMC 2133729. PMID 19870830.
- ^ Waldenström, J. (1943). "Incipient myelomatisis or "essential" hyoerglobulinemis with fibrinogenopenia—a new syndrome?". Acta Medica Scandinavica. 142 (3–4): 216–247. doi:10.1111/j.0954-6820.1944.tb03955.x.
- ^ Potter, M. (2007). The early history of plasma cell tumors in mice, 1954-1976. Advances in Cancer Research. Vol. 98. pp. 17–51. doi:10.1016/S0065-230X(06)98002-6. ISBN 9780123738967. PMID 17433907.
- ^ Monica, T. J.; Williams, S. B.; Goochee, C. F.; Maiorella, B. L. (1995). "Characterization of the glycosylation of a human IgM produced by a human-mouse hybridoma". Glycobiology. 5 (2): 175–185. doi:10.1093/glycob/5.2.175. PMID 7780192.
- ^ Heyman, B.; Shulman, M. J. (2016). "Structure, Function, and Production of Immunoglobulin M (IgM)". In Ratcliffe, M. (ed.). Encyclopedia of Immunobiology. Vol. 2. Elsevier. pp. 1–14. doi:10.1016/B978-0-12-374279-7.05001-3. ISBN 978-0-12-374279-7.
- ^ Beale, D.; Feinstein, A. (1969). "Studies on the Reduction of a Human 19S Immunoglobulin M". Biochemical Journal. 112 (2): 187–194. doi:10.1042/bj1120187. PMC 1187691. PMID 4979347.
- ^ Milstein, C.P.; et al. (1975). "Interchain disulfide bridges of mouse Immunoglobulin M". Biochemical Journal. 151 (3): 615–624. doi:10.1042/bj1510615. PMC 1172409. PMID 766753.
- ^ Halpern, M. S.; Koshland, M. E. (1970). "Novel subunit of secretory IgA". Nature. 228 (5278): 1276–1278. Bibcode:1970Natur.228.1276H. doi:10.1038/2281276a0. PMID 5530654. S2CID 36189290.
- ^ Mestecky, J.; Zikin, J.; Butler, W. T. (1971). "Immunoglobulin M an secretory immunoglobulin A: presence of common polypeptide chain different from light chains". Science. 171 (3976): 1163–1165. Bibcode:1971Sci...171.1163M. doi:10.1126/science.171.3976.1163. PMID 5544873. S2CID 6834561.
- ^ Frutiger, S.; et al. (1992). "Disulfide bond assignment in human J chain and its covalent pairing with immunoglobulin M". Biochemistry. 31 (50): 12643–12647. doi:10.1021/bi00165a014. PMID 1472500.
- ^ Johansen, F. E.; Braathen, R.; Brandtzaeg, P. (2000). "Role of J chain in secretory immunoglobulin formation". Scandinavian Journal of Immunology. 52 (3): 240–8. doi:10.1046/j.1365-3083.2000.00790.x. PMID 10972899.
- ^ Sørensen, V.; et al. (2000). "Structural requirements for incorporation of J chain into human IgM and IgA". International Immunology. 12 (1): 19–27. doi:10.1093/intimm/12.1.19. PMID 10607746.
- ^ a b Cattaneo, A.; Neuberger, M. S. (1987). "Polymeric immunoglobulin M is secreted by transfectants of non-lymphoid cells in the absence of immunoglobulin J chain". The EMBO Journal. 6 (9): 2753–2758. doi:10.1002/j.1460-2075.1987.tb02569.x. PMC 553699. PMID 3119328.
- ^ Fazel, S.; Wiersma, E. J.; Shulman, M. J. (1997). "Interplay of J chain and disulfide bonding in assembly of polymeric IgM". International Immunology. 9 (8): 1149–1158. doi:10.1093/intimm/9.8.1149. PMID 9263012.
- ^ Parkhouse, R.; Askonas, B. A.; Dourmashkin, R. R. (1970). "Electron microscopic studies of mouse immunoglobulin M; structure and reconstitution following reduction". Immunology. 18 (4): 575–584. PMC 1455497. PMID 5421036.
- ^ Schwager, J.; Hadji-Azlmi, I. (1984). "Mitogen-induced B-cell differentiation in Xenopus laevis". Differentiation. 27 (3): 182–188. doi:10.1111/j.1432-0436.1984.tb01426.x. PMID 6334001.
- ^ Fillatreau, S.; et al. (2013). "The astonishing diversity of Ig classes and B cell repertoires in teleost fish". Frontiers in Immunology. 4: 1–14. doi:10.3389/fimmu.2013.00028. PMC 3570791. PMID 23408183.
- ^ Getahun, A.; et al. (1999). "Influence of the μ-chain C-terminal sequence on polymerization of immunoglobulin M". Immunology. 97 (3): 408–413. doi:10.1046/j.1365-2567.1999.00797.x. PMC 2326861. PMID 10447761.
- ^ Dolder, F. (1971). "Occurrence, Isolation and Interchain Bridges of Natural 7-S Immunoglobulin M in Human Serum". Biochimica et Biophysica Acta. 236 (3): 675–685. PMID 4997811.
- ^ Eskeland, T.; Christensen, T. B. (1975). "IgM molecules with and without J chain in serum and after purification, studied by ultracentrifugation, electrophoresis, and electron microsopy". Scandinavian Journal of Immunology. 4 (3): 217–228. doi:10.1111/j.1365-3083.1975.tb02620.x. PMID 807966. S2CID 8246173.
- ^ Davis, A. C.; Roux, K. H.; Shulman, M. J. (1988). "On the structure of polymeric IgM". European Journal of Immunology. 18 (7): 1001–1008. doi:10.1002/eji.1830180705. PMID 3136022. S2CID 34679165.
- ^ a b Davis, A. C.; et al. (1989). "Intermolecular disulfide bonding in IgM: effects of replacing cysteine residues in the µ heavy chain". The EMBO Journal. 8 (9): 2519–2526. doi:10.1002/j.1460-2075.1989.tb08389.x. PMC 401247. PMID 2511005.
- ^ Collins, C.; Tsui, F. W.; Shulman, M. J. (2002). "Differential activation of human and guinea pig complement by pentameric and hexameric IgM". European Journal of Immunology. 32 (6): 1802–1810. doi:10.1002/1521-4141(200206)32:6<1802::AID-IMMU1802>3.0.CO;2-C. PMID 12115664.
- ^ Davis, A. C.; et al. (1989). "Mutations of the mouse m H chain which prevent polymer assembly". Journal of Immunology. 43 (4): 1352–1357. PMID 2501393.
- ^ Smith, R. I. F.; Coloma, M. J.; Morrison, S. L. (1995). "Addition of a mu-tailpiece to IgG results in polymeric antibodies with enhanced effector functions including complement-mediated cytolysis by IgG4". Journal of Immunology. 154 (5): 2226–2236. PMID 7868896.
- ^ Sørensen, V.; et al. (1996). "Effect of the IgM and IgA secretory tailpieces on polymerization and secretion of IgM and IgG". Journal of Immunology. 156 (8): 2858–2865. PMID 8609405.
- ^ Smith, R.; Morrison, S. L. (1994). "Recombinant polymeric IgG: An approach to engineering more potent antibodies". Nature Biotechnology. 12 (7): 683–688. doi:10.1038/nbt0794-683. PMID 7764912. S2CID 19055205.
- ^ Wiersma, E. J.; Shulman, M. J. (1995). "Assembly of IgM: role of disulfide bonding and noncovalent interactions". Journal of Immunology. 154 (10): 5265–5272. PMID 7730630.
- ^ Chapuis, R. M.; Koshland, M. E. (1974). "Mechanism of IgM polymerization". Proc. Natl. Acad. Sci. U.S.A. 71 (3): 657–661. Bibcode:1974PNAS...71..657C. doi:10.1073/pnas.71.3.657. PMC 388071. PMID 4207070.
- ^ Mihaesco, C.; Mihaesco, E.; Metzger, H. (1973). "Variable J-chain content in human IgM". FEBS Letters. 37 (2): 303–306. doi:10.1016/0014-5793(73)80483-1. PMID 4202824. S2CID 41601548.
- ^ Brandtzaeg, P. (1976). "Complex formation between secretory component and human immunoglobulin related to their content of J chain". Scandinavian Journal of Immunology. 5 (4): 411–419. doi:10.1111/j.1365-3083.1976.tb00295.x. PMID 821140. S2CID 39847718.
- ^ Grubb, A. O. (1978). "Quantitation of J chain in human biological fluids by a simple immunochemical procedure". Acta Medica Scandinavica. 204 (1–6): 453–465. doi:10.1111/j.0954-6820.1978.tb08473.x. PMID 104551.
- ^ Müller, R.; et al. (2013). "High-resolutiion structures of the IgM Fc domainsreveal principles of its hexamer formation". Proc. Natl. Acad. Sci. U.S.A. 110 (25): 10183–10188. Bibcode:2013PNAS..11010183M. doi:10.1073/pnas.1300547110. PMC 3690842. PMID 23733956.
- ^ Johansen, F. E.; Braathen, R.; Brandtzaeg, P. (2000). "Role of J chain in secretory immunoglobulin formation". Scandinavian Journal of Immunology. 52 (3): 240–8. doi:10.1046/j.1365-3083.2000.00790.x. PMID 10972899.
- ^ Shima, H.; et al. (2010). "Identification of TOSO/FAIM3 as an Fc receptor for IgM". Int. Immunol. 22 (3): 149–56. doi:10.1093/intimm/dxp121. PMID 20042454.
- ^ Ouchida, R.; et al. (2012). "Critical role of the IgM Fc receptor in IgM homeostasis, B-cell survival, and humoral immune responses". Proc. Natl. Acad. Sci. U.S.A. 109 (40): E2699–706. Bibcode:2012PNAS..109E2699O. doi:10.1073/pnas.1210706109. PMC 3479561. PMID 22988094.
- ^ Heyman, B (2013). Antibody mediated regulation of humoral immunity. in Nimmerjahn, F. (ed.) Molecular and cellular mechanisms of antibody activity: Springer.
- ^ Urbaniak, S. J. & Greiss, M. A. (2000). "RhD haemolytic disease of the fetus and the newborn". Blood Rev. 14 (1): 33–61. doi:10.1054/blre.1999.0123. PMID 10805260.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Sörman A, Zhang L, Ding Z, Heyman, B. (2014). "How antibodies use complement to regulate antibody responses". Mol. Immunol. 61 (2): 79–88. doi:10.1016/j.molimm.2014.06.010. PMID 25001046.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Murphy, K.; Weaver, C. (2016). Janeway's Immunobiology. New York, NY: Garland Science/Taylor and Francis. p. 195. ISBN 9780815345053.
- ^ van Furth, R.; Schuit, H. R.; Hijmans, W. (1965). "The immunological development of the human fetus". Journal of Experimental Medicine. 122 (6): 1173–88. doi:10.1084/jem.122.6.1173. PMC 2138097. PMID 4159036.
- ^ 윌리엄 프랜시스 가농의 의학 생리학 리뷰
- ^ McAlister, C. C.; et al. (2004). "Protective anti-donor IgM production after crossmatch positive liver-kidney transplantation". Liver Transplantation. 10 (2): 315–9. doi:10.1002/lt.20062. PMID 14762873.
- ^ Jayasekera, J. P.; Moseman, E. A.; Carroll, M. C. (2007). "Natural antibody and complement mediate neutralization of influenza virus in the absence of prior immunity". Journal of Virology. 81 (7): 3487–94. doi:10.1128/JVI.02128-06. PMC 1866020. PMID 17202212.
- ^ "OMIM Entry - # 601495 - AGAMMAGLOBULINEMIA 1, AUTOSOMAL RECESSIVE; AGM1". omim.org. Retrieved 2021-03-25.
- ^ Gusdorf, L.; Lipsker, D. (17 July 2017). "Schnitzler Syndrome: a Review". Current Rheumatology Reports. 19 (8): 46. doi:10.1007/s11926-017-0673-5.
- ^ Simon, A.; Asli, B.; Braun-Falco, M.; Koning, H. De; Fermand, J.-P.; Grattan, C.; Krause, K.; Lachmann, H.; Lenormand, C.; Martinez-Taboada, V.; Maurer, M.; Peters, M.; Rizzi, R.; Rongioletti, F.; Ruzicka, T.; Schnitzler, L.; Schubert, B.; Sibilia, J.; Lipsker, D. (2013). "Schnitzler's syndrome: diagnosis, treatment, and follow-up". Allergy. 68 (5): 562–568. doi:10.1111/all.12129.


