황열병
Yellow fever| 황열병 | |
|---|---|
| 기타 이름 | 황색 잭, 황색 [1]페스트, 브론즈[2] 존 |
 | |
| 황열 바이러스 TEM 마이크로그래프(234,000×배율) | |
| 전문 | 전염병 |
| 증상 | 발열, 오한, 근육통, 두통, 노란[3] 피부 |
| 합병증 | 간부전, 출혈[3] |
| 통상적인 개시 | 노출[3] 후 3~6일 후 |
| 지속 | 3~4일[3] |
| 원인들 | 모기에 의해[3] 퍼지는 황열병 바이러스 |
| 진단 방법 | 혈액 검사[4] |
| 예방 | 황열 백신[3] |
| 치료 | 지원 케어[3] |
| 빈도수. | 중증 환자 수가 최대 130,000명(2013년)[3] |
| 사망. | 최대 45,000 (2013년)[3] |
황열은 전형적으로 [3]짧은 기간의 바이러스성 질병이다.대부분의 경우, 증상에는 발열, 오한, 식욕부진, 메스꺼움, 근육통(특히 등)과 [3][5]두통이 포함됩니다.증상은 보통 5일 [3]이내에 호전됩니다.약 15%의 사람에게서 열이 오른 후 하루 만에 복통이 재발하고 간 손상이 일어나 [3][6]피부가 노랗게 변하기 시작합니다.이렇게 되면 출혈과 신장 질환의 위험이 [3][7]높아진다.
이 병은 황열 바이러스에 의해 발생하며 감염된 [3][8]모기에 물려 전파된다.그것은 사람, 다른 영장류,[9] 그리고 몇몇 종류의 [3]모기들에게만 감염된다.도시에서, 그것은 주로 열대 지방과 [3]아열대에서 발견되는 모기의 일종인 Aedes aegypti에 의해 전파된다.그 바이러스는 플라비바이러스속의 RNA 바이러스이다.[10][11]그 병은 특히 초기 단계에서 [3]다른 질병과 구별하기 어려울 수 있다.의심되는 환자를 확인하려면 중합효소 연쇄 반응을 이용한 혈액 샘플 검사가 필요합니다.[4]
안전하고 효과적인 황열 예방 백신이 존재하며,[3] 일부 국가는 여행자들에게 예방 접종을 요구한다.감염을 막기 위한 다른 노력으로는 전염되는 [3]모기의 개체 수를 줄이는 것이 있다.황열병이 흔한 지역에서는 발병 [3]예방을 위해 환자 조기 진단과 인구 상당수의 예방접종이 중요하다.일단 감염되면 관리는 증상이 나타나며 바이러스에 [3]대한 구체적인 대책은 없다.사망은 [3][12]중증질환자의 절반까지 발생한다.
2013년 황열병은 전 세계적으로 [3]약 127,050명의 심각한 감염과 45,000명의 사망자를 발생시켰으며,[4] 이 중 거의 90%가 아프리카에서 발생했다.거의 10억 명의 사람들이 이 병이 [3]흔한 지역에 살고 있다.그것은 남아메리카와 [13]아프리카 대륙의 열대 지역에서 흔하지만,[3][14] 아시아에서는 그렇지 않다.1980년대 이후 황열병의 발생 건수가 [3][15]증가하고 있다.이는 면역력이 떨어지는 사람, 도시에 사는 사람, 자주 이동하는 사람, 그리고 기후 변화가 [3]모기 서식지를 증가시키기 때문이라고 여겨진다.
이 질병은 아프리카에서 시작되어 15세기 사하라 이남의 아프리카 [1][16]노예들의 유럽 인신매매와 함께 아메리카 대륙으로 확산되었다.17세기 이후, 그 질병의 주요 발병은 아메리카, 아프리카, 그리고 유럽에서 [1]몇 차례 발생했다.18세기와 19세기에 황열병은 가장 위험한 전염병 중 하나로 여겨졌다; 수많은 전염병이 미국의 주요 도시와 [1]세계의 다른 지역들을 휩쓸었다.
1927년에 황열 바이러스는 인간 바이러스가 최초로 [10][17]분리되었다.
징후 및 증상
황열은 3~6일의 [18]잠복기를 거쳐 시작된다.대부분의 경우 열, 두통, 오한, 요통, 피로, 식욕부진, 근육통, 메스꺼움, [19]구토 등으로 가벼운 감염만 일으킨다.이 경우 감염은 3~6일 [20]정도만 지속된다.
그러나 15%의 경우, 사람들은 재발 발열로 특징지어지는 두 번째 독성 질환 단계로 진입합니다. 이번에는 간 손상으로 인한 황달과 복통을 [21]동반합니다.입, 코, 눈, 위장관의 출혈은 피를 포함한 구토를 유발하며, 그래서 스페인어로 황열병을 뜻하는 Vömito negro (검은 토사물)[22]라고 불립니다.신부전, 딸꾹질, [23][24]헛소리도 있을 수 있다.
황달에 걸린 사람 중 치사율은 20~50%인 반면 전체 치사율은 약 3~7.5%[25]이다.심각한 경우 사망률이 50%[26]를 초과할 수 있습니다.
감염에서 살아남는 것은 평생 [27]면역을 제공하며, 보통 영구적인 장기 [28][29]손상을 초래하지 않는다.
문제
황열은 중증 질환자의 20~50%가 사망에 이를 수 있다.황달, 피로, 심장 박동 문제, 발작 및 내부 출혈은 회복 시간 [30][31]동안 황열 합병증으로 나타날 수 있습니다.
원인
| 황열 바이러스 | |
|---|---|
 | |
| 플라비바이러스 구조 및 게놈 | |
| 바이러스 분류 | |
| (순위 미지정): | 바이러스 |
| 영역: | 리보비리아 |
| 왕국: | 오르토나비라과 |
| 문: | 키트리노비리코타 |
| 클래스: | 플라수비케테스 |
| 주문: | 아마릴로비랄레스 |
| 패밀리: | 플라비바이러스과 |
| 속: | 플라비바이러스 |
| 종류: | 황열 바이러스 |
황열병은 황열 바이러스, 폭 40~50의 외피 RNA 바이러스, [10]플라비바이러스과의 모식종과 같은 이름으로 인해 발생한다.1900년경 미국의 의사 월터 리드에 의해 인간의 혈청을 여과하여 전염되고 모기에 의해 전염되는 것으로 밝혀진 최초의 질병이었다.[32]양성의 단일 가닥 RNA는 약 10,862개의 뉴클레오티드 길이로 폴리단백질을 [33]코드하는 단일 개방 판독 프레임을 가지고 있습니다.숙주단백질가수분해효소는 이 폴리단백질을 세 가지 구조(C, pRM, E)와 일곱 가지 비구조 단백질(NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5)로 절단한다. 열거는 [34]게놈에서 단백질을 코드하는 유전자의 배열에 해당한다.최소 황열 바이러스(YFV) 3'UTR 영역은 숙주 5'-3' 핵산가수분해효소 XRN1을 [35]정지시키기 위해 필요하다.UTR은 엑소핵산가수분해효소를 정지시키는 분자 신호 역할을 하는 PKS3 유사핵산 구조를 포함하고 있으며, 서브게놈 플라비바이러스 [36]RNA(sfRNA) 생산을 위한 유일한 바이러스 요구 사항이다.sfRNA는 엑소뉴클레아제에 의한 바이러스 게놈의 불완전한 분해의 결과이며 바이러스 [37]병원성에 중요하다.황열은 출혈열 [38]그룹에 속합니다.
그 바이러스는 특히 단구, 대식세포, 슈반세포, 수지상세포를 감염시킨다.그것들은 특정 수용체를 통해 세포 표면에 부착되고 내염색체 소포에 [39]흡수된다.엔도솜 내에서는 감소된 pH가 엔도솜막과 바이러스 [40]외피의 융합을 유도한다.캡시드는 세포에 들어가 부패하고 [41]게놈을 방출한다.수용체 결합은 막융합뿐만 아니라 단백질 E에 의해 촉매되며, 단백질 E는 낮은 pH에서 구조를 변화시켜 90개의 호모디머를 60개의 [34][42]호모트리머로 재배열시킨다.
숙주 세포에 들어간 후, 바이러스 게놈은 거친 소포체(ER) 및 이른바 소포체 [43]패킷으로 복제된다.우선 ER 내부에서 미성숙한 형태의 바이러스 입자가 생성되며, 그 M단백질은 아직 성숙한 형태로 분해되지 않았기 때문에 전구체 M(prM)으로 표시되며 단백질 [44]E와 복합체를 형성한다.미성숙 입자는 골지 장치에서 [45]prM을 M으로 분해하는 숙주 단백질 퓨린에 의해 처리된다.이것에 의해, 복합체로부터 E가 해방되어, 현재는 성숙한 전염성 바이러스인 [34]Virionu로 대체될 수 있습니다.
전송
황열 바이러스는 주로 황열 모기인 이집트 아데스의 물림을 통해 전염되지만, 호랑이 모기(알보픽투스)와 같은 다른 대부분의 아데즈 모기들도 이 바이러스의 [46]매개체 역할을 할 수 있다.모기에 의해 전염되는 다른 아르보 바이러스들처럼, 황열병은 감염된 인간이나 [47]다른 영장류의 피를 섭취할 때 암컷 모기에 의해 흡수된다.바이러스는 모기의 위까지 도달하고, 바이러스의 농도가 충분히 높으면, 바이러스들은 상피 세포를 감염시켜 그곳에서 복제할 수 있다.거기서부터, 그들은 헤모콜에 도달하고 거기에서 침샘에 [48]도달한다.모기가 다음에 피를 빨아들일 때, 모기는 상처에 침을 주입하고, 바이러스는 물린 사람의 [49]혈류에 도달한다.A. 이집트 내에서 황색 에버 바이러스의 체내 감염, 즉 암컷 모기에서 알로, 그리고 유충으로의 전염이 나타난다.[50]이전에 혈액을 섭취하지 않은 벡터의 감염은 이 [51]질병의 갑작스러운 단일 발병에 영향을 미치는 것으로 보인다.
바이러스가 모기로부터 인간이나 [52]다른 영장류에게 전염되는 역학적으로 다른 세 가지 감염 주기가[15] 발생한다."도시 주기"에서는 황열 모기 A. 이집트만 관련된다.도시에 잘 적응하고 지카열, 뎅기열, 치쿤구냐 [53]등 다른 질병도 전염시킬 수 있다.도시 순환은 아프리카에서 발생하는 황열병의 주요 발생의 원인이다.1999년 볼리비아에서 발생한 것을 제외하고, 이 도시 순환은 남미에서 [54]더 이상 존재하지 않는다.
도시 순환 외에 아프리카와 남미에서는 숲 순환(숲 또는 정글 순환)이 존재하며, 아프리카에서는 Aedes Africanus 또는 Hemagogus와 Sabethes(남미에서는)의 모기가 [55]벡터 역할을 한다.정글에서 모기는 주로 사람이 아닌 영장류에게 감염된다; 그 질병은 [49]아프리카 영장류에서 대부분 증상이 없다.남미에서는 현재 인간이 감염될 수 있는 유일한 방법은 열대우림 주기이며,[46] 이것은 대륙에서 황열병의 발생률이 낮다는 것을 설명해준다.정글에서 감염된 사람들은 바이러스를 도시 지역으로 옮길 수 있고, 그곳에서 A. 이집트는 매개체 역할을 한다.이 숲의 순환 때문에 [15]황열병은 매개체 역할을 하는 모기를 근절하는 것 외에는 근절될 수 없다.
아프리카에서는 "사바나 사이클" 또는 중간 사이클로 알려진 세 번째 감염 사이클이 정글과 도시 [56]사이클 사이에서 발생합니다.Aedes속의 다른 모기들이 관련되어 있다.최근 몇 년 동안,[57] 이것은 아프리카에서 황열병의 가장 흔한 전염 형태였다.
황열병이 동남아시아로 확산되는 것에 대한 우려가 있는데, 황열병의 매개체는 이미 A. 이집트이다.[58]
병인 발생
모기에서 전염된 후, 그 바이러스는 림프절에서 복제되고 특히 수상 세포를 감염시킨다.거기서부터, 그들은 간에 도달하고 간세포(아마도 쿠퍼 세포를 통해 간접적으로)를 감염시켜, 이러한 세포의 호산구 분해와 사이토카인의 방출로 이어진다.Councilman body로 알려진 아포토시스 덩어리는 간세포의 [59][60]세포질에 나타난다.
치사율은 사이토카인 폭풍, 쇼크, 그리고 다발성 장기 부전이 [25]뒤따를 때 발생할 수 있다.
진단.
황열은 증상학과 여행 이력에 기초한 임상 진단이 가장 흔하다.그 병의 경미한 경우들은 [47]바이러스학상으로만 확인될 수 있다.가벼운 황열 증례도 지역 발병에 크게 기여할 수 있기 때문에, 모든 의심되는 황열 증례(환부를 떠난 후 6-10일 후 발열, 통증, 메스꺼움, 구토 증상 포함)는 심각하게 [47]치료됩니다.
황열이 의심되면 발병 후 6~10일이 지나야 바이러스를 확인할 수 있다.바이러스의 게놈이 [4]증폭되는 역전사 중합효소 연쇄반응에 의해 직접 확인을 얻을 수 있다.또 다른 직접적인 접근법은 혈장을 이용한 바이러스의 분리 및 세포 배양 성장이다. 이것은 1-4주가 [61][62]걸릴 수 있다.
혈청학적으로 황열에 대한 특정 IgM 또는 (이전 샘플과 비교하여) 특정 IgG 역자의 증가에 대한 질병의 급성 단계 동안 효소 관련 면역 흡수제 어세이에서 [63]황열을 확인할 수 있다.임상 증상과 함께 IgM의 검출이나 IgG 역가의 4배 증가는 황열병의 충분한 징후로 간주된다.이러한 검사들은 뎅기열 바이러스 같은 다른 플라비 바이러스와 교차 반응할 수 있기 때문에, 이러한 간접적인 방법들은 황열 [64]감염을 결론적으로 입증할 수 없다.
간 생검을 통해 간세포의 염증과 괴사를 확인하고 바이러스 항원을 검출할 수 있다.황열 환자는 출혈 경향이 있기 때문에 [65]사망 원인을 확인하기 위해 사후 조직검사를 하는 것이 좋습니다.
감별 진단에서는 황열 감염은 말라리아와 같은 다른 발열 질환과 구별되어야 한다.에볼라 바이러스, 라사 바이러스, 마버그 바이러스, 주닌 바이러스 등 다른 바이러스성 출혈열은 [66]반드시 원인으로 제외되어야 한다.
예방
황열병의 개인적 예방에는 황열병이 [46]유행하는 지역의 예방접종과 모기 물림 방지 등이 포함된다.황열 예방을 위한 제도적 대책으로는 예방접종 프로그램과 모기 방제책이 있다.가정에서 사용하는 모기장 배포 프로그램은 말라리아와 황열 양쪽의 사례를 감소시킨다.야외에서는 EPA에 등록된 방충제를 사용하는 것이 좋습니다.짧은 시간이라도 노출되면 모기에 물릴 가능성이 있다.긴팔 옷, 긴 바지, 양말은 예방에 도움이 됩니다.저수 용기에 살충제를 사용하는 것은 잠재적인 모기 번식 장소를 없애는 데 도움이 될 수 있다.EPA에 등록된 살충제 스프레이는 [67]황열병의 전염을 감소시킨다.
- DEET, 피카리딘, 에틸부틸아세틸아미노프로피온산염(IR3535) 또는 레몬유칼립투스 오일이 노출된 [68]피부에는 방충제를 사용하십시오.
- 모기는 얇은 옷에 물릴 수 있기 때문에 퍼메트린이나 EPA 등록 기피제를 함유한 기피제를 옷에 뿌리면 더 [69]많은 보호 효과를 얻을 수 있습니다.퍼메트린으로 처리된 의류는 시판되고 있다.페르메트린이 함유된 모기 퇴치제는 피부에 [70]직접 도포하는 것이 승인되지 않았다.
- 많은 모기들이 무는 절정기는 해질녘부터 새벽까지이다.그러나 황열 바이러스를 옮기는 모기 중 하나인 A. aegypti는 [71]낮에 먹이를 먹습니다.방충망이 쳐져 있거나 에어컨이 설치된 방에서 지내는 것은, 특히 물리는 시간이 가장 많을 때, [71]모기에게 물릴 위험을 줄여줍니다.
예방 접종

현지인이 아닌 사람이 감염되면 더 심각한 병에 걸리기 쉽기 때문에 해당 지역을 여행하는 사람들에게 예방접종을 권장한다.예방은 95%의 사람들에게 [73]백신 투여 후 10일째에 시작되며, 최소 10년 이상 지속된다고 보고되었다.세계보건기구(WHO)는 현재 백신을 [74]1회 접종하면 황열병에 대한 평생 면역력을 얻을 수 있다고 밝히고 있다.감쇠된 생백신 줄기 17D는 1937년 맥스 [73]테일러에 의해 개발되었다.WHO는 [4]생후 9개월에서 12개월 사이에 감염 지역에 사는 사람들에게 정기적인 예방접종을 권고하고 있다.
주사 부위에서 4명 [75]중 1명꼴로 발열, 통증, 국소 통증, 홍조를 경험한다.드문 경우(20만~30만 [73]명 중 1명 미만)지만 황열병 백신 관련 내장향성 질환을 일으킬 수 있어 60%가 치명적이다.그것은 아마도 면역체계의 유전적 형태 때문일 것이다.또 다른 가능한 부작용은 20만~30만 건 중 1건꼴로 발생하는 신경계 감염으로 뇌수막염으로 이어질 수 있고 5% [73][4][25]미만으로 치명적이다.
WHO가 2006년에 시작한 황열병 이니셔티브는 서아프리카 [76]14개국에서 1억 5백만 명 이상의 사람들에게 예방접종을 했다.2015년에는 발병 사례가 보고되지 않았다.이 캠페인은 GAVI 동맹과 유럽과 [77]아프리카의 정부 기관들에 의해 지원되었다.세계보건기구(WHO)에 따르면 대상국의 도시 지역에 감염된 모기가 많아 집단 예방접종이 황열병을 없앨 수는 없지만 [78]감염자 수는 크게 줄어들 것으로 보인다.
황열병 백신에 대한 수요는 일상적인 예방접종 [79]프로그램의 일환으로 황열병 예방접종을 시행하는 국가가 늘어나면서 계속 증가하고 있다.최근 앙골라(2015년), 콩고민주공화국(2016년), 우간다(2016년)에서 황열병이 급증하고, 2017년 나이지리아와 브라질에서 황열병이 발생하면서 수요가 더욱 증가하고 있다.[79][80]따라서, 발병 시 예방적 집단 면역 캠페인의 민감한 집단에게 예방 접종을 하기 위해, 백신의 부분 투여는 제한된 백신 [79]공급을 극대화하는 용량 절약 전략으로 고려되고 있다.부분선량 황열 예방접종은 제조사 [79][81]권고에 따라 재구성된 백신 용량 감소 투여를 말한다.부분선량 황열 예방접종을 최초로 실용화한 것은 2016년 [79]중반 콩고민주공화국에서 발생한 대규모 황열 예방접종에 대한 대응이었다.
2017년 3월, WHO는 브라질에서 비상 비축량 350만 [82]도스로 백신 접종 캠페인을 시작했다.2017년 3월, WHO는 브라질의 [83]특정 지역을 여행하는 사람들에게 백신 접종을 권고했다.2018년 3월, 브라질은 정책을 전환하여 현재 예방접종을 받지 않은 7750만 명의 시민 모두에게 2019년 [84]4월까지 예방접종을 할 계획이라고 발표했다.
강제 예방 접종
아시아의 일부 국가들은 황열병을 전염시키는 능력을 가진 모기들과 민감한 원숭이들이 [85]존재하기 때문에 황열병의 잠재적 위험에 있는 것으로 여겨진다.그 병은 아직 아시아에서는 발생하지 않았다.바이러스 유입을 막기 위해 일부 국가는 황열 지역을 [86]통과한 외국인 방문객에게 사전 예방접종을 요구하고 있다.예방접종은 예방접종 증명서로 증명해야 하며, 예방접종 후 10일 동안 유효하다.2013년 5월 17일 WHO는 후속 부스터 예방접종이 불필요하다고 권고했지만, 모든 영향을 받는 국가의 모든 국경 초소에서 오래된(10년 이상) 인증서는 허용되지 않을 수 있다.황열병 [72]예방접종이 필요한 나라들의 목록은 WHO에 의해 발표된다.어떤 이유로 접종을 할 수 없는 경우에는 접종이 가능할 수 있습니다.이 경우 WHO 공인 예방접종센터에서 발급받은 면제증명서가 필요합니다.황열병이 발생한 44개국 중 32개국이 예방접종 프로그램을 시행하고 있지만, 이들 국가 중 상당수는 인구의 50% 미만이 예방접종을 [4]하고 있다.
벡터 컨트롤
특히 같은 모기가 뎅기열과 [87]치쿤구냐병도 옮길 수 있기 때문에 황열 모기 A. 이집트 모기의 방제는 매우 중요하다.A. 이집트는 식수 공급이 불안정한 지역의 주민에 의해 설치되거나 가정용 쓰레기, 특히 타이어, 캔, 페트병 등에서 우선적으로 번식한다.이러한 조건은 개발도상국의 [88]도시 지역에서 흔히 볼 수 있다.
A. 이집트 개체 [89]수를 줄이기 위해 두 가지 주요 전략이 사용된다.한가지 접근법은 발육중인 애벌레를 죽이는 것이다.애벌레가 발육하는 수분 축적을 줄이기 위한 조치를 취한다.유충을 먹는 물고기, 요각류와 함께 유충의 [90]수를 줄이는 라르비사이드가 사용된다.수년 동안 베트남에서는 메조사이클롭스속의 요각류가 [91]뎅기열을 예방하는 데 사용되어 왔다.이것은 몇몇 지역에서 모기 벡터를 근절시켰다.비슷한 노력이 황열병에 효과적일 수 있다.피리프록시펜은 사람에게 안전하고 소량으로도 효과가 있기 때문에 화학 [4]살충제로 권장된다.
두 번째 전략은 성인 황열 모기의 개체 수를 줄이는 것이다.치명적인 산란기는 해충을 [92]직접 겨냥하기 때문에 적은 양의 농약을 사용하여 에이드 개체 수를 줄일 수 있습니다.물탱크의 커튼과 뚜껑에는 살충제를 뿌릴 수 있지만, 집 안에서 사용하는 것은 [93]WHO에 의해 권장되지 않습니다.살충제로 처리된 모기장은 [4]말라리아를 옮기는 아노펠레스 모기에 대항하는 것처럼 효과적이다.
치료
다른 플라비바이러스 감염과 마찬가지로 황열 치료법은 알려져 있지 않다.입원하는 것이 바람직하며 경우에 따라서는 급속한 악화로 인해 집중 치료가 필요할 수 있습니다.어떤 급성 치료 방법들은 효과가 없다: 증상 발생 후 수동 면역은 아마도 효과가 없을 것이다; 리바비린과 다른 항바이러스제들, 그리고 인터페론에 의한 치료들은 황열 [25]환자들에게 효과가 없다.증상 치료는 파라세타몰(아세트아미노펜)과 같은 약물에 의한 수분 보충과 통증 완화를 포함한다.아세틸살리실산(아스피린)[94]그러나 아스피린과 다른 비스테로이드성 항염증제(NSAIDs)는 항응고제 [95]효과로 인한 위장 출혈 위험이 증가하기 때문에 종종 피한다.
역학
황열병은 남아메리카와 아프리카의 [96]열대 및 아열대 지역에서 흔하다.전 세계적으로, 약 6억 명의 사람들이 풍토 지역에 살고 있다.WHO는 [97]매년 전세계적으로 20만 건의 황열병이 발생하는 것으로 추정하고 있다.황열 감염자의 약 15%가 중증 질환으로 진행되며 황열 [98]치료법이 없어 절반까지 사망한다.
아프리카
황열병 감염의 90%가 아프리카 [4]대륙에서 발생한다.2016년에는 앙골라에서 발원해 인근 국가로 확산된 뒤 대대적인 예방접종 [99]캠페인에 의해 저지됐다.2016년 3, 4월 중국에서 미백신 중국인의 앙골라 유전자형 수입 사례가 11건 보고돼 아시아에서 처음으로 [100][101]발병했다.
계통학 분석에서 황열 바이러스의 7가지 유전자형이 확인되었으며, 그것들은 인간과 A. 이집트 벡터에 다르게 적응하는 것으로 추정된다.5가지 유전자형(Angola, Central/East Africa, East Africa, West Africa I 및 West Africa II)은 아프리카에서만 발생합니다.서아프리카 유전자형 I은 나이지리아와 그 주변 [102]지역에서 발견된다.서아프리카 유전자형 I은 종종 주요 발병과 관련이 있기 때문에 특히 전염성이 강한 것으로 보인다.나이지리아와 앙골라 이외의 지역에서 발견된 세 가지 유전자형은 발병률이 낮은 지역에서 발생한다.케냐(1992년-1993년)와 수단(2003년과 2005년)에서 발생한 두 번의 발병은 지난 40년간 발견되지 [103]않았던 동아프리카 유전자형과 관련이 있다.
남미
남미에서는 두 가지 유전자형(남미 유전자형 I 및 II)[15]이 확인되었다.계통학적 분석에 따르면 이 두 유전자형은 서아프리카에서[104] 유래한 것으로 보이며 [105]브라질에 처음 도입된 것으로 보인다.남미 유전자형을 낳은 아프리카 유전자형의 도입일은 1822년(95% 신뢰구간 1701~1911년)[105]으로 보인다.역사적 기록은 1685년과 1690년 사이에 브라질 헤시피에서 황열병이 발생했음을 보여준다.그 병은 1849년에 [106]다음 번 발병하면서 사라진 것으로 보인다.그것은 아프리카에서 노예 무역을 통해 노예를 밀매하면서 도입된 것으로 보인다.유전자형 I은 5개의 하위 분류군, A에서 [107]E로 나뉩니다.
2016년 말 브라질 미나스제라이스주에서 실반 또는 밀림 에피조틱으로 [108]특징지어지는 대규모 발병이 시작되었다.황열병의 감시종 역할을 하는 갈색 [109]고함원숭이들의 유행으로 시작되었고, 그 후 정글에서 일하는 남성들에게 전염되었다.A. 이집트 모기에 의해 사람 사이에 전염된 사례는 없었다. 이 모기는 빠르게 퍼질 수 있는 도시 발생을 지속할 수 있다.2017년 4월, 대부분의 사람들이 백신을 [83]접종하지 않은 브라질 해안으로 실반 발병이 계속되었다.5월 말에는 3,000명 이상의 의심환자가 발생했고 758명이 확인되었으며 264명이 [110]황열로 확인되었다.보건성은 예방접종 캠페인을 벌여 2월과 3월 카니발 시즌 동안 확산될 것을 우려했다.CDC는 레벨 2 경보를 발령했습니다(강화된 주의사항을 실천합니다).[111]
유전자형 I과 II의 베이지안 분석에 따르면 유전자형 I은 현재 브라질, 콜롬비아, 베네수엘라, 트리니다드 토바고의 거의 모든 감염을 설명하고 있으며, 유전자형 II는 [112]페루의 모든 사례를 설명하고 있다.유전자형 I은 1908년경 브라질 북부 지역에서 유래했다(95% 최고 후방 밀도 간격[HPD]: 1870-1936).유전자형 II는 1920년 페루에서 유래했다. (95% HPD: 1867–1958)[113]두 유전자형에 대한 돌연변이 추정률은 약 5 × 10−4 치환/사이트/년이었으며, 이는 다른 [114]RNA 바이러스와 유사했다.
아시아
주요 벡터(A. aegypti)는 아시아, 태평양, 호주의 열대 및 아열대 지역에서도 발생하지만 제트기 여행으로 2016년 앙골라와 콩고 황열병이 아프리카에서 11건 발생하기 전까지는 황열병이 발생한 적이 없다.제안되는 설명은 다음과 같습니다.[115]
- 동쪽에 있는 모기의 변종이 황열 바이러스를 [116]전염시키는 능력이 떨어진다는 것이다.
- 그 면역력은 관련된 바이러스(예를 들어 뎅기열)[117]에 의해 야기되는 다른 질병 때문에 모집단에 존재한다.
- 해운업이 불충분했기 때문에 병이 발병한 적이 없다는 것이다.
하지만 어느 것도 [118][119]만족스러운 것으로 여겨지지 않는다.또 다른 제안은 아시아에 대한 노예 무역이 미주 [120]대륙에 대한 것과 같은 규모의 없다는 것이다.대서양 횡단 노예 무역은 [121]아마도 아프리카에서 서반구로 황열병을 가져왔을 것이다.
역사
초기 역사
황열병의 진화적 기원은 아프리카에 있을 가능성이 높으며, 이 질병이 비인간 영장류에서 [122][123]인간으로 전염된다.이 바이러스는 동아프리카 또는 중앙아프리카에서 발생했으며 그곳에서 서아프리카로 확산된 것으로 생각된다.그것은 아프리카의 풍토병이었기 때문에 지역 주민들은 그것에 대한 면역력을 키웠다.식민지 주민이 살고 있는 아프리카 공동체에서 황열병이 발생했을 때, 대부분의 유럽인들은 죽은 반면, 토착 아프리카인들은 보통 [124]독감과 유사한 비치명적 증상이 나타났다.특정 집단이 어린 시절 장기간 노출되어 황열에 대한 면역이 생기는 이 현상을 후천성 [125]면역이라고 한다.A.집트균뿐 아니라 이 바이러스는 아마도 유럽 탐험과 식민지화에 [126]따른 콜롬비아 교환의 일부인 아프리카에서 노예를 밀매하면서 북미와 남아메리카로 옮겨졌을 것이다.
신세계에서 황열병이 처음으로 발생한 것은 1647년 바베이도스 [127]섬이었다.1648년 스페인 식민지 개척자들에 의해 유카탄 반도에서 발병한 것으로 기록되었으며, 마야 원주민들은 이 병을 "혈액 토사"라고 불렀다.1685년 브라질은 헤시피에서 첫 전염병을 앓았다."[128]황열"이라는 이름으로 이 병에 대해 처음 언급된 것은 1744년이었다.
- (John Mitchell) (1805) (1741–2) 필라델피아 의료 박물관 웨이백 머신에 2017-02-23 보관, 1:1-20.
- (John Mitchell) (1814) "1737년, 1741년, 1742년에 버지니아에서 유행했던 황열병의 설명"은 고(故) 존 미첼, M.D.F.R.S. of Virginia로부터 뉴욕의 고(故) 캐드월러더 콜든에게 보낸 편지에서 2017-0223년에 보관되었다.""황열"이라는 용어는 186페이지에 나온다.188페이지에서 미첼은 "미국에서는 보통 황열병으로 불리는 것이 디스템퍼였다"고 언급한다.하지만, 191-192페이지에서 그는 "황열병이라는 이름을 붙일 정도로 이 황열병의 [citation needed]원인에 대해 생각해 보겠다"고 말하고 있다.
그러나 미첼 박사는 자신이 관찰하고 치료한 병을 오진했고, 그 병은 아마도 웨일병이나 간염일 것이다.참조:Jarcho S(1957년)."존 미첼, 벤자민 러쉬, 그리고 황열병이".의학의 역사의 게시. 31(2):132–136. PMID 13426674.<>/ref>, 맥닐과 생태 환경 파괴. 설탕 플렌테이션의 도입으로 인한 모기와 바이러스성 재생산, 황열병의 이후 발생하기 위한 조건을 만들어 낸다고 주장한다.[129]삼림 벌채는 모기와 그들의 [130]알을 먹고 사는 식충성 조류와 다른 생물들의 개체 수를 줄였다.
식민지 시대와 나폴레옹 전쟁 동안, 서인도제도는 그 [131]지역의 풍토병인 황열병 때문에 군인들에게 특히 위험한 장소로 알려져 있었다.자메이카 주둔 영국군의 사망률은 캐나다 주둔군 사망률의 7배였는데, 대부분 황열병과 다른 열대성 질병 때문이었다.[132]그곳에 주둔한 영국과 프랑스군 모두 "옐로 잭"[133]의 영향을 심각하게 받았다.생도맹그(히스파니올라)의 돈벌이가 되는 설탕 무역의 주도권을 되찾고 싶어 나폴레옹은 프랑스의 신대륙 제국을 되찾기 위해 매제 찰스 르클레르 장군이 이끄는 군대를 생도맹그에 파견하여 노예 [134]반란 이후 지배권을 장악하였다.역사학자 J. R. McNeill은 황열병이 전투 [135]중에 이들 군대의 약 35,000명에서 45,000명의 사상자를 냈다고 주장한다.프랑스군의 3분의 1만이 철수와 귀환을 위해 살아남았다.나폴레옹은 그 섬과 북미에 대한 계획을 포기하고 1803년 루이지애나 매입을 미국에 팔았다.1804년, 아이티는 서반구에서 [136]두 번째 공화국으로 독립을 선언했다.아이티 혁명의 질병으로 인한 사망자 수가 [137]부풀려진 것이 아니냐는 논란이 일고 있다.
황열병은 열대성 기후에서 가장 흔하지만, 미국 북부는 황열병에서 제외되지 않았다.영어를 사용하는 북미에서 처음으로 발병한 것은 1668년 [138]뉴욕에서였다.필라델피아와 미시시피 강 계곡의 프랑스 식민지 개척자들은 1669년에 대규모 발병을 기록했고, 18세기와 19세기에 필라델피아, 볼티모어, 그리고 뉴욕에서 추가로 황열병이 유행했다.이 질병은 뉴올리언스에서 증기선 항로를 따라 이동했고,[139] 총 10만 명에서 15만 명의 사망자를 냈다.1793년 당시 미국의 수도였던 필라델피아에서 발생한 황열병은 인구의 [140]9% 이상인 수천 명의 사망자를 낳았다.이 사망자 중 한 명은 제임스 허친슨으로, 도시의 주민들을 치료하는데 도움을 주었다.정부는 조지 워싱턴 대통령을 [141]포함한 뉴저지 트렌튼으로 도시를 탈출했다.
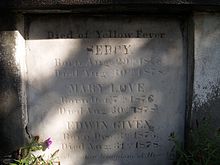
뉴올리언스의 남쪽 도시는 19세기 동안, 특히 1833년과 [142]1853년에 큰 전염병으로 시달렸다.1873년 루이지애나주 뉴올리언스와 슈리브포트에서 큰 전염병이 발생했다.그곳의 주민들은 이 병을 "노란 잭"이라고 불렀다.미국에서는 1905년까지 도시 전염병이 계속되었고, 마지막 발병은 뉴올리언스에 [143][15][144]영향을 미쳤다.
18세기와 19세기 동안 아메리카 대륙에서 적어도 25건의 주요 발병이 발생했는데, 1741년 칠레 카르타헤나, 1762년과 1900년 쿠바, 1803년 산토 도밍고, [145]1878년 테네시 멤피스에서 특히 심각한 발병이 발생했다.
19세기 초 카리브해에서 발생한 황열병의 유행은 "심각한 건강 문제로 이어졌다"며 수많은 사망과 질병이 해군 작전을 축소시키고 [146]사기를 저하시킴으로써 미 해군에 경종을 울렸다.한 에피소드는 1822년 4월 USS 마케도니아호가 보스턴을 떠나 제임스 비들 제독의 서인도 비행대의 일부가 되면서 시작되었다.모두에게 알려지지 않은 채, 그들은 재난으로 향하는 순항길에 오르려고 했고 그들의 임무는 [147]"지옥을 통과하는 순항이 될 것"이었다.해군 장관 스미스 톰슨은 미국 상선을 경비하고 [148]해적 행위를 진압하도록 함대를 배치했다.1822년 5월 26일부터 8월 3일까지 파견된 기간 동안 외과 의사 존 캐들(John Cadle)을 포함한 마케도니아 병사 76명이 사망했다.이들 중 74명은 황열로 인한 것으로 알려졌다.비들은 또 다른 52명의 승무원이 병가 명단에 올랐다고 보고했다.해군 장관에게 보낸 보고서에서, 비들과 외과의사 동료 찰스 체이스는 그 원인을 "열"이라고 말했다.이 패배의 결과로, 비들은 그의 함대가 노퍽 해군 야드로 일찍 복귀할 수밖에 없었다고 언급했다.도착하자마자, 마케도니아 선원들은 치료를 [149][150][151]받았고 버지니아 크레인 섬에 격리되었다.
1853년 루이지애나주 클루티어빌은 늦여름 황열병이 발생해 주민 91명 중 68명이 사망했다.지역 의사는 뉴올리언스에서 [152][153]온 소포에 불특정 감염 요원들이 실려 왔다고 결론지었다.1854년 조지아주 사바나에서 650명의 주민이 [154]황열병으로 사망했다.1858년 사우스캐롤라이나 찰스턴에 있는 세인트 매튜 독일 복음 루터 교회는 308명의 황열로 사망해 신도 수가 [155]절반으로 줄었다.바이러스에 감염된 사람들을 태운 배가 1855년 [156]6월 버지니아 남동부의 햄프턴 로드에 도착했다.이 질병은 지역 사회 전체에 빠르게 퍼졌고, 결국 3,000명 이상의 사람들이 사망했는데, 대부분 노퍽과 [157]포츠머스의 주민들이다.1873년 루이지애나주 슈리브포트는 황열병으로 80일 동안 759명의 시민을 잃었고 400명 이상의 추가 희생자가 결국 사망했다.8월부터 11월까지의 총 사망자 수는 약 1,200명이었다.[158][159]
1878년 미시시피 강 [160]계곡에서 만연한 전염병으로 약 20,000명의 사람들이 죽었다.그 해에 멤피스는 이례적으로 많은 양의 비가 내렸고, 이는 모기 개체수의 증가로 이어졌다.그 결과는 황열병의 [161]대유행이었다.기선 존 D.포터는 멤피스를 탈출하는 사람들을 북쪽으로 데려갔지만 승객들은 황열병이 퍼질 것을 우려해 하차할 수 없었다.그 배는 이후 두 달 동안 미시시피 강을 배회한 [162]후 승객들을 내렸다.
남유럽에서도 대규모 발병 사례가 발생하고 있다.지브롤터는 1804년, 1814년,[163] 그리고 1828년에 발병으로 많은 생명을 잃었다.바르셀로나는 1821년 발발 당시 수천 명의 시민을 잃었다.리슐리외 공작은 전염병이 스페인에서 [164]프랑스로 확산되는 것을 막기 위해 피레네 산맥의 프랑스와 스페인 국경지대에 3만 명의 프랑스군을 배치했다.
원인과 전염
오타와 예언자로 알려진 이즈키엘 스톤 위긴스는 1888년 플로리다 잭슨빌에서 발생한 황열병의 원인이 [165]점성술이라고 주장했다.
행성들은 태양과 지구와 같은 선상에 있었고 이것은 사이클론, 지진 등을 제외하고 더 많은 탄소를 포함하고 미생물을 생성했다.화성의 대기는 평범하지 않았지만 주민들은 아마도 탄소를 흡수하고 [166]질병을 예방하기 위해 만들어진 새로 발견된 운하에 의해 열로부터 보호되었을 것이다.
1848년, 조시아 C. 노트는 황열병이 나방이나 모기 같은 곤충에 의해 퍼진다고 주장했는데,[167] 이는 황열병의 전염 패턴에 근거한 그의 생각이었다.쿠바의 의사이자 과학자인 카를로스 핀레이는 1881년 황열병은 오랫동안 [168][169]믿어왔던 것처럼 사람 간의 직접적인 접촉보다는 이전에 감염된 모기들에 의해 전염될 수 있다고 제안했다.1890년대 스페인-미국 전쟁에서 황열병으로 인한 손실이 매우 높았기 때문에, 육군 의사들은 월터 리드가 이끄는 의사 제임스 캐롤, 아리스티데스 아그라몬테, 그리고 제시 윌리엄 라지아로 구성된 팀과 함께 연구 실험을 시작했다.그들은 핀레이의 "모기 가설"을 성공적으로 증명했다.황열병은 모기에 의해 전염되는 첫 번째 바이러스였다.의사 윌리엄 고가스는 이러한 통찰력을 적용하여 아바나에서 황열병을 퇴치했다.그는 또한 파나마 운하를 건설하는 동안 황열병 퇴치 운동을 벌였다.이전에 프랑스인들이 운하를 건설하려다 황열병과 말라리아로 인한 사망률로 인해 부분적으로 실패했는데, 이것은 많은 [15]노동자들을 죽게 했다.
비록 리드는 미국 역사책에서 황열병을 이겨낸 공로를 많이 인정받았지만, 그는 핀레이가 황열병의 매개체를 발견했고, 어떻게 황열병을 통제할 수 있는지를 전적으로 인정했습니다.리드는 종종 자신의 기사에서 핀레이의 논문을 인용했고, 또한 그의 개인적인 [170]서신에서 핀레이의 발견에 대한 공로를 돌렸다.핀레이의 작품을 받아들인 것은 1900년 [171]미군 황열 위원회의 가장 중요하고 광범위한 영향 중 하나였다.미국 정부와 육군은 핀레이가 처음 제안한 방법을 적용하여 쿠바와 파나마에서 황열병을 퇴치하고 파나마 운하를 완공했다.리드가 핀레이의 연구를 기반으로 한 반면, 역사학자 프랑수아 들라포르테는 황열병 연구는 논쟁의 여지가 있는 문제였다고 지적한다.Finlay와 Reed를 포함한 과학자들은 그들이 마땅히 받아야 [172]할 공로를 항상 주지 않고 덜 저명한 과학자들의 연구를 바탕으로 성공적이 되었다.리드의 연구는 황열병 퇴치에 필수적이었다.그는 또한 [173]쿠바에서 실험하는 동안 참가자들이 실험의 일부가 됨으로써 위험을 감수하고 있다는 것을 확실히 알도록 하기 위해 첫 번째 유형의 의료 동의서를 사용한 것으로 인정받고 있다.
쿠바와 파나마처럼 브라질도 모기와 황열병에 대한 위생 캠페인을 성공적으로 이끌었다.1903년 당시 보건국장이었던 오스왈도 크루즈가 주도한 캠페인은 이 병을 근절하는 데 그치지 않고 [174]리우데자네이루와 같은 브라질 도시들의 물리적 지형도 재편하는 결과를 낳았다.우기 동안, 리우데자네이루는 도시를 둘러싼 만에서 물이 리오의 좁은 거리로 넘쳐나면서 정기적으로 홍수를 겪었다.리우데자네이루 전역에서 발견된 열악한 배수 시스템과 함께, 이것은 도시 주변 지역에 늪지대의 환경을 만들었다.고여있는 물웅덩이가 1년 내내 시내 거리에 서있었고 질병을 옮기는 모기를 옮기는 비옥한 땅임이 증명되었다.이에 따라 크루즈의 지휘 아래 '모기 검사관'으로 알려진 공중위생부대는 살포, 쥐 박멸, 배수 개선, 비위생적인 주택 파괴 등 리우 전역에서 황열병 퇴치를 위해 치열하게 일했다.궁극적으로, 도시의 위생과 보수 캠페인은 리우데자네이루의 인근 지역을 재편성했다.가난한 주민들은 도심에서 리오의 교외로, 또는 도시 외곽에 있는 마을로 밀려났다.나중에 리오의 가장 빈곤한 주민들은 빈민가에 [175]살게 될 것이다.
1920년에서 1923년 사이에 록펠러 재단의 국제 보건 위원회는 [176]멕시코에서 비싸고 성공적인 황열병 퇴치 캠페인을 시작했습니다.IHB는 성공으로 멕시코 연방정부의 존경을 받았다.황열병의 근절은 미국과 멕시코의 관계를 강화시켰는데, 그 이전 몇 년 동안 그다지 좋지 않았던 관계였다.황열병의 근절은 또한 더 나은 지구 [177]건강을 위한 중요한 단계였다.
1927년에 과학자들은 서아프리카에서 [178]황열병을 분리했다.그 후 1930년대에 두 개의 백신이 개발되었습니다.맥스 테일러는 1937년 17D 황열병 백신의 완성을 이끌었고, 그 공로로 노벨 생리의학상을 [179]수상했습니다.베로 세포를 기반으로 한 새로운 백신이 개발 중이지만, 17D 백신은 여전히 사용되고 있다(2018년 [4][180][181]현재).
현황
벡터 제어와 엄격한 백신 접종 프로그램을 이용하여,[182] 황열병의 도시 순환은 남미에서 거의 근절되었다.1943년 이후 볼리비아 산타크루즈 데 라 시에라에서는 단 한 건의 도시발병만이 발생했다.그러나 1980년대 이후 황열병 환자가 다시 증가해 A.집트균이 남미 도심으로 돌아왔다.이것은 부분적으로 이용 가능한 살충제의 제한과 기후 변화로 인한 서식지 이탈 때문이다.벡터 제어 프로그램이 포기되었기 때문이기도 하다.아직 새로운 도시 순환이 확립되지 않았지만, 과학자들은 이런 일이 언제든 다시 일어날 수 있다고 믿고 있다.2008년 파라과이에서 발생한 사건은 사실상 도시적인 것으로 여겨졌지만,[4] 결국 그렇지 않은 것으로 판명되었다.
아프리카에서 바이러스 퇴치 프로그램은 대부분 백신 [183]접종에 의존해 왔다.이 프로그램들은 야생 영장류와 관련된 숲의 순환을 깨지 못했기 때문에 대부분 성공하지 못했다.정기적인 예방접종 프로그램을 시행하는 나라가 거의 없어 황열병 대책은 소홀히 하고 있어 향후 확산 [4]가능성이 높아지고 있다.
조사.
황열 햄스터 모델에서 항바이러스 리바비린의 조기 투여는 질병의 [184]많은 병리학적 특징의 효과적인 치료법이다.바이러스 감염 후 첫 5일 동안의 리바비린 치료는 생존율을 향상시키고, 간과 비장의 조직 손상을 감소시키며, 간세포 지방증을 예방하고, 간 손상 지표인 알라닌 아미노기전달효소의 수준을 표준화했다.황열 바이러스 감염에서 간 병리를 감소시키는 리바비린의 작용 메커니즘은 관련 [184]바이러스인 C형 간염 치료에서의 활동과 유사할 수 있다.리바비린은 황열 감염의 치명적인 붉은털 모델에서 생존을 개선하지 못했기 때문에, 이전에는 가능한 치료법으로 [185]여겨져 왔다.Wolbachia의 [186]wMel 변종 모기에 대한 감염이 감소하였다.
황열병은 여러 나라에 의해 잠재적인 생물학적 [187]무기로 연구되어 왔다.
메모들
레퍼런스
- ^ a b c d Oldstone M (2009). Viruses, Plagues, and History: Past, Present and Future. Oxford University Press. pp. 102–4. ISBN 978-0-19-975849-4. Archived from the original on 2017-02-23.
- ^ Bazin H (2011). Vaccination: a history from Lady Montagu to genetic engineering. Montrouge: J. Libbey Eurotext. p. 407. ISBN 978-2-7420-0775-2. Archived from the original on 2017-02-23.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab "Yellow fever Fact sheet N°100". World Health Organization. May 2013. Archived from the original on 19 February 2014. Retrieved 23 February 2014.
- ^ a b c d e f g h i j k l m Tolle MA (April 2009). "Mosquito-borne diseases". Current Problems in Pediatric and Adolescent Health Care. 39 (4): 97–140. doi:10.1016/j.cppeds.2009.01.001. PMID 19327647.
- ^ "Yellow Fever". Healthline. 2021-02-25. Retrieved 2022-04-22.
- ^ Scully C (2014). Scully's Medical Problems in Dentistry. Elsevier Health Sciences. p. 572. ISBN 978-0-7020-5963-6.
- ^ "Yellow fever". www.who.int. Retrieved 2022-04-30.
- ^ "Yellow fever - Symptoms and causes". Mayo Clinic. Retrieved 2022-04-27.
- ^ Goes de Jesus, Jaqueline; Gräf, Tiago; Giovanetti, Marta; Mares-Guia, Maria Angélica; Xavier, Joilson; Lima Maia, Maricelia; Fonseca, Vagner; Fabri, Allison; dos Santos, Roberto Fonseca; Mota Pereira, Felicidade; Ferraz Oliveira Santos, Leandro (2020-08-11). "Yellow fever transmission in non-human primates, Bahia, Northeastern Brazil". PLOS Neglected Tropical Diseases. 14 (8): e0008405. doi:10.1371/journal.pntd.0008405. ISSN 1935-2727. PMC 7418952. PMID 32780745.
- ^ a b c Lindenbach BD, Rice CM (2007). "Flaviviridae: The Viruses and Their Replication". In Knipe DM, Howley PM (eds.). Fields Virology (5th ed.). Philadelphia, PA: Lippincott Williams & Wilkins. p. 1101. ISBN 978-0-7817-6060-7.
- ^ "Flavivirus virus genus Britannica". www.britannica.com. Retrieved 2022-04-27.
- ^ "Frequently Asked Questions About Yellow Fever". CDC. August 21, 2015. Archived from the original on 23 March 2016. Retrieved 18 March 2016.
- ^ Lataillade, Lucy de Guilhem de; Vazeille, Marie; Obadia, Thomas; Madec, Yoann; Mousson, Laurence; Kamgang, Basile; Chen, Chun-Hong; Failloux, Anna-Bella; Yen, Pei-Shi (2020-11-16). "Risk of yellow fever virus transmission in the Asia-Pacific region". Nature Communications. 11 (1): 5801. Bibcode:2020NatCo..11.5801L. doi:10.1038/s41467-020-19625-9. ISSN 2041-1723. PMC 7669885. PMID 33199712.
- ^ "CDC Yellow Fever". Archived from the original on 2012-12-21. Retrieved 2012-12-12.
- ^ a b c d e f Barrett AD, Higgs S (2007). "Yellow fever: a disease that has yet to be conquered". Annual Review of Entomology. 52: 209–229. doi:10.1146/annurev.ento.52.110405.091454. PMID 16913829. S2CID 9896455.
- ^ "History of Yellow Fever in the U.S." ASM.org. Retrieved 2022-04-27.
- ^ Sfakianos J, Hecht A (2009). Babcock H (ed.). West Nile Virus (Curriculum-based juvenile nonfiction). Deadly Diseases & Epidemics. Foreword by David Heymann (2nd ed.). New York: Chelsea House. p. 17. ISBN 978-1-60413-254-0.
The yellow fever virus was isolated in 1927
- ^ "CDC: Yellow fever—Symptoms and treatment". Archived from the original on 2012-03-21. Retrieved 2010-11-10.
- ^ "Yellow fever". WHO. Archived from the original on 2009-08-17. Retrieved 2009-08-13.
- ^ "Yellow fever". www.who.int. Retrieved 2021-07-11.
- ^ Control of Communicable Diseases Manual (20th ed.). Amer Public Health Assn. 2015. ISBN 978-0-87553-018-5.
- ^ Chastel C (August 2003). "[Centenary of the discovery of yellow fever virus and its transmission by a mosquito (Cuba 1900-1901)]". Bulletin de la Socitété de Pathologie Exotique (in French). 96 (3): 250–256. PMID 14582304.
- ^ 어윈 셔먼 박사, 세상을 바꾼 12가지 질병. 페이지 144ASM 프레스2007. ISBN 978-1-55581-466-3.OCLC 141178241.
- ^ 프랭클린, 존 서덜랜드, 존기니피그 의사: 뉴욕 자기실험을 통한 의학연구 드라마 윌리엄 모로(1984년 3월) ISBN 0-688-02666-4
- ^ a b c d Monath TP (April 2008). "Treatment of yellow fever". Antiviral Research. 78 (1): 116–124. doi:10.1016/j.antiviral.2007.10.009. PMID 18061688. S2CID 44119619.
- ^ Tomori O (2004). "Yellow fever: the recurring plague". Critical Reviews in Clinical Laboratory Sciences. 41 (4): 391–427. doi:10.1080/10408360490497474. PMID 15487593. S2CID 13559157.
- ^ Modrow S, Falke D, Truyen U (2002). Molekulare Virologie – Eine Einführung für Biologen und Mediziner (2nd ed.). Spektrum Akademischer Verlag. p. 182. ISBN 978-3-8274-1086-3.
- ^ Rogers DJ, Wilson AJ, Hay SI, Graham AJ (2006). "The global distribution of yellow fever and dengue". Global Mapping of Infectious Diseases: Methods, Examples and Emerging Applications. Advances in Parasitology. Vol. 62. pp. 181–220. doi:10.1016/S0065-308X(05)62006-4. ISBN 978-0-12-031762-2. PMC 3164798. PMID 16647971.
- ^ "Symptoms, Diagnosis, & Treatment". www.cdc.gov. 2020-02-26. Retrieved 2022-04-30.
- ^ "Yellow fever - Symptoms and causes". Mayo Clinic. Retrieved 2022-03-31.
- ^ "Yellow Fever: Symptoms, Complications, and Treatment". Practo. Retrieved 2022-03-31.
- ^ Staples JE, Monath TP (August 2008). "Yellow fever: 100 years of discovery". JAMA. 300 (8): 960–962. doi:10.1001/jama.300.8.960. PMID 18728272.
- ^ Chandriani S, Skewes-Cox P, Zhong W, Ganem DE, Divers TJ, Van Blaricum AJ, et al. (April 2013). "Identification of a previously undescribed divergent virus from the Flaviviridae family in an outbreak of equine serum hepatitis". Proceedings of the National Academy of Sciences of the United States of America. 110 (15): E1407–E1415. doi:10.1007/978-3-642-20718-1_14. ISBN 978-3-642-20717-4. PMC 7169642. PMID 23509292.
- ^ a b c Sampath A, Padmanabhan R (January 2009). "Molecular targets for flavivirus drug discovery". Antiviral Research. 81 (1): 6–15. doi:10.1016/j.antiviral.2008.08.004. PMC 2647018. PMID 18796313.
- ^ Roby JA, Pijlman GP, Wilusz J, Khromykh AA (January 2014). "Noncoding subgenomic flavivirus RNA: multiple functions in West Nile virus pathogenesis and modulation of host responses". Viruses. 6 (2): 404–427. doi:10.3390/v6020404. PMC 3939463. PMID 24473339.
- ^ Funk A, Truong K, Nagasaki T, Torres S, Floden N, Balmori Melian E, et al. (November 2010). "RNA structures required for production of subgenomic flavivirus RNA". Journal of Virology. 84 (21): 11407–11417. doi:10.1128/JVI.01159-10. PMC 2953152. PMID 20719943.
- ^ Silva PA, Pereira CF, Dalebout TJ, Spaan WJ, Bredenbeek PJ (November 2010). "An RNA pseudoknot is required for production of yellow fever virus subgenomic RNA by the host nuclease XRN1". Journal of Virology. 84 (21): 11395–11406. doi:10.1128/jvi.01047-10. PMC 2953177. PMID 20739539.
- ^ "Hemorrhagic Fevers". medlineplus.gov. Retrieved 2022-04-24.
- ^ Vercammen E, Staal J, Beyaert R (January 2008). "Sensing of viral infection and activation of innate immunity by toll-like receptor 3". Clinical Microbiology Reviews. 21 (1): 13–25. doi:10.1128/CMR.00022-07. PMC 2223843. PMID 18202435.
- ^ "Receptor-Mediated Endocytosis - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-04-24.
- ^ Mudhakir D, Harashima H (March 2009). "Learning from the viral journey: how to enter cells and how to overcome intracellular barriers to reach the nucleus". The AAPS Journal. 11 (1): 65–77. doi:10.1208/s12248-009-9080-9. PMC 2664881. PMID 19194803.
- ^ Dhiman G, Abraham R, Griffin DE (July 2019). "Human Schwann cells are susceptible to infection with Zika and yellow fever viruses, but not dengue virus". Scientific Reports. 9 (1): 9951. Bibcode:2019NatSR...9.9951D. doi:10.1038/s41598-019-46389-0. PMC 6616448. PMID 31289325.
- ^ Inoue T, Tsai B (January 2013). "How viruses use the endoplasmic reticulum for entry, replication, and assembly". Cold Spring Harbor Perspectives in Biology. 5 (1): a013250. doi:10.1101/cshperspect.a013250. PMC 3579393. PMID 23284050.
- ^ Veesler D, Johnson JE (2012). "Virus maturation". Annual Review of Biophysics. 41: 473–496. doi:10.1146/annurev-biophys-042910-155407. PMC 3607295. PMID 22404678.
- ^ Op De Beeck A, Molenkamp R, Caron M, Ben Younes A, Bredenbeek P, Dubuisson J (January 2003). "Role of the transmembrane domains of prM and E proteins in the formation of yellow fever virus envelope". Journal of Virology. 77 (2): 813–820. doi:10.1128/JVI.77.2.813-820.2003. PMC 140810. PMID 12502797.
- ^ a b c "Yellow fever". www.who.int. Retrieved 2022-04-24.
- ^ a b c "Yellow fever". www.who.int. Retrieved 2022-04-24.
- ^ Kumar A, Srivastava P, Sirisena P, Dubey SK, Kumar R, Shrinet J, Sunil S (August 2018). "Mosquito Innate Immunity". Insects. 9 (3): 95. doi:10.3390/insects9030095. PMC 6165528. PMID 30096752.
- ^ a b "Yellow Fever Virus - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-04-24.
- ^ Nag DK, Payne AF, Dieme C, Ciota AT, Kramer LD (September 2021). "Zika virus infects Aedes aegypti ovaries". Virology. 561: 58–64. doi:10.1016/j.virol.2021.06.002. PMID 34147955.
- ^ Fontenille D, Diallo M, Mondo M, Ndiaye M, Thonnon J (1997). "First evidence of natural vertical transmission of yellow fever virus in Aedes aegypti, its epidemic vector". Transactions of the Royal Society of Tropical Medicine and Hygiene. 91 (5): 533–535. doi:10.1016/S0035-9203(97)90013-4. PMID 9463659.
- ^ "Infectious Diseases Related to Travel". Yellow Book. Centers for Disease Control and Prevention. Archived from the original on 20 March 2016. Retrieved 20 March 2016.
- ^ Zerbo A, Delgado RC, González PA (2020-12-01). "Aedes-borne viral infections and risk of emergence/resurgence in Sub-Saharan African urban areas". Journal of Biosafety and Biosecurity. 2 (2): 58–63. doi:10.1016/j.jobb.2020.10.002. ISSN 2588-9338. S2CID 228911642.
- ^ Kotar SL, Gessler JE (2017-02-03). Yellow Fever: A Worldwide History. McFarland. ISBN 978-1-4766-2628-4.
- ^ "Sabethes - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-04-24.
- ^ Blyth DM, Robertson JL, Busowski MT (2021-10-16). Brusch JL (ed.). "Yellow Fever: Practice Essentials, Background, Etiology". Medscape.
- ^ "Yellow fever fact sheet". WHO—Yellow fever. Archived from the original on 2006-04-18. Retrieved 2006-04-18.
- ^ "Ebola outbreak Alert and response operations Diseases Biorisk reduction Yellow fever : a current threat". WHO. Archived from the original on 8 August 2016. Retrieved 4 August 2016.
- ^ Ryan KJ, Ray CG, eds. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. ISBN 978-0-8385-8529-0.
- ^ Quaresma JA, Barros VL, Pagliari C, Fernandes ER, Guedes F, Takakura CF, et al. (February 2006). "Revisiting the liver in human yellow fever: virus-induced apoptosis in hepatocytes associated with TGF-beta, TNF-alpha and NK cells activity". Virology. 345 (1): 22–30. doi:10.1016/j.virol.2005.09.058. PMID 16278000.
- ^ Leland DS, Ginocchio CC (January 2007). "Role of cell culture for virus detection in the age of technology". Clinical Microbiology Reviews. 20 (1): 49–78. doi:10.1128/CMR.00002-06. PMC 1797634. PMID 17223623.
- ^ "Validate User". academic.oup.com. Retrieved 2022-04-30.
- ^ Falconar AK, de Plata E, Romero-Vivas CM (September 2006). "Altered enzyme-linked immunosorbent assay immunoglobulin M (IgM)/IgG optical density ratios can correctly classify all primary or secondary dengue virus infections 1 day after the onset of symptoms, when all of the viruses can be isolated". Clinical and Vaccine Immunology. 13 (9): 1044–1051. doi:10.1128/CVI.00105-06. PMC 1563575. PMID 16960117.
- ^ Houghton-Triviño N, Montaña D, Castellanos J (March 2008). "Dengue-yellow fever sera cross-reactivity; challenges for diagnosis". Revista de Salud Publica. 10 (2): 299–307. doi:10.1590/s0124-00642008000200010. PMID 19039426.
- ^ Talwani R, Gilliam BL, Howell C (February 2011). "Infectious diseases and the liver". Clinics in Liver Disease. 15 (1): 111–130. doi:10.1016/j.cld.2010.09.002. PMC 3660095. PMID 21111996.
- ^ Cleri DJ, Ricketti AJ, Porwancher RB, Ramos-Bonner LS, Vernaleo JR (June 2006). "Viral hemorrhagic fevers: current status of endemic disease and strategies for control". Infectious Disease Clinics of North America. 20 (2): 359–93, x. doi:10.1016/j.idc.2006.02.001. PMC 7135140. PMID 16762743.
- ^ "Prevention Yellow Fever CDC". www.cdc.gov. Archived from the original on 2016-10-26. Retrieved 2016-10-26.
- ^ Lo WL, Mok KL, Yu Pui Ming SD (September 2018). "Which insect repellents should we choose? Implications from results of local market survey and review of current guidelines". Hong Kong Journal of Emergency Medicine. 25 (5): 272–280. doi:10.1177/1024907918773630. ISSN 1024-9079. S2CID 115355721.
- ^ Shmaefsky BR (November 2009). Yellow Fever. Infobase Publishing. ISBN 978-1-60413-231-1.
- ^ US EPA, OCSPP (2013-07-15). "Repellent-Treated Clothing". www.epa.gov. Retrieved 2022-04-25.
- ^ a b "Frequently Asked Questions". www.cdc.gov. 2020-02-26. Retrieved 2022-04-25.
- ^ a b "Countries with risk of yellow fever transmission and countries requiring yellow fever vaccination (May 2021)". World Health Organization. United Nations. 26 May 2021. Retrieved 16 January 2022.
- ^ a b c d Barrett AD, Teuwen DE (June 2009). "Yellow fever vaccine - how does it work and why do rare cases of serious adverse events take place?". Current Opinion in Immunology. 21 (3): 308–313. doi:10.1016/j.coi.2009.05.018. PMID 19520559.
- ^ WHO 황열 예방 접종 촉진제는 WHO 웨이백 기계에서 2013-06-09년 아카이브할 필요가 없습니다.Who.int (2013-05-17)2014년 5월 12일 취득.
- ^ 황열병 백신 정보 기술서.2013-09-21 Wayback Machine Centers for Disease Control and Prevention에서 보관.2011년 3월 30일
- ^ "Yellow fever". World Health Organization. Archived from the original on 18 April 2017. Retrieved 2 April 2017.
- ^ "Measles vaccination has saved an estimated 17.1 million lives since 2000". www.who.int. Retrieved 2022-04-25.
- ^ "Twelve million West Africans get yellow fever vaccines". BBC News. 23 November 2009. Archived from the original on 8 September 2017. Retrieved 23 November 2009.
- ^ a b c d e "Fractional Dose Yellow Fever Vaccine as a Dose-sparing Option for Outbreak Response. WHO Secretariat Information Paper. Department of Immunization, Vaccines and Biologicals. WHO reference number: WHO/YF/SAGE/16.1". World Health Organization. 20 July 2016. Retrieved 2 September 2018.
- ^ "WHO supports the immunization of 874 000 people against yellow fever in Nigeria. News Release". World Health Organization. 16 October 2017. Retrieved 2 September 2018.
- ^ World Health Organization (October 2017). "Human papillomavirus vaccines: WHO position paper, May 2017-Recommendations". Vaccine. 35 (43): 5753–5755. doi:10.1016/j.vaccine.2017.05.069. PMID 28596091.
- ^ "WHO dispatched 3.5 million doses of yellow fever vaccine for outbreak response in Brazil". World Health Organization. Archived from the original on 1 April 2017. Retrieved 2 April 2017.
- ^ a b "Yellow fever – Brazil". Nature. 150 (3811): 573. 1942. Bibcode:1942Natur.150T.573.. doi:10.1038/150573d0.
- ^ Darlington S (20 March 2018). "Fearing New Outbreaks, Brazil Will Vaccinate Country Against Yellow Fever". The New York Times. Retrieved 21 March 2018.
- ^ Kuno G (November 2020). "The Absence of Yellow Fever in Asia: History, Hypotheses, Vector Dispersal, Possibility of YF in Asia, and Other Enigmas". Viruses. 12 (12): 1349. doi:10.3390/v12121349. PMC 7759908. PMID 33255615.
- ^ Wasserman S, Tambyah PA, Lim PL (July 2016). "Yellow fever cases in Asia: primed for an epidemic". International Journal of Infectious Diseases. 48: 98–103. doi:10.1016/j.ijid.2016.04.025. PMID 27156836.
- ^ "Vector-borne diseases". www.who.int. Retrieved 2022-04-25.
- ^ "Humanitarian emergencies". www.who.int. Retrieved 2022-04-25.
- ^ Singh RK, Dhama K, Khandia R, Munjal A, Karthik K, Tiwari R, et al. (2018). "Prevention and Control Strategies to Counter Zika Virus, a Special Focus on Intervention Approaches against Vector Mosquitoes-Current Updates". Frontiers in Microbiology. 9: 87. doi:10.3389/fmicb.2018.00087. PMC 5809424. PMID 29472902.
- ^ US EPA, OCSPP (2013-02-21). "Controlling Mosquitoes at the Larval Stage". www.epa.gov. Retrieved 2022-04-25.
- ^ Tran TT, Olsen A, Viennet E, Sleigh A (January 2015). "Social sustainability of Mesocyclops biological control for dengue in South Vietnam". Acta Tropica. 141 (Pt A): 54–59. doi:10.1016/j.actatropica.2014.10.006. PMID 25312335.
- ^ Hustedt JC, Boyce R, Bradley J, Hii J, Alexander N (June 2020). "Use of pyriproxyfen in control of Aedes mosquitoes: A systematic review". PLOS Neglected Tropical Diseases. 14 (6): e0008205. doi:10.1371/journal.pntd.0008205. PMC 7314096. PMID 32530915.
- ^ Pérez D, Van der Stuyft P, Toledo ME, Ceballos E, Fabré F, Lefèvre P (January 2018). "Insecticide treated curtains and residual insecticide treatment to control Aedes aegypti: An acceptability study in Santiago de Cuba". PLOS Neglected Tropical Diseases. 12 (1): e0006115. doi:10.1371/journal.pntd.0006115. PMC 5766245. PMID 29293501.
- ^ "Acetylsalicylic Acid Plus Caffeine Plus Paracetamol - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-04-25.
- ^ Sterk E (January 2013). "Yellow Fever Case Management" (PDF). OCG BibOp. Médecins Sans Frontières. Retrieved 6 May 2021.
NSAIDS need to be avoided because of the risk of gastrointestinal bleeding and the anti-platelet effect (aspirin).
- ^ Simon LV, Hashmi MF, Torp KD (2022). "Yellow Fever". StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 29262028. Retrieved 2022-04-25.
- ^ "Global Health - Newsroom - Yellow Fever". www.cdc.gov. 2019-02-19. Retrieved 2022-04-25.
- ^ "Yellow fever vaccination booster not needed". www.who.int. Retrieved 2021-10-09.
- ^ "Mass vaccination campaign to protect millions against yellow fever in Angola and Democratic Republic of the Congo". www.who.int. Retrieved 2022-04-25.
- ^ "Yellow Fever – China". World Health Organization. Archived from the original on 19 March 2017. Retrieved 9 February 2017.
- ^ Woodall JP, Yuill TM (July 2016). "Why is the yellow fever outbreak in Angola a 'threat to the entire world'?". International Journal of Infectious Diseases. 48: 96–97. doi:10.1016/j.ijid.2016.05.001. PMID 27163382.
- ^ Mutebi JP, Barrett AD (November 2002). "The epidemiology of yellow fever in Africa". Microbes and Infection. 4 (14): 1459–1468. doi:10.1016/S1286-4579(02)00028-X. PMID 12475636.
- ^ Ellis BR, Barrett AD (2008). "The enigma of yellow fever in East Africa". Reviews in Medical Virology. 18 (5): 331–346. doi:10.1002/rmv.584. PMID 18615782. S2CID 23266086.
- ^ Mutebi JP, Rijnbrand RC, Wang H, Ryman KD, Wang E, Fulop LD, et al. (September 2004). "Genetic relationships and evolution of genotypes of yellow fever virus and other members of the yellow fever virus group within the Flavivirus genus based on the 3' noncoding region". Journal of Virology. 78 (18): 9652–9665. doi:10.1128/JVI.78.18.9652-9665.2004. PMC 515011. PMID 15331698.
- ^ a b Auguste AJ, Lemey P, Pybus OG, Suchard MA, Salas RA, Adesiyun AA, et al. (October 2010). "Yellow fever virus maintenance in Trinidad and its dispersal throughout the Americas". Journal of Virology. 84 (19): 9967–9977. doi:10.1128/JVI.00588-10. PMC 2937779. PMID 20631128.
- ^ Bhattacharya A. A REVIEW ON VIRAL HEMORRHAGIC FEVER. Lulu.com. ISBN 978-1-304-11397-9.
- ^ de Souza RP, Foster PG, Sallum MA, Coimbra TL, Maeda AY, Silveira VR, et al. (January 2010). "Detection of a new yellow fever virus lineage within the South American genotype I in Brazil". Journal of Medical Virology. 82 (1): 175–185. doi:10.1002/jmv.21606. PMID 19950229. S2CID 96746.
- ^ "YELLOW FEVER - AMERICAS (01): PAHO/WHO 2016". www.promedmail.org. International Society for Infectious Diseases. Archived from the original on 16 February 2017. Retrieved 16 February 2017.
- ^ "Yellow fever killing thousands of monkeys in Brazil". www.sciencedaily.com. Archived from the original on 24 March 2017. Retrieved 24 March 2017.
- ^ "ProMED-mail post Yellow fever - Americas (47): Brazil, PAHO/WHO". www.promedmail.org. International Society for Infectious Diseases. Archived from the original on 8 September 2017. Retrieved 1 June 2017.
- ^ "Yellow Fever in Brazil – Alert – Level 2, Practice Enhanced Precautions – Travel Health Notices Travelers' Health CDC". wwwnc.cdc.gov. Archived from the original on 25 May 2017. Retrieved 1 June 2017.
- ^ Mir D, Delatorre E, Bonaldo M, Lourenço-de-Oliveira R, Vicente AC, Bello G (August 2017). "Phylodynamics of Yellow Fever Virus in the Americas: new insights into the origin of the 2017 Brazilian outbreak". Scientific Reports. 7 (1): 7385. Bibcode:2017NatSR...7.7385M. doi:10.1038/s41598-017-07873-7. PMC 5547128. PMID 28785067.
- ^ Mir D, Delatorre E, Bonaldo M, Lourenço-de-Oliveira R, Vicente AC, Bello G (August 2017). "Phylodynamics of Yellow Fever Virus in the Americas: new insights into the origin of the 2017 Brazilian outbreak". Scientific Reports. 7 (1): 7385. Bibcode:2017NatSR...7.7385M. doi:10.1038/s41598-017-07873-7. PMC 5547128. PMID 28785067.
- ^ "Mutation Rate - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-04-25.
- ^ Lataillade LG, Vazeille M, Obadia T, Madec Y, Mousson L, Kamgang B, et al. (November 2020). "Risk of yellow fever virus transmission in the Asia-Pacific region". Nature Communications. 11 (1): 5801. Bibcode:2020NatCo..11.5801L. doi:10.1038/s41467-020-19625-9. PMC 7669885. PMID 33199712.
- ^ "Yellow Fever Virus - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-04-25.
- ^ "Dengue and severe dengue". www.who.int. Retrieved 2022-04-25.
- ^ Vainio J, Cutts F, eds. (1998). Yellow Fever. WHO Division of Emerging and other Communicable Diseases Surveillance and Control.
- ^ Monath TP (1989). "The absence of yellow fever in Asia: hypotheses. A cause for concern?". Virus Inf Exch Newslett: 106–7.
- ^ Cathey JT, Marr JS (May 2014). "Yellow fever, Asia and the East African slave trade". Transactions of the Royal Society of Tropical Medicine and Hygiene. 108 (5): 252–257. doi:10.1093/trstmh/tru043. PMID 24743951.
- ^ Bryant JE, Holmes EC, Barrett AD (May 2007). "Out of Africa: a molecular perspective on the introduction of yellow fever virus into the Americas". PLOS Pathogens. 3 (5): e75. doi:10.1371/journal.ppat.0030075. PMC 1868956. PMID 17511518.
- ^ Gould EA, de Lamballerie X, Zanotto PM, Holmes EC (2003). Origins, evolution, coadaptations within the genus Flavivirus. Advances in Virus Research. Vol. 59. pp. 277–314. doi:10.1016/S0065-3527(03)59008-X. ISBN 978-0-12-039859-1. PMID 14696332.
- ^ Bryant JE, Holmes EC, Barrett AD (May 2007). "Out of Africa: a molecular perspective on the introduction of yellow fever virus into the Americas". PLOS Pathogens. 3 (5): e75. doi:10.1371/journal.ppat.0030075. PMC 1868956. PMID 17511518.
- ^ 올드스톤, M. (1998년)바이러스, 전염병, 그리고 역사, 뉴욕: 옥스포드 대학 출판부.
- ^ McNeill JR (2010). Mosquito Empires: Ecology and war in the greater Caribbean, 1620–1914. NY: Cambridge University Press. pp. 44–45.
- ^ Chippaux JP, Chippaux A (2018). "Yellow fever in Africa and the Americas: a historical and epidemiological perspective". The Journal of Venomous Animals and Toxins Including Tropical Diseases. 24: 20. doi:10.1186/s40409-018-0162-y. PMC 6109282. PMID 30158957.
- ^ McNeill JR (1 April 2004). "Yellow Jack and Geopolitics: Environment, Epidemics, and the Struggles for Empire in the American Tropics, 1650–1825". OAH Magazine of History. 18 (3): 9–13. doi:10.1093/maghis/18.3.9.
- ^ "황열"에 대한 최초의 언급은 1744년 버지니아 주의 존 미첼 박사가 쓴 원고에서 나타난다. 그 사본은 뉴욕의 의사인 캐드월러더 콜든 씨와 닥터에게 보내졌다.필라델피아에 사는 벤자민 러시; 그 원고는 결국 1805년에 인쇄되었고 1814년에 다시 인쇄되었다.참조:
- "Dr. John Mitchell's Account of the Yellow Fever in Virginia in 1741-42, Written in 1748". Annals of Medical History. 6 (1): 91–92. January 1934. PMC 7943142. PMID 33944007.
- ^ McNeill J (2010). Mosquito Empires: Ecology and War in the Greater Caribbean, 1620–1914. New York, NY: Cambridge University Press. ISBN 978-0-511-67268-2.
- ^ Burkett-Cadena ND, Vittor AY (February 2018). "Deforestation and vector-borne disease: Forest conversion favors important mosquito vectors of human pathogens". Basic and Applied Ecology. 26: 101–110. doi:10.1016/j.baae.2017.09.012. PMC 8290921. PMID 34290566.
- ^ Buckley RN (1978). "The Destruction of the British Army in the West Indies 1793-1815: A Medical History". Journal of the Society for Army Historical Research. 56 (226): 79–92. ISSN 0037-9700. JSTOR 44224266. PMID 11614813.
- ^ McNeill JR (2002). "Yellow fever and geopolitics: environment, epidemics, and the struggles for empire in the American tropics, 1650-1900". History Now. 8 (2): 10–16. PMID 20690235.
- ^ McNeill JR (2004). "Yellow Jack and Geopolitics: Environment, Epidemics, and the Struggles for Empire in the American Tropics, 1640-1830". Review (Fernand Braudel Center). 27 (4): 343–364. ISSN 0147-9032. JSTOR 40241611.
- ^ Marshall A (2020-11-18). "What was the Haitian Revolution (1791-1804)?". Boot Camp & Military Fitness Institute. Retrieved 2022-04-25.
- ^ McNeill JR (2010). Mosquito Empires: Ecology and War in the Greater Caribbean, 1620–1914. Cambridge University Press. p. 259.
- ^ "Haiti profile - Timeline". BBC News. 2019-02-11. Retrieved 2022-04-25.
- ^ Girard PR (2011). The Slaves Who Defeated Napoleon: Toussaint Louverture and the Haitian War of Independence, 1801–1804. University of Alabama Press. pp. 179–80. ISBN 978-0-8173-1732-4. Archived from the original on 2016-09-11.
- ^ Kotar SL, Gessler JE (2017-02-03). Yellow Fever: A Worldwide History. McFarland. ISBN 978-1-4766-2628-4.
- ^ Patterson KD (April 1992). "Yellow fever epidemics and mortality in the United States, 1693-1905". Social Science & Medicine. 34 (8): 855–865. doi:10.1016/0277-9536(92)90255-O. PMID 1604377.
- ^ Miller JC (2005). "The Wages of Blackness: African American Workers and the Meanings of Race during Philadelphia's 1793 Yellow Fever Epidemic". The Pennsylvania Magazine of History and Biography. 129 (2): 163–194.
- ^ "Yellow Fever Attacks Philadelphia, 1793". EyeWitness to History. Archived from the original on 2007-06-07. Retrieved 2009-08-14.
- ^ "How Yellow Fever Turned New Orleans Into The 'City Of The Dead'". NPR.org. Retrieved 2022-04-25.
- ^ Pierce J, Writer J (2005). Yellow Jack: How Yellow Fever ravaged America and Walter Reed Discovered Its Deadly Secrets. Hoboken: John Wiley & Sons. p. 3.
- ^ "The Tennessee Encyclopedia of History and Culture:Yellow Fever Epidemics". Tennessee Historical Society. Archived from the original on December 12, 2013. Retrieved June 20, 2013.
- ^ 존 S. 마와 존 T.캐티."1802년 생도맹그 황열병과 루이지애나 구매" 공중위생관리 및 실천 저널 19#.1 (2013년) : 77–82. Wayback Machine에서 온라인 아카이브 2016-02-04
- ^ 랭글리, 해롤드 D.미국 초기 해군의 의학의 역사 (Johns Hopkins Press: Baltimore 1995), 274-275
- ^ Sharp JG. "The Disastrous Voyage: Yellow Fever aboard the USS Macedonian & USS Peacock, 1822". Archived from the original on 25 October 2019. Retrieved 15 August 2020.
- ^ "Annual Report of the Secretary of the Navy - 1823". public2.nhhcaws.local. Retrieved 2022-04-25.
- ^ James Biddle to Smith Thompson (3 August 1822). "Captains Letters". Nara M125. 79. letter no. 15.
- ^ "The Macedonian a list of the deaths". Connecticut Herald. 20 August 1822. p. 2.
- ^ 샤프, 아이비드
- ^ 미국 의학 협회의 거래, 제9권, TK 및 PG 콜린스, 1856년, 704쪽, 사무엘 오의 "1853년과 1854년, La Cloutierville 마을의 황열병"스크럭스, M.D.
- ^ 뉴올리언스 제네시스 1970년 6월 261-262쪽, "클루티에빌 황열병 사망, 1853년"
- ^ Lockley T (2012). "'Like a clap of thunder in a clear sky': differential mortality during Savannah's yellow fever epidemic of 1854" (PDF). Social History. 37 (2): 166–186. doi:10.1080/03071022.2012.675657. S2CID 2571401. Retrieved 22 February 2018.
- ^ 성 매튜 복음 루터 교회: 기독교 봉사 125년, 1967년.
- ^ Mauer HB. "Mosquito control ends fatal plague of yellow fever". etext.lib.virginia.edu. Archived from the original on 2012-12-12. Retrieved 2007-06-11. (언데이티드 신문 스크랩).
- ^ "Yellow Fever". www.usgwarchives.net. Retrieved 30 September 2019.
- ^ "Louisiana Office of Public Health Statistics, page 6" (PDF).
- ^ "Tour Stop 1 - Yellow Fever Victims - Tour - Oakland Cemetery - Shreveport - Louisiana - Founded 1847". www.oaklandcemeteryla.org.
- ^ Crosby MC (2006). The American Plague. New York: Berkley Publishing Group. p. 75.
- ^ "Yellow Fever — the plague of Memphis". HistoricMemphis.com. Archived from the original on August 21, 2014. Retrieved August 20, 2014.
- ^ Barnes E (2005). Diseases and Human Evolution. Albuquerque: University of New Mexico. ISBN 978-0-8263-3065-9.
- ^ Sawchuk LA, Burke SD (January 1998). "Gibraltar's 1804 yellow fever scourge: the search for scapegoats". Journal of the History of Medicine and Allied Sciences. 53 (1): 3–42. doi:10.1093/jhmas/53.1.3. PMID 9510598.
- ^ 제임스 테일러, 우리가 사는 시대: 19세기의 역사, 옥스퍼드 대학, 1882; 페이지 222.
- ^ "WORLD DISEASES – "YELLOW FEVER" West Bend News". 2020-06-30. Retrieved 2022-04-25.
- ^ John W. Cowart, "Yellow Jacksonville in Yellow Fever, Yellow Jacksonville, 1888년 플로리다 Duval County 방문" 2013-01-05년 Wayback Machine, Historical Text Archive에서 아카이브
- ^ 요시야 C.Not (1848) "황열과 담즙열과 대비되는 황열 – 질병 발생 원인 – 그 전파 방식 – 원격 원인 – 곤충 또는 동물성 기원 추정", 뉴올리언스 의학 및 외과 저널, "4": 563–601.
- ^ 카를로스 후안 핀레이(발표자:1881년 8월 14일, 발행: 1882) "모기 엉덩이 관절염 고려제"2017-02-23 웨이백 머신에서 보관(황열 전염의 매개체로 가정된 모기) Anales de la Real Academy de Ciencias Médicas, Féicas y Naturales de la Habana, 18:147–169.온라인으로 이용하실 수 있습니다.
- ^ Chaves-Carballo E (October 2005). "Carlos Finlay and yellow fever: triumph over adversity". Military Medicine. 170 (10): 881–885. doi:10.7205/milmed.170.10.881. PMID 16435764.
- ^ Pierce JR, Writer J (2005). Yellow Jack: How Yellow Fever Ravaged America and Walter Reed Discovered Its Deadly Secrets. Wiley. ISBN 978-0-471-47261-2.
- ^ "U.S. Army Yellow Fever Commission". UVA Health Sciences: Historical Collections. Archived from the original on 2017-04-26. Retrieved 2017-08-01.
- ^ Delaporte F (1991). The History of Yellow Fever: An Essay on the Birth of Tropical Medicine. Cambridge: MIT Press. pp. 89–90. ISBN 9780262041126.
- ^ Crosby MC (2006). The American Plague. New York: Berkley Publishing Group. p. 177.
- ^ Wilson AL, Courtenay O, Kelly-Hope LA, Scott TW, Takken W, Torr SJ, Lindsay SW (January 2020). "The importance of vector control for the control and elimination of vector-borne diseases". PLOS Neglected Tropical Diseases. 14 (1): e0007831. doi:10.1371/journal.pntd.0007831. PMC 6964823. PMID 31945061.
- ^ 테레사 A.미드, 현대 라틴 아메리카의 역사: 1800년부터 현재까지, 제1판 (시체스터:Wiley-Blackwell, 2010), 페이지 148–149.
- ^ Fosdick RB (1952). The Story of the Rockefeller Foundation. New York: Harper & Brothers. pp. 58–79.
- ^ Birn AE, Solórzano A (November 1999). "Public health policy paradoxes: science and politics in the Rockefeller Foundation's hookworm campaign in Mexico in the 1920s". Social Science & Medicine. 49 (9): 1197–1213. doi:10.1016/s0277-9536(99)00160-4. PMID 10501641.
- ^ Bigon L (2014). "Transnational Networks of Administrating Disease and Urban Planning in West Africa: The Inter-Colonial Conference on Yellow Fever, Dakar, 1928". GeoJournal. 79 (1): 103–111. doi:10.1007/s10708-013-9476-z. S2CID 153603689.
- ^ "The Nobel Prize in Physiology or Medicine 1951". Nobel Foundation. Retrieved 2017-11-30.
- ^ National Institutes of Health (July 27, 2016). "NIH launches early-stage yellow fever vaccine trial" (Press release). United States Department of Health and Human Services. Retrieved July 14, 2019.
- ^ 국립 알레르기 및 전염병(NIAID)(6월 1일 2018년), A1단계 시제품은 안전, Reactogenicity, Immunogenicity MVA-BN 옐로우 피버 백신-Stream과 Montanide ISA-720 Adjuvant 없이 18–45년 건강한 자원 봉사자(국가 교육 과정 성취도 시험 번호:NCT02743455), 미국 국립 의학 도서관 회수된 7월 평가를 위한.14일 2019년.
- ^ "Yellow fever". www.who.int. Retrieved 2022-04-25.
- ^ Deressa W, Kayembe P, Neel AH, Mafuta E, Seme A, Alonge O (December 2020). "Lessons learned from the polio eradication initiative in the Democratic Republic of Congo and Ethiopia: analysis of implementation barriers and strategies". BMC Public Health. 20 (Suppl 4): 1807. doi:10.1186/s12889-020-09879-9. PMC 7747367. PMID 33339529.
- ^ a b Sbrana E, Xiao SY, Guzman H, Ye M, Travassos da Rosa AP, Tesh RB (September 2004). "Efficacy of post-exposure treatment of yellow fever with ribavirin in a hamster model of the disease". The American Journal of Tropical Medicine and Hygiene. 71 (3): 306–312. doi:10.4269/ajtmh.2004.71.306. PMID 15381811.
- ^ Huggins JW (1989). "Prospects for treatment of viral hemorrhagic fevers with ribavirin, a broad-spectrum antiviral drug". Reviews of Infectious Diseases. 11 (Suppl 4): S750–S761. doi:10.1093/clinids/11.Supplement_4.S750. PMID 2546248.
- ^ van den Hurk AF, Hall-Mendelin S, Pyke AT, Frentiu FD, McElroy K, Day A, et al. (2012). "Impact of Wolbachia on infection with chikungunya and yellow fever viruses in the mosquito vector Aedes aegypti". PLOS Neglected Tropical Diseases. 6 (11): e1892. doi:10.1371/journal.pntd.0001892. PMC 3486898. PMID 23133693.
- ^ Endicott SL, Hageman E (1998). The United States and Biological Warfare: Secrets from the Early Cold War and Korea. Indiana University Press. ISBN 978-0-253-33472-5.
추가 정보
| 라이브러리 리소스 정보 황열병 |
- Crosby M (2006). The American Plague: The Untold Story of Yellow Fever, the Epidemic that Shaped Our History. New York: The Berkley Publishing Group. ISBN 978-0-425-21202-8.
- Espinosa M (2009). Epidemic Invasions: Yellow Fever and the Limits of Cuban Independence, 1878–1930. Chicago: University of Chicago Press. ISBN 978-0-226-21811-3.
- Gessner I (2016). Yellow Fever Years: An Epidemiology of Nineteenth-Century American Literature and Culture. Frankfurt/Main: Peter Lang. ISBN 978-3-631-67412-3.
- Harcourt-Smith S (1974). "'Yellow Jack': Caribbean Fever". History Today. 23 (9): 618–624.
- Murphy J (2003). An American Plague: The True and Terrifying Story of the Yellow Fever Epidemic of 1793. New York: Clarion Books. ISBN 978-0-395-77608-7.
- Nuwer DS (2009). Plague Among the Magnolias: The 1878 Yellow Fever Epidemic in Mississippi. University of Alabama Press. ISBN 978-0-8173-1653-2.
외부 링크
- 컬리의 황열병
- Finlay CJ (January 2012). "The Mosquito Hypothetically Considered as the Transmitting Agent of Yellow Fever". MEDICC Review. 14 (1): 56–59. doi:10.37757/MR2012V14.N1.10. PMID 34503309.
- "미군 황열 위원회" 클로드 무어 보건과학 도서관, 버지니아 대학교
- "Yellow fever virus". NCBI Taxonomy Browser. 11089.















