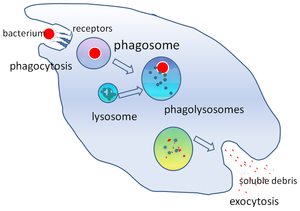
파고솜
Phagosome세포생물학에서, 파고솜은 식세포에 의해 둘러싸인 입자 주위에 형성되는 소포이다.전문 식세포는 대식세포, 호중구, 수상세포를 포함한다.[1]
미생물, 노화세포 또는 아포토시스세포 주위의 세포막의 융접에 의해 파고솜이 형성된다.파고솜은 세포막 결합 단백질을 가지고 있으며 리소좀과 융합하여 성숙한 파골리소좀을 형성합니다.리소좀은 가수분해효소와 병원체를 죽이고 소화시키는 활성산소종을 포함하고 있다.파고솜은 또한 비전문 식세포에서도 형성될 수 있지만, 그들은 더 작은 범위의 입자를 집어삼킬 수 있고, ROS를 포함하지 않습니다.소화된 입자의 유용한 물질(예: 아미노산)은 세포 내로 이동되고 노폐물은 세포 외이식에 의해 제거된다.파고솜 형성은 조직의 항상성과 병원균에 대한 선천적이고 적응적인 숙주 방어에 중요하다.
그러나 일부 박테리아는 식세포증을 침략 전략으로 이용할 수 있다.이들은 파골리소좀 내부에서 번식하거나(예: Coxiella spp.)[2] 파고솜이 리소좀과 융합하기 전에 세포질로 탈출한다(예: Rickettia spp).[3]마이코박테륨 결핵과[4][5] 마이코박테륨 [6]아비움 파라결핵을 포함한 많은 마이코박테리아는 리소좀이 파고솜과 융합하여 성숙한 파골리소좀을 만드는 것을 막기 위해 숙주 대식세포를 조작할 수 있다.이러한 파고솜의 불완전한 성숙은 그 [7]안에 있는 병원균에 유리한 환경을 유지한다.
형성
파고솜은 직경이 [8]0.5 μm 이상인 전체 박테리아 또는 아포토시스 및 노화세포를 분해하기에 충분히 크다.이것은 파고솜이 나노미터로 측정되는 엔도솜보다 몇 배 더 크다는 것을 의미합니다.
병원균이나 옵소닌이 식세포 표면에 무작위로 분포하는 막경락수용체에 결합할 때 파고솜이 형성된다.결합 시, "외부" 신호는 액틴 중합과 미생물을 둘러싸고 융합하는 유사 포디아의 형성을 촉발합니다.단백질인산화효소 C, 포스포이노시티드 3-키나아제 및 포스포리파아제 C(PLC)는 모두 입자 내부화를 [9]신호 전달 및 제어하기 위해 필요하다.병원체가 둘러싸이면 더 많은 세포 표면 수용체가 지퍼 형태의 메커니즘으로 입자에 결합할 수 있어 결합 [10]열성을 높일 수 있다.FcR 수용체(FcR), 보체 수용체(CR), 만노스 수용체 및 덱틴-1은 식세포 수용체로 섬유아세포와 [11]같은 비식세포세포에서 발현되면 식세포증을 유도할 수 있다.Toll-like 수용체와 같은 다른 단백질은 병원체 패턴 인식에 관여하며 종종 식세포에 모집되지만, 비식세포에서 특별히 식세포증을 유발하지는 않기 때문에 식세포 수용체로 간주되지 않는다.
동작화
옵소닌은 항체와 보체와 같은 분자 태그로 병원균에 부착하고 식세포증을 상향 조절합니다.면역글로불린G(IgG)는 혈청에 존재하는 항체의 주요 유형이다.그것은 적응 면역 시스템의 일부이지만, 식세포 병원체에 대식세포를 모집함으로써 선천적인 반응과 연결된다.항체는 가변 Fab 도메인을 가진 미생물에 결합하고, Fc 도메인은 Fc 수용체(FcR)에 결합하여 식세포증을 유도한다.
보체 매개 내부화는 훨씬 덜 유의적인 막 돌기를 가지지만, 두 경로의 하류 신호 전달은 Rho GTPases를 [12]활성화하기 위해 수렴한다.그들은 파고솜이 엔도솜과 리소좀과 융합하는 데 필요한 액틴 중합체를 조절한다.
비식세포
다른 비전문 식세포는 적혈구를 삼킬 수 있는 갑상선 및 방광 상피 세포와 망막 [8]막대를 내장하는 망막 상피 세포와 같은 어느 정도의 식세포 활성을 가지고 있다.그러나 비전문 식세포는 FcR과 같은 특정 식세포 수용체를 발현하지 않으며 내부화 속도가 훨씬 낮다.
몇몇 침입성 박테리아는 또한 숙주의 흡수를 중재하기 위해 비식세포에서 식세포증을 유도할 수 있다.예를 들어, Shigella는 숙주 세포 골격을 바꾸고 장세포의 [13]기저외측으로 들어가는 독소를 분비할 수 있다.
구조.
플라즈마막의 융접에 의해 파고솜의 막이 형성되므로 인지질 이중층의 기본조성은 동일하다.엔도솜과 리소좀은 세포막에 기여하기 위해, 특히 기생충과 같이 [14]삼켜진 입자가 매우 클 때, 파고솜과 융합합니다.그들은 또한 다양한 막 단백질을 파고솜에 전달하고 소기관 구조를 변형시킵니다.
파고솜은 인공 저밀도 라텍스 비즈를 삼킨 후 수크로스 농도 구배를 따라 정제하여 구조와 구성을 [15]연구할 수 있습니다.서로 다른 시점에서 파고솜을 정제함으로써 성숙 과정도 특징지을 수 있다.초기 파고솜은 Rab5에 의해 특징지어지며, 소포는 후기 파고솜으로 성숙함에 따라 Rab7로 이행한다.
성숙 과정
초기 파고솜은 본질적으로 살균성이 있는 것이 아니다.숙성함에 따라 pH 6.5에서 pH 4까지 산성도가 높아지며 단백질 마커와 가수분해효소가 특징적이다.서로 다른 효소는 다양한 최적 pH에서 작용하여 범위를 형성하여 각각 성숙 과정의 좁은 단계에서 작동합니다.효소 활성은 pH 수준을 수정하여 미세 조정할 수 있으며, 유연성을 높일 수 있습니다.파고솜은 세포골격의 미세관을 따라 움직이며, 동적인 "키스 앤 런"[16] 방식으로 순차적으로 엔도솜과 리소좀과 융합합니다.이 세포내 수송은 파고솜의 크기에 달려있다.세포주변에서 핵주변으로 매우 지속적으로 큰 세포소기관(지름 약 3μm)이 운반되는 반면, 작은 세포소기관(지름 약 1μm)은 세포주변과 [17]세포주변 사이에서 더 양방향으로 운반된다.액포 양성자 펌프(v-ATPase)는 유기체 구획을 산성화하기 위해 파고솜에 전달되며, 병원체에 더 적대적인 환경을 조성하고 단백질 분해를 촉진한다.박테리아 단백질은 낮은 pH에서 변성되고 산성 환경의 영향을 받지 않는 단백질 분해 효소에 더 쉽게 접근할 수 있습니다.효소는 나중에 제시되기 전에 파골리소좀에서 재활용되어 낭비되지 않는다.인지질막의 구성 또한 파고솜이 [15]성숙함에 따라 변화한다.
융합은 파고솜의 내용에 따라 몇 분에서 몇 시간이 걸릴 수 있습니다; FcR 또는 만노스 수용체에 매개되는 융합은 30분 미만으로 지속되지만, 라텍스 비즈를 포함한 파고솜은 리소좀과 [8]융합하는 데 몇 시간이 걸릴 수 있습니다.파고솜막의 조성이 성숙 속도에 영향을 미치는 것으로 알려져 있다.결핵균은 세포막의 재활용과 융합인자의 유입을 막는다는 가설을 가진 소수성 세포벽을 가지고 있어 파고솜이 리소좀과 융합하지 않고 분해가 [18]방지된다.
작은 내강 분자는 큰 분자보다 융합에 의해 더 빨리 전달되는데, 이것은 제한된 교환만이 [8]허용되는 "키스 앤 런" 동안 파고솜과 다른 소포 사이에 작은 수성 채널이 형성된다는 것을 암시합니다.
융접 조절
내부화 직후, F-액틴은 새롭게 형성된 파고솜으로부터 탈중합하여 단백질의 [8]융합 및 전달을 위해 엔도솜에 접근할 수 있게 된다.성숙 과정은 특징적인 단백질 마커에 따라 초기 단계와 후기 단계로 나뉘며, 작은 Rab GTPases에 의해 조절된다.Rab5는 초기 파고솜에 존재하며,[19] Rab7로 표시된 후기 파고솜으로의 이행을 제어합니다.
Rab5는 PI-3 키나아제 및 Vps34와 같은 다른 테더링 단백질을 파고솜 막에 공급하기 때문에 엔도솜은 파고솜에 단백질을 전달할 수 있다.Rab5는 [19]효모의 CORVET 복합체와 HOPS 복합체를 통해 Rab7로의 이행에 부분적으로 관여한다.포유류의 정확한 성숙 경로는 잘 알려져 있지 않지만, HOPS가 Rab7과 결합하고 구아노신 뉴클레오티드 해리 억제제(GDI)[20]를 대체할 수 있다고 제안된다.Rab11은 멤브레인 [21]재활용에 관여하고 있습니다.
파골리소좀
파고솜은 리소좀과 융합하여 다양한 살균 특성을 가진 파골리소좀을 형성합니다.파골리소좀은 활성산소와 질소종(ROS 및 RNS)과 가수분해효소를 포함하고 있습니다.이 구획은 또한 박테리아 단백질을 변성시키는 데 사용되는 H를 막을 가로질러 운반하는+ 양성자 펌프(v-ATPases)로 인해 산성입니다.
식세포의 정확한 특성은 식세포의 종류에 따라 다르다.수상세포에 있는 것들은 대식세포나 호중구보다 살균성이 약하다.또한 대식세포는 항염증성 '킬러' M1과 '복구' M2로 구분되며, M1의 식염소체는 아르기닌을 반응성이 높은 일산화질소로 대사할 수 있으며, M2는 오르니틴을 사용하여 세포의 증식과 조직 회복을 [22]촉진한다.
기능.
병원체의 열화
대식세포와 호중구는 대부분의 병원체 분해를 담당하는 전문 식세포이지만 살균 방법은 다르다.호중구는 파고솜과 융합하는 과립을 가지고 있다.과립은 NADPH 산화효소 및 myeloperoxidase를 포함하고 있으며, 이들은 산화 폭발로 병원균을 죽이기 위해 독성 산소와 염소 유도체를 생성한다.프로테아제 및 항균성 펩타이드도 파골리소좀에 방출된다.대식세포는 과립이 없고, 미생물을 [21]소화시키기 위해 파골리소좀 산성화, 글리코시다아제, 단백질 분해효소에 더 많이 의존합니다.수지상 세포에 있는 파고솜은 리소좀 단백질 분해효소의 낮은 농도와 단백질 분해효소 억제제의 존재로 인해 산성이 낮고 가수 분해 활성이 훨씬 약하다.
염증
파고솜 형성은 일반적인 신호 분자를 통해 염증과 연관되어 있다.PI-3 키나제 및 PLC는 내부화 메커니즘과 [9]염증 유발에 모두 관여한다.두 단백질은 Rho GTPases와 함께 사이토카인 생성을 유도하고 MAP 키나제 시그널링 캐스케이드를 활성화하는 선천적 면역 반응의 중요한 구성요소이다.IL-1β, IL-6, TNFα, IL-12를 포함한 소염성 사이토카인이 모두 [8]제조된다.
그 과정은 엄격히 조절되고 염증 반응은 파고솜 내의 입자의 종류에 따라 다르다.병원균에 감염된 아포토시스 세포는 염증을 유발하지만, 정상적인 조직 교체의 일부로 분해된 손상된 세포는 그렇지 않다.옵소닌 매개 식세포증에 따라 반응도 달라진다.FcR 및 만노스 수용체 매개 반응은 소염 반응성 산소종과 아라키돈산 분자를 생성하지만 CR 매개 반응은 이러한 [8]생성물을 생성하지 않는다.
항원 제시
미성숙한 수상 세포(DCs)는 식세포를 형성할 수 있지만, 성숙한 DC는 세포골격 [21]재모델링과 관련된 Rho GTPases의 변화로 인해 식세포를 형성할 수 없다.DC의 파고솜은 대식세포와 호중구보다 가수분해성이 낮고 산성이 낮다. DC는 병원체 분해보다는 항원 제시와 관련이 있기 때문이다.특정 세균 인식을 위해 적절한 크기의 단백질 조각을 보유해야 하므로 펩타이드는 부분적으로만 [21]분해됩니다.박테리아의 펩타이드는 주요 조직적합성복합체(MHC)로 운반된다.펩타이드 항원은 림프구에 제시되며, 림프구는 T세포 수용체에 결합하고 T세포를 활성화하여 선천성 [9]면역과 적응성 면역 사이의 격차를 해소합니다.이것은 포유동물, 조류, 턱 물고기에 특유하다. 곤충은 적응성 [23]면역력을 가지고 있지 않기 때문이다.
영양소
아메바와 같은 고대 단세포 생물들은 면역 전략보다는 영양소를 얻기 위한 방법으로 식세포증을 사용한다.그들은 다른 작은 미생물들을 집어삼키고 1분에 1개 정도의 박테리아로 구성된 식세포 [24]안에서 소화하는데, 이것은 전문 식세포보다 훨씬 더 빠른 속도입니다.흙 아메바 딕티오스텔리움 디스코이디움은 인간에게 [25]레지오넬라병을 일으키는 레지오넬라 폐렴균이 주요 식량원이다.아메바의 파고솜 성숙은 대식세포와 매우 유사하기 때문에 그 과정을 [16]연구하기 위한 모델 유기체로 사용된다.
조직 클리어런스
파고솜은 조직의 항상성을 유지하기 위해 노화 세포와 아포토시스 세포를 분해한다.적혈구는 체내에서 가장 높은 회전율을 가지며 간과 비장의 대식세포에 의해 식세포된다.배아에서 죽은 세포를 제거하는 과정은 잘 특징지어지지 않지만 대식세포나 조혈줄기세포에서 [26]유래한 다른 세포에 의해 수행되지는 않는다.아포토시스 세포가 전문 식세포에 의해 식세포되는 것은 성인에게만 해당된다.염증은 특정 병원체 또는 손상 관련 분자 패턴(PAMPs 또는 DAMPs)에 의해서만 유발되며, 노화 전지의 제거는 [14]비염증적이다.
오토파고솜
오토파고솜은 주로 미토콘드리아(미토콘드리아)와 같은 손상된 세포소기관을 선택적으로 분해하는 데 사용된다는 점에서 파고솜과 다르다.하지만, 세포가 굶주리거나 스트레스를 받을 때, 오토파고솜은 또한 아미노산과 [27]다른 영양소를 세포에 제공하기 위해 비선택적으로 세포 조직을 분해할 수 있습니다.자가 식세포는 전문 식세포에만 국한되지 않고, 쥐의 간세포에서 세포생물학자 Christian de Duve에 [28]의해 처음 발견됩니다.오토파고솜은 이중막, 즉 삼켜진 소기관으로부터의 내막을 가지며, 외막은 소포체 또는 ER-Golgi Intermediate Compartment(ERGIC;[29] ER-Golgi Intermediate Compartment(ERGIC)오토파고솜은 또한 리소좀과 융합하여 내용물을 분해한다.M. 결핵이 파고솜 산화를 억제할 때, Interferon Gamma는 자가파지를 유도하고 성숙 [30]과정을 회복시킬 수 있다.
세균의 회피와 조작
많은 박테리아가 파고솜의 살균 특성을 피하거나 심지어 침략 전략으로 식세포증을 이용하도록 진화해 왔다.
- 결핵균은 ROS를 [31]생성하지 않는 호흡경로 하부의 M2 대식세포를 대상으로 하고 있으며, 결핵은 단백질 공급을 방해하고 파고솜 [8][32]산화를 차단하는 PtpA, SapM 등의 포스파타아제를 분비하여 신호경로를 조작할 수도 있다.
- Regionella pneumophila는 분비 경로의 다른 부분에 있는 소포를 모방하기 위해 Phagosome 막을 다시 모델링할 수 있습니다. 그래서 리소좀은 Phagosome을 인식하지 못하고 Phagosome과 융합하지 않습니다.이 박테리아는 숙주 밀매를 방해하는 독소를 분비하기 때문에 레지오넬라를 포함한 액포는 보통 소포체 또는 [33]ERGIC에서 발견되는 막 단백질을 수집합니다.이것은 분비성 소포를 변형된 파고솜으로 다시 보내고 박테리아에 영양분을 공급한다.
- 리스테리아 모노사이토게네스는 모공 형성 단백질 리스테리올리신 O를 분비하여 박테리아가 파고솜을 빠져나와 세포졸로 들어갈 수 있도록 합니다.리스테리올리신은 파고솜의 [34]산성 환경에 의해 활성화된다.또한 리스테리아는 파고좀 탈출을 촉진하는 두 개의 포스포리파아제 C 효소를 분비한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Robinson & Babcock 1998, 페이지 187 : 1998 및 Ernst & Stendahl 2006, 페이지 7-10 : 2006
- ^ Hackstadt T, Williams JC (May 1981). "Biochemical stratagem for obligate parasitism of eukaryotic cells by Coxiella burnetii". Proceedings of the National Academy of Sciences of the United States of America. 78 (5): 3240–4. doi:10.1073/pnas.78.5.3240. PMC 319537. PMID 6942430.
- ^ Winkler HH (1990). "Rickettsia Species (As Organisms)". Annual Review of Microbiology. 44: 131–153. doi:10.1146/annurev.micro.44.1.131. PMID 2252380.
- ^ MacMicking JD, Taylor GA, McKinney JD (October 2003). "Immune control of tuberculosis by IFN-gamma-inducible LRG-47". Science. 302 (5645): 654–9. Bibcode:2003Sci...302..654M. doi:10.1126/science.1088063. PMID 14576437. S2CID 83944695.
- ^ Vandal OH, Pierini LM, Schnappinger D, Nathan CF, Ehrt S (August 2008). "A membrane protein preserves intrabacterial pH in intraphagosomal Mycobacterium tuberculosis". Nature Medicine. 14 (8): 849–54. doi:10.1038/nm.1795. PMC 2538620. PMID 18641659.
- ^ Kuehnel MP, Goethe R, Habermann A, Mueller E, Rohde M, Griffiths G, Valentin-Weigand P (August 2001). "Characterization of the intracellular survival of Mycobacterium avium ssp. paratuberculosis: phagosomal pH and fusogenicity in J774 macrophages compared with other mycobacteria". Cellular Microbiology. 3 (8): 551–66. doi:10.1046/j.1462-5822.2001.00139.x. PMID 11488816. S2CID 8962102.
- ^ Tessema MZ, Koets AP, Rutten VP, Gruys E (November 2001). "How does Mycobacterium avium subsp. paratuberculosis resist intracellular degradation?". The Veterinary Quarterly. 23 (4): 153–62. doi:10.1080/01652176.2001.9695105. PMID 11765232.
- ^ a b c d e f g h Aderem A, Underhill DM (April 1999). "Mechanisms of phagocytosis in macrophages". Annual Review of Immunology. 17 (1): 593–623. doi:10.1146/annurev.immunol.17.1.593. PMID 10358769.
- ^ a b c Aderem A (June 2003). "Phagocytosis and the inflammatory response". The Journal of Infectious Diseases. 187 Suppl 2 (s2): S340-5. doi:10.1086/374747. PMID 12792849.
- ^ Dupuy AG, Caron E (June 2008). "Integrin-dependent phagocytosis: spreading from microadhesion to new concepts". Journal of Cell Science. 121 (11): 1773–83. doi:10.1242/jcs.018036. PMID 18492791.
- ^ Underhill DM, Ozinsky A (April 2002). "Phagocytosis of microbes: complexity in action". Annual Review of Immunology. 20 (1): 825–52. doi:10.1146/annurev.immunol.20.103001.114744. PMID 11861619.
- ^ Kaplan G (August 1977). "Differences in the mode of phagocytosis with Fc and C3 receptors in macrophages". Scandinavian Journal of Immunology. 6 (8): 797–807. doi:10.1111/j.1365-3083.1977.tb02153.x. PMID 561436. S2CID 25373560.
- ^ Köhler H, Rodrigues SP, McCormick BA (March 2002). "Shigella flexneri Interactions with the Basolateral Membrane Domain of Polarized Model Intestinal Epithelium: Role of Lipopolysaccharide in Cell Invasion and in Activation of the Mitogen-Activated Protein Kinase ERK". Infection and Immunity. 70 (3): 1150–8. doi:10.1128/IAI.70.3.1150-1158.2002. PMC 127798. PMID 11854195.
- ^ a b Desjardins M, Houde M, Gagnon E (October 2005). "Phagocytosis: the convoluted way from nutrition to adaptive immunity". Immunological Reviews. 207 (1): 158–65. doi:10.1111/j.0105-2896.2005.00319.x. PMID 16181334. S2CID 30191200.
- ^ a b Desjardins M, Celis JE, van Meer G, Dieplinger H, Jahraus A, Griffiths G, Huber LA (December 1994). "Molecular characterization of phagosomes". The Journal of Biological Chemistry. 269 (51): 32194–200. doi:10.1016/S0021-9258(18)31620-X. PMID 7798218.
- ^ a b Gotthardt D, Warnatz HJ, Henschel O, Brückert F, Schleicher M, Soldati T (October 2002). "High-resolution dissection of phagosome maturation reveals distinct membrane trafficking phases". Molecular Biology of the Cell. 13 (10): 3508–20. doi:10.1091/mbc.E02-04-0206. PMC 129962. PMID 12388753.
- ^ Keller S, Berghoff K, Kress H (December 2017). "Phagosomal transport depends strongly on phagosome size". Scientific Reports. 7 (1): 17068. Bibcode:2017NatSR...717068K. doi:10.1038/s41598-017-17183-7. PMC 5719076. PMID 29213131.
- ^ de Chastellier C, Thilo L (September 1997). "Phagosome maturation and fusion with lysosomes in relation to surface property and size of the phagocytic particle". European Journal of Cell Biology. 74 (1): 49–62. PMID 9309390.
- ^ a b Fairn GD, Grinstein S (August 2012). "How nascent phagosomes mature to become phagolysosomes". Trends in Immunology. 33 (8): 397–405. doi:10.1016/j.it.2012.03.003. PMID 22560866.
- ^ Kinchen JM, Ravichandran KS (April 2010). "Identification of two evolutionarily conserved genes regulating processing of engulfed apoptotic cells". Nature. 464 (7289): 778–82. Bibcode:2010Natur.464..778K. doi:10.1038/nature08853. PMC 2901565. PMID 20305638.
- ^ a b c d Savina A, Amigorena S (October 2007). "Phagocytosis and antigen presentation in dendritic cells". Immunological Reviews. 219 (1): 143–56. doi:10.1111/j.1600-065X.2007.00552.x. PMID 17850487. S2CID 1267478.
- ^ Mills CD (5 May 2015). "Anatomy of a discovery: m1 and m2 macrophages". Frontiers in Immunology. 6: 212. doi:10.3389/fimmu.2015.00212. PMC 4419847. PMID 25999950.
- ^ Warr GW (1997). "The adaptive immune system of fish". Developments in Biological Standardization. 90: 15–21. PMID 9270830.
- ^ Cosson P, Soldati T (June 2008). "Eat, kill or die: when amoeba meets bacteria". Current Opinion in Microbiology. 11 (3): 271–6. doi:10.1016/j.mib.2008.05.005. PMID 18550419.
- ^ Solomon JM, Rupper A, Cardelli JA, Isberg RR (May 2000). "Intracellular growth of Legionella pneumophila in Dictyostelium discoideum, a system for genetic analysis of host-pathogen interactions". Infection and Immunity. 68 (5): 2939–47. doi:10.1128/iai.68.5.2939-2947.2000. PMC 97507. PMID 10768992.
- ^ Lichanska AM, Hume DA (June 2000). "Origins and functions of phagocytes in the embryo" (PDF). Experimental Hematology. 28 (6): 601–11. doi:10.1016/s0301-472x(00)00157-0. hdl:20.500.11820/b865effa-680c-4f60-905e-ba9137f57613. PMID 10880746.
- ^ Ding WX, Yin XM (July 2012). "Mitophagy: mechanisms, pathophysiological roles, and analysis". Biological Chemistry. 393 (7): 547–64. doi:10.1515/hsz-2012-0119. PMC 3630798. PMID 22944659.
- ^ Castro-Obregon S (2010). "The Discovery of Lysosomes and Autophagy". Nature Education. 3 (9): 49.
- ^ Ge L, Schekman R (January 2014). "The ER-Golgi intermediate compartment feeds the phagophore membrane". Autophagy. 10 (1): 170–2. doi:10.4161/auto.26787. PMC 4389871. PMID 24220263.
- ^ Gutierrez MG, Master SS, Singh SB, Taylor GA, Colombo MI, Deretic V (December 2004). "Autophagy is a defense mechanism inhibiting BCG and Mycobacterium tuberculosis survival in infected macrophages". Cell. 119 (6): 753–66. doi:10.1016/j.cell.2004.11.038. PMID 15607973.
- ^ Cambier CJ, Takaki KK, Larson RP, Hernandez RE, Tobin DM, Urdahl KB, Cosma CL, Ramakrishnan L (January 2014). "Mycobacteria manipulate macrophage recruitment through coordinated use of membrane lipids". Nature. 505 (7482): 218–22. doi:10.1038/nature12799. PMC 3961847. PMID 24336213.
- ^ Wong D, Chao JD, Av-Gay Y (February 2013). "Mycobacterium tuberculosis-secreted phosphatases: from pathogenesis to targets for TB drug development". Trends in Microbiology. 21 (2): 100–9. doi:10.1016/j.tim.2012.09.002. PMID 23084287.
- ^ Roy CR, Kagan JC (1 January 2013). Evasion of Phagosome Lysosome Fusion and Establishment of a Replicative Organelle by the Intracellular Pathogen Legionella pneumophila. Landes Bioscience.
- ^ Portnoy DA, Auerbuch V, Glomski IJ (August 2002). "The cell biology of Listeria monocytogenes infection: the intersection of bacterial pathogenesis and cell-mediated immunity". The Journal of Cell Biology. 158 (3): 409–14. doi:10.1083/jcb.200205009. PMC 2173830. PMID 12163465.