오존
Ozone | |||
 | |||
| |||
| 이름들 | |||
|---|---|---|---|
| IUPAC이름 오존 | |||
| 계통 IUPAC명 삼산소 | |||
| 기타이름 2 λ-트리옥시디엔; 카테나-트리옥시젠 | |||
| 식별자 | |||
3D 모델(JSMO) | |||
| ChEBI | |||
| 켐스파이더 | |||
| ECHA 인포카드 | 100.030.051 | ||
| EC 번호 |
| ||
| 1101 | |||
| MeSH | 오존 | ||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니아이 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| O3 | |||
| 어금니 질량 | 47.997g·mol−1 | ||
| 외모 | 무색에서 옅은 청색 가스[1] | ||
| 냄새 | 풍젠트[1] | ||
| 밀도 | 2.144 g/L (0 °C에서) | ||
| 융점 | -192.2°C, -313.9°F, 81.0K | ||
| 비등점 | -112°C; -170°F; 161K | ||
| 1.05 mL−1 (0 °C에서) | |||
| 기타 용매에 대한 용해도 | CCl4, 황산에 매우 용해됨 | ||
| 증기압 | 55.7 atm[2](-[a]12.15°C 또는 10.13°F 또는 261.00K) | ||
| 공액산 | 양성자화 오존 | ||
| +6.7·10cm−63/mol | |||
굴절률(nD) | 1.2226(액체), 1.00052(가스, STP, 546nm—고분산 참고)[3] | ||
| 구조. | |||
| 다2v | |||
| 다이고날 | |||
| 이면체 | |||
| 혼성화 | O1을 위한 스포트2 | ||
| 0.53 D | |||
| 열화학 | |||
어금니 엔트로피 (S⦵298) | 238.92 JK−1 mol−1 | ||
스덴탈피 형성 (δ) | 142.67 kJ mol−1 | ||
| 유해성 | |||
| GHS 라벨링: | |||
     | |||
| 위험 | |||
| H270, H314 | |||
| NFPA 704 (파이어다이아몬드) | |||
| 치사량 또는 농도(LD, LC): | |||
LCLo (최저 발행) | 12.6 ppm (mouse, 3시간) 50ppm (사람, 30분) 36ppm (rabbit, 3시간) 21ppm (mouse, 3시간) 21.8 ppm (rat, 3시간) 24.8 ppm (guinea돼지, 3시간) 4.8 ppm (rat, 4시간)[4] | ||
| NIOSH(미국 건강 노출 한도): | |||
PEL(허용) | TWA 0.1 ppm (0.2 mg/m3)[1] | ||
REL (권장) | C 0.1 ppm (0.2 mg/m3)[1] | ||
IDLH(즉각 위험) | 5ppm[1] | ||
| 관련화합물 | |||
관련화합물 | 이산화황 트리스황 일산화이황 고리형 오존 | ||
별도의 언급이 없는 경우를 제외하고, 표준 상태(25 °C [77 °F], 100 kPa에서)의 재료에 대한 데이터가 제공됩니다. | |||
오존(/ˈ오 ʊ조 ʊn/)은 화학식 O의 무기 분자입니다.이것은 특유의 톡 쏘는 냄새가 나는 옅은 푸른색의 가스입니다.산소 동소체는 이원자 동소체 O보다
2 훨씬 덜 안정적인 산소 동소체이며, 낮은 대기에서 O
2(산소)로 분해됩니다.오존은 지구 대기 내의 자외선 (UV) 빛과 전기 방전의 작용에 의해 다이옥시겐으로부터 형성됩니다.이것은 후자 전체에 걸쳐 매우 낮은 농도로 존재하며, 태양의 자외선(UV)을 대부분 흡수하는 성층권의 오존층에 가장 높은 농도로 존재합니다.
오존의 냄새는 염소를 연상시키며 공기 중에서 0.1ppm 이하의 농도로 많은 사람들이 감지할 수 있습니다.오존의3 O 구조는 1865년에 결정되었습니다.그 분자는 구부러진 구조를 가지고 있고 약한 반자성을 가지고 있는 것으로 나중에 증명되었습니다.표준 조건에서, 오존은 극저온에서 검푸른 액체, 마지막으로 보라색의 검은 고체로 응축되는 옅은 푸른 가스입니다.더 일반적인 다이옥시겐에 대한 오존의 불안정성은 농축 가스와 액체 오존 모두 높은 온도, 물리적 충격 또는 비등점까지의 급속한 온난화에서 폭발적으로 분해될 수 있는 것입니다.[5][6]따라서 낮은 농도에서만 상업적으로 사용됩니다.
오존은 강력한 산화제(다이옥시겐보다 훨씬 더 많음)이며 산화와 관련된 많은 산업 및 소비자 용도를 가지고 있습니다.그러나 이와 같은 높은 산화 전위는 오존이 동물의 점액 조직과 호흡 조직, 그리고 식물의 조직을 약 0.1ppm 이상으로 손상시킵니다.오존은 지표면 근처의 강력한 호흡 위험 및 오염 물질로 만들지만, 오존층의 농도가 높은 것(2~8ppm)은 지구 표면에 손상된 자외선이 도달하는 것을 방지하는 데 도움이 됩니다.
명명법
사소한 이름인 오존은 가장 일반적으로 사용되고 선호되는 IUPAC 이름입니다.유효한 IUPAC 이름인 2 λ-트리옥시디엔 및 카테나-트리옥시젠은 각각 치환 및 부가 명명법에 따라 구성됩니다.오존이라는 이름은 오존의 독특한 냄새를 가리키는 그리스의 중성 현재 입자인 ὄζειν(ozein)에서 유래되었습니다.
적절한 맥락에서, 오존은 2개의 수소 원자가 제거된 트리옥시데인으로 간주될 수 있고, 이와 같이, 트리옥시다닐리덴은 치환 명명법에 따라 체계적인 명칭으로 사용될 수 있습니다.기본적으로 이 이름들은 오존 분자의 급진성을 고려하지 않습니다.훨씬 더 구체적인 맥락에서, 이것은 또한 비 라디칼 단일항 바닥 상태를 명명할 수 있는 반면, 디라디칼 상태는 트리옥시단디일(trioxidanediyl)이라고 명명됩니다.
트리옥시디안디일(또는 오조나이드)은 비체계적으로 치환기 그룹(-OOO-)을 지칭하는 데 사용됩니다.위에 제시된 오존의 상황별 이름에 그룹 이름이 혼동되지 않도록 주의해야 합니다.
역사


1785년, 네덜란드의 화학자 마르티누스 반 마름은 물 위에서 전기 스파크를 수반하는 실험을 하고 있었는데, 그는 전기 반응 때문이라고 생각했고, 그가 실제로 오존을 만들어냈다는 것을 깨닫지 못했기 때문에 그는 이상한 냄새를 알아차렸습니다.[8][9]
반세기 후에, 크리스티안 프리드리히 쇤바인은 같은 톡 쏘는 냄새를 알아차렸고 번개를 뒤따르는 냄새로 인식했습니다.1839년, 그는 기체 상태의 화학물질을 분리하는 데 성공했고, "냄새를 맡다"라는 뜻의 그리스어 오제인(ozein)에서 유래한 "오존(ozone)"이라고 이름 지었습니다.[10][11]이러한 이유로, 쇤바인은 오존의 발견에 대해 일반적으로 인정받고 있습니다.[12][13][14][8]그는 또한 오존 냄새와 인의 냄새의 유사성에 주목했고, 1844년에 백린과 공기의 반응의 산물이 동일하다는 것을 증명했습니다.[10]이후 오존을 "전기화된 산소"라고 부르려는 노력에 그는 백린에서 나오는 오존을 "인화된 산소"라고 부르자고 제안함으로써 조롱했습니다.[10]오존의 공식 O는3 1865년 자크-루이 소렛에[15] 의해 결정되고 1867년 쇤바인에 의해 확인되었습니다.[10][16]
19세기 후반부터 20세기까지 대부분 동안, 오존은 자연주의자들과 건강을 추구하는 사람들에 의해 환경의 건강한 요소로 여겨졌습니다.캘리포니아 보몬트는 엽서와 상공회의소 편지지에서 알 수 있듯이 "보몬트: 오존층"이라는 공식 슬로건을 가지고 있었습니다.[17]야외에서 일하는 자연주의자들은 오존 함량 때문에 더 높은 고도에 이롭다고 종종 생각했습니다.하와이에서 일하는 박물학자 헨리 헨쇼는 "일하기에 필요한 에너지를 유지하기에 충분한 오존이 있는 고도에서는 상당히 다른 대기가 있습니다."라고 썼습니다.[18]해변의 공기는 오존 함량 때문에 건강에 좋다고 여겨졌습니다.이 믿음을 불러일으키는 냄새는 사실 할로겐화 해조류 대사산물과[19] 디메틸설파이드의 냄새입니다.[20]
오존의 매력의 대부분은 정화 특성과 연관성을 불러일으킨 "신선한" 냄새에서 비롯된 것으로 보입니다.과학자들은 그것의 해로운 영향에 주목했습니다.1873년 제임스 드워와 존 그레이 맥켄드릭은 개구리가 느리고, 새들이 숨을 헐떡이며, 토끼의 혈액은 "오존화된 공기"에 노출된 후 산소 수치가 감소하는 것을 보여 "파괴적인 작용을 한다"고 기록했습니다.[21][12]쇤바인 본인은 오존 흡입으로 인한 흉통, 점막의 자극, 호흡 곤란 등이 발생했고, 작은 포유류들이 사망했다고 보고했습니다.[22]1911년, 레너드 힐과 마틴 플랙은 왕립학회 B 회보에서 오존의 건강한 효과는 "단순한 반복에 의해 일반적인 믿음의 일부가 되었습니다. 그러나 그것의 좋은 효과를 지지하는 정확한 생리학적 증거는 지금까지 거의 전적으로 부족했습니다.지금까지 오존의 생리적 효과와 관련하여 잘 알려진 유일한 지식은 그것이 언제든지 비교적 강한 농도로 흡입될 경우 폐의 자극과 œ 감소를 유발하고 사망에 이르게 한다는 것입니다."
1차 세계대전 동안 오존은 런던의 퀸 알렉산드라 군 병원에서 상처에 대한 소독약으로 테스트되었습니다.가스는 상처에 15분 동안 직접적으로 가해졌습니다.이것은 박테리아 세포와 인체 조직 모두에 손상을 입히는 결과를 낳았습니다.소독제를 사용한 세척과 같은 다른 소독 방법이 더 좋은 것으로 나타났습니다.[12][24]
1920년대까지는 폭발성 농축 화학 물질에 분석 화학 기법을 적용하는 것이 어려워 오존 시료에도 소량의 옥소존(O
4)이 존재하는지 여부가 확실하지 않았습니다.[25][26]1923년 게오르크-마리아 슈밥(Ernst Hermann Riesenfeld 밑에서 박사학위 논문을 위해 일하는)은 오존을 성공적으로 굳히고 옥소존 가설을 결론적으로 반박하는 정확한 분석을 수행한 최초의 사람이었습니다.[25][26]1920년대에 리젠펠트 그룹에 의해 측정되지 않은 순수 농축 오존의 물리적 특성이 결정되었습니다.[25]
물리적 특성

오존은 무색 또는 옅은 청색 가스로, 물에 약간 용해되며 사염화탄소 또는 플루오로카본과 같은 비활성 비극성 용매에 훨씬 더 많이 용해되며 청색 용액을 형성합니다.161 K (-112 °C; -170 °F)에서는 응결하여 검푸른 액체를 형성합니다.농축된 기체 오존과 액체 오존이 모두 폭발할 수 있기 때문에 액체가 끓는점까지 따뜻해지도록 하는 것은 위험합니다.80K 이하의 온도(-193.2°C, -315.7°F)에서는 보라색 검은색 고체를 형성합니다.[27]
대부분의 사람들은 염소 표백제와 비슷한 매우 특정한 날카로운 냄새가 나는 공기에서 약 0.01μmol/mol의 오존을 검출할 수 있습니다.0.1~1μmol/mol의 노출은 두통, 눈의 화끈거림, 호흡기 통로에 대한 자극을 유발합니다.[28]공기 중의 낮은 농도의 오존도 라텍스, 플라스틱 그리고 동물의 폐 조직과 같은 유기 물질에 매우 파괴적입니다.
오존은 약한 반자성입니다.[29]
구조.
마이크로파 분광기의 실험적 증거에 따르면 오존은 C 대칭을 가진2v 구부러진 분자(물 분자와 유사함)[30]입니다.O-O 거리는 오후 127.2 (1.272 Å)입니다.O-O-O 각도는 116.78°[31]입니다.중심 원자는 하나의 단독 쌍과 함께 sp² 혼성체입니다.오존은 쌍극자 모멘트가 0.53 D인 극성 분자입니다.[32]분자는 두 개의 기여 구조를 가진 공명 하이브리드로 표현될 수 있는데, 각각은 한 쪽에 단일 결합을 가지고 다른 쪽에는 이중 결합을 가지고 있습니다.그 약정은 양쪽 모두 1.5의 전체 채권 주문을 보유하고 있습니다.아질산 음이온과 등전자성입니다.자연적으로 발생하는 오존은 치환 동위 원소(16O, O, O)로 구성될 수 있습니다.순환 형태가 예측되었지만 관측되지 않았습니다.

반응
오존은 알려진 가장 강력한 산화제 중 하나이며, 그것은 훨씬 더 강합니다.O2. 또한 고농도에서는 불안정하여 일반적인 이원자 산소로 붕괴됩니다.그것의 반감기는 온도, 습도, 공기의 움직임과 같은 대기 조건에 따라 달라집니다.실험실 조건에서 반감기는 실온(24°C)의 정지 공기에서 평균 ~1500분(25시간), 시간당 공기 변화가 없는 습도입니다.[33]
이러한 반응은 온도가 증가함에 따라 더욱 빠르게 진행됩니다.오존의 디플레이그레이션은 스파크에 의해 발생할 수 있으며 오존 농도가 10 wt% 이상일 때 발생할 수 있습니다.[34]
오존은 또한 전기 화학 전지의 양극에서 산소로부터 생성될 수 있습니다.이 반응은 연구 목적으로 더 적은 양의 오존을 생성할 수 있습니다.[35]
이는 필요한 전압 이상으로 전압을 설정한 경우 물의 전기 분해 과정에서 호프만 가스 장치에서 원하지 않는 반응으로 관찰될 수 있습니다.
금속재질로
오존은 대부분의 금속(금, 백금, 이리듐 제외)을 산화시켜 가장 높은 산화 상태의 금속 산화물로 만듭니다.예를 들어,
질소와 탄소화합물로
오존은 또한 산화질소를 이산화질소로 산화시킵니다.
이 반응은 화학 발광을 동반합니다.NO는2 질산염 라디칼로 더 산화될 수 있습니다.
형성된 NO는3 NO와2 반응하여 오산화질소(NO25)를 형성할 수 있습니다.
고체 과염소산 니트로늄은 NO2, ClO2, O3 가스로 만들 수 있습니다.
오존은 암모늄염과 반응하지 않지만 암모니아를 질산 암모늄으로 산화시킵니다.
오존은 상온에서도 탄소와 반응하여 이산화탄소를 형성합니다.
유황화합물 포함
오존은 황화물을 황화물로 산화시킵니다.예를 들어 납()II) 황화물은 납()으로 산화됩니다.II) 황산염:
황산은 오존, 물, 황 원소 또는 이산화황으로부터 생성될 수 있습니다.
기체 상태에서 오존은 황화수소와 반응하여 이산화황을 형성합니다.
그러나 수용액에서는 서로 경쟁하는 두 가지 반응이 동시에 일어나는데, 하나는 황 원소를 생성하는 반응이고, 하나는 황산을 생성하는 것입니다.
알켄 및 알킨 사용
알켄은 오존 분해라고 불리는 과정에서 오존에 의해 산화적으로 분해되어, 작업의 두 번째 단계에 따라 알코올, 알데하이드, 케톤 및 카르복실산을 제공할 수 있습니다.
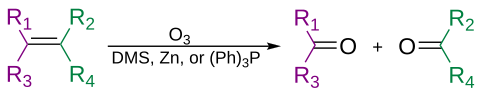
오존은 또한 알킨을 분해하여 산무수물 또는 디케톤 생성물을 형성할 수 있습니다.[37]물이 있는 곳에서 반응을 하면 무수물이 가수분해되어 카르복실산이 2개가 됩니다.
오존 용해는 보통 -78 °C의 디클로로메탄 용액에서 수행됩니다.일련의 분열과 재배열 후, 유기 오조니드가 형성됩니다.환원 작업(예: 아세트산 또는 디메틸설파이드의 아연)으로 케톤 및 알데하이드가 형성되고 산화 작업(예: 수성 또는 알코올 과산화수소)으로 카르복실산이 형성됩니다.[38]
기타기판
오존의 세 원자 모두 주석()의 반응처럼 반응할 수 있습니다.II) 염산 및 오존이 포함된 염화물:
과염소산 요오드는 차가운 무수 과염소산에 용해된 요오드를 오존 처리하여 만들 수 있습니다.
오존은 요오드화칼륨과 반응하여 산소와 요오드 가스를 제공하여 정량을 측정할 수 있습니다.[39]
연소
오존은 연소 반응과 가연성 가스에 사용될 수 있습니다. 오존은 다이옥시겐(O2)에서 연소되는 것보다 더 높은 온도를 제공합니다.다음은 고온을 유발할 수 있는 탄소 아질화물 연소에 대한 반응입니다.
오존은 극저온에서 반응할 수 있습니다.77 K (-196.2 °C, -321.1 °F)에서 원자 수소는 액체 오존과 반응하여 수소 과산화물 라디칼을 형성하며, 이량체화됩니다.[40]
오존 분해
오존분해의 종류
오존은 인체 환경(항공기 기내, 복사기가 있는 사무실, 레이저 프린터, 살균기 등)에서 흔히 발견되거나 발생하는 [41][42]독성 물질이며, 오염을 줄이기 위해서는 촉매 분해가 매우 중요합니다.이러한 형태의 분해는 특히 고체 촉매와 함께 가장 널리 사용되며 온도가 낮으면 전환율이 높아지는 등 많은 장점을 가지고 있습니다.또한, 생성물과 촉매를 순간적으로 분리할 수 있으며, 이를 통해 별도의 분리 작업 없이 촉매를 쉽게 회수할 수 있습니다.또한, 기상에서 오존의 촉매 분해에 가장 많이 사용되는 물질은 Pt, Rh 또는 Pd와 같은 귀금속과 Mn, Co, Cu, Fe, Ni 또는 Ag와 같은 전이 금속입니다.
기체상 오존 분해에는 두 가지 다른 가능성이 있습니다.
첫 번째는 열에 의한 작용만으로 오존을 분해할 수 있는 열분해입니다.문제는 이러한 유형의 분해가 온도가 250°C 이하일 때 매우 느리다는 것입니다.그러나 온도가 높을수록 분해 속도가 증가할 수 있지만 이는 높은 에너지 비용을 수반합니다.
두 번째는 광화학적 분해로, 자외선(UV)을 가진 오존을 복사하고 산소와 라디칼 퍼옥사이드를 발생시킵니다.[43]
오존의 분자산소로의 분해속도론
오존 분해 과정은 최종적으로 분자 산소로 이어지는 두 개의 기본 반응을 포함하는 복잡한 반응이며, 이는 반응 순서와 속도 법칙이 적합 방정식의 화학양론으로 결정될 수 없음을 의미합니다.
전체반응 : 2 ⟶ ->3
요금법(관찰):
오존 분해는 1차 운동학을 따르는 것으로 결정되었고, 위의 속도 법칙으로부터 분자 산소에 대한 부분 순서는 -1이고 오존에 대한 부분 순서는 2이므로 전역 반응 순서는 1입니다.
오존 분해는 두 가지 기본 단계로 구성됩니다.첫 번째 반응은 단분자 반응에 해당하는데, 이는 오존 분자 하나가 두 개의 생성물(분자 산소와 산소)로 분해되기 때문입니다.그러면, 첫 번째 단계에서 나온 산소는 두 번째 단계에서 반응물로 참여하기 때문에 중간체인데, 이는 두 개의 서로 다른 반응물(오존과 산소)이 생성되기 때문이며, 이는 기체 상태에서 분자 산소에 해당하는 두 개의 반응물이 생성되기 때문입니다.
1단계: 단분자 반응 ⟶ + O ->+
2단계: 이분자 반응 O + ⟶ O + O -> 2
이 두 단계는 반응 속도가 다른데, 첫 번째 단계는 가역적이고 두 번째 단계보다 빠르기 때문에 반응 속도가 느리기 때문에 이를 판단하는 단계가 두 번째 단계라는 것을 의미하고 이것을 이용하여 관측된 반응 속도를 결정합니다.모든 단계의 반응속도 법칙은 다음과 같습니다.
다음 메커니즘은 실험적으로 관찰된 오존 분해 속도 법칙을 설명할 수 있으며, 또한 오존 및 산소에 대한 반응 순서를 결정할 수 있으며, 이를 통해 전체 반응 순서가 결정됩니다.느린 단계인 쌍분자 반응은 생성물의 생성 속도를 결정하는 단계이며, 이 단계에서 두 개의 산소 분자가 생성된다는 것을 고려하면 속도 법칙은 다음과 같은 형태를 갖습니다.
그러나 이 방정식은 산소(중간)의 농도에 따라 달라지며, 이는 첫 번째 단계를 고려하여 결정할 수 있습니다.첫 번째 단계는 더 빠르고 가역적이며 두 번째 단계는 더 느리기 때문에 첫 번째 단계의 반응물과 생성물은 평형 상태에 있으므로 중간체의 농도는 다음과 같이 결정할 수 있습니다.
이 식들을 이용하면 분자 산소의 형성 속도는 다음과 같습니다.
마지막으로, 제시된 메커니즘은 다음과 같이 속도 상수(Kobs)와 1차 운동학에 해당하는 실험적으로 관찰된 속도를 설정할 수 있습니다.[44]
여기서 = ⋅ K - }}={
오존층 환원
오존의 감소는 오존 음이온인 O-3을 제공합니다.이 음이온의 유도체는 폭발성이 있으며 극저온에서 보관해야 합니다.모든 알칼리 금속에 대한 오존화물이 알려져 있습니다.KO3, RbO3, CsO는3 각각의 산화물로부터 제조될 수 있습니다.
KO3는 위와 같이 형성될 수 있지만 수산화칼륨과 오존으로부터 형성될 수도 있습니다.[45]
NaO3 및 LiO는3 Na 또는+ Li+ 이온을 포함하는 이온 교환 수지에 액체 NH에서3 CsO의3 작용에 의해 제조되어야 합니다.[46]
암모니아의 칼슘 용액은 오존과 반응하여 칼슘 오조니드가 아닌 암모늄 오조니드를 생성합니다.[40]
적용들
오존은 물에서 철과 망간을 제거하는 데 사용될 수 있으며, 이 침전물은 여과될 수 있습니다.
오존은 또한 물에 녹아있는 황화수소를 황산으로 산화시킵니다.
이 세 가지 반응은 오존 기반 우물 수처리를 사용하는 데 있어 핵심적인 역할을 합니다.
오존은 또한 시안화물을 시안화물로 바꿔 해독할 것입니다.
분광 특성
오존은 대칭 스트레치(1103.157cm−1), 벤딩(701.42cm−1), 대칭 스트레치(1042.096cm−1)의 세 가지 진동 모드를 가진 구부러진 3원자 분자입니다.[48]대칭적인 신축성과 굽힘은 약한 흡수체이지만 대칭적인 신축성은 강하고 오존이 중요한 작은 온실가스가 되는 원인이 됩니다.이 IR 대역은 UV 기반 측정이 일반적이지만 주변 오존과 대기 오존을 감지하는 데도 사용됩니다.[49]
오존의 전자기 스펙트럼은 매우 복잡합니다.대기 분자의 MPI Mainz UV/VIS Spectrum Atlas에서 개요를 볼 수 있습니다.[50]
모든 밴드는 해리성으로, 광자를 흡수한 후 분자가 O+O로2 떨어지는 것을 의미합니다.가장 중요한 흡수는 하틀리 밴드로, 300 nm를 약간 넘는 범위에서 200 nm를 약간 넘는 범위까지 확장됩니다.성층권에서 자외선을 흡수하는 역할을 하는 것이 바로 이 대역입니다.
높은 파장 쪽에서는 하틀리 대역이 이른바 허긴스 대역으로 전이되는데, 허긴스 대역은 ~360 nm 정도 사라질 때까지 급격히 떨어집니다.400 nm 이상은 NIR 안으로 잘 뻗어 있는 채피우스와 울프 밴드입니다.그곳에서 구조화되지 않은 흡수 밴드는 높은 주변 오존 농도를 감지하는 데 유용하지만, 너무 약해서 실질적인 효과가 크지 않습니다.
극자외선에는 200 nm 아래에서 ~120 nm에서 최대로 천천히 증가하는 추가 흡수 대역이 있습니다.
지구 대기의 오존
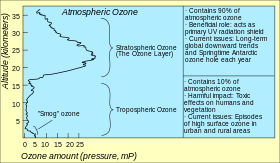


대기 중의 총 오존 수준(주어진 세로 열의 오존 양)을 표현하는 표준 방법은 돕슨 단위를 사용하는 것입니다.점 측정값은 nmol/mol(10억분율, ppb) 또는 μg/m의3 농도로 보고됩니다.대기 중 오존 농도에 대한 연구는 1920년대에 시작되었습니다.[51]
오존층
위치 및 생산
대기 중 오존의 가장 높은 수준은 성층권으로 지표면으로부터 약 10km에서 50km 사이의 오존층이라고도 알려진 지역에 있습니다.그러나 이 "층"에서도 오존 농도는 100만분의 2에서 8분의 1밖에 되지 않기 때문에 산소의 대부분은 부피 기준으로 약 21만분의 1로 다이옥시겐 O입니다2.[52]
성층권의 오존은 주로 240 nm에서 160 nm 사이의 단파 자외선으로부터 생성됩니다.산소는 헤르츠베르크 대역에서 240 nm에서 약하게 흡수되기 시작하지만, 산소의 대부분은 오존이 흡수하지 않는 200 nm에서 160 nm 사이의 강한 슈만-룽지 대역에서 흡수되어 해리됩니다.X-Ray 한계까지 연장되는 짧은 파장의 빛은 분자 산소를 해리시킬 만큼 에너지가 강하지만 상대적으로 적은 양이며, 라이만 알파(121nm)의 강한 태양 방출은 분자 산소 흡수가 최소인 지점에 떨어집니다.[53]
오존 생성과 파괴의 과정은 채프먼 사이클이라 불리며 분자 산소의 광분해로 시작됩니다.
산소 원자가 다른 산소 분자와 반응하여 오존을 형성합니다.
여기서 "M"은 반응의 과잉 에너지를 방출하는 세 번째 물체를 의미합니다.그리고 나서 오존 분자는 UV-C 광자를 흡수하고 해리할 수 있습니다.
O 원자와 산소 분자가 서로 떨어져 날아가 다른 분자와 충돌할 때, 과잉된 운동 에너지는 성층권을 가열합니다.자외선이 운동 에너지로 전환되면서 성층권이 따뜻해집니다.오존의 광분해에서 생성된 산소 원자는 이전 단계에서와 같이 다른 산소 분자와 반응하여 더 많은 오존을 형성합니다.맑은 대기에서는 질소와 산소만 있으면 오존이 원자 산소와 반응하여 두 개의2 O 분자를 형성할 수 있습니다.
이 종료 단계에서 원자 산소가 오존으로 되돌아오는 사이클링의 속도를 추정하는 것은 단순히23 O 대 O의 농도의 비율을 취함으로써 알 수 있습니다.종결 반응은 특정 자유 라디칼의 존재에 의해 촉매되는데, 그 중 가장 중요한 것은 하이드록실(OH), 일산화질소(NO) 및 원자 염소(Cl) 및 브롬(Br)입니다.20세기 후반, 성층권의 오존의 양은 감소하고 있는 것으로 밝혀졌는데, 주로 클로로플루오르카본(CFC)과 비슷한 염소화 및 브롬화 유기 분자의 농도 증가 때문입니다.그 감소의 건강 영향에 대한 염려는 1987년 몬트리올 의정서로 이어졌고, 많은 오존을 고갈시키는 화학물질의 생산에 대한 금지 그리고 21세기의 첫번째와 두번째 10년에 성층권 오존 농도의 회복의 시작으로 이어졌습니다.
지구상에 사는 생명체의 중요성

오존층에 있는 오존은 약 200 nm 자외선에서 315 nm까지의 햇빛 파장을 걸러내고, 오존 피크 흡수는 약 250 nm입니다.[54]이 오존 UV 흡수는 낮은 UV-C(200-280 nm)와 전체 UV-B 대역(280-315 nm)을 통해 공기 중의 일반 산소와 질소에 의한 UV 흡수를 연장시키기 때문에 생명체에게 중요합니다.오존을 통과한 후 UV-B가 남아있는 작은 흡수되지 않은 부분은 인간에게 햇볕에 그을리게 하고, 식물과 동물 모두의 생체 조직에 직접적인 DNA 손상을 입힙니다.오존이 중거리 UV-B에 미치는 영향은 290nm에서 UV-B에 미치는 영향으로 설명되며, 이는 표면보다 3억 5천만 배 더 강력한 복사 세기를 가지고 있습니다.그럼에도 불구하고, 비슷한 진동수의 충분한 자외선-B 방사선이 땅에 닿아 햇볕에 타는 것을 야기하고, 이러한 같은 파장은 인간의 비타민 D 생성에 책임이 있는 것들 중 하나입니다.
오존층은 UV-A (315–400 nm)라고 불리는 더 긴 자외선 파장에 거의 영향을 미치지 않지만, 이 방사선은 햇볕에 그을리거나 직접적인 DNA 손상을 일으키지 않으며, 특정한 사람들에게 장기적인 피부 손상을 일으킬 수도 있지만,일반적으로 식물이나 지표면에 사는 생물체의 건강에 위험하지 않습니다(자외선에 가까운 정보는 자외선 참조).
저준위 오존
| 시리즈의 일부(on) |
| 오염 |
|---|
 |
저준위 오존(또는 대류권 오존)은 대기 오염 물질입니다.[55]자동차 엔진이나 산업 작업에 의해 직접적으로 배출되는 것이 아니라 탄화수소와 질소산화물이 포함된 공기에 햇빛이 반응하여 오염원에서 직접 오존을 형성하거나 수 킬로미터의 역풍에 의해 형성됩니다.
오존은 알데하이드와 같은 일부 탄화수소와 직접적으로 반응하여 공기 중에서 제거되기 시작하지만, 제품 자체가 스모그의 주요 구성 요소입니다.자외선에 의한 오존 광분해는 하이드록실 라디칼 HO•의 생성으로 이어지며, 이는 공기 중에서 탄화수소를 제거하는 데 일부 역할을 하지만, 강력한 눈 자극제가 될 수 있는 퍼옥시아실 질산염과 같은 스모그 성분 생성의 첫 단계이기도 합니다.대류권 오존의 대기 수명은 약 22일이며, 주요 제거 메커니즘은 지면에 축적되고, 위에서 언급한 반응은 HO•를 제공하며, OH 및 퍼옥시 라디칼 HO2•[56]와의 반응에 의해 생성됩니다.
지면 수준 오존의 증가와 일부 식물 종의 광합성을 방해하고 전반적인 성장을 방해하는 오염으로 인해 농업 수확량이 크게 감소했다는 증거가 있습니다.[57][58]미국 환경보호국(EPA)은 인간의 건강을 보호하기 위해 고안된 1차 규제 외에 농작물 피해를 줄이기 위한 2차 규제를 제안했습니다.
도시지역의 오존 농도가 낮음
오존 수치가 상승한 도시의 특정한 예로는 콜로라도의 덴버, 텍사스의 휴스턴, 멕시코의 멕시코 시티 등이 있습니다.휴스턴의 수치는 약 41nmol/mol인 반면 멕시코 시티는 약 125nmol/mol로 훨씬 더 위험합니다.[58]
저준위 오존, 또는 대류권 오존은 도시 지역에서 가장 우려되는 오존 오염 유형이며, 일반적으로 증가하고 있습니다.[59]도시 지역의 오존 오염은 인구 밀도에 영향을 미치며, 문제가 되는 오존 수치의 주요 원인인 오염 물질 NO와2 VOC를 배출하는 차량의 높은 인구로 인해 악화됩니다.[60]도시 지역의 오존 오염은 특히 기온 상승과 관련이 있으며, 폭염 시 열 관련 사망률을 증가시키고 있습니다.[61]도심 지역 폭염 시 오존 농도는 평소보다 20% 이상 높아질 수 있습니다.[62]도시 지역의 오존 오염은 여름과 가을에 더 높은 초과 수준에 이르는데, 이것은 날씨 패턴과 교통 패턴으로 설명될 수 있습니다.[60]빈곤을 경험하는 사람들은 오염 수준에 기여할 가능성이 적음에도 불구하고 전반적으로 오염에 더 많은 영향을 받습니다.[63]
위에서 언급했듯이, 콜로라도의 덴버는 많은 양의 오존을 가진 미국의 많은 도시들 중 하나입니다.미국 폐 협회에 따르면 덴버-오로라 지역은 미국에서 14번째로 오존 오염이 심한 지역입니다.[64]오존 농도가 높다는 문제는 이 지역에서 새로운 것이 아닙니다.2004년 EPA는 덴버 메트로/노스 프론트 레인지를[b] 1997년의 8시간 오존 기준에 따라 비도장 구역으로 할당했지만,[65] 이후 2007년까지 이 상태를 연기했습니다.비달성 기준은 한 지역이 EPA의 대기질 기준을 충족하지 못한다는 것을 나타냅니다.이에 대응하여 콜로라도 오존 행동계획을 수립하고, 이 계획을 통해 다양한 변화가 이루어졌습니다.첫 번째 주요 변화는 자동차 배출 테스트가 주 전역에 걸쳐 Larimer 및 Weld County 지역과 같이 이전에 배출 테스트를 의무화하지 않은 더 많은 카운티로 확대되었다는 것입니다.질소산화물(NOx)과 휘발성유기화합물(VOC) 배출량을 줄이는 변화도 있어 오존 수치를 낮추는 데 도움이 될 것으로 보입니다.
이 지역의 높은 오존 수치의 큰 원인 중 하나는 콜로라도 대도시 지역의 대부분과 겹치는 덴버-줄스버그 분지(DJB)에 위치한 석유 및 천연 가스 산업입니다.오존은 지구의 성층권에서 자연적으로 생성되지만 인간의 노력으로 대류권에서도 생성됩니다.앞서 간략히 언급한 것처럼 NOx와 VOCs는 태양광과 반응하여 광화학이라고 불리는 과정을 통해 오존을 생성합니다.오존 상승 1시간(<75ppb) 6월 중 발생 -오존 수치 상승이 지역 광화학에 의한 것임을 나타내는 8월."[66]콜로라도-볼더 대학의 기사에 따르면, "석유와 천연 가스 VOC 배출은 오존 생성에 주요한 역할을 하며 북부 콜로라도 전방 지역(NCFR)의 높은 O3 수준에 기여할 가능성이 있습니다."[66]라고 합니다. 바람 패턴과 대형 석유 및 천연 가스 작업에서 발생하는 배출물을 연구하기 위해 복잡한 분석을 사용하여 t.저자들은 "NCFR의 상승된 O3 레벨은 DJB의 와텐베르크 필드 지역의 O&NG 작업이 위치한 상향풍 부문인 N-ESE로부터의 항공 운송과 대부분 상관관계가 있다"고 결론 내렸습니다.[66]
2008년에 작성된 콜로라도 오존 행동 계획에는 "NOx의 대규모 산업 자원에 대한 배출 통제"와 "새로운 석유 및 가스 응축수 탱크 및 공압 밸브에 대한 주 전체의 통제 요구 사항"을 평가하기 위한 계획이 포함되어 있습니다.[67]2011년에는 NOx 배출을 줄이기 위한 보다 구체적인 계획이 포함된 지역 헤이즈 계획이 발표되었습니다.이러한 노력은 실행하기가 점점 더 어려워지고 있으며, 실현되기까지 여러 해가 걸립니다.물론 오존 수치가 높게 유지되는 다른 이유들도 있습니다.여기에는 더 많은 자동차 배출을 의미하는 인구 증가와 배출가스를 억제할 수 있는 NCFR을 따라 있는 산들이 포함됩니다.관심이 있는 경우 매일 대기질 수치를 콜로라도 공중보건환경부 웹사이트에서 확인할 수 있습니다.[68]앞서 언급한 바와 같이 덴버는 현재까지도 높은 수준의 오존을 경험하고 있습니다.콜로라도 전방 지역의 높은 오존 농도 문제를 해결하기 위해서는 수년이 걸릴 것이며 시스템을 생각하는 접근법이 필요할 것입니다.
오존균열

오존 가스는 천연 고무, 니트릴 고무 및 스티렌-부타디엔 고무와 같이 사슬 구조 내에 올레핀 또는 이중 결합을 갖는 중합체를 공격합니다.이러한 고분자를 이용하여 제조된 제품은 특히 공격에 취약하여 시간이 지남에 따라 균열이 길어지고 깊어지는 현상, 고무 성분이 전달하는 하중과 대기 중 오존 농도에 따라 균열이 증가하는 속도 등이 발생합니다.이러한 재료는 표면에 결합하여 보호 필름을 만들거나 재료와 혼합하여 장기적인 보호를 제공하는 왁스와 같은 안티오존제를 첨가하여 보호할 수 있습니다.예를 [69]들어 자동차 타이어에서는 오존 균열이 심각한 문제였지만, 현대 타이어에서는 문제가 되지 않습니다.한편, 개스킷 및 O-링과 같은 많은 중요 제품은 압축 공기 시스템 내에서 생성된 오존에 의해 공격을 받을 수 있습니다.강화 고무로 제작된 연료 라인 또한 공격에 취약하며, 특히 일부 오존은 전기 부품에 의해 생성되는 엔진실 내에서 공격을 받기 쉽습니다.고무 제품을 DC 전기 모터에 가깝게 보관하면 오존 분해를 가속화할 수 있습니다.모터의 정류자는 불꽃을 발생시켜 오존을 생성합니다.
온실가스로서의 오존
오존은 산업혁명 이전에 지표면에 존재했지만, 현재 피크 농도는 산업화 이전 수준보다 훨씬 높고, 심지어 오염원에서 멀리 떨어진 배경 농도도 상당히 높습니다.[70][71]오존은 지구에서 방출되는 적외선 에너지의 일부를 흡수하는 온실가스의 역할을 합니다.오존의 온실가스 효력은 전 세계적으로 균일한 농도로 존재하지 않기 때문에 정량화하기가 어렵습니다.그러나 기후 변화와 관련된 가장 널리 받아들여지는 과학적 평가(예: 기후 변화에 관한 정부간 패널 제3차 평가 보고서)[72]에 따르면 대류권 오존의 복사 강제력은 이산화탄소의 약 25%입니다.
대류권 오존의 연간 지구 온난화 잠재량은 918톤에서 1022톤 사이입니다.이것은 분자당 기준으로 대류권의 오존은 이산화탄소보다 약 1,000배 강한 복사 강제력 효과를 가지고 있음을 의미합니다.하지만 대류권 오존은 대기 중에서 이산화탄소보다 훨씬 더 빨리 부패하는 짧은 수명의 온실가스입니다.이것은 20년 동안 대류권 오존의 지구 온난화 잠재력이 훨씬 적음을 의미합니다. 대류권 오존의 경우 약 62톤에서 69톤의 이산화탄소가 해당됩니다.[73]
대류권 오존은 수명이 짧은 특성 때문에 지구적으로 강한 영향을 미치지 않지만 지역 규모에 매우 강한 복사 강제 효과를 가지고 있습니다.사실, 세계에는 대류권 오존이 이산화탄소의 150%를 강제하는 방사능을 가진 지역이 있습니다.[74]예를 들어, 대류권의 오존 증가는 1955년에서 2000년 사이에 남방해 상부 온난화의 ~30%에 책임이 있는 것으로 나타났습니다.[75]
건강에 미치는 영향
지난 수십 년간, 과학자들은 급성 그리고 만성 오존 노출이 인간의 건강에 미치는 영향을 연구했습니다.수백 건의 연구에서 오존은 현재 도시 지역에서 발견되는 수준으로 사람들에게 해롭다고 주장하고 있습니다.[76][77]오존은 호흡기, 심혈관 및 중추신경계에 영향을 미치는 것으로 나타났습니다.조기 사망과 생식 건강 및 발달 문제도 오존 노출과 관련이 있는 것으로 나타났습니다.[78]
취약인구
미국 폐 협회는 호흡 오존의 영향에 특히 취약한 5명의 인구를 확인했습니다.[79]
- 어린이와 청소년
- 65세 이상인 사람
- 야외에서 일하거나 운동하는 사람들
- 천식, 만성폐쇄성폐질환(기종, 만성기관지염을 포함하는 COPD라고도 함) 등 기존 폐질환이 있는 사람
- 심혈관질환자
추가적인 증거는 여성, 비만인 사람들 그리고 저소득층 사람들 또한 더 많은 연구가 필요하지만 오존으로부터 더 높은 위험에 직면할 수 있다는 것을 암시합니다.[79]
급성 오존 노출
급성 오존 노출 범위는 수 시간에서 수 일에 이릅니다.오존은 가스이기 때문에 폐와 호흡기 전체에 직접적인 영향을 미칩니다.흡입된 오존은 염증을 유발하고 급성이지만 가역적인 폐 기능 변화를 일으키며 기도 과민반응을 일으킵니다.[80]이러한 변화는 호흡 곤란, 쌕쌕거림, 기침으로 이어져 천식이나 만성 폐쇄성 폐질환(COPD)과 같은 폐 질환을 악화시켜 치료를 받아야 할 필요성을 야기할 수 있습니다.[81][82]오존에 대한 급성 및 만성 노출은 다음과 같은 메커니즘으로 인해 호흡기 감염의 위험을 증가시키는 것으로 나타났습니다.[83]
오존의 유해성, 특히 폐에 미치는 영향에 대한 메커니즘을 알아내기 위해 많은 연구가 수행되었습니다.이 연구들은 오존에 노출되는 것이 폐 조직 내의 면역 반응에 변화를 일으켜 선천적 면역 반응과 적응적 면역 반응 모두를 방해하고 폐 상피 세포의 보호 기능을 변화시킨다는 것을 보여주었습니다.[84]이러한 면역 반응의 변화와 관련된 염증 반응은 폐 감염의 위험 증가와 지상 오존 오염에 노출된 후 천식 및 반응성 기도의 악화 또는 유발에 기여할 가능성이 있는 요인으로 생각됩니다.[84][85]
선천적(세포) 면역 체계는 다양한 화학적 신호와 세포 유형으로 구성되어 있으며, 다양한 병원체 유형, 일반적으로 숙주 내의 박테리아 또는 이물질/물질에 대해 광범위하게 작용합니다.[85][86]선천적인 시스템의 세포는 오존에 노출된 후 이러한 세포 유형의 기능이 변화하는 것으로 보여짐에 따라 폐에서 오존 병리의 메커니즘에 기여하는 것으로 생각되는 식세포, 호중구를 포함합니다.[86][85]"식세포증"의 과정을 통해 병원균이나 이물질을 제거하는 목적을 수행하는 세포인 대식세포는 오존에 반응하여 방출하는 염증 신호의 수준을 변화시켜 폐에 염증 반응을 일으키거나 면역 보호를 감소시키는 것으로 나타났습니다.[86][84]주로 박테리아 병원균을 목표로 하는 선천적 면역체계의 또 다른 중요한 세포 유형인 호중구는 [86]높은 오존 수준에 노출된 후 6시간 이내에 기도에 존재하는 것으로 밝혀졌습니다.하지만 폐 조직의 높은 수준에도 불구하고, 박테리아를 제거하는 능력은 오존에 노출됨으로써 손상된 것으로 보입니다.[84]
적응면역시스템은 특정 병원체를 표적으로 하는 항체의 개발을 통해 장기적인 보호를 제공하는 면역의 한 분야이며, 높은 오존 노출에도 영향을 받습니다.[85][86]적응 면역 반응의 세포 구성 요소인 림프구는 오존에 노출된 후 "사이토카인"이라고 불리는 증가된 양의 염증성 화학 물질을 생성하는데, 이것은 기도 과민 반응과 천식 증상을 악화시키는 원인이 될 수 있습니다.[84]
기도 상피 세포는 병원체로부터 개인을 보호하는 데도 중요한 역할을 합니다.정상 조직에서 상피층은 보호 장벽을 형성하고, 또한 폐에서 이물질, 점액, 병원균을 제거하는 데 작용하는 특수한 연골 구조를 포함합니다.오존에 노출되면 섬모가 손상되고 병원균의 점막 청소가 줄어듭니다.게다가, 상피 장벽이 약해져 병원균이 장벽을 넘어 증식하고 더 깊은 조직으로 퍼지게 됩니다.함께, 이러한 상피 장벽의 변화는 사람들이 폐 감염에 더 취약하도록 돕습니다.[84]
오존을 흡입하는 것은 면역 체계와 폐에 영향을 줄 뿐만 아니라, 심장에도 영향을 미칠 수 있습니다.오존은 단기적인 자율 불균형을 일으켜 심박수의 변화와 심박수의 변동성을 감소시킵니다.[87] 그리고 한 시간 정도만 높은 수준에 노출되면 노인들은 심실하 부정맥이 발생하여 조기 사망과 뇌졸중의 위험이 높아집니다.[88]오존은 또한 혈관 수축을 초래하여 전신 동맥압을 증가시켜 기존의 심장 질환 환자의 심장 이환율 및 사망률을 증가시킬 수 있습니다.[89][90]
만성 오존 노출
오존을 한 번에 8시간 이상 몇 주, 몇 달 또는 몇 년 동안 호흡하는 것이 만성 노출을 정의합니다.많은 연구들이 이러한 노출로 인한 다양한 인구의 건강에 심각한 영향을 끼치고 있음을 시사하고 있습니다.
한 연구에 따르면 만성 오존과 모든 원인, 순환 및 호흡기 사망률 사이에 위험이 10ppb당[91] 2%, 3% 및 12% 증가하는 유의한 양의 연관성이 있는 것으로 나타났으며, 연간 오존 및 모든 원인 사망률의 연관성(95% CI)을 보고했으며, 위험 비율은 1.02(1.01–1.04), 심혈관 사망률은 1.03(1.01–1.05)입니다.유사한 연구는 모든 원인에 의한 사망률과 유사한 연관성을 발견하고 심혈관 사망률에 더 큰 영향을 미치는 것을 발견했습니다.[92]호흡기 원인에 의한 사망 위험 증가는 오존에 대한 장기간의 만성 노출과 관련이 있습니다.[93]
만성 오존은 특히 천식이 있는 어린이들에게 해로운 영향을 미칩니다.천식이 있는 어린이들의 입원 위험은 오존에 만성적으로 노출됨에 따라 증가합니다; 어린 아이들과 저소득층은 심지어 더 큰 위험에 처해있습니다.[94]
호흡기 질환(천식,[95] COPD,[96] 폐암[97])을 앓고 있는 성인들은 사망률과 이환율의 위험이 더 높으며, 위중한 환자들은 만성 오존 노출과 함께 급성 호흡곤란증후군을 일으킬 위험이 증가합니다.[98]
공기청정기에서 생성되는 오존
공기청정기로 판매되는 오존발생기는 의도적으로 가스오존을 생산합니다.[42]이것들은 종종 실내 공기 오염을 통제하기 위해 시판되고 오존을 묘사하기 위해 오해의 소지가 있는 용어들을 사용합니다.어떤 예들은 오존이 건강하거나 "더 나은" 산소 종류임을 암시하면서, 그것을 "에너지화된 산소" 또는 "순수한 공기"로 묘사하고 있습니다.[42]그러나 EPA에 따르면 "공공보건기준을 초과하지 않는 농도에서는 오존이 악취를 유발하는 많은 화학물질을 제거하는 데 효과적이지 않다는 것을 보여주는 증거가 있다"며 "공공보건기준을 초과하지 않는 농도에서 사용할 경우 실내 공기에 적용되는 오존은 바이러스, 세균, 곰팡이 또는 다른 생물학적 오염물질."[42]게다가, 또 다른 보고서는 "일부 통제된 연구의 결과는 사용자가 제조사의 작동 지침을 따를 때에도 이러한 [인간 안전] 기준보다 상당히 높은 오존 농도가 가능하다는 것을 보여줍니다"라고 말합니다.[99]
캘리포니아 항공 자원 위원회에는 실내 오존 한계치인 백만분의 0.050 parts를 충족하는 공기 청정기(이오나이저 포함)가 나열된 페이지가 있습니다.[100]그 기사에서:
캘리포니아에서 판매되는 모든 휴대용 실내 공기 청정 장치는 캘리포니아 항공 자원 위원회(CARB)의 인증을 받아야 합니다.인증을 받으려면 공기청정기의 전기안전성과 오존 배출 테스트를 거쳐야 하며, 오존 배출 농도는 백만분의 0.050ppm을 충족해야 합니다.규정에 대한 자세한 내용은 에어 클리너 규정을 참조하십시오.
오존 대기오염


오존 전구체는 주로 화석 연료의 연소 중에 배출되는 오염 물질의 그룹입니다.지상 오존 오염(tropospheric ozone)은 이러한 전구체들에 대한 주간 자외선의 작용에 의해 지구 표면 근처에서 생성됩니다.지표면의 오존은 주로 화석 연료 전구체에서 나오지만 메탄은 천연 전구체이며 지표면의 오존의 매우 낮은 자연 배경 수준은 안전하다고 여겨집니다.이 섹션에서는 지면 오존을 배경 수준보다 훨씬 높이는 화석 연료 연소의 건강 영향을 조사합니다.
지상 오존이 폐 기능을 해치고 호흡기를 자극할 수 있다는 것을 보여주는 많은 증거가 있습니다.[55][102]오존에 대한 노출은 조기 사망, 천식, 기관지염, 심장마비, 그리고 다른 심폐 문제와 연관되어 있습니다.[103][104]
오존에 장기간 노출되면 호흡기 질환으로 인한 사망 위험이 높아지는 것으로 나타났습니다.[42]미국 도시에 거주하는 45만 명을 대상으로 한 연구에서 오존 수치와 호흡기 질환 사이에 18년간 상당한 상관관계가 있는 것으로 나타났습니다.이 연구는 휴스턴이나 로스앤젤레스와 같은 오존 수치가 높은 도시에 사는 사람들이 폐 질환으로 사망할 위험이 30% 이상 증가했다고 밝혔습니다.[105][106]
세계보건기구, 미국환경보호국, 유럽연합의 대기질 지침은 측정 가능한 나쁜 건강 영향을 일으킬 수 있는 수준을 확인하기 위해 고안된 상세한 연구에 근거합니다.
EPA의 과학자들에 의하면, 민감한 사람들은 40 nmol/mol 정도로 낮은 오존 수치에 악영향을 받을 수 있다고 합니다.[104][107][108]EU에서는 현재 오존 농도에 대한 목표치가 120 µg/m으로 약 60 nmol/mol입니다.이 대상은 지침 2008/50/EC에 따라 모든 회원국에 적용됩니다.[109]오존 농도는 일 평균 최대 8시간으로 측정되며 2010년 1월부터 연간 25일 이상 달력일에 목표치를 초과해서는 안 됩니다.이 지침은 앞으로 120 µg/m 제한을 엄격하게 준수해야 하지만(즉, 오존 농도가 1년 중 어느 날에도 초과되지 않아야 함), 이 요구 사항에 대해 정해진 날짜는 없으며 이는 장기적인 목표로 취급됩니다.
미국의 경우 청정대기법은 EPA가 지상 오존을 포함한 여러 오염물질에 대한 국가 대기질 기준을 설정하도록 지시하고 있으며, 이 기준을 준수하지 않는 카운티는 기준치를 낮추기 위한 조치를 취해야 합니다.2008년 5월 법원의 명령에 따라 EPA는 오존 기준을 80 nmol/mol에서 75 nmol/mol로 낮췄습니다.이 조치는 논란의 여지가 있는 것으로 밝혀졌는데, 이 기관의 과학자들과 자문 위원회가 기준치를 60 nmol/mol로 낮출 것을 권고했기 때문입니다.[104]많은 공중 보건 및 환경 단체에서도 60nmol/mol 기준을 지지하고 있으며, 세계 보건 기구에서는 100 µg/mol(51nmol/mol)을 권장하고 있습니다.
2010년 1월 7일, 미국 환경 보호국(EPA)은 스모그의 주 성분인 오염 오존에 대한 국가 대기 대기 품질 표준(NAAQS)의 수정 사항을 발표했습니다.
... EPA는 2008년 최종 규칙에서 0.075 μmol/mol로 설정된 8시간 1차 표준의 수준을 0.060~0.070 μmol/mol 범위 내에서 낮은 수준으로 설정하여 O의
3 배열에 대한 어린이 및 기타 위험 인구에 대한 보호를 강화할 것을 제안합니다.호흡기 원인에 대한 응급 부서 방문 및 병원 입원을 포함한 호흡기 질환의 심각한 지표에 대한 폐 기능 저하 및 증가된 호흡기 증상, 가능한 심혈관 관련 질환 및 총 비사고 및 심폐 사망률...[113]
2015년 10월 26일, EPA는 8시간 1차 NAAQS를 0.075 ppm에서 0.070 ppm으로 수정한 시행일을 2015년 12월 28일로 하는 최종 규칙을 발표했습니다.[114]
EPA는 일반 대중에게 공기 오염 수준을 설명하는 데 도움이 되는 공기질 지수(AQI)를 개발했습니다.현재 기준에서 8시간 평균 오존 몰 분율 85~104nmol/mol은 "민감한 그룹에 건강에 좋지 않음", 105nmol/mol~124nmol/mol은 "건강에 좋지 않음", 125nmol/mol~404nmol/mol은 "매우 건강에 좋지 않음"으로 설명됩니다.[115]
오존은 또한 복사기와 같은 전자 장비로 인해 부분적으로 실내 공기 오염에 존재할 수 있습니다.뇌우와 천식 환자의 병원 입원으로 인해 증가한 꽃가루, 곰팡이 포자, 오존 사이에도 연관성이 있는 것으로 알려져 있습니다.[116]
빅토리아 시대에, 한 영국 민간신화는 바다의 냄새가 오존에 의한 것이라고 믿었습니다.사실, "바다 냄새"라는 특징은 식물성 플랑크톤에 의해 발생하는 화학물질인 디메틸설파이드에 의해 발생합니다.빅토리아 시대의 영국인들은 그로 인한 냄새를 "가벼운" 것으로 여겼습니다.[117]
폭염
2003년 유럽의 폭염 기간 동안 오존과 열의 공동 사망률 영향을 평가하기 위한 조사 결과, 이것들이 추가적인 것으로 나타났습니다.[118]
생리학
오존은 활성 산소 형태인 슈퍼옥사이드, 싱글릿 산소, 과산화수소 및 차아염소산 이온과 함께 백혈구 및 기타 생물학적 시스템(예: 마리골드의 뿌리)에 의해 이물질을 파괴하는 수단으로 생성됩니다.오존은 유기 이중 결합과 직접적으로 반응합니다.또한, 오존이 다이옥시겐으로 분해될 때, 그것은 반응성이 높고 많은 유기 분자를 손상시킬 수 있는 산소 자유 라디칼을 발생시킵니다.게다가, 오존의 강력한 산화성은 염증의 원인이 될 수 있다고 믿어집니다.오존이 체내에서 어떻게 생성되고 어떤 작용을 하는지에 대한 인과관계는 여전히 고려 중에 있으며, 다른 신체 화학적 과정들이 같은 반응을 일으킬 수 있기 때문에 다양한 해석의 대상이 되고 있습니다.인간 면역 반응의 항체 촉매 수분 산화 경로를 오존 생성과 연관시키는 증거가 있습니다.이 시스템에서 오존은 물과 호중구에서 생성된 단일 산소로부터 트리옥산의 항체 촉매 생성에 의해 생성됩니다.[119]
흡입될 때 오존은 폐에 늘어선 화합물과 반응하여 동맥경화반(심장 질환의 한 형태)의 생성과 병인을 촉진하는 것으로 생각되는 특정한 콜레스테롤 유래 대사 물질을 형성합니다.이러한 대사산물은 인간 동맥경화성 동맥에서 자연적으로 발생하는 것으로 확인되었으며, 알돌화를 통해 5,6개의 세코스테롤뿐만 아니라 5,6개의[120] 세코스테롤을 형성하기 위해 콜레스테롤의 이중 결합의 오존 용해에 의해 생성되는 아세토스테롤 종류로 분류됩니다.[121]
식물 생장과 작물 수확량에 미치는 영향
오존은 식물의 성장에 악영향을 끼친다: "... 오존은 총 엽록소, 카로티노이드 및 탄수화물 농도를 감소시키고 1-아미노시클로프로판-1-카르복실산(ACC) 함량 및 에틸렌 생산을 증가시킵니다.처리된 공장에서 아스코르브산염 잎 풀은 감소한 반면 지질 과산화 및 용질 누출은 오존이 없는 대조군보다 상당히 높았습니다.이 데이터는 오존이 감귤류의 산화 스트레스에 대한 보호 메커니즘을 유발했음을 나타냅니다."[122]고추 식물을 모델로 사용한 연구들은 오존이 과일 수확량을 감소시키고 과일의 품질을 변화시킨다는 것을 보여주었습니다.[123][124]또한 엽록소 수치의 감소와 잎의 항산화 방어가 관찰되었으며, 활성산소종(ROS) 수치와 지질 및 단백질 손상을 증가시키는 것으로 나타났습니다.[123][124]
2022년 연구에 따르면 동아시아는 화석 연료 연소의 부산물인 오존 오염으로 인해 연간 630억 달러의 농작물 손실을 보고 있습니다.중국은 잠재적인 밀 생산량의 약 3분의 1과 쌀 생산량의 약 4분의 1을 잃고 있습니다.[125][126]
안전규정
오존의 강한 산화성 때문에 오존은 특히 눈과 호흡기에 영향을 미치는 주요 자극제이며 낮은 농도에서도 위험할 수 있습니다.캐나다 산업안전보건센터는 다음과 같이 보고하고 있습니다.
매우 낮은 농도의 오존도 상기도와 폐에 해로울 수 있습니다.부상 정도는 오존 농도와 노출 기간에 따라 달라집니다.심각하고 영구적인 폐 손상이나 사망은 아주 짧은 시간이라도 상대적으로 낮은 농도에 노출되어 발생할 수 있습니다."[127]
오존에 노출될 가능성이 있는 근로자를 보호하기 위해 미국 산업안전보건국은 8시간 가중 평균으로 계산된 0.1μmol/mol(29 CFR 1910.1000 표 Z-1)의 허용 노출 한도(PEL)를 설정했습니다.농도가 높을수록 특히 위험하며 NIOSH는 5μmol/mol의 생명 및 건강에 대한 즉각적인 위험 한도(IDLH)를 설정했습니다.[128]오존이 사용되는 작업 환경 또는 오존이 생성될 가능성이 있는 작업 환경에는 적절한 환기가 있어야 하며, 농도가 OSHA PEL을 초과할 경우 이를 경보하는 오존 감시기를 구비하는 것이 좋습니다.오존에 대한 지속적인 모니터는 여러 공급업체에서 구입할 수 있습니다.
오존 노출이 증가하면 여객기에서 발생할 수 있으며 고도와 대기 난기류에 따라 수준이 다를 수 있습니다.[129]미국 연방항공청 규정에서는 최대 4시간 평균 100nmol/mol로 250nmol/mol의 제한을 설정하고 있습니다.[130]일부 비행기에는 승객 노출을 줄이기 위해 환기 시스템에 오존 변환기가 장착되어 있습니다.[129]
생산.

오존 발생기 또는 오존 발생기는 사람이 없는 방에서 공기를 정화하거나 연기 냄새를 제거하기 위해 오존을 생성하는 데 사용됩니다.[131]이러한 오존 발생기는 시간당 3g 이상의 오존을 생성할 수 있습니다.오존은 종종 O가2 반응하지 않는 조건에서 자연에서 형성됩니다.[28]산업에서 사용되는 오존은 μmol/mol(ppm, 백만분의 1), nmol/mol(ppb, 십억분의 1), μg/m3, mg/h(시간당 밀리그램) 또는 중량 퍼센트로 측정됩니다.적용된 농도 체계는 공기 중에서 1%에서 5%까지 그리고 구형 생성 방법의 경우 6%에서 14%까지 다양합니다.새로운 전기분해 방법은 출력수에서 용존 오존 농도를 20%에서 30%까지 얻을 수 있습니다.
전통적인 발전 방식(코로나 방전, 자외선 등)을 이용하여 오존을 얼마나 많이 생성하고 있는지에는 온도와 습도가 큰 역할을 합니다.기존 방식은 매우 건조한 공기와 달리 습한 주변 공기로 작동할 경우 공칭 용량의 50% 미만을 생산합니다.새로운 발전기는 전해법을 사용하여 물 분자를 오존 생성의 원천으로 사용함으로써 더 높은 순도와 용해를 달성할 수 있습니다.
코로나 방전법

대부분의 산업용 및 개인용으로 가장 일반적인 유형의 오존 발생기입니다.의료 등급 및 산업 등급 오존 발생기를 포함하여 오존 생성의 "핫 스파크" 코로나 방전 방법의 다양성이 존재하지만, 이러한 장치는 일반적으로 코로나 방전 튜브 또는 오존 플레이트를 통해 작동합니다.[132][133]이들은 일반적으로 비용 효율적이며 오존 농도가 3~6%에 이를 때 주변 공기 이외의 산소 공급원이 필요하지 않습니다.기상 또는 기타 환경 조건으로 인한 주변 공기의 변동은 오존 생성의 변동성을 야기합니다.그러나, 그들은 또한 부산물로서 질소산화물을 생성합니다.에어 드라이어를 사용하면 수증기를 제거하여 질산 형성을 줄이거나 없앨 수 있고 오존 생성을 증가시킬 수 있습니다.상온에서 질산은 흡입 시 위험한 증기로 형성됩니다.증상으로는 가슴 통증, 호흡 곤란, 두통, 코와 목이 건조하여 타는 듯한 느낌이 들 수 있습니다.산소 농축기를 사용하면 수증기뿐만 아니라 질소의 대량을 제거함으로써 오존 생성을 더욱 증가시키고 질산 형성의 위험을 더욱 감소시킬 수 있습니다.
자외선
UV 오존 발생기, 또는 진공 자외선(VUV) 오존 발생기는 태양이 생성하는 것의 일부인 협대역 자외선을 생성하는 광원을 사용합니다.태양의 자외선은 지구의 성층권에 있는 오존층을 유지합니다.[134]
UV 오존 발생기는 오존 생성을 위해 주변 공기를 사용하며 공기 준비 시스템(에어 드라이어 또는 산소 농축기)을 사용하지 않으므로 비용이 적게 드는 경향이 있습니다.그러나 UV 오존 발생기는 일반적으로 약 0.5% 이하의 농도로 오존을 생성하므로 잠재적인 오존 생성 속도가 제한됩니다.이 방법의 또 다른 단점은 주변 공기(산소)가 UV 소스에 더 오랜 시간 노출되어야 하고, UV 소스에 노출되지 않은 가스는 처리되지 않는다는 것입니다.이로 인해 UV 발생기는 급격하게 이동하는 공기 또는 물줄기를 다루는 상황에서 사용하기에 비현실적입니다(예: 덕트 내 공기 살균).오존 생성은 자외선 살균 조사의 잠재적인 위험 중 하나입니다.VUV 오존 발생기는 수영장과 수백만 갤런의 물에서 사용됩니다.VUV 오존 발생기는 코로나 방전 발생기와 달리 유해한 질소 부산물을 생성하지 않으며 코로나 방전 시스템과 달리 습한 공기 환경에서 VUV 오존 발생기가 매우 잘 작동합니다.또한 일반적으로 값비싼 오프 가스 메커니즘이 필요하지 않으며, 추가 비용과 유지보수가 필요한 에어 드라이어나 산소 농축기가 필요하지 않습니다.
콜드 플라즈마
콜드 플라즈마 방식은 DBD에 의해 생성된 플라즈마에 순수한 산소 가스가 노출되는 방식입니다.이원자 산소는 단일 원자로 쪼개지고, 세 쌍둥이에서 다시 결합하여 오존을 형성합니다.업계에서는 일부 DBD 오존 발생기를 CD 코로나 방전 발생기로 잘못 라벨링하는 것이 일반적입니다.일반적으로 모든 고체 평판 금속 전극 오존 발생기는 유전체 장벽 방전 방법을 사용하여 오존을 생성합니다.냉간 플라즈마 기계는 순수한 산소를 투입원으로 사용하며 오존의 최대 농도는 약 24%입니다.효율이 약 2%인 자외선 생산에 비해 주어진 시간 내에 훨씬 많은 양의 오존을 생성합니다.방전은 두 전극 사이의 간격에서 전자의 필라멘트 이동(마이크로 방전)으로 나타납니다.마이크로 방전이 균일하게 분배되기 위해서는 금속 전극을 분리하고 아크를 방지하기 위해 유전체 절연체를 사용해야 합니다.
전해조
전해 오존 생성(EOG)은 물 분자를 H2, O, O로23 분해합니다.대부분의 EOG 방법에서는 수소 가스를 제거하여 산소와 오존을 유일한 반응 생성물로 남깁니다.따라서 EOG는 주변 공기에 존재하는 질소 가스와 같이 코로나 방전 방법에서 발견되는 다른 경쟁 가스 없이 물에서 더 높은 용해를 달성할 수 있습니다.이 생성 방법은 20-30%의 농도를 달성할 수 있으며, 물을 원료로 사용하기 때문에 공기의 질과 무관합니다.오존을 생성하는 데 필요한 높은 과전위가 산소와 비교하여 일반적으로 전기분해적으로 오존의 생성은 불리합니다.이것이 전형적인 수전해 시 오존이 생성되지 않는 이유입니다.그러나 전기 분해 하에서 오존이 우선적으로 생성되도록 신중한 촉매 선택을 통해 산소의 과전위를 증가시킬 수 있습니다.이 방법을 위해 일반적으로 선택되는 촉매는 이산화[135] 납 또는 붕소가 도핑된 다이아몬드입니다.[136]
오존 대 산소 비율은 양극에서 전류 밀도를 증가시키고, 양극 주변의 전해질을 0°C에 가깝게 냉각시키고, 염기성 용액 대신 산성 전해질(희황산 등)을 사용하며, DC 대신 펄스 전류를 인가함으로써 향상됩니다.[137]
특별한 고려사항
오존은 다른 산업용 가스와 같이 저장되고 운반될 수 없으며(오존은 빠르게 이원자 산소로 붕괴되기 때문에) 따라서 현장에서 생산되어야 합니다.사용 가능한 오존 발생기는 고전압 전극의 배열 및 설계에 따라 다릅니다.가스/수관 열교환기는 시간당 20kg 이상의 생산 능력에서 접지 전극으로 사용될 수 있으며, 가스 측에 튜브형 고전압 전극으로 조립될 수 있습니다.일반적인 가스 압력 체계는 산소의 경우 2bar(200kPa), 공기의 경우 3bar(300kPa) 정도입니다.대형 설비에는 수 메가와트의 전력이 설치될 수 있으며, 50~8000Hz의 단상 교류 전류와 3,000~20,000볼트의 피크 전압으로 적용됩니다.인가 전압은 대개 인가 주파수와 반비례 관계에 있습니다.
오존 생성 효율에 영향을 미치는 주요 파라미터는 가스 온도이며, 이 온도는 냉각수 온도 및/또는 가스 속도에 의해 제어됩니다.물이 시원할수록 오존 합성이 좋아집니다.가스 속도가 낮을수록 농도가 높은 편입니다(그러나 순 오존은 적게 생성됩니다).일반적인 산업 조건에서는 유효 전력의 거의 90%가 열로 소멸되며 충분한 냉각수 흐름에 의해 제거되어야 합니다.
오존의 반응성이 높기 때문에 스테인리스 스틸(품질 316L), 티타늄, 알루미늄(수분이 없는 한), 유리, 폴리테트라플루오로에틸렌 또는 폴리불화비닐리덴과 같은 일부 재료만 사용할 수 있습니다.비톤은 일정한 기계적 힘과 습도가 없는 상태에서 사용할 수 있습니다(습도 제한은 제형에 따라 적용됩니다).일반 대기 수준을 제외하고는 물이 닿지 않는다는 제한과 함께 하이팔론을 사용할 수 있습니다.취화 또는 수축은 오존에 노출된 엘라스토머의 일반적인 고장 모드입니다.오존 균열은 O-링과 같은 엘라스토머 씰의 일반적인 고장 모드입니다.
실리콘 고무는 일반적으로 고무 샘플의 노화를 가속화하기 위한 장비와 같이 오존 농도가 1 wt% 미만일 때 개스킷으로 사용하기에 적합합니다.
부수생산
오존은 전기 방전 및 고에너지 전자기 방사선의 작용에 의해 O로부터
2 형성될 수 있습니다.전기 접점, 모터 브러시 또는 기계식 스위치의 억제되지 않은 아크는 접점을 둘러싸고 있는 대기 산소의 화학적 결합을 분해합니다 [O → 2O].아크 내부와 주변의 자유 산소 라디칼이 재결합하여 오존[O
3]을 생성합니다.[138]어떤 전기 장비들은 상당한 양의 오존을 발생시킵니다.이온성 공기 청정기, 레이저 프린터, 복사기, 테이저건 및 아크 용접기와 같은 고전압을 사용하는 장치의 경우에는 특히 그렇습니다.브러시를 사용하는 전기 모터는 장치 내부에서 반복적인 스파크가 발생하여 오존을 발생시킬 수 있습니다.엘리베이터나 유압 펌프에 사용되는 것과 같이 브러시를 사용하는 큰 모터는 더 작은 모터보다 더 많은 오존을 발생시킵니다.
오존은 베네수엘라 카타툼보 강에서 발생한 카타툼보 번개 폭풍 현상에서도 비슷하게 형성되고 있지만, 오존의 불안정성으로 오존층에 어떤 영향을 미칠지는 불확실합니다.[139]그것은 세계에서 가장 큰 단일 자연 발생 오존층이며, 이로 인해 오존층이 유네스코 세계 문화 유산으로 지정되어야 한다는 요구를 받고 있습니다.[140]
실험실생산

실험실에서 오존은 9볼트 배터리, 연필 흑연봉 음극, 백금선 양극, 3몰 황산 전해질을 이용한 전기 분해로 생산할 수 있습니다.[141]일어나는 반세포 반응은 다음과 같습니다.
여기서 E°는 표준 전극 전위를 나타냅니다.
순반응에서 물의 3당량은 오존의 1당량과 수소의 3당량으로 변환됩니다.산소 형성은 경쟁 반응입니다.
고전압 아크에 의해서도 생성될 수 있습니다.가장 간단한 형태로, 네온사인 변압기의 출력과 같은 고전압 AC는 두 개의 금속 막대에 연결되며, 끝단은 아크를 허용할 수 있도록 서로 충분히 가깝게 배치됩니다.결과적으로 발생하는 호는 대기 중의 산소를 오존으로 변환합니다.
오존을 포함하는 것이 종종 바람직합니다.이것은 외부 튜브의 상단과 하단에 가스 포트가 있는 상단에 함께 밀봉된 두 개의 동심 유리 튜브로 구성된 장치로 수행할 수 있습니다.내부 코어는 길이가 긴 금속 호일이 전원의 한쪽에 연결되어 있어야 합니다.전원의 다른 면은 외부 튜브를 감싸는 다른 호일 조각에 연결해야 합니다.하단 포트에는 드라이 O의
2 공급원이 적용됩니다.포일 리드에 고전압을 인가하면 중간에 있는 드라이 다이옥시겐 사이에 전기가 방전되어 O와
3 O가
2 형성되어 탑 포트로 흘러 나옵니다.이것은 Siemen's ozoniser라고 불립니다.반응은 다음과 같이 요약할 수 있습니다.[28]
적용들
산업
오존의 가장 큰 용도는 의약품, 합성 윤활제 및 기타 상업적으로 유용한 유기 화합물의 제조이며, 여기서 오존은 탄소-탄소 결합을 분리하는 데 사용됩니다.[28]그것은 또한 물질을 표백하거나 공기와 수원의 미생물을 죽이는 데에도 사용될 수 있습니다.[142]많은 도시의 식수 시스템은 일반적인 염소 대신 오존으로 박테리아를 죽입니다.[143]오존은 매우 높은 산화 가능성을 가지고 있습니다.[144]오존은 유기염소 화합물을 형성하지 않으며, 처리 후에도 물에 남아있지 않습니다.오존은 브로마이드 농도가 높은 공급수에서 의심되는 브로마이드 발암 물질을 형성할 수 있습니다.미국의 안전한 식수법은 정기적인 시험 결과에 따라 이 시스템들이 파이프에 최소 0.2 μmol/mol의 잔류 유리 염소를 유지하기 위해 염소 양을 도입하도록 의무화하고 있습니다.전력이 풍부한 곳에서 오존은 수요에 따라 생산되기 때문에 위험한 화학 물질을 운반하고 저장할 필요가 없기 때문에 물을 처리하는 비용 효율적인 방법입니다.일단 부패하면, 마시는 물에 아무런 맛도 냄새도 남지 않습니다.
비록 낮은 수준의 오존이 주거용 주택에서 일부 소독제를 사용하는 것으로 광고되고 있지만, 공기 중 병원균에 신속하고 상당한 영향을 미치기 위해 요구되는 건조한 공기 중의 오존 농도는 미국 산업 안전 보건국과 환경 보호국이 권장하는 안전 수준을 초과합니다.습도 조절은 오존의 파괴력과 산소로 붕괴되는 속도를 크게 향상시킬 수 있습니다(습도를 더하면 더 많은 효과를 얻을 수 있습니다).대부분의 병원균의 포자 형태는 천식 환자들이 문제를 갖기 시작하는 농도의 대기 오존에 매우 관대합니다.
1908년 런던 지하철 중앙선은 항공 소독제로 도입되었습니다.이 과정은 가치 있는 것으로 밝혀졌지만, 1956년까지 단계적으로 폐지되었습니다.그러나 유익한 효과는 열차 모터의 전기 방전으로 부수적으로 생성된 오존에 의해 유지되었습니다(위 참조:부수적 생산).[145]
오존 발생기는 코로나19 발생 후 교실을 소독하기 위해 2021년 가을 학기 동안 웨일즈의 학교와 대학교에 제공되었습니다.[146]
산업적으로 오존은 다음과 같은 용도로 사용됩니다.
- 병원, 식품공장, 요양원 [147]등의 세탁물 소독
- 염소[28] 대신 물 소독
- 화재 후와 같은 공기 및 물체를 탈취합니다.이 과정은 직물 복원에 광범위하게 사용됩니다.
- 음식물이나 접촉면의 박테리아를 죽입니다.[148]
- 양조장과 유제품과 같은 물을 많이 사용하는 산업은 용해된 오존을 과초산, 차아염소산염 또는 열과 같은 화학 세정제의 대체물로 효과적으로 사용할 수 있습니다.
- 냉각탑을 소독하고 화학물질 소모량 감소, 물 배출 감소, 성능 향상으로 레지오넬라균을 제어합니다.
- 수영장 및 스파 소독
- 저장된 곡물에[149] 들어있는 곤충
- 식품 가공 공장의 공기 중에서 효모와 곰팡이 포자를 세척합니다.
- 신선한 과일과 야채를 씻어 효모와 곰팡이와 박테리아를 죽입니다.[148]
- 물 속 오염물질(철, 비소, 황화수소, 질산염, 복합유기물이 '색'으로 뭉쳐 있는 것)을 화학적으로 공격합니다.
- 응집(철과 비소가 제거된 곳에서 여과를 돕는 분자의 응집)에 도움을 제공합니다.
- 화학적 합성을[150] 통한 화합물 제조
- 깨끗한 직물 및 표백제 직물(앞의 용도는 직물 복원에 사용되고 뒤의 용도는 특허 출원)[151]
- 염소 기반 표백에서 방염제 역할을 합니다.
- 잉크가 부착될 수 있도록 플라스틱 가공을 보조합니다.
- 고무 샘플을 노화시켜 고무 배치의 내용연수를 결정합니다.
- 지표수 처리장에서 Giardia lamblia와 Cryptosporidium과 같은 수인성 기생충을 박멸합니다.
오존은 실험실과 산업에서 많은 유기 반응의 시약입니다.오존 용해는 알켄을 카보닐 화합물로 분해하는 것입니다.
전 세계의 많은 병원들은 수술 사이에 수술실을 오염시키기 위해 대형 오존 발생기를 사용합니다.그 방들은 청소된 후, 남아있는 모든 박테리아를 효과적으로 죽이거나 중화시키는 오존으로 채워지기 전에 밀폐된 상태로 유지됩니다.[152]
오존은 목재 펄프의 표백에서 염소 또는 이산화염소의 대안으로 사용됩니다.[153]이는 종종 산소 및 과산화수소와 함께 사용되어 고품질의 백서를 제조할 때 염소 함유 화합물의 필요성을 제거합니다.[154]
오존은 시안화물을 시안산염으로 산화시키고 결국 이산화탄소로 산화시킴으로써 시안화물 폐기물(예: 금광 및 은광업)을 해독하는 데 사용될 수 있습니다.[155]
물소독
유전체 장벽 방전(Dielectric Barrier Discharge, DBD) 플라즈마 반응기가 개발된 이래, 오존을 이용한 수처리에 사용되어 왔습니다.[156]그러나, 염소와 같은 보다 저렴한 대체 소독제로 인해, DBD 오존수 제염의 이러한 적용은 높은 전력 소비와 부피가 큰 장비에 의해 제한되어 왔습니다.[157][158]그럼에도 불구하고, DBD 플라즈마 기반 오존 제염은 독성 잔류물에 대한 염소와 같은 일반적인 살균제의 부정적인 영향과 특정 미생물의 살처분에 대한 비효과성을 밝혀내는 연구와 함께 현재 이용 가능한 기술에 관심의 대상이 되고 있습니다.[159]브롬화물의 농도가 높은 물의 오존화는 바람직하지 않은 브롬화된 소독 부산물의 형성을 초래하지만, 담수화에 의해 음용수가 생성되지 않는 한, 오존화는 일반적으로 이러한 부산물에 대한 우려 없이 적용될 수 있습니다.[158][160][161][162]오존의 장점으로는 높은 열역학적 산화 전위, 유기 물질에 대한 민감성 감소, pH 변화에 대한 내성 향상, 세균, 곰팡이, 바이러스 및 포자와 낭종을 죽이는 능력을 유지할 수 있습니다.[163][164][165]오존은 수십 년간 유럽에서 널리 받아들여졌지만, 미국에서는 고출력 소비의 한계와 부피가 큰 설치, 오존 독성이 부착된 낙인 때문에 오염 제거에 거의 사용되지 않고 있습니다.[157][166]이러한 점을 고려하여 최근에는 효과적인 오존수 처리 시스템[167] 연구를 위한 연구 노력이 진행되고 있습니다. 연구자들은 경량 및 소형 저전력 표면 DBD 원자로,[168][169] 에너지 효율적인 체적 DBD[170] 원자로 및 저전력 마이크로 스케일 DBD 원자로를 조사했습니다.[171][172]이러한 연구는 특히 미국에서 물의 DBD 플라즈마 기반 오존 오염 제거를 재수용하는 길을 여는 데 도움이 될 수 있습니다.
소비자들
높은 수준의 오존을 발생시키는 장치들, 그 중 일부는 이온화를 사용하여, 무인 건물, 방, 도관, 나무 울타리, 보트 및 기타 차량을 소독하고 탈취하는 데 사용됩니다.
오존 처리된 물은 옷을 세탁하고 가정에서 음식, 식수, 표면을 소독하는 데 사용됩니다.미국 식품의약국(FDA)에 따르면, 그것은 "육류와 가금류를 포함한 식품에 항균제로서 오존을 기체 및 수성 단계에서 안전하게 사용할 수 있도록 제공하기 위해 식품 첨가제 규정을 개정하는 것"이라고 합니다.캘리포니아 폴리테크닉 대학의 연구는 여과된 수돗물에 용해된 오존의 0.3 μmol/mol 수준이 살모넬라균, 대장균 0157과 같은 음식물 매개 미생물에서 99.99% 이상의 감소를 가져올 수 있음을 보여주었습니다.H7과 Campylobacter.이 양은 앞서 언급한 WHO 권고 한도의 20,000배에 해당합니다.[148][173]오존은 과일과 채소의 농약 잔류물을 제거하는 데 사용될 수 있습니다.[174][175]
오존은 물 속의 박테리아를 죽이고 그것들을 자유 상태로 다시 활성화시킴으로써 염소나 브롬의 양을 줄이기 위해 가정과 온수 욕조에서 사용됩니다.오존은 물 속에 충분히 오래 남아있지 않기 때문에, 오존 자체는 목욕자들 간의 교차 오염을 방지하는 데 효과적이지 않으며 할로겐과 함께 사용되어야 합니다.자외선이나 코로나 방전에 의해 생성된 기체 상태의 오존은 물에 주입됩니다.[176]
오존은 수족관과 어항의 물 처리에도 널리 사용되고 있습니다.그것의 사용은 박테리아 성장을 최소화하고, 기생충을 통제하고, 일부 질병의 전염을 없애고, 물의 "노란"을 줄이거나 없앨 수 있습니다.오존은 물고기의 아가미 구조와 접촉해서는 안됩니다.천연 소금물은 (생명체와 함께) 충분한 "즉각적인 수요"를 제공하여 조절된 양의 오존이 브롬화 이온을 저브롬산으로 활성화시키고, 오존은 몇 초에서 몇 분 만에 완전히 붕괴됩니다.만약 산소를 공급받는 오존을 사용한다면, 물은 용존산소 함량이 높고 물고기의 아가미 구조는 위축되어 산소가 풍부한 물에 의존하게 될 것입니다.
양식업
물에 오존을 주입하는 과정인 오존화는 유기 분해를 촉진하기 위해 양식에 사용될 수 있습니다.또한 오존은 질산염으로의 변환을 통해 아질산염 수준을[177] 줄이기 위해 재순환 시스템에 추가됩니다.물 속의 아질산염 수치가 높으면, 아질산염은 물고기의 혈액과 조직에도 축적되어 산소 수송을 방해합니다. (헤모글로빈의 헴 그룹을 철(Fe2+
)에서 철(Fe3+
)로 산화시켜 헤모글로빈을 O에
2 결합시킬 수 없게 만듭니다.)[178]이러한 명백한 긍정적인 효과에도 불구하고, 재순환 시스템에서의 오존 사용은 염수 시스템에서의 생체이용가능한 요오드 수준을 감소시키는 것과 관련이 있으며, 이는 고트레와 같은 요오드 결핍 증상과 세네갈 발바닥 유충의 성장 감소를 초래합니다.[179]
오존산염 해수는 노다바이러스에 대한 해독과 대서양 넙치 알의 표면 소독에 사용됩니다.노다바이러스는 물고기에게 심각한 사망을 일으키는 치명적이고 수직으로 전염되는 바이러스입니다.해독 알은 3~4일 후 부화하지 않아 폐사하는 등 오존 농도가 높아 취급해서는 안 됩니다.[180]
농업
갓 자른 파인애플과 바나나에 오존을 적용하면 노출 시간이 최대 20분일 때 플라보노이드와 총 페놀 함량이 증가합니다.아스코르브산(비타민 C의 한 형태) 함량의 감소가 관찰되지만 총 페놀 함량과 플라보노이드에 대한 긍정적인 효과는 부정적인 효과를 극복할 수 있습니다.[181]오존 처리 시 토마토는 β-carotene, 루테인, 리코펜의 증가를 보여줍니다.[182]그러나 수확 전 기간에 딸기에 오존을 적용한 결과 아스코르브산 함량이 감소하는 것으로 나타났습니다.[183]
오존은 EDTA를 사용하여 토양으로부터 일부 중금속을 추출하는 것을 용이하게 합니다.EDTA는 일부 중금속(Pb, Zn)과 함께 강력하고 수용성인 배위 화합물을 형성하여 오염된 토양으로부터 이들을 용해시키는 것을 가능하게 합니다.오염된 토양을 오존으로 전처리하면 Pb, Am, Pu의 추출 효능은 각각 11.0~28.9%,[184] 43.5%,[185] 50.7%[185] 증가합니다.
의도치 않은 환경오염물질에 대한 영향
농작물 수분작용은 생태계의 필수적인 부분입니다.오존은 식물과 꽃가루 매개체의 상호작용에 해로운 영향을 미칠 수 있습니다.[186]꽃가루 매개자들은 한 식물에서 다른 식물로 꽃가루를 옮깁니다.이것은 생태계 내부의 필수적인 순환입니다.수분작용 장소 주변의 특정한 대기 상태에 변화를 일으키거나 생물학적 생물체로 변화를 일으키는 것은 수분작용자와 꽃이 피는 식물의 자연적인 주기에 알려지지 않은 변화를 일으킬 수 있습니다.북서부 유럽에서 실시된 한 연구에서는 오존 농도가 높을 때 농작물 꽃가루 매개자들이 더 부정적인 영향을 받았습니다.[187]
대체의학
의학적 상태의 치료를 위한 오존의 사용은 고품질의 증거에 의해 뒷받침되지 않으며, 일반적으로 대체 의학으로 여겨집니다.[188]
참고 항목
- 고리형 오존
- 별의 가려짐 현상에 의한 지구 오존 모니터링(GOMOS)
- 샤푸아 흡수
- 국제 오존층 보존의 날 (9월 16일)
- 번개
- 질소산화물
- 오존홀로 알려진 현상을 포함한 오존층 파괴.
- 오존 치료
- 오존웹
- 오존 용해
- 고분자 분해
- 멸균(미생물학)
참고문헌
각주
인용문
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. "#0476". National Institute for Occupational Safety and Health (NIOSH).
- ^ 가스백과사전; 오존
- ^ Cuthbertson, Clive; Cuthbertson, Maude (1914). "On the Refraction and Dispersion of the Halogens, Halogen Acids, Ozone, Steam Oxides of Nitrogen, and Ammonia". Philosophical Transactions of the Royal Society A. 213 (497–508): 1–26. Bibcode:1914RSPTA.213....1C. doi:10.1098/rsta.1914.0001. Retrieved 4 February 2016.
- ^ "Ozone". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Streng, A. G. (1961). "Tables of Ozone Properties". Journal of Chemical & Engineering Data. 6 (3): 431–436. doi:10.1021/je00103a031.
- ^ Batakliev, Todor; Georgiev, Vladimir; Anachkov, Metody; Rakovsky, Slavcho; Zaikov, Gennadi E. (June 2014). "Ozone decomposition". Interdisciplinary Toxicology. 7 (2): 47–59. doi:10.2478/intox-2014-0008. ISSN 1337-6853. PMC 4427716. PMID 26109880.
- ^ "ozone (n.)". Online Etymological Dictionary. Merriam-Webster. Retrieved 24 May 2023.
- ^ a b Toth, Gary; Hillger, Don. "Precursor Era Contributors to Meteorology". colostate.edu.
- ^ "electrochemical reaction Definition, Process, Types, Examples, & Facts Britannica". www.britannica.com. Retrieved 2022-09-24.
- ^ a b c d Rubin, Mordecai B. (2001). "The History of Ozone: The Schönbein Period, 1839–1868" (PDF). Bull. Hist. Chem. 26 (1): 40–56. Archived from the original (PDF) on 2008-04-11. Retrieved 2008-02-28.
- ^ "Scientists born on October 18th". Today in Science History.
- ^ a b c d Jacewicz, Natalie (2017). "A Killer of a Cure". Distillations. 3 (1): 34–37. Retrieved April 13, 2018.
- ^ Le Prestre, Philippe G., ed. (1998). Protecting the ozone layer : lessons, models, and prospects ; [product of the Tenth Anniversary Colloquium of the Montreal Protocol, held on September 13, 1997 ; part of a series of events held in Montreal to mark the 10th anniversary of the signing of the Montreal Protocol on Substances that Deplete the Ozone Layer, September 16, 1987]. Boston: Kluwer. p. 2. ISBN 9780792382454.
- ^ Schönbein, Christian Friedrich (1840). "Research on the nature of the odour in certain chemical reactions". Letter to the Académie des Sciences in Paris.
- ^ Jacques-Louis Soret (1865). "Recherches sur la densité de l'ozone". Comptes rendus de l'Académie des sciences. 61: 941.
- ^ "Ozone FAQ". Global Change Master Directory. Archived from the original on 2006-06-01. Retrieved 2006-05-10.
- ^ Redlands Chamber of Commerce Collection, City Archives, A.K. Smiley 공공도서관, Redlands, CA
- ^ Henry Henshaw to William Brewster 1902년 7월 2일 하버드 비교동물학 자료관
- ^ O'Connell, Sanjida (18 August 2009). "The science behind that fresh seaside smell". The Telegraph. Archived from the original on 2022-01-12.
- ^ "Secrets of 'bracing' sea air bottled by scientists". www.telegraph.co.uk. Retrieved 2022-05-13.
- ^ Anstie, Francis (1874). "Clinic of the Month: Dr. McKendrick on Ozone". The Practitioner: A Journal of Therapeutics and Public Health. 12 (January–June): 123.
- ^ Rubin, Mordecai B. (2001). "THE HISTORY OF OZONE. THE SCHÖNBEIN PERIOD, 1839–1868" (PDF). Bulletin for the History of Chemistry. 26 (1): 48. Retrieved 13 April 2018.
- ^ Hill, L.; Flack, M. (28 December 1911). "The Physiological Influence of Ozone". Proceedings of the Royal Society B: Biological Sciences. 84 (573): 404–415. Bibcode:1911RSPSB..84..404H. doi:10.1098/rspb.1911.0086.
- ^ Stoker, George (1916). "The Surgical Uses of Ozone". Lancet. 188 (4860): 712. doi:10.1016/S0140-6736(01)31717-8.
- ^ a b c Rubin, Mordecai B. (2004). "The History of Ozone. IV. The Isolation of Pure Ozone and Determination of its Physical Properties (1)" (PDF). Bull. Hist. Chem. 29 (2): 99–106. Retrieved 2021-04-12.
- ^ a b Block, J. H. (1986), Vanselow, R.; Howe, R. (eds.), "Georg-Maria Schwab: Early Endeavours in the Science of Catalysis", Chemistry and Physics of Solid Surfaces VI, Springer Series in Surface Sciences, Berlin, Heidelberg: Springer, vol. 5, pp. 1–8, doi:10.1007/978-3-642-82727-3_1, ISBN 978-3-642-82727-3
- ^ "Oxygen". WebElements. Retrieved 2006-09-23.
- ^ a b c d e Brown, Theodore L.; LeMay, H. Eugene Jr.; Bursten, Bruce E.; Burdge, Julia R. (2003) [1977]. "22". In Nicole Folchetti (ed.). Chemistry: The Central Science (9th ed.). Pearson Education. pp. 882–883. ISBN 978-0-13-066997-1.
- ^ "Is O3 Diamagnetic in Nature?". BYJUS. Retrieved 2022-03-01.
- ^ "Microwave Rotational Spectroscopy". Chemistry LibreTexts. 2013-10-02. Retrieved 2022-07-13.
- ^ Tanaka, Takehiko; Morino, Yonezo (1970). "Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states". Journal of Molecular Spectroscopy. 33 (3): 538–551. Bibcode:1970JMoSp..33..538T. doi:10.1016/0022-2852(70)90148-7.
- ^ Mack, Kenneth M.; Muenter, J. S. (1977). "Stark and Zeeman properties of ozone from molecular beam spectroscopy". Journal of Chemical Physics. 66 (12): 5278–5283. Bibcode:1977JChPh..66.5278M. doi:10.1063/1.433909.
- ^ 대기조건과 이동에 따른 오존의 반감기 McClurkin, J.D.*#1, Maier, D.E.2. Doi:10.5073/jka.2010.425.167.326
- ^ Koike, K; Nifuku, M; Izumi, K; Nakamura, S; Fujiwara, S; Horiguchi, S (2005). "Explosion properties of highly concentrated ozone gas" (PDF). Journal of Loss Prevention in the Process Industries. 18 (4–6): 465. doi:10.1016/j.jlp.2005.07.020. Archived from the original (PDF) on 2009-03-27.
- ^ "Electrochemical Production of High-Concentration Ozone-Water Using Freestanding Perforated Diamond Electrodes".
- ^ Harris, Daniel C. (2007). Quantitative Chemical Analysis. W. H. Freeman. pp. 279. ISBN 9780716776949.
- ^ Bailey, P. S. (1982). "Chapter 2". Ozonation in Organic Chemistry. Vol. 2. New York, NY: Academic Press. ISBN 978-0-12-073102-2.
- ^ Solomons, T.W. Graham & Fryhle, Craig B. (2008). "Chapter 8 Alkenes and Alkynes – Part II: Addition Reactions and Synthesis". Organic Chemistry, 9th Edition. Wiley. p. 344. ISBN 978-0-470-16982-7.
- ^ Al-Baarri, A. N.; Legowo, A. M.; Abduh, S. B. M.; Mawarid, A. A.; Farizha, K. M.; Silvia, M. (June 2019). "Production of Ozone and the Simple Detection using Potassium Iodide Titration Method". IOP Conference Series: Earth and Environmental Science. 292 (1): 012062. Bibcode:2019E&ES..292a2062A. doi:10.1088/1755-1315/292/1/012062. ISSN 1755-1315. S2CID 198344024.
- ^ a b Horvath M.; Bilitzky L.; Huttner J. (1985). Ozone. Elsevier. pp. 44–49. ISBN 978-0-444-99625-1.
- ^ Menzel, D. B. (1984). "Ozone: an overview of its toxicity in man and animals". Journal of Toxicology and Environmental Health. 13 (2–3): 183–204. doi:10.1080/15287398409530493. ISSN 0098-4108. PMID 6376815.
- ^ a b c d e "Ozone Generators that are Sold as Air Cleaners". EPA. United States Environmental Protection Agency. 28 February 2022. Archived from the original on 9 February 2022. Retrieved 28 February 2022.
- ^ Roca Sánchez, Anna (2015-09-01). Estudio cinético de la descomposición catalítica de ozono (Thesis).
- ^ Batakliev, Todor; Georgiev, Vladimir; Anachkov, Metody; Rakovsky, Slavcho; Zaikov, Gennadi E. (June 2014). "Ozone decomposition". Interdisciplinary Toxicology. 7 (2): 47–59. doi:10.2478/intox-2014-0008. ISSN 1337-6853. PMC 4427716. PMID 26109880.
- ^ Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 439. ISBN 978-0-13-039913-7.
- ^ Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 265. ISBN 978-0-13-039913-7.
- ^ Horvath M.; Bilitzky L.; Huttner J. (1985). Ozone. Elsevier. pp. 259, 269–270. ISBN 978-0-444-99625-1.
- ^ Shimanouchi, T. (1972). "Ozone". NIST: National Institute of Standards and Technology. U.S. Department of Commerce. 6 (3): 993–1102.
- ^ World Meteorological Organization. "Chapter 16: Measurement of Ozone" (PDF). Part I: Measurement of Meteorological Variables. Archived from the original (PDF) on 31 March 2016.
- ^ Max Planck Institute – Mainz. "The MPI-Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest".
- ^ "Measured Ozone Depletion". Ozone-Information.com. Archived from the original on 2013-09-14. Retrieved 2014-01-22.
- ^ Hultman, G. Eric (1980-01-01). The Ozone Survival Manual. McGraw-Hill. ISBN 9780915498734.
- ^ Keller-Rudek, Hannelore. "The MPI-Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest: O2, Lyman-alpha". Archived from the original on 2015-11-17.
- ^ Matsumi, Yutaka; Kawasaki, Masahiro (2003). "Photolysis of Atmospheric Ozone in the Ultraviolet Region". Chemical Reviews. 103 (12): 4767–82. doi:10.1021/cr0205255. PMID 14664632. 두 흡수 대역에서 오존의 그래픽 흡수를 파장의 함수로 봅니다.
- ^ a b 입자상 물질, 오존 및 이산화질소에 따른 대기오염의 건강 측면WHO-유럽 보고서 2003년 1월 13-15일 (PDF)
- ^ Stevenson; et al. (2006). "Multimodel ensemble simulations of present-day and near-future tropospheric ozone". American Geophysical Union. Archived from the original on 2011-11-04. Retrieved 2006-09-16.
- ^ "Rising Ozone Levels Pose Challenge to U.S. Soybean Production, Scientists Say". NASA Earth Observatory. 2003-07-31. Archived from the original on 2010-03-16. Retrieved 2006-05-10.
- ^ a b Mutters, Randall (March 1999). "Statewide Potential Crop Yield Losses From Ozone Exposure". California Air Resources Board. Archived from the original on 2004-02-17. Retrieved 2006-05-10.
- ^ Rethinking the Ozone Problem in Urban and Regional Air Pollution. 1991-01-01. doi:10.17226/1889. ISBN 978-0-309-04631-2.
- ^ a b Sharma, Sumit; Sharma, Prateek; Khare, Mukesh; Kwatra, Swati (May 2016). "Statistical behavior of ozone in urban environment". Sustainable Environment Research. 26 (3): 142–148. doi:10.1016/j.serj.2016.04.006.
- ^ Diem, Jeremy E.; Stauber, Christine E.; Rothenberg, Richard (2017-05-16). Añel, Juan A. (ed.). "Heat in the southeastern United States: Characteristics, trends, and potential health impact". PLOS ONE. 12 (5): e0177937. Bibcode:2017PLoSO..1277937D. doi:10.1371/journal.pone.0177937. ISSN 1932-6203. PMC 5433771. PMID 28520817.
- ^ Hou, Pei; Wu, Shiliang (July 2016). "Long-term Changes in Extreme Air Pollution Meteorology and the Implications for Air Quality". Scientific Reports. 6 (1): 23792. Bibcode:2016NatSR...623792H. doi:10.1038/srep23792. ISSN 2045-2322. PMC 4815017. PMID 27029386.
- ^ Tessum, Christopher W.; Apte, Joshua S.; Good kind, Andrew L.; Muller, Nicholas Z.; Mullins, Kimberley A.; Paolella, David A.; Polasky, Stephen; Springer, Nathaniel P.; Thakrar, Sumil K. (2019-03-11). "Inequity in consumption of goods and services adds to racial–ethnic disparities in air pollution exposure". Proceedings of the National Academy of Sciences. 116 (13): 6001–6006. Bibcode:2019PNAS..116.6001T. doi:10.1073/pnas.1818859116. ISSN 0027-8424. PMC 6442600. PMID 30858319.
- ^ 미국 폐 협회 (N.D.)당신이 숨쉬는 공기는 얼마나 건강합니까?2019년 3월 20일 lung.org 에서 검색했습니다.
- ^ "History of ozone in Colorado". Colorado Department of Public Health & Environment. Retrieved 2023-04-18.
- ^ a b c Evans, Jason M.; Helmig, Detlev (February 2017). "Investigation of the influence of transport from oil and natural gas regions on elevated ozone levels in the northern Colorado front range". Journal of the Air & Waste Management Association. 67 (2): 196–211. doi:10.1080/10962247.2016.1226989. ISSN 1096-2247. PMID 27629587.
- ^ Colorado Department of Public Health and Environment, Regional Air Quality Council, & North Front Range Metropolitan Planning Organization. "Colorado Ozone Action Plan" (PDF). dx.doi.org. Retrieved 2019-03-21.
- ^ 콜로라도 공중보건환경부 (n.d.)콜로라도 공기질.2019년 3월 20일 https://www.colorado.gov/airquality/air_quality.aspx 에서 검색했습니다.
- ^ Layer, Robert W.; Lattimer, Robert P. (July 1990). "Protection of Rubber against Ozone". Rubber Chemistry and Technology. 63 (3): 426–450. doi:10.5254/1.3538264.
- ^ "Tropospheric Ozone in EU – The consolidated report". European Environmental Agency. 1998. Retrieved 2006-05-10.
- ^ "Atmospheric Chemistry and Greenhouse Gases". Intergovernmental Panel on Climate Change. Archived from the original on 2006-07-10. Retrieved 2006-05-10.
- ^ "Climate Change 2001". Intergovernmental Panel on Climate Change. 2001. Archived from the original on 2006-09-13. Retrieved 2006-09-12.
- ^ 공개 선언 및 청구를 지원하기에 충분한 생애주기 평가 방법론, 위원회 표준 초안, 버전 2.1.과학적 인증 시스템, 2011년 2월.부속문서 B, 섹션 4.
- ^ NASA Goddard 홈페이지 대류권 오존 NASA Goddard 우주 비행 센터 코드 613.3, 화학 및 역학 지부Acdb-ext.gsfc.nasa.gov (2006-09-20).2012-02-01년 회수.
- ^ Liu, Wei; Hegglin, Michaela I.; Checa-Garcia, Ramiro; Li, Shouwei; Gillett, Nathan P.; Lyu, Kewei; Zhang, Xuebin; Swart, Neil C. (April 2022). "Stratospheric ozone depletion and tropospheric ozone increases drive Southern Ocean interior warming". Nature Climate Change. 12 (4): 365–372. Bibcode:2022NatCC..12..365L. doi:10.1038/s41558-022-01320-w. ISSN 1758-6798. S2CID 247844868.
요약 보고서 레이: - ^ Stewart, D. R.; Saunders, E.; Perea, R. A.; Fitzgerald, R.; Campbell, D. E.; Stockwell, W. R. (13 November 2017). "Linking Air Quality and Human Health Effects Models: An Application to the Los Angeles Air Basin". Environmental Health Insights. 11: 1178630217737551. doi:10.1177/1178630217737551. PMC 5692127. PMID 29162976.
- ^ US EPA, OAR (5 June 2015). "Health Effects of Ozone Pollution". US EPA.
- ^ US EPA, OAR (2015-05-29). "Ground-level Ozone Basics". US EPA. Retrieved 2020-11-26.
- ^ a b American Lung Association Scientific and Medical Editorial Review Panel. "Ozone". American Lung Association. Retrieved 24 March 2019.
- ^ Jule, Y.; Michaudel, C.; Fauconnier, L.; Togbe, D.; Riffel, B. (2018). "Ozone-induced acute and chronic alterations in the lung in mice: a combined digital imaging and functional analysis". European Respiratory Journal. 52: 4313.
- ^ Burnett, R. T.; Brook, J. R.; Yung, W. T.; Dales, R. E.; Krewski, D. (1997). "Association between ozone and hospitalization for respiratory diseases in 16 Canadian cities". Environmental Research. 72 (1): 24–31. Bibcode:1997ER.....72...24B. doi:10.1006/enrs.1996.3685. PMID 9012369.
- ^ Desqueyroux, H.; Pujet, J. C.; Prosper, M.; Squinazi, F.; Momas, I. (2002). "Short-term effects of low-level air pollution on respiratory health of adults suffering from moderate to severe asthma". Environmental Research. 89 (1): 29–37. Bibcode:2002ER.....89...29D. doi:10.1006/enrs.2002.4357. PMID 12051782.
- ^ Gent, J. F.; Triche, E. W.; Holford, T. R.; Belanger, K.; Bracken, M. B.; Beckett, W. S.; Leaderer, B. P. (2003). "Association of low-level ozone and fine particles with respiratory symptoms in children with asthma". JAMA. 290 (14): 1859–1867. doi:10.1001/jama.290.14.1859. PMID 14532314.
- ^ a b c d e f Al-Hegelan, M.; Tighe, R. M.; Castillo, C.; Hollingsworth, J. W. (2011). "Ambient ozone and pulmonary innate immunity". Immunol Res. 49 (1–3): 173–91. doi:10.1007/s12026-010-8180-z. PMC 3747041. PMID 21132467.
- ^ a b c d 건강 상태 온라인 [인터넷].독일 쾰른:의료의 질과 효율성 연구소(IQWiG); 2006-선천적이고 적응적인 면역체계.2010년 12월 7일 [2016년 8월 4일 업데이트].https://www.ncbi.nlm.nih.gov/books/NBK279396/ 에서 이용 가능
- ^ a b c d e Janeway CA Jr, Travers P, Walport M, et al.면역생물학:건강과 질병의 면역체계.5판.뉴욕: 갈랜드 사이언스; 2001.면역 체계의 구성 요소.다음 사이트에서 사용 가능: https://www.ncbi.nlm.nih.gov/books/NBK27092/
- ^ Gold, D. R.; Litonjua, A.; Schwartz, J.; Lovett, E.; Larson, A.; Nearing, B.; Verrier, R. (2000). "Ambient pollution and heart rate variability". Circulation. 101 (11): 1267–1273. doi:10.1161/01.cir.101.11.1267. PMID 10725286.
- ^ Sarnat, S. E.; Suh, H. H.; Coull, B. A.; Schwartz, J.; Stone, P. H.; Gold, D. R. (2006). "Ambient particulate air pollution and cardiac arrhythmia in a panel of older adults in Steubenville, Ohio". Occupational and Environmental Medicine. 63 (10): 700–706. doi:10.1136/oem.2006.027292. PMC 2078044. PMID 16757505.
- ^ Brook, R. D.; Brook, J. R.; Urch, B.; Vincent, R.; Rajagopalan, S.; Silverman, F. (2002). "Inhalation of fine particulate air pollution and ozone causes acute arterial vasoconstriction in healthy adults". Circulation. 105 (13): 1534–1536. doi:10.1161/01.cir.0000013838.94747.64. PMID 11927516.
- ^ Zanobetti, A.; Canner, M. J.; Stone, P. H.; Schwartz, J.; Sher, D.; Eagan-Bengston, E.; Gold, D. R. (2004). "Ambient pollution and blood pressure in cardiac rehabilitation patients". Circulation. 110 (15): 2184–2189. doi:10.1161/01.cir.0000143831.33243.d8. PMID 15466639.
- ^ Turner, M. C.; Jerrett, M.; Pope, III; Krewski, D.; Gapstur, S. M.; Diver, W. R.; Burnett, R. T. (2016). "Long-term ozone exposure and mortality in a large prospective study". American Journal of Respiratory and Critical Care Medicine. 193 (10): 1134–1142. doi:10.1164/rccm.201508-1633oc. PMC 4872664. PMID 26680605.
- ^ Crouse, D. L.; Peters, P. A.; Hystad, P.; Brook, J. R.; van Donkelaar, A.; Martin, R. V.; Brauer, M. (2015). "Ambient PM2. 5, O3, and NO2 exposures and associations with mortality over 16 years of follow-up in the Canadian Census Health and Environment Cohort (CanCHEC)". Environmental Health Perspectives. 123 (11): 1180–1186. doi:10.1289/ehp.1409276. PMC 4629747. PMID 26528712.
- ^ Jerrett, Michael; Burnett, Richard T.; Pope, C. Arden; Ito, Kazuhiko; Thurston, George; Krewski, Daniel; Shi, Yuanli; Calle, Eugenia; Thun, Michael (2009-03-12). "Long-Term Ozone Exposure and Mortality". The New England Journal of Medicine. 360 (11): 1085–1095. doi:10.1056/NEJMoa0803894. ISSN 0028-4793. PMC 4105969. PMID 19279340.
- ^ Lin, S.; Liu, X.; Le, L. H.; Hwang, S. A. (2008). "Chronic exposure to ambient ozone and asthma hospital admissions among children". Environmental Health Perspectives. 116 (12): 1725–1730. doi:10.1289/ehp.11184. PMC 2599770. PMID 19079727.
- ^ Zu, K.; Shi, L.; Prueitt, R. L.; Liu, X.; Goodman, J. E. (2018). "Critical review of long-term ozone exposure and asthma development". Inhalation Toxicology. 30 (3): 99–113. doi:10.1080/08958378.2018.1455772. PMID 29869579.
- ^ Malig, B. J.; Pearson, D. L.; Chang, Y. B.; Broadwin, R.; Basu, R.; Green, R. S.; Ostro, B. (2015). "A time-stratified case-crossover study of ambient ozone exposure and emergency department visits for specific respiratory diagnoses in California (2005–2008)". Environmental Health Perspectives. 124 (6): 745–753. doi:10.1289/ehp.1409495. PMC 4892911. PMID 26647366.
- ^ Vanwinge, C.; Gilles, C.; Gerard, C.; Blacher, S.; Noel, A.; Cataldo, D.; Rocks, N. (2017). "A Role For Ozone Pollution In Lung Cancer Progression". Am J Respir Crit Care Med. 195: A2352.
- ^ Ware, L. B.; Zhao, Z.; Koyama, T.; May, A. K.; Matthay, M. A.; Lurmann, F. W.; Calfee, C. S. (2016). "Long-term ozone exposure increases the risk of developing the acute respiratory distress syndrome". American Journal of Respiratory and Critical Care Medicine. 193 (10): 1143–1150. doi:10.1164/rccm.201507-1418oc. PMC 4872663. PMID 26681363.
- ^ 소비자 오존 공기청정기에 대한 EPA 보고서.Epa.gov .2012-02-01년 회수.
- ^ 캘리포니아 인증 공기청정장치.캘리포니아 항공 자원 위원회에서 왔습니다.
- ^ Jeannie Allen (2003-08-22). "Watching Our Ozone Weather". NASA Earth Observatory. Retrieved 2008-10-11.
- ^ CAFE(2004)의 후속 질문에 대한 답변 2005-09-09 Wayback Machine(PDF)의 아카이브(Archived 2005-09-09)
- ^ EPA Course Developers (2016-03-21). "Health Effects of Ozone in the General Population". EPA.
- ^ a b c Weinhold B (2008). "Ozone nation: EPA standard panned by the people". Environ. Health Perspect. 116 (7): A302–A305. doi:10.1289/ehp.116-a302. PMC 2453178. PMID 18629332.
- ^ Jerrett, Michael; Burnett, Richard T.; Pope, C. Arden, III; Ito, Kazuhiko; Thurston, George; Krewski, Daniel; Shi, Yuanli; Calle, Eugenia; Thun, Michael (March 12, 2009). "Long-Term Ozone Exposure and Mortality". N. Engl. J. Med. 360 (11): 1085–1095. doi:10.1056/NEJMoa0803894. PMC 4105969. PMID 19279340.
{{cite journal}}: CS1 유지 : 여러 이름 : 저자 목록 (링크) - ^ Wilson, Elizabeth K. (March 16, 2009). "Ozone's Health Impact". Chemical & Engineering News. 87 (11): 9. doi:10.1021/cen-v087n011.p009a.
- ^ Dahl, R (2006). "Ozone Overload: Current Standards May Not Protect Health". Environ. Health Perspect. 114 (4): A240. doi:10.1289/ehp.114-a240a. PMC 1440818.
- ^ Bell, ML; Peng, RD; Dominici, F (2006). "The exposure-response curve for ozone and risk of mortality and the adequacy of current ozone regulations". Environ. Health Perspect. 114 (4): 532–6. doi:10.1289/ehp.8816. PMC 1440776. PMID 16581541.
- ^ 지침 2008/50/EC.Eur-lex.europa.eu .2013-01-17에 검색되었습니다.
- ^ "DIRECTIVE 2008/50/EC on ambient air quality and cleaner air for Europe". EC. 2008-06-11. Retrieved 2010-08-23.
- ^ "Comments of the American Lung Association, Environmental Defense, Sierra Club on the U.S. Environmental Protection Agency's Proposed Revisions to the National Ambient Air Quality Standards for Ozone July 11, 2007 – 72 FR 37818" (PDF). Lungusa.org. Archived from the original (PDF) on July 10, 2010.
- ^ "Ambient (outdoor) air pollution". www.who.int. Retrieved 2020-07-31.
- ^ 오존에 대한 국가 대기질 기준.환경보호국 (EPA).제안규칙
- ^ "Federal Register National Ambient Air Quality Standards for Ozone". www.federalregister.gov. 2015-10-26. Retrieved 2016-05-16.
- ^ 오존이란? airinfonow.org
- ^ Anderson, W.; G.J. Prescott; S. Packham; J. Mullins; M. Brookes; A. Seaton (2001). "Asthma admissions and thunderstorms: a study of pollen, fungal spores, rainfall, and ozone". QJM: An International Journal of Medicine. 94 (8): 429–433. doi:10.1093/qjmed/94.8.429. PMID 11493720.
- ^ 이스트앵글리아 대학교 보도자료, 해변 냄새 복제 2007년 2월 2일 Wayback Machine에서 2012-10-31 보관
- ^ Kosatsky T. (July 2005). "The 2003 European heat waves". Eurosurveillance. 10 (7): 3–4. doi:10.2807/esm.10.07.00552-en. PMID 29208081. Retrieved January 14, 2014.
- ^ Hoffmann, Roald (January 2004). "The Story of O". American Scientist. 92 (1): 23. doi:10.1511/2004.1.23. Archived from the original on 2006-09-25. Retrieved 2006-10-11.
- ^ Smith, LL (2004). "Oxygen, oxysterols, ouabain, and ozone: a cautionary tale". Free Radical Biology & Medicine. 37 (3): 318–24. doi:10.1016/j.freeradbiomed.2004.04.024. PMID 15223065.
- ^ Paul Wentworth; Nieva, J; Takeuchi, C; Galve, R; Wentworth, AD; Dilley, RB; Delaria, GA; Saven, A; et al. (2003). "Evidence for Ozone Formation in Human Atherosclerotic Arteries". Science. 302 (5647): 1053–6. Bibcode:2003Sci...302.1053W. doi:10.1126/science.1089525. PMID 14605372. S2CID 11099904.
- ^ Iglesias, Domingo J.; Ángeles Calatayuda; Eva Barrenob; Eduardo Primo-Milloa; Manuel Talon (2006). "Responses of citrus plants to ozone: leaf biochemistry, antioxidant mechanisms and lipid peroxidation". Plant Physiology and Biochemistry. 44 (2–3): 125–131. doi:10.1016/j.plaphy.2006.03.007. PMID 16644230.
- ^ a b Bortolin, Rafael Calixto; Caregnato, Fernanda Freitas; Divan, Armando Molina; Reginatto, Flávio Henrique; Gelain, Daniel Pens; Moreira, José Cláudio Fonseca (2014-02-01). "Effects of chronic elevated ozone concentration on the redox state and fruit yield of red pepper plant Capsicum baccatum". Ecotoxicology and Environmental Safety. 100: 114–121. doi:10.1016/j.ecoenv.2013.09.035. ISSN 0147-6513. PMID 24238720.
- ^ a b Bortolin, Rafael Calixto; Caregnato, Fernanda Freitas; Divan Junior, Armando Molina; Zanotto-Filho, Alfeu; Moresco, Karla Suzana; de Oliveira Rios, Alessandro; de Oliveira Salvi, Aguisson; Ortmann, Caroline Flach; de Carvalho, Pâmela (2016-07-01). "Chronic ozone exposure alters the secondary metabolite profile, antioxidant potential, anti-inflammatory property, and quality of red pepper fruit from Capsicum baccatum". Ecotoxicology and Environmental Safety. 129: 16–24. doi:10.1016/j.ecoenv.2016.03.004. ISSN 0147-6513. PMID 26970882.
- ^ Dickie, Gloria (2022-01-17). "Ozone harms East Asian crops, costing $63 bln a year, scientists say". Reuters. Retrieved 2022-01-23.
- ^ "Air pollution takes a bite out of Asia's grain crops". Nature. 601 (7894): 487. 2022-01-21. Bibcode:2022Natur.601R.487.. doi:10.1038/d41586-022-00117-3. PMID 35064229. S2CID 246165555.
- ^ 캐나다 산업보건안전센터, 오존 호흡과 관련된 주요 건강상의 위험요소는 무엇입니까?
- ^ 생명 또는 건강농도에 대한 즉시위험문서(IDLH): NIOSH 화학물질 목록 및 수정된 IDLH 값 문서(3/1/95 기준)
- ^ a b 라이, 제니퍼 (2008-05-08)."오존에 무거운 비행기 – 데일리 브리핑".Portfolio.com .2012-02-01년 회수.
- ^ 비행기의 공기 질: 오존과 피부의 천연 오일 탓Sciencedaily.com (2007-09-05).2012-02-01년 회수.
- ^ "Visual Encyclopedia of Chemical Engineering". encyclopedia.che.engin.umich.edu.
- ^ "Ozone Cell vs Ozone Plate – A2Z Ozone". Archived from the original on 2020-01-10. Retrieved 2020-01-10.
- ^ Smith, L. I.; Greenwood, F. L.; Hudrlik, O. (1946). "A laboratory ozonizer". Organic Syntheses. 26: 63.; Collective Volume, vol. 3, p. 673
- ^ Dohan, J. M.; W. J. Masschelein (1987). "Photochemical Generation of Ozone: Present State-of-the-Art". Ozone Sci. Eng. 9 (4): 315–334. doi:10.1080/01919518708552147.
- ^ Foller, Peter C.; Tobias, Charles W. (1982). "The Anodic Evolution of Ozone". Journal of the Electrochemical Society. 129 (3): 506. Bibcode:1982JElS..129..506F. doi:10.1149/1.2123890.
- ^ Arihara, Kazuki; Terashima, Chiaki; Fujishimam Akira (2007). "Electrochemical Production of High-Concentration Ozone-Water Using Freestanding Perforated Diamond Electrodes". Journal of the Electrochemical Society. 154 (4): E71. Bibcode:2007JElS..154E..71A. doi:10.1149/1.2509385.
- ^ Hale, Arthur J. (1919). The Manufacture of Chemicals by Electrolysis. D. Van Nostrand Co. pp. 15, 16. Retrieved 12 September 2019.
- ^ "Lab Note #106 Environmental Impact of Arc Suppression". Arc Suppression Technologies. April 2011. Retrieved October 10, 2011.
- ^ ¿렐람파고스 델 카타툼보 리제네란 라 카파 데 오조노?Wayback Machine에서 2016-03-05 보관.아젠시아 데 노티시아스 데 라 유니버시다드 델 줄리아.
- ^ "Fire in the Sky". Archived from the original on 2011-07-21. Retrieved 2008-08-16.
- ^ Ibanez, Jorge G.; Rodrigo Mayen-Mondragon; M. T. Moran-Moran (2005). "Laboratory Experiments on the Electrochemical Remediation of the Environment. Part 7: Microscale Production of Ozone". Journal of Chemical Education. 82 (10): 1546. Bibcode:2005JChEd..82.1546A. doi:10.1021/ed082p1546.
- ^ "Ozone and Color Removal". Ozone Information. Archived from the original on 2011-07-15. Retrieved 2009-01-09.
- ^ Hoigné, J. (1998). Handbook of Environmental Chemistry, Vol. 5 part C. Berlin: Springer-Verlag. pp. 83–141.
- ^ "Oxidation Potential of Ozone". Ozone-Information.com. Archived from the original on 2008-04-19. Retrieved 2008-05-17.
- ^ Postgate, J. R. (1992). Microbes and man (3rd ed.). Cambridge: Cambridge University Press. p. 97. ISBN 9780521412599.
- ^ Weaver, Matthew (30 August 2021). "Concerns over plan to use ozone to disinfect classrooms in Wales". The Guardian.
- ^ "Decontamination: Ozone scores on spores". Hospital Development. Wilmington Media Ltd. 2007-04-01. Archived from the original on 2007-09-29. Retrieved 2007-05-30.
- ^ a b c Montecalvo, Joseph; Doug Williams. "Application of Ozonation in Sanitizing Vegetable Process Washwaters" (PDF). California Polytechnic State University. Archived from the original (PDF) on May 28, 2008. Retrieved 2008-03-24.
- ^ Steeves, Susan A. (January 30, 2003). "Ozone may provide environmentally safe protection for grains". Purdue News.
- ^ "Chemical Synthesis with Ozone". Ozone-Information.com. Archived from the original on 2008-04-10. Retrieved 2008-05-17.
- ^ "Clean and bleach fabrics by ozone" (PDF).
- ^ de Boer, Hero E. L.; van Elzelingen-Dekker, Carla M.; van Rheenen-Verberg, Cora M. F.; Spanjaard, Lodewijk (October 2006). "Use of Gaseous Ozone for Eradication of Methicillin-Resistant Staphylococcus aureus From the Home Environment of a Colonized Hospital Employee". Infection Control and Hospital Epidemiology. 27 (10): 1120–1122. doi:10.1086/507966. JSTOR 507966. PMID 17006820. S2CID 11627160.
- ^ Sjöström, Eero (1993). Wood Chemistry: Fundamentals and Applications. San Diego, CA: Academic Press, Inc. ISBN 978-0-12-647481-7.
- ^ Su, Yu-Chang; Chen, Horng-Tsai (2001). "Enzone Bleaching Sequence and Color Reversion of Ozone-Bleached Pulps". Taiwan Journal of Forest Science. 16 (2): 93–102. Archived from the original on 2010-10-14. Retrieved 2007-08-31.
- ^ Bollyky, L. J. (1977). Ozone Treatment of Cyanide-Bearing Wastes, EPA Report 600/2-77-104. Research Triangle Park, N.C.: U.S. Environmental Protection Agency.
- ^ Siemens, Werner (1857). "About the electrostatic induction and the delay of the current in bottle wires". Annals of Physics. 178 (9): 66. doi:10.1002/andp.18571780905.
- ^ a b US Environmental Protection Agency. (2009). "Drinking Water Treatability Database".
- ^ a b Sorlini, Sabrina; Collivignarelli, Carlo (2005). "Trihalomethane formation during chemical oxidation with chlorine, chlorine dioxide and ozone of ten Italian natural waters". Desalination. 176 (1–3): 103–111. doi:10.1016/j.desal.2004.10.022.
- ^ Gallard, Hervé; Gunten, Urs von (2002). "Chlorination of natural organic matter: kinetics of chlorination and of THM formation". Water Research. 36 (1): 65–74. Bibcode:2002WatRe..36...65G. doi:10.1016/S0043-1354(01)00187-7. PMID 11766819.
- ^ Croué, J. P.; Koudjonou, B. K.; Legube, B. (1996). "Parameters affecting the formation of bromate ion during ozonation".
- ^ Siddiqui, Mohamed S.; Amy, Gary L. (1993). "Factors affecting DBP formation during ozone–bromide reactions". American Water Works Association. 85 (1): 63–72. doi:10.1002/j.1551-8833.1993.tb05922.x.
- ^ World Health Organization. (2003). "Atrazine in drinking-water: background document for development of WHO guidelines for drinking-water quality".
- ^ Khadre, M. A.; Yousef, A. E.; Kim, J‐G. (2001). "Microbiological aspects of ozone applications in food: a review". Journal of Food Science. 66 (9): 1242–1252. doi:10.1111/j.1365-2621.2001.tb15196.x.
- ^ Mujovic, Selman; Foster, John E. (2018). "Plasma Physics and Chemistry for Water Reuse: Scaling the Plasma-Water Interface as an AOP Alternative". Proceedings of the Water Environment Federation 2018. 15: 1969–1983.
- ^ Guzel-Seydim, Zeynep B.; Greene, Annel K.; Seydim, A. C. (2004). "Use of ozone in the food industry". LWT - Food Science and Technology. 37 (4): 453–460. doi:10.1016/j.lwt.2003.10.014.
- ^ Weschler, Charles J. (2000). "Ozone in indoor environments: concentration and chemistry". Indoor Air. 10 (4): 269–288. doi:10.1034/j.1600-0668.2000.010004269.x. PMID 11089331.
- ^ Choudhury, Bhaswati; Portugal, Sherlie; Mastanaiah, Navya; Johnson, Judith A.; Roy, Subrata (2018). "Inactivation of Pseudomonas aeruginosa and Methicillin-resistant Staphylococcus aureus in an open water system with ozone generated by a compact, atmospheric DBD plasma reactor". Scientific Reports. 8 (1): 17573. Bibcode:2018NatSR...817573C. doi:10.1038/s41598-018-36003-0. PMC 6279761. PMID 30514896.
- ^ Choudhury, Bhaswati; Portugal, Sherlie; Johnson, Judith A.; Roy, Subrata (2020). "Performance evaluation of fan and comb shaped plasma reactors for distribution of generated ozone in a confined space". AIAA Scitech 2020 Forum: 1165.
- ^ 미국 10,651,014호, 서브라타 로이 & 셰리 포르투갈 "콤팩트 휴대용 플라즈마 반응기" 2020년 5월 12일 발행.
- ^ Draou, Abdelkader; Nemmich, Said; Nassour, Kamel; Benmimoun, Youcef; Tilmatine, Amar (2019). "Experimental analysis of a novel ozone generator configuration for use in water treatment applications". International Journal of Environmental Studies. 76 (2): 338–350. doi:10.1080/00207233.2018.1499698. S2CID 105285760.
- ^ Zito, Justin C.; Durscher, Ryan J.; Soni, Jignesh; Roy, Subrata; Arnold, David P. (2012). "Flow and force inducement using micron size dielectric barrier discharge actuators". Applied Physics Letters. 100 (19): 193502. Bibcode:2012ApPhL.100s3502Z. doi:10.1063/1.4712068.
- ^ Kuvshinov, Dmitriy; Lozano-Parada, Jaime; Siswanto, Anggun; Zimmerman, William (2014). "Efficient compact micro DBD plasma reactor for ozone generation for industrial application in liquid and gas phase systems". International Journal of Chemical, Molecular, Nuclear, Materials and Metallurgical Engineering. 8 (1).
- ^ Long, Ron (2008). "POU Ozone Food Sanitation: A Viable Option for Consumers & the Food Service Industry" (PDF). Archived from the original (PDF) on 2011-07-15. (보고서에 따르면 수돗물이 상추에서 병원균을 99.95% 제거하는 것으로 나타남; 치료 전에 병원균을 접종함)
- ^ Tersano Inc (2007). "lotus Sanitises Food without Chemicals". Archived from the original on 2007-02-11. Retrieved 2007-02-11.
- ^ Jongen, W (2005). Improving the Safety of Fresh Fruit and Vegetables. Boca Raton: Woodhead Publishing Ltd. ISBN 978-1-85573-956-7.
- ^ "Alternative Disinfectants and Oxidant Guidance Manual" (PDF). United States Environmental Protection Agency. April 1999. Retrieved 2008-01-14.
- ^ Noble, A.C.; Summerfelt, S.T. (1996). "Diseases encountered in rainbow trout cultured in recirculating systems". Annual Review of Fish Diseases. 6: 65–92. doi:10.1016/S0959-8030(96)90006-X.
- ^ Ferreira, O; de Costa, O.T.; Ferreira, Santos; Mendonca, F. (2004). "Susceptibility of the Amazonian fish, Colossoma macropomum (Serrasalminae), to short-term exposure to nitrite". Aquaculture. 232 (1–4): 627–636. doi:10.1016/S0044-8486(03)00524-6.
- ^ Ribeiro, A.R.A.; Ribeiro, L.; Saele, Ø.; Hamre, K.; Dinis, M.T.; Moren, M. (2009). "Iodine-enriched rotifers andArtemiaprevent goitre in Senegalese sole (Solea senegalensis) larvae reared in a recirculation system". Aquaculture Nutrition. 17 (3): 248–257. doi:10.1111/j.1365-2095.2009.00740.x.
- ^ Buchan, K.; Martin-Robinchaud, D.; Benfey, T.J.; MacKinnon, A; Boston, L (2006). "The efficacy of ozonated seawater for surface disinfection of haddock (Melanogrammus aeglefinus) eggs against piscine nodavirus". Aquacultural Engineering. 35: 102–107. doi:10.1016/j.aquaeng.2005.10.001.
- ^ Alothman, M.; Kaur, B.; Fazilah, A.; Bhat, Rajeev; Karim, Alias A. (2010). "Ozone-induced changes of antioxidant capacity of fresh-cut tropical fruits". Innovative Food Science and Emerging Technologies. 11 (4): 666–671. doi:10.1016/j.ifset.2010.08.008.
- ^ Tzortzakis, N.; Borland, A.; Singleton, I.; Barnes, J (2007). "Impact of atmospheric ozone-enrichment on quality-related attributes of tomato fruit". Postharvest Biology and Technology. 45 (3): 317–325. doi:10.1016/j.postharvbio.2007.03.004.
- ^ Keutgen, A.J.; Pawelzik, E. (2008). "Influence of pre-harvest ozone exposure on quality of strawberry fruit under simulated retail conditions". Postharvest Biology and Technology. 49: 10–18. doi:10.1016/j.postharvbio.2007.12.003.
- ^ Lestan, D.; Hanc, A.; Finzgar, N. (2005). "Influence of ozonation on extractability of Pb and Zn from contaminated soils". Chemosphere. 61 (7): 1012–1019. Bibcode:2005Chmsp..61.1012L. doi:10.1016/j.chemosphere.2005.03.005. PMID 16257321.
- ^ a b Plaue, J.W.; Czerwinski, K.R. (2003). "The influence of ozone on ligand-assisted extraction of 239Pu and 241Am from rocky flats soil". Radiochim. Acta. 91 (6–2003): 309–313. doi:10.1524/ract.91.6.309.20026. S2CID 96019177.
- ^ Otieno, Mark (October 2022). "Interactive effects of ozone and carbon dioxide on plant-pollinator interactions and yields in a legume crop". Environmental Advances. 9: 100285. doi:10.1016/j.envadv.2022.100285.
- ^ Rollin, Orianne (July 2022). "Effects of ozone air pollution on crop pollinators and pollination". Global Environmental Change. 75: 102529. doi:10.1016/j.gloenvcha.2022.102529. S2CID 249086005 – via Elsevier Science Direct.
- ^ "Oxygen Therapy". American Cancer Society. Archived from the original on March 21, 2012. Retrieved 29 November 2012.
{{cite web}}: CS1 maint : URL(링크) 부적합
추가열람
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- 베커, K. H., U. Kogelschatz, K. H. Schoenbach, R. J. Barker (ed.대기압에서의 비평형 공기 플라스마플라스마 물리학의 시리즈.브리스톨 앤드 필라델피아:IMT2000 3GPP - ISBN 0-7503-0962-8; 2005
- 미국 환경 보호국입니다.Risk and Benefits Group. (2014년 8월)오존에 대한 건강위험 및 노출평가 : 최종보고서
외부 링크
이 섹션에서 외부 링크를 사용하는 것은 위키백과의 정책이나 지침을 따르지 않을 수 있습니다.(2023년 6월)(이 를 및 |
- 국제 오존 학회
- 유럽환경청 근 실시간 오존지도(오존웹)
- 나사의 오존 자원 페이지
- OSHA 오존 정보 2016-01-20 Wayback Machine에서 보관됨
- 폴 크루첸 인터뷰—노벨 수상자 폴 크루첸이 노벨상 수상자 해리 크로토와 대화하는 베가 사이언스 트러스트의 영상
- 미국항공우주국의 오존에 관한 지구관측소 기사
- 국제 화학 안전 카드 0068
- 화학적 위험에 대한 NIOSH 포켓 가이드
- 국립환경보건과학원 오존정보연구소
- 지표면 오존 대기오염
- "스모그"를 북극 온난화와 연결시키는 NASA의 연구나사 고다드 우주 연구소 (GISS)의 연구는 겨울과 봄 동안 북극에 있는 오존의 온난화 효과를 보여줍니다.
- 미국 뉴잉글랜드 폐협회의 지표면 오존 정보





















![{\displaystyle V_{1}=K_{1}\cdot [{\ce {O3}}]\qquad V_{2}=K_{2}\cdot [{\ce {O}}]\cdot [{\ce {O3}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa89c5e2c3b0c501381aadcdaa39b60594d1b4c7)
![{\displaystyle V=2K_{2}\cdot [{\ce {O}}]\cdot [{\ce {O3}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9243dbd85bcf44b84a7066876ae41fb536ccbfe2)
![{\displaystyle K_{1}={\frac {K_{1}}{K_{-1}}}={\frac {[{\ce {O2}}]\cdot [{\ce {O}}]}{[{\ce {O3}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/048f2f135e0f4a159da14ab2b26a334d856b0464)
![{\displaystyle [{\ce {O}}]={\frac {K_{1}\cdot [{\ce {O3}}]}{K_{-1}\cdot [{\ce {O2}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98fafe6a7ff5c5725717421d2ad60788083ee4d8)
![{\displaystyle V={2K_{2}\cdot K_{1}\cdot [{\ce {O_3}}]^{2} \over K_{-1}\cdot [{\ce {O_2}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/da560af608b21e57aab047710fb13a5c532467b5)
![{\displaystyle V={K_{\text{obs}}\cdot [{\ce {O_3}}]^{2} \over [{\ce {O_2}}]}=K_{\text{obs}}\cdot [{\ce {O_3}}]^{2}\cdot [{\ce {O_2}}]^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/69189abb1a3881b3f8e427d5f963edd866401b67)








![{\displaystyle {\ce {O2->[{\ce {photon}}][({\ce {radiation}}\ \lambda \ <\ 240\ {\ce {nm}})]2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/22c15c0d1b053ba02c27ceed129794d2cb91dd2a)




![{\displaystyle {\ce {3O2->[{\text{electricity}}]2O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc22efb27fc01c8f1f3e7c215eddbfc9444cd0bc)