양극
Anode양극은 기존 전류가 편광 전기장치에 들어가는 전극이다.이는 일반적인 전류가 전기 장치를 빠져나가는 전극인 음극과 대조됩니다.일반적인 니모닉은 ACID로 "디바이스에 양극 전류"[1]를 의미합니다.회로에서 일반 전류(양전하의 흐름)의 방향은 전자 흐름의 방향과 반대이므로, (음전하의) 전자는 갈바닉 셀의 양극에서 셀에 연결된 외부 또는 외부 회로로 흐릅니다.갈바닉 셀과 전해 셀에서 양극은 산화 반응이 일어나는 전극이다.
전해전지에서 양극은 과도한 양의 [2]전하를 가진 와이어 또는 플레이트이다.그 결과 음이온은 산화 가능한 양극 쪽으로 이동하는 경향이 있습니다.
역사적으로 갈바닉 셀의 양극은 아연으로 [3][4]: pg. 209, 214 구성되었기 때문에 아연극으로도 알려져 있었다.
전하 흐름
양극과 음극이라는 용어는 전극의 전압 극성이 아니라 전극을 통과하는 전류의 방향에 의해 정의됩니다.양극은 외부회로에서 디바이스에 통상전류(양전하)가 흐르는 전극이며, 음극은 디바이스에서 통상전류가 흐르는 전극이다.예를 들어 충전 시에 충전용 배터리에서 발생하는 것처럼 전극을 통과하는 전류가 역방향일 경우 전극을 양극 및 음극으로 명명하는 역방향으로 한다.
기존 전류는 전하 캐리어가 움직이는 방향뿐만 아니라 캐리어의 전하에도 좌우됩니다.소자 외부의 전류는 보통 금속 전도체의 전자에 의해 전달됩니다.전자는 음전하를 띠기 때문에 전자의 흐름 방향은 기존 전류의 방향과 반대입니다.그 결과 전자는 양극을 통해 소자를 떠나 음극을 통해 소자로 들어간다.
양극과 음극의 정의는 전극 이름이 고정되고 실제 전하 흐름(전류)에 의존하지 않는 다이오드 및 진공 튜브와 같은 전기 장치의 경우 다릅니다.이러한 소자는 보통 한 방향으로 상당한 전류를 흘려보내고 다른 방향으로는 무시할 수 있는 전류를 흘려보냅니다.따라서 전극은 이 "전류"의 방향에 따라 명명됩니다.다이오드에서 양극은 전류가 들어가는 단자이고 음극은 전류가 나가는 단자이며 다이오드가 전방 바이어스일 때 양극은 전류가 나가는 단자입니다.전극의 이름은 장치를 통해 역류 전류가 흐르는 경우 변경되지 않습니다.마찬가지로 진공관에서는 필라멘트에 의해 가열되기 때문에 하나의 전극만 진공관으로 전자를 방출할 수 있으므로 전자는 외부 회로에서 가열된 전극을 통해서만 장치에 들어갈 수 있습니다.따라서 이 전극은 영구적으로 음극으로 명명되고 전자가 튜브에서 나오는 전극은 양극으로 명명됩니다.
예

관련된 음극에 대한 양극 전압의 극성은 디바이스 유형과 동작 모드에 따라 달라집니다.다음 예제에서는 전력을 공급하는 장치에서는 양극이 음수이고 전력을 소비하는 장치에서는 양극이 양수입니다.
방전 배터리 또는 갈바닉 셀(왼쪽 그림)에서 양극은 음극 단자이며, 이는 일반 전류가 셀로 흐르기 때문입니다.이 내부 전류는 외부로 이동하는 전자에 의해 외부로 전달되며, 한 방향으로 흐르는 음전하는 반대 방향으로 흐르는 양전하와 전기적으로 동등합니다.
재충전 배터리 또는 전해 셀에서 양극은 외부 제너레이터로부터 전류를 받는 양극 단자입니다.충전 배터리를 통과하는 전류는 방전 시 전류 방향과 반대입니다. 즉, 배터리 방전 중에 음극이었던 전극이 배터리 충전 중에 양극이 됩니다.
양극과 음극 명칭의 이러한 모호성은 배터리 엔지니어링에 혼란을 야기합니다. 이는 고유한 물리적 구성요소와 관련된 양극과 음극이 있어야 하기 때문입니다.일반적으로 방전 중에 전자를 방출하는 배터리의 전극을 양극 또는 음극(-) 전극으로 명명하고 전자를 흡수하는 전극을 음극 또는 양극(+)으로 명명합니다.전극을 사용합니다.
물리전극의 이름을 양극(+) 또는 음극(-)으로 지정하면 전기화학 및 전자기기뿐만 아니라 충전 배터리의 충전/방전 조건에도 동일하게 적용되므로 추가적인 이점이 있습니다.
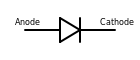
다이오드에서 양극은 화살표 기호(삼각형의 평평한 쪽)의 끝에 있는 양의 단자이며, 여기서 전류가 장치로 흐릅니다.다이오드에 대한 전극 명명법은 관심 전류가 역류인 제너 다이오드나 태양전지 같은 유형에서도 항상 순방향 전류('가장 쉽게' 전류가 흐르는' 화살표의 방향)에 기초한다.
진공관 또는 가스가 채워진 튜브에서 양극은 전류가 튜브로 들어가는 단자입니다.
어원학
The word was coined in 1834 from the Greek ἄνοδος (anodos), 'ascent', by William Whewell, who had been consulted[4] by Michael Faraday over some new names needed to complete a paper on the recently discovered process of electrolysis.패러데이는 이 논문에서 전류가 "분해체"(전기질)를 "동서에서 서양으로" 또는 "태양이 움직이는 것처럼 보이는 기억력에 도움을 주는" 방향으로 흐르도록 전해전지가 방향을 잡으면 양극이 "동쪽 전해질로 전류가 들어가는 곳"이라고 설명했다.o 위로, odos 길, 태양이 뜨는 길.[5][6]
'동쪽'을 '인' 방향(실제로는 '인' → '동쪽' → '위')을 의미하기 위해 '동쪽'을 사용하는 것은 의도적으로 보일 수 있다.앞서 위에서 인용한 첫 번째 참조에서와 같이 패러데이는 보다 간단한 용어인 "eisode"(전류가 들어가는 입구)를 사용했다.그가 그것을 '동쪽 전극'(다른 후보들은 '동쪽 전극', '오리오드', '아나톨로드')을 의미하는 것으로 바꾼 동기는 정확한 성질을 알 수 없었던 전류의 방향 규칙에서 나중에 변경될 수 있는 가능성에 대해 면역이 되도록 하기 위함이었다.그가 이 효과에 대해 언급한 것은 지구의 자기장 방향이었는데, 그것은 그 당시에는 불변하다고 여겨졌다.그는 근본적으로 내부 전류가 지구의 방향과 같은 자기 쌍극자장을 유도하는 위도 국소선 주위의 가상의 자기 전류 루프와 평행하고 같은 방향으로 흐르는 것을 셀에 대한 그의 임의적인 방향이라고 정의했다.이로 인해 내부 전류는 앞에서 설명한 것처럼 동서로 바뀌었지만, 나중에 관례가 변경되면 서에서 동으로 바뀌게 되어 더 이상 동 전극이 '통로'가 되지 않게 되었다.따라서, "eisode"는 부적절해졌을 것이고, 반면 "동쪽 전극"을 의미하는 "anode"는 전류가 기초하는 실제 현상의 변하지 않은 방향과 관련하여 올바른 상태를 유지했을 것이며, 그 후 알려지지 않았지만, 그는 자기 참조에 의해 모호하게 정의되었다고 생각했다.돌이켜보면, 이름 변경은 불행한 일이었는데, 왜냐하면 그리스 어근만으로는 양극의 기능을 더 이상 드러내지 않을 뿐만 아니라, 우리가 지금 알고 있듯이, "양극" 용어가 기반을 두고 있는 지구의 자기장 방향은 반전의 대상이 되는 반면, "양극" 용어가 기반을 두고 있는 현재의 방향 규약은 반전의 대상이 되기 때문이다.미래에 변할 이유가 없습니다.
나중에 전자가 발견된 이후, 역사적으로 잘못되었지만 기억하기 쉽고 기술적으로 더 오래갈 수 있는 어원이 제시되었다: 그리스 양극에서 나온 '웨이 업', '전자를 위한 세포(또는 다른 장치) 밖으로 나가는 방법'이다.
전해 양극
전기화학에서 양극은 산화가 일어나는 곳이며 전해전지의 [7]정극성 접점입니다.양극에서는 전기전위에 의해 음이온(음이온)이 화학반응하여 전자(산화)를 방출하고, 그 후 구동회로로 흘러들어간다.기억: LEO Red Cat(전자의 손실은 산화, 음극에서 감소 발생), AnOx Red Cat(아노드 산화, 환원 음극), OIL RIG(산소는 손실, 환원 전자의 이득), 로마 가톨릭과 정통(환원 – 음극, 산화 – GERODE) 또는 LIO.ctrons는 Reduction입니다.
이 공정은 금속 정련에 널리 사용된다.예를 들어 구리 정련에서는 용해로의 중간 생성물인 구리 양극을 적절한 용액(황산 등)에서 전해하여 고순도(99.99%)의 캐소드를 생성합니다.이 방법을 사용하여 생성되는 구리 캐소드는 전해동이라고도 한다.
역사적으로 비반응 양극이 전기 분해에 필요한 경우 흑연(패러데이 시대에는 연골이라고 함) 또는 백금이 [8]선택되었습니다.그것들은 양극에 가장 반응성이 낮은 물질 중 일부인 것으로 밝혀졌다.백금은 다른 물질에 비해 매우 느리게 부식되고 흑연은 분해되어 수용액에서 이산화탄소를 발생시킬 수 있지만, 그렇지 않으면 반응에 참여하지 않습니다.
배터리 또는 갈바닉 셀 양극
배터리 또는 갈바닉 셀에서 양극은 전자가 회로의 외부로 유출되는 음극입니다.내부에서 양전하를 띤 양이온은 양극으로부터 흐릅니다(음전하를 끌어당길 것으로 예상되지만, 이는 양극과 음극 금속/전해질 시스템의 전해액에 대한 상대적인 전극 전위가 다르기 때문입니다). 하지만, 회로의 셀 외부에 있는 전자는부접촉을 통해 밖으로 밀려나 예상대로 전압 전위에 의해 회로를 통과합니다.주의: 갈바닉 셀에서는 전해 셀에서 발생하는 것과는 달리 음이온이 양극으로 흐르지 않으며 내부 전류는 음이온에서 흘러나오는 양이온에 의해 완전히 설명됩니다(cf 도면).

배터리 제조업체는 특히 기술 자료에서 음극을 [9]양극으로 간주할 수 있습니다.기술적으로 정확하지는 않지만 2차(또는 충전식) 셀의 양극이 어떤 전극인지에 대한 문제를 해결합니다.기존의 정의를 사용하면 양극 스위치는 충전 사이클과 방전 사이클 사이에서 종료됩니다.
진공관 양극
음극선관 등의 전자진공장치에서 양극은 정전하 전자집전장치이다.튜브에서 양극은 음극에서 방출되는 전자를 전기 흡인력으로 모으는 대전된 양판이다.그것은 또한 이러한 전자의 흐름을 가속화한다.
다이오드 양극
반도체 다이오드에서 양극은 처음에 접합부에 구멍을 공급하는 P도프층이다.접합영역에서 양극에 의해 공급되는 구멍은 N도프영역에서 공급되는 전자와 결합해 고갈영역을 형성한다.P도프층은 고갈된 영역에 구멍을 공급하기 때문에 P도프층에 음의 도판트 이온이 남는다(정전하 캐리어 이온의 경우 P).이로 인해 양극에 기본 음전하가 생성됩니다.회로에서 다이오드의 양극에 양의 전압이 인가되면 더 많은 구멍이 고갈된 영역으로 전달될 수 있으며, 이로 인해 다이오드가 전도성이 되어 회로를 통해 전류가 흐를 수 있습니다.양극과 음극이라는 용어는 적용된 전위의 극성(전압)에 따라 어느 방향으로도 흐를 수 있으므로 제너 다이오드에는 적용하지 마십시오.
희생 양극
음극 방식에서 보호되는 금속 시스템보다 부식 환경에 더 반응하는 금속 양극이 보호 시스템에 전기적으로 연결됩니다.그 결과 금속계 대신 금속 양극이 부분적으로 부식 또는 용해된다.예를 들어, 철 또는 강철 선박의 선체는 아연 희생 양극으로 보호될 수 있으며, 아연 희생 양극은 바닷물에 용해되어 선체의 부식을 방지할 수 있습니다.희생 양극은 특히 파이프라인이나 수상 선박과 같은 흐르는 액체의 작용에 의해 정전하가 발생하는 시스템에 필요합니다.희생 양극은 일반적으로 탱크형 온수기에도 사용됩니다.
1824년, 이 파괴적인 전해 작용이 선체, 그 고정 장치 및 수중 장비에 미치는 영향을 줄이기 위해, 과학자 엔지니어인 험프리 데이비는 최초의 그리고 여전히 가장 널리 사용되는 해양 전기 분해 보호 시스템을 개발했습니다.데이비는 선체에 전기적으로 반응하는(귀하지 않은) 금속으로 만들어진 희생 양극을 설치하고 전기적으로 연결하여 음극 방식 회로를 형성했습니다.
이러한 유형의 방호 기능의 분명한 예는 아연도금 공정입니다.이 공정은 철 구조물(펜스 등)에 아연 금속을 코팅합니다.아연이 손상되지 않은 한 철은 부식의 영향으로부터 보호됩니다.불가피하게 아연 코팅은 균열 또는 물리적 손상에 의해 파손됩니다.이러한 현상이 발생하면 부식성 요소가 전해액으로 작용하고 아연/철 조합이 전극으로 작용합니다.결과적으로 발생하는 전류는 아연 코팅이 희생되지만 모재가 부식되지 않도록 보장합니다.이러한 코팅은 철 구조를 수십 년 동안 보호할 수 있지만, 일단 보호 코팅이 소모되면 철은 빠르게 부식됩니다.
반대로 주석으로 강철을 코팅할 경우 코팅의 균열이 발생하면 실제로 철의 산화를 가속합니다.
인가 전류 양극
인가된 전류 [10]양극에는 또 다른 음극방지가 사용된다.그것은 티타늄으로 만들어졌으며 혼합 금속 산화물로 덮여 있다.희생 양극봉과 달리 인가 전류 양극은 구조를 희생시키지 않는다.이 기술은 DC 소스에서 제공하는 외부 전류를 사용하여 음극 방식([11]cathodic protection을 만듭니다.인가 전류 양극은 파이프라인, 보트 및 [12]온수기와 같은 대형 구조물에 사용됩니다.
관련 반의어
양극의 반대는 음극이다.소자의 전류가 반전되면 전극이 기능을 전환하므로 반전된 전류가 인가되는 한 양극이 음극이 되고 음극이 양극이 됩니다.단, 다이오드는 예외이며 전극의 이름은 항상 정방향에 기초합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Denker, John (2004). "How to Define Anode and Cathode". av8n.com. Archived from the original on 28 March 2006.
- ^ Pauling, Linus; Pauling, Peter (1975). Chemistry. San Francisco: W. H. Freeman. ISBN 978-0716701767. OCLC 1307272.
- ^ "Zincode definition and meaning Collins English Dictionary". www.collinsdictionary.com. Retrieved 11 June 2021.
- ^ a b Ross, S (1961). "Faraday Consults the Scholars: The Origins of the Terms of Electrochemistry". Notes and Records of the Royal Society of London. 16 (2): 187–220. doi:10.1098/rsnr.1961.0038. S2CID 145600326.
- ^ 패러디(1월 1834년)."실험적 방안 전기에.7Series".왕립 협회의 철학적 거래. 124(1):77.Bibcode:1834RSPT..124...77F.doi:10.1098/rstl.1834.0008.S2CID 116224057.912월 2017년에입니다. 여기가 패러데이의 단어는 전극, 양극, 음극, 음이온, 양이온, 전해질, electrolyze을 소개한다 오리지널과 Archived.
- ^ Faraday, Michael (1849). "Experimental Researches in Electricity". 1. Taylor. hdl:2027/uc1.b4484853. Archived from the original on 9 December 2017.
{{cite journal}}: 인용저널에 (도움말)재인쇄 필요 - ^ McNaught, A. D.; Wilkinson, A. (1997). IUPAC Compendium of Chemical Terminology (2nd ed.). Oxford: Blackwell Scientific Publications. doi:10.1351/goldbook.A00370. ISBN 978-0-9678550-9-7.
- ^ Faraday, Michael (1849). Experimental Researches In Electricity. Vol. 1. London: The University of London.
- ^ "What is the anode, cathode and electrolyte?". Duracell Frequently Asked Questions page. Retrieved 24 October 2020.
- ^ "Impressed Current Protection Anodes - Specialist Castings". Archived from the original on 8 January 2017.
- ^ "What is an Impressed Current Anode? - Definition from Corrosionpedia".
- ^ "Powered Anode Rod Advantages #1 Anode Rod Corro-Protec". 13 March 2019.