인슐린(메디케이션)
Insulin (medication) 인슐린 병 | |
| 임상자료 | |
|---|---|
| 상명 | 후물린, 노볼린, 인수만 등 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a682611 |
| 라이센스 데이터 | |
| 경로: 행정 | 피하, 정맥, 근육, 흡입 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 식별자 | |
| CAS 번호 |
|
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 화학 및 물리적 데이터 | |
| 어금질량 | 5793.5999 g/19987 |
| 밀도 | 1.09[2] g/cm3 |
| 녹는점 | 233°C(451°F) |
인슐린은 고혈당 치료제로 쓰이는 단백질 호르몬이다.[4] 이것은 당뇨병 타입 1, 당뇨병 타입 2, 임신성 당뇨병과 당뇨 케토아시드증, 고혈당 상태와 같은 당뇨병의 합병증을 포함한다.[4] 높은 혈중 칼륨 수치를 치료하는 데도 포도당과 함께 사용된다.[5] 전형적으로 그것은 피부 밑의 주입에 의해 주어지지만, 어떤 형태는 정맥이나 근육에 주사하는 것에 의해서도 사용될 수 있다.[4]
일반적인 부작용은 저혈당이다.[4] 다른 부작용으로는 주사 부위의 통증이나 피부 변화, 저혈압 칼륨 및 알레르기 반응을 들 수 있다.[4] 임신 중 사용은 아기에게 비교적 안전하다.[4] 인슐린은 돼지나 소의 췌장에서 만들어질 수 있다.[6] 인간 버전은 돼지 버전을 수정하거나 재조합 기술을 통해 만들어질 수 있다.[6] 그것은 세 가지 주요 유형으로, 단기 작용(일반 인슐린), 중간 작용(중립 프로토민 해데돈(NPH) 인슐린), 그리고 장기 작용(인슐린 글래진 등)이 있다.[6]
인슐린은 1922년 찰스 베스트와 프레드릭 베인팅에 의해 캐나다에서 처음으로 약으로 사용되었다.[7][8] 그것은 세계보건기구의 필수 의약품 목록에 올라 있다.[9] 2017년 인간 인슐린은 미국에서 73번째로 가장 많이 처방된 약으로 1천만 개 이상의 처방을 받았다.[10][11]
의학적 용법

인슐린은 당뇨병을 포함한 많은 질병과 당뇨 케토아시드증, 고혈당 상태와 같은 급성 합병증을 치료하는데 사용된다.[4] 높은 혈중 칼륨 수치를 치료하는 데도 포도당과 함께 사용된다.[4] 인슐린은 이전에 인슐린 쇼크 치료라고 불리는 정신과 치료에 사용되었다.[12]
부작용
알레르기
인슐린에 대한 알레르기는 약 2%의 사람들에게 영향을 미쳤는데, 그 중 대부분의 반응은 인슐린 자체 때문이 아니라 아연, 프로토타민, 메타 크레솔과 같은 인슐린에 첨가된 방부제 때문이다. 대부분의 반응은 1형 과민성 반응으로 과민증을 유발하는 경우는 거의 없다. 인슐린에 대한 알레르기가 의심되는 것은 피부 따끔한 검사, 패치 검사, 그리고 가끔 피부 조직 검사를 통해 확인할 수 있다. 인슐린 과민성 반응에 대한 첫 번째 라인 치료에는 항히스타민제를 사용한 증상 요법이 포함된다. 그런 다음 대상자는 자신이 반응하는 특정 작용제를 포함하지 않거나 감소를 겪는 준비물로 전환된다.[13]
피하 역효과
부위가 회전하지 않고 피하주사를 반복하면 지혈증과 아밀로이도마(Amyloidomas)를 유발할 수 있는데, 이것은 피부 아래에서 단단하게 잘 보이는 결절로 발현된다.[14]
원칙
| 인슐린 준비물의[15][16] 아미노산 순서 | |||||||
|---|---|---|---|---|---|---|---|
| 아미노산 대체품 | |||||||
|
| A 체인 위치 | B 체인 위치 | |||||
| 출처 종 | A-8 | A-10 | A-21 | B-28 | B-29 | B-30 | B-31 B-32 |
| 보바인 | 알라 | 발 | Asn | 프로 | 리스 | 알라 | 해당 없음 |
| 포신 | 스르 | 일레 | Asn | 프로 | 리스 | 알라 | 해당 없음 |
| 인간 | 스르 | 일레 | Asn | 프로 | 리스 | 스르 | 해당 없음 |
| 아스파르트(노볼로그) | 스르 | 일레 | Asn | 질식시키다 | 리스 | 스르 | 해당 없음 |
| 리스트프로 (Humalog) | 스르 | 일레 | Asn | 리스 | 프로 | 스르 | 해당 없음 |
| 글루리신 (아피드라) | 스르 | 일레 | Asn | 프로 | 글루 | 스르 | 해당 없음 |
| 글래진 (랜투스) | 스르 | 일크 | 글리 | 프로 | 리스 | 스르 | 아그 |
| 데테미르(레브미르) | 스르 | 일레 | Asn | 프로 | 리스 | 해당 없음 | 미리스틱산 |
| 디그루덱(트레시바) | 스르 | 일레 | Asn | 프로 | 리스 | 해당 없음 | 헥사데카네디오산 |
| | |||||||
인슐린은 췌장에 의해 생성되는 내인성 호르몬이다.[17] 인슐린 단백질은 진화 시간에 걸쳐 보존되어 왔으며 포유류와 무척추동물 둘 다에 존재한다. 인슐린/인슐린과 같은 성장인자 신호 전달 경로(IIS)는 선충, 파리, 쥐(Drosopila melanogaster), 쥐(Musus musculus)를 포함한 종에서 광범위하게 연구되어 왔다. 그것의 행동 메커니즘은 종마다 매우 유사하다.[18]
제1형 당뇨병과 제2형 당뇨병은 모두 췌장 기능의 상실로 표시되지만 정도는 다르다.[17] 두 종류의 당뇨병을 가진 사람들은 저혈당과 고혈당의 위험에 처해 있으며, 잠재적으로 심각한 결과를 초래할 수 있다. 많은 사람들이 혈당 수치를 관리하고 목표치 이내로 유지하기 위해 인슐린 치료를 요구한다.[19][20][21]
1916년 니콜래 C. Paulescu (1869-1931)는 당뇨병 개를 정상화하는 수성 췌장 추출물을 개발하는 데 성공했다. 1921년에는 당뇨병성 개에 대한 췌장 추출물의 성공적 효과를 중심으로 파리 생물학회에 4편의 논문을 발표했다. Paulescu에 의한 식품 동화에서의 췌장의 역할에 관한 연구는 1921년 8월 벨기에 리에의 국제물리학 연구소에 발표되었다. 처음에 임상용으로 인슐린을 얻는 유일한 방법은 다른 생물의 췌장에서 인슐린을 추출하는 것이었다. 동물샘은 육류 포장 산업의 폐기물로서 얻을 수 있었다. 인슐린은 주로 소(Eli Lilly and Company)와 돼지(Nordisk 인슐린 노동 수용소)에서 유래되었다. 8온스의 정제된 인슐린을 만들기 위해서는 2톤의 돼지 부품이 필요할 수 있다.[22][23][24] 이러한 원천에서 나오는 인슐린은 인간의 인슐린(소인 인슐린에서는 3개의 아미노산 차이, 포르신에서는 1개의 아미노산 차이)과 매우 유사하기 때문에 사람에게 효과적이다.[24] 처음에, 낮은 준비 순도는 비-인슐린 물질의 존재에 대한 알레르기 반응을 초래했다. 1920년대 이후 고압 액체 크로마토그래피(HPLC) 방식 덕분에 순도는 궁극적으로 1970년대 중반까지 99%에 달했다. 인공적인 "인간" 인슐린 품종에도 사소한 알레르기 반응이 여전히 가끔 발생한다.[24]
1982년부터는 재조합 DNA 기술을 이용한 유전자 공학 기법을 통해 생체합성 "인간" 인슐린이 임상용으로 제조되어 왔다. 제넨텍은 이런 인슐린인슐린 '휴무린'을 처음 생산하는 데 사용되는 기술을 개발했지만 제품 자체를 상업적으로 마케팅하지는 않았다. 일라이 릴리는 1982년에 휴뮬린을 시판했다.[25] 휴무린은 실제 인간의 DNA가 숙주세포(이 경우 대장균)에 삽입되는 현대적인 유전공학 기법을 이용해 생산된 최초의 의약품이다. 그러면 숙주 세포는 정상적으로 자라고 번식할 수 있게 되고, 삽입된 인간 DNA 때문에 인간 인슐린의 합성 버전을 생산하게 된다. 제조사들은 이것이 많은 불순물들의 존재를 감소시킨다고 주장한다. 그러나 그러한 인슐린으로부터 준비된 임상 준비물은 몇 가지 중요한 측면에서 내인성 인간 인슐린과 다르다. 예를 들어, 최근 몇 년 동안 전신적인 효과를 가지고 있는 C-펩타이드의 부재가 있다. 노보노디스크는 또한 효모 과정을 이용하여 유전적으로 조작된 인슐린을 독자적으로 개발했다.[26][27]
국제당뇨병연맹이 2002년 회원국의 인슐린 접근과 이용가능성에 대해 조사한 결과 현재 전 세계에서 판매되고 있는 인슐린의 약 70%가 재조합형 생체합성형 '인간' 인슐린이다.[28] 임상 경험이 이러한 인슐린이 알레르기 반응을 일으킬 가능성이 더 낮은지에 대한 상반된 증거를 제공했음에도 불구하고 오늘날 임상적으로 사용되는 대부분의 인슐린은 이런 방식으로 생산된다. 부작용은 저혈당, 경련, 기억력 상실 및 집중력 상실로 인해 환자가 혼수상태에 빠질 수 있다는 경고 신호의 상실을 포함한다.[29] 그러나 2005년 국제당뇨연맹의 입장 표명은 "인슐린 한 종을 다른 종보다 선호한다는 압도적인 증거가 없다" "[현대적이고 고도로 정제된] 동물성 절개류는 완벽하게 받아들일 수 있는 대안으로 남아 있다"[30]는 점에서 매우 분명하다.
2006년 1월 이후 미국과 일부 국가에서 유통되는 모든 인슐린은 합성인 "인간" 인슐린 또는 그 유사성이다. 2005년 또는 그 이전에 릴리가 만든 포르신 인슐린 재고가 일부 남아 있을 수 있지만 미국에서 사용할 소 또는 포르신 유도 인슐린을 얻기 위해서는 특별 FDA 수입 절차가 필요하며, 포신 렌즈 인슐린도 미국에서 수의학용으로 판매되어 판매되고 있다.당뇨병에 걸린 [31]동물들
기저 인슐린
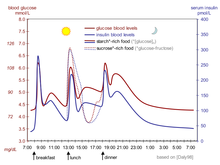
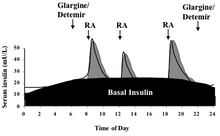
제1형 당뇨병의 경우 인슐린 생산량이 극히 낮기 때문에 신체는 외생 인슐린을 필요로 한다. 제2형 당뇨병을 앓고 있는 사람들, 특히 헤모글로빈 A1c 값이 매우 높은 사람들은 그들의 몸이 생산되는 인슐린 수준으로 약화되기 때문에 기준 인슐린 비율을 요구할 수도 있다. 기초 인슐린은 식사 시간 사이와 하룻밤 사이에 몸의 혈당을 조절한다. 인슐린 작용의 이 기저율은 일반적으로 중간 작용 인슐린(NPH 등)이나 장기간 작용하는 인슐린 아날로그의 사용을 통해 달성된다. 제1형 당뇨병 환자의 경우, 인슐린 펌프를 사용하여 신속하게 반응하는 인슐린의 지속적인 주입을 통해서도 얻을 수 있다. 하루 인슐린 요구량의 약 절반은 기저 인슐린으로 투여되며, 보통 밤에 하루에 한 번 투여된다.[32]
프랜디알 인슐린
사람이 탄수화물과 포도당이 함유된 음식을 먹을 때, 인슐린은 음식의 신체의 신진대사를 조절하는데 도움을 준다. 식사 시간 또는 볼러스 인슐린이라고도 불리는 프란디알 인슐린은 식사 전 인슐린을 투여하는 볼러스 용량으로 설계돼 식사 후 발생하는 혈당 스파이크를 조절한다. prandial 인슐린의 선량은 정적이거나 환자가 현재 혈당, 계획된 탄수화물 섭취 또는 둘 모두를 사용하여 계산할 수 있다. 이 계산은 또한 펌프를 사용하는 환자에서 인슐린 펌프에 의해 수행될 수 있다. 이러한 방법으로 계산된 선량으로 구성된 인슐린 연대는 집중적인 인슐린 퇴행요법으로 간주된다.[33] prandial 인슐린은 보통 식사 15~30분 전에 빠른 반응 인슐린이나 일반 인슐린을 사용하여 투여된다. 일부 환자의 경우 기본 인슐린과 원시 인슐린을 모두 제공하기 위해 NPH(장기 작용) 인슐린과 신속/정기 인슐린을 모두 포함하는 결합 인슐린을 사용할 수 있다.[32]
치료의 어려움
당뇨병에 대한 임상 치료로 인슐린을 사용하는 것에는 몇 가지 어려움이 있다.[34]
- 관리 모드.
- '올바른' 선량 및 타이밍 선택 인슐린 손잡이 1단위의 탄수화물의 양은 사람마다, 그리고 하루 동안 매우 다양하지만, 1 IE 당 7에서 20그램 사이의 값이 대표적이다.
- 적절한 인슐린 준비물 선택(일반적으로 '시작 속도 및 작용 지속 시간' 근거).
- 식품 섭취 시기, 양 및 유형에 맞게 용량 및 타이밍 조정.
- 수행된 연습에 맞게 복용량과 타이밍 조정.
- 복용량, 유형 및 시기를 다른 조건에 맞게 조정(예: 질병의 스트레스 증가)
- 피하 분만을 통한 혈류 흡수 변화
- 투약량은 인슐린과 C-펩타이드의 조합이 서서히 그리고 직접적으로 포탈맥으로 방출되는 대신 피하 볼루스 용량만을 투여한다는 점에서 비생리학적이다.
- 탄수화물을 먹거나 혈당 수치가 높을 때마다 주사를 놓는 것은 그야말로 성가신 일이다.
- 실수할 경우 위험하다(대부분 '너무 많은' 인슐린).
종류들
인슐린의 의학적 준비는 결코 '물 속의 인슐린'에 지나지 않는다. 임상 인슐린은 특별히 준비된 인슐린과 방부제를 포함한 다른 물질들의 혼합물이다. 이러한 인슐린 흡수를 지연시키고, 주사부위의 반응을 줄이기 위해 용액의 pH를 조절하는 등.[citation needed]
인간 인슐린 분자의 미세한 변이를 인슐린 아날로그(기술적으로 "인슐린 수용체 리간드")라고 부르는데, 기술적으로 인슐린이 아니라 호르몬의 포도당 관리 기능을 유지하는 아날로그라고 해서 붙여진 이름이다. 그들은 피하주입 인슐린으로는 현재 불가능한 흡수 및 활동 특성을 가지고 있다. 실제 베타 세포 인슐린(인슐린 리스프로, 인슐린 아스파르트, 인슐린 글루리신 등)을 흉내내려는 시도에 빠르게 흡수되거나 '피크' 대신 주사 후 꾸준히 흡수되어 인슐린 작용(인슐린 데테미르, 인슐린 글라진 등)이 다소 빠른 속도로 감소하는 것이 모두 인슐린의 글루크린을 유지한다.인체의 ose-internative 작용 그러나 meta-analyses의 코크레인 협업에 의해 행해진 2005,[35]독일 연구소의 품질 및 비용 효율에 대한 의료 부문에[IQWiG]에 2007,[36]에서 해제하고 캐나다청 마약은 기술 보건(CADTH)[37]에 2007년에 출시되는 등 많은 병원에 분명한 장점을 보여 주었다.제가 알 사용일반적인 인슐린 유형에 대한 Nsulin 유사성.[citation needed]
인슐린 종류와 복용량/타이밍을 선택하는 것은 당뇨병에 걸린 사람들과 가깝게 일하는 숙련된 의료 전문가가 해야 한다.[citation needed]
일반적으로 사용되는 인슐린의 종류는 다음과 같다.[17]
빠른연동작
인슐린 아날로그 아스파르트, 리스프로, 글루리신 등이 포함된다. 이것들은 5~15분 이내에 작동하기 시작하고 3~4시간 동안 활동한다. 대부분의 인슐린은 헥사머를 형성하는데, 이 인슐린은 혈액에 활성 형태로 들어가는 것을 지연시킨다; 이 아날로그 인슐린들은 정상적인 인슐린 활동을 할 수 밖에 없다. 새로운 품종들은 현재 미국에서 규제 승인을 기다리고 있는데, 이것은 빠르게 작동하도록 설계되었지만 일반 인간 인슐린과 동일한 유전 구조를 유지하고 있다.[38][39]
단기연기
30분 이내에 작업을 시작하고 약 5~8시간 동안 활성 상태인 정규 인슐린을 포함한다.
중간 작용
1시간에서 3시간 후에 활동을 시작하고 16시간에서 24시간 동안 활성 상태인 NPH 인슐린을 포함한다.
롱액션
글래진 U100과 데테미르(detemir)의 아날로그를 포함한다. 각각은 1~2시간 이내에 작동하기 시작하여 약 24시간 동안 주요 피크나 딥 없이 계속 활동한다(많은 개인에 따라 다르지만).
초장기연기
인슐린 글라진 U300과 디루드덱의 유사 성분을 포함하며, 30~90분 이내에 작업을 시작하고 24시간 이상 계속 활동한다.[16]
조합 인슐린 제품
빠른 반응 인슐린 또는 짧은 반응 인슐린과 긴 작용 인슐린의 조합, 일반적으로 NPH 인슐린을 포함한다. 콤비네이션 제품은 짧은 연기 인슐린(빠른 연기는 5~15분, 짧은 연기는 30분)으로 작동하기 시작해 16~24시간 동안 활성 상태를 유지한다. 혼합 인슐린 비율이 서로 다른 여러 가지 변화가 있다(예: Novolog Mix 70/30은 70% aspart protamine[ankin to NPH] 및 30% aspart).
관리방법
많은 약과 달리 인슐린은 현재 구강으로 복용할 수 없다. 위장에 유입된 거의 모든 단백질과 마찬가지로, 그것은 단편(단일 아미노산 성분)으로 줄어들어 모든 활동이 상실된다. 인슐린이 알약으로 투여될 수 있도록 소화기관으로부터 인슐린을 보호하는 방법에 대한 연구가 있었다. 지금까지 이것은 완전히 실험적인 것이다.
피하지방
인슐린은 보통 바늘이나 인슐린 펌프가 있는 일회용 주사기나 바늘이 달린 인슐린 펜을 반복해서 사용하는 피하 주사제로 복용한다. 인슐린 주사제의 반복적인 피부 구멍을 줄이려는 사람들은 주사기와 함께 주사 포트를 사용하는 경우가 많다.
피하 주사 인슐린을 사용하는 것은 반감기, 작용 개시, 작용 지속시간 등 사용되는 제형의 다양한 특성을 고려하면서 인슐린 분비의 자연적인 생리적 주기를 모방하도록 고안되었다. 많은 사람들에게 있어, 빠른 혹은 짧은 반응의 인슐린 제품뿐만 아니라 중간 혹은 긴 반응의 제품도 하루에 주사하는 양을 줄이기 위해 사용된다. 일부에서는 인슐린 주사를 GLP-1 작용제와 같은 다른 주사요법과 결합시킬 수도 있다. 효과적인 인슐린 치료를 위해 주사부위 세척과 주사기법이 필요하다.[32]
인슐린 펌프
인슐린 펌프는 어떤 사람들에게는 타당한 해결책이다. 사람에게 유리한 점은 배경 또는 기저 인슐린 투여량, 단위 분수로 계산된 조영제 용량, 조영제 주입 투여량을 결정하는 데 도움이 될 수 있는 펌프 내 계산기 등이다. 제한은 비용, 저혈당 및 고혈당 증상의 가능성, 카테터 문제, 현재 혈당 수치를 기준으로 인슐린 전달을 제어하는 "폐쇄 루프" 수단이 없다.
인슐린 펌프는 일시적으로 이식된 카테터 또는 캐뉼라에 부착된 '전기 주입기'와 같을 수 있다. 재래식 (또는 제트) 주입에 의해 적절한 포도당 제어를 달성할 수 없는 일부는 적절한 펌프로 그렇게 할 수 있다.
카테터를 삽입하는 것은 감염과 궤양의 위험을 내포하고, 어떤 사람들은 또한 주입 세트로 인해 지방질 위축증을 일으킬 수도 있다. 이러한 위험은 주입 사이트를 청결하게 유지함으로써 최소화할 수 있다. 인슐린 펌프는 올바르게 사용하기 위한 주의와 노력이 필요하다.
복용량 및 시기
복용량 단위
인슐린의 한 국제 단위(1 IU)는 34.7 μg 순수 결정 인슐린의 "생물학적 등가물"로 정의된다.
인슐린 단위의 첫 번째 정의는 토끼의 저혈당 유도에 필요한 양이었다. 이것은 1922년 토론토 대학의 제임스 콜립에 의해 설정되었다. 물론 이것은 토끼의 크기와 식단에 달려 있었다. 인슐린의 단위는 토론토 대학의 인슐린 위원회가 정했다.[40] 이 단위는 결국 구 USP 인슐린 단위로 진화했는데, 여기서 인슐린 1단위(U)가 단식토끼의 혈당 농도를 45mg/dl(2.5mmol/L)로 낮추는 데 필요한 인슐린 양과 동등하게 설정되었다. 일단 인슐린의 화학적 구조와 질량이 알려지자 인슐린의 단위는 USP 단위를 얻기 위해 필요한 순수 결정 인슐린의 질량으로 정의되었다.
인슐린 치료에 사용되는 측정 단위는 미터법의 현대적인 형태인 국제 단위계(약칭 SI)의 일부가 아니다. 대신 약리학적 국제 단위(IU)는 WHO 생물표준화 전문가 위원회가 정의한다.[41]
잠재적 합병증
외부 인슐린을 필요로 하는 사람들에게 중요한 문제는 적절한 양의 인슐린과 적절한 타이밍을 선택하는 것이다.
당뇨병 환자가 아닌 경우와 마찬가지로 혈당 생리적 조절이 가장 좋을 것이다. 식사 후 혈당 수치가 증가하면 췌장에서 인슐린이 빨리 분비되기 위한 자극이다. 인슐린 수치가 증가하면 혈당 흡수 및 세포 저장이 초래되고 글리코겐이 포도당 변환으로 감소하며 혈당 수치가 감소하며 인슐린 방출이 감소한다. 그 결과 식사 후 혈당 수치가 어느 정도 상승하고, 1시간 정도 지나면 정상 '단식' 수준으로 돌아온다. 합성 인간 인슐린이나 심지어 인슐린 아날로그를 사용한 최고의 당뇨병 치료법조차도, 아무리 투여해도, 당뇨가 아닌 사람들의 정상적인 포도당 조절에 훨씬 미치지 못한다.
더 복잡한 문제는 먹는 음식의 구성(혈당지수 참조)이 장 흡수율에 영향을 미친다는 점이다. 일부 음식의 포도당은 다른 음식의 포도당 같은 양보다 더 빠르게 흡수된다(또는 덜 흡수된다. 게다가 지방과 단백질은 동시에 섭취하는 탄수화물에 의한 포도당 흡수를 지연시킨다. 또한, 운동은 인슐린의 도움 없이도 포도당을 섭취할 수 있는 능력을 가지고 있기 때문에 다른 모든 요소들이 똑같을 때에도 인슐린의 필요성을 감소시킨다.
복잡하고 상호 작용하는 요인 때문에 식사 후 1~2시간 이내에 합리적인 혈당 수치를 달성하기 위해 특정 식사에 인슐린(그리고 어떤 종류)이 얼마나 필요한지 확인하는 것은 원칙적으로 불가능하다. 당뇨가 아닌 사람의 베타 세포는 지속적인 포도당 수준 모니터링과 인슐린 방출을 통해 일상적이고 자동으로 이를 관리한다. 당뇨병 환자에 의한 그러한 모든 결정은 경험과 훈련(즉, PA, 또는 어떤 곳에서는 전문 당뇨병 교육자의 지시에 따라)에 근거해야 하며, 나아가서는 개인의 경험에 근거해야 한다. 그러나 그것은 직설적이지 않으며 습관이나 일상에 의해 행해져서는 안 된다. 그러나 어느 정도 주의를 기울이면 임상 실습에서 상당히 잘 할 수 있다. 예를 들어, 당뇨병에 걸린 일부 사람들은 지방, 단백질, 탄수화물, 액체를 같은 양으로 섭취한 후보다 탈지 우유를 마신 후에 더 많은 인슐린을 필요로 한다. 탈지우유에 대한 그들의 특별한 반응은 당뇨병에 걸린 다른 사람들과는 다르지만, 같은 양의 전유도 그 사람에게도 여전히 다른 반응을 일으킬 가능성이 있다. 전체 우유는 상당한 지방을 함유하고 있는 반면 탈지 우유는 훨씬 적은 양을 함유하고 있다. 그것은 당뇨병을 앓고 있는 모든 사람들, 특히 인슐린을 복용하는 사람들을 위한 지속적인 균형잡힌 행동이다.
인슐린 의존성 당뇨병이 있는 사람들은 일반적으로 식사를 커버하기 위해 약간의 염기성 인슐린(기본성 인슐린)뿐만 아니라 단작용 인슐린(bolus)을 필요로 한다. 기저율과 볼러스율을 유지하는 것은 인슐린 의존성 당뇨병을 가진 사람들이 매일 관리해야 하는 지속적인 균형잡힌 행동이다. 이는 일반적으로 정기적인 혈액 검사를 통해 달성되지만, 현재 연속 혈당 검사 장비(연속 혈당 모니터 또는 CGM)가 사용 가능해지고 있어 광범위한 사용이 보편화되면 이러한 균형 조정 작용을 개선하는 데 도움이 될 수 있다.
전략들
장시간 작용하는 인슐린은 췌장에 의한 인슐린의 기저 분비에 근사치를 하기 위해 사용되는데, 이는 하루의 경과에 따라 달라진다.[42] 이러한 목적으로 NPH/이소판, 렌즈, 초경량, 글래진 및 데테미어를 사용할 수 있다. NPH의 장점은 저렴한 비용, 즉 단작작용 형태의 인슐린과 혼합할 수 있다는 점, 따라서 투여해야 하는 주사 횟수를 최소화하고 투여 후 4~6시간 동안 NPH의 활동이 절정에 달해 취침시간 선량이 새벽과 함께 상승하는 경향의 균형을 맞출 수 있다는 점이다.낮은 오후 기저 욕구의 균형을 맞추기 위한 조향 선량과 저녁 욕구를 충족시키기 위한 오후 선량의 균형을 맞추기 위한 조향 선량이 그것이다. 취침시간 NPH의 단점은 동트기 직전 절정을 놓기에 충분한 시간(자정시간 가까이)이 걸리지 않으면 저혈당증을 유발할 가능성이 있다는 것이다. 글래긴과 데테미르의 이론적 장점 중 하나는 실제로 많은 사람들이 둘 다 24시간 내내 지속되지 않는다는 것을 발견하지만, 글래긴과 데테미르의 이론적 이점은 하루에 한 번만 투여하면 된다는 것이다. 매일 같은 시간에 주어진다면 하루 중 언제든지 투여할 수 있다. 장기 작용 인슐린의 또 다른 장점은 인슐린 요법의 기본 성분(하루 종일 최소 수준의 인슐린 제공)을 프리랜디얼 또는 볼러스 성분으로부터 분리할 수 있다는 것이다(초단시간 작용 인슐린을 통한 식사 제공) 반면 NPH와 일반 인슐린을 사용하는 요법은 모든 용량에 a라는 단점이 있다.정의는 기초 및 기초 커버리지 모두에 영향을 미친다. 글래긴과 데테미르는 NPH, 렌테, 울트라렌트보다 훨씬 비싸며 다른 형태의 인슐린과 섞일 수 없다.[citation needed]
단작작용을 하는 인슐린은 섭취를 예상하여 발생하는 내인성 인슐린 급증을 시뮬레이션하는 데 사용된다. 이 목적을 위해 정규 인슐린, listpro, 아스파르트, 글루리신을 사용할 수 있다. 정기적인 인슐린은 식사 전 약 30분간의 리드 타임을 부여하여 최대 효과를 발휘하고 저혈당증의 가능성을 최소화해야 한다. Lispro, 아스파르트, 글루리신 등은 식사의 첫 한 입과 함께 복용 승인을 받았으며, 식사가 끝난 후에 주어도 효과가 있을 수 있다. 단작작용을 하는 인슐린은 또한 고혈당증을 교정하는데 사용된다.[citation needed]
손가락 마디 혈당 확인과 인슐린 투여를 위한 통상적인 일정은 모든 식사 전이며 때로는 취침 시간에도 있다. 보다 최근의 지침은 또한 식사가 효과적으로 '보호'되고 있는지 확인하기 위해 식사 후 2시간 후에 체크할 것을 요구하고 있다.[citation needed]
슬라이딩 저울
1934년에 처음 설명되어,[43] 의사가 일반적으로 슬라이딩 스케일 인슐린(SSI)이라고 부르는 것은 대개 식사 시간 및 때로는 취침 시간에서 피하로 주어진 빠르고 빠르게 작용하는 인슐린이지만 [44]혈당이 임계값을 초과했을 때만이다(예: 10 mmol/L, 180 mg/dL).[45] 기본 인슐린은 투여되지 않으며, 대개 매일 아침 혈당이 상승하고, 그 다음 날 주기가 반복되면서 하루 종일 혈당이 상승한다.[citation needed] 이른바 '슬라이딩 스케일(sliding-scale)' 방식은 비판의 목소리가 컸지만 여전히 널리 가르쳐지고 있다.[46][47][48][49] 슬라이딩 스케일 인슐린(SSI)은 요양원에 거주하는 개인의 장기 당뇨병을 관리하는 효과적인 방법이 아니다.[44][50] 슬라이딩 스케일 인슐린은 더 큰 불편함을 초래하고 간호 시간을 증가시킨다.[50]
| 아침 식사 전에 | 점심 전에 | 저녁 식사 전에 | 취침시에 | |
|---|---|---|---|---|
| NPH 선량 | 12단위 | 6단위 | ||
| 손가락이 끼면 규칙적인 인슐린 투여량 포도당은 (mg/dl) [mmol/L]이다. | ||||
| 70–100 [3.9–5.5] | 4단위 | 4단위 | ||
| 101–150 [5.6–8.3] | 5단위 | 5단위 | ||
| 151–200 [8.4–11.1] | 6단위 | 6단위 | ||
| 201–250 [11.2–13.9] | 7단위 | 7단위 | ||
| 251–300 [14.0–16.7] | 8단위 | 1단위 | 8단위 | 1단위 |
| >300 [>16.7] | 9단위 | 2단위 | 9단위 | 2단위 |
인슐린 글라진 및 인슐린 리스트프로를 사용한 샘플 처방:
- 인슐린 글라진: 취침시 20단위
| 손가락이 끼면 포도당이 나온다. (mg/dl) [mmol/L]: | 아침 식사 전에 | 점심 전에 | 저녁 식사 전에 | 취침시에 |
|---|---|---|---|---|
| 70–100 [3.9–5.5] | 5단위 | 5단위 | 5단위 | |
| 101–150 [5.6–8.3] | 6단위 | 6단위 | 6단위 | |
| 151–200 [8.4–11.1] | 7단위 | 7단위 | 7단위 | |
| 201–250 [11.2–13.9] | 8단위 | 8단위 | 8단위 | 1단위 |
| 251–300 [14.0–16.7] | 9단위 | 9단위 | 9단위 | 2단위 |
| >300 [>16.7] | 10단위 | 10단위 | 10단위 | 3단위 |
카뷰레터 카운팅 및 DAFNE
식사 시간과 간식으로 더 큰 자유를 허용하는 더 복잡한 방법은 '카르브 카운팅'이다. 이러한 접근방식은 영국 및 기타 국가에서 당뇨병을 앓고 있는 사람들에게 "정상적인 섭취를 위한 약물 조절" 또는 DAFNE로 가르친다.
유럽에서는 DAFNE 체제에 익숙하지 않은 사람들이 기본 시작 인슐린 투여량 지침이 '식사하는 탄수화물 10g마다 1단위의 인슐린을 복용하라'는 교육 과정을 수강할 수 있다. DAFNE 과정은 또한 혈당 모니터링, 운동 및 탄수화물 추정과 같이 자연적으로 이 체제와 함께 작용하는 주제를 다루며, 이는 개인의 통제 요구사항을 해결하는 데 도움이 된다.
또 하루 총 용량(TDD)인 인슐린을 1단위의 인슐린에 의해 몇 그램의 탄수화물이 '커버링'될 것인가를 추정할 수 있으며, 이 결과를 이용하여 식사의 탄수화물 함량에 따라 몇 단위의 인슐린을 투여해야 하는가를 추정할 수 있다. 예를 들어 1단위의 인슐린이 15g의 탄수화물을 함유할 것으로 판단되면 75g의 탄수화물이 함유된 식사를 하기 전에 반드시 5단위의 인슐린을 투여해야 한다.
일부 대안적인 방법들은 또한 식사의 단백질 함량을 고려한다(과다한 식단 단백질이 글루코네제네시스를 통해 포도당으로 전환될 수 있기 때문이다).
DAFNE의 경우, 대부분의 복용량은 특히 라벨이 부착되지 않은 식품에 대해 상당한 수준의 추측을 수반하며, 만약 그 사람이 자신의 신체 요구 사항을 알고 있다면, 한 복용량에서 다음 복용량까지 공정하게 일관되게 작용하게 될 것이다. 예를 들어 아침 저녁으로 인슐린 1단위를 10g의 탄수화물에 복용할 수 있지만, 한낮에 식사할 때 인슐린이 더 많이 필요하기 때문에 8.5g당 1단위로 조절해야 한다는 사실을 알게 된다.
인체의 인슐린 사용에 영향을 미치는 다른 덜 명백한 요소들도 고려해야 한다. 예를 들어, 어떤 사람들은 더운 날에 인슐린을 더 잘 처리해서 인슐린을 덜 필요로 한다는 것을 발견할 수 있다. 이것으로, 그 사람은 다시 그들의 과거 경험으로부터 그들의 선량을 최대한 이해하도록 조정해야 한다.
DAFNE 체제는 경험을 통해 자신의 몸의 필요를 배우도록 요구하는데, 이는 시간과 인내심이 필요하지만, 그렇게 되면 효과적일 수 있다.
폐쇄 루프 예측 모델링
인슐린 요구사항이 변동하는 사람들은 폐쇄 루프 예측 모델링 접근법의 혜택을 받을 수 있다. "카르브 계수"의 연장선으로서, 이 폐쇄 루프 예측 모델링 접근법에서는 "정상적인" 일일 탄수화물 소비량과 신체 활동의 양에 대한 목표 혈당 수준에 도달하기 위해 필요한 4개의 일일 인슐린 투여량을 식전 및 야간 혈당 수치 판독을 기반으로 지속적으로 조정한다. 각각의 새로운 혈당 수치는 신체의 인슐린 요구 사항을 미세 조정하고 추적하기 위한 피드백을 제공한다. 이 전략 내에서 실험적으로 결정해야 하는 주요 특정 요인은 혈당 보정 인자와 탄수화물 비율이다. 혈당 보정 계수는 네 개의 피드백 루프에 대한 "비례적 이득"과 "적분 이득" 인자를 모두 설정한다. 너무 낮게 복용할 경우 목표 혈당치와의 편차가 효과적으로 교정되지 않고 너무 높게 복용할 경우 혈당 조절이 불안정해진다. 이 접근법에서 탄수화물 비율은 비표준 탄수화물 섭취만을 설명하기 위해 사용되기 때문에, 일반적으로 식사 비율에 따라 작업할 필요가 없다.
예를 들어, 식사에 필요한 볼러스 양을 계산할 때 기저 인슐린 양의 조정이 설명되도록 하기 위해, 사람의 몸에 작용하는 인슐린의 양을 적절히 모델링하는 것이 이 전략에서 필수적이다. 각 인슐린의 활성도를 파악하고, 과거의 혈당 추세를 분석하며, 비표준 탄수화물 섭취와 운동 수준을 고려해야 하기 때문에, 이 전략은 모든 계산을 처리할 수 있는 전용 스마트폰 어플리케이션을 필요로 하며, 의미 있는 복용 권장 사항과 예상 혈당 수치를 반환해야 한다.
선량 계산
인슐린 투약량은 공식에 의해 주어진다.
개인의 혈당 및 탄수화물 섭취와 이러한 상수에 기초한다.
- TR = 목표 속도
- CF = 교정 인자
- KF = 탄수화물 계수
혈당 및 목표율은 mg/dL 또는 mmol/L로 표시된다. 상수는 의사나 약사가 설정해야 한다.
남용
외생 인슐린의 남용은 섭취한 탄수화물을 처리하는 데 필요한 양을 초과하는 경우 저혈당 혼수상태와 사망의 동반 위험을 수반한다. 급성위험에는 뇌손상, 마비, 사망 등이 있다. 증상으로는 어지럼증, 허약함, 떨림, 두근거림, 발작, 혼란, 두통, 졸음, 혼수상태, 열병, 메스꺼움 등이 있을 수 있다. 과다 복용으로 고통 받는 모든 사람은 의료 평가와 치료를 위해 참조되어야 하며, 이는 몇 시간 또는 며칠 동안 지속될 수 있다.[51]
미국 국립독약데이터시스템(2013년)의 자료에 따르면 독극물 센터에 보고된 인슐린 환자 중 89.3%가 치료상의 오류로 인해 고의성이 없는 것으로 나타났다. 또 다른 10%의 사건은 고의적이며, 자살 시도, 학대, 범죄 의도, 이차적 이득 또는 기타 알 수 없는 이유를 반영할 수 있다.[51] 외생 인슐린에 의해 유도된 저혈당증은 말초순환에서 인슐린 대 C-펩타이드의 비율을 검사해 화학적으로 검출할 수 있다.[52] 운동선수들의 외인성 인슐린 남용을 감지하기 위해 이러한 접근법을 사용할 수 있다고 제안되었다.[53]
2001년 7월 일본 내분비학저널(Journal of Endocrinology)에서 피터 셍센이 보도한 대로 이르면 1998년 일본 나가노 동계올림픽에서 인슐린을 경기력 향상 시도에 사용할 가능성이 제기됐다. 비당파 운동선수들이 합법적으로 인슐린을 사용할 수 있는지에 대한 문제는 러시아의 한 의료진에 의해 제기되었다.[54][55] 인슐린이 실제로 운동능력을 향상시킬지는 확실하지 않지만 인슐린의 사용에 대한 우려는 1998년 국제올림픽위원회(IOC)가 비당파 운동선수들의 호르몬 사용을 금지하도록 만들었다.[56]
마크 파이나루-와다와 랜스 윌리엄스 기자가 쓴 '그림자 게임'(2001)에는 야구선수 배리 본즈가 자신이 복용하고 있다고 주장된 성장 호르몬의 효과를 높일 것이라는 명백한 믿음에 인슐린(다른 약뿐만 아니라)을 사용했다는 주장이 포함됐다.[57] 본즈는 결국 BALCO에 대한 정부 조사의 일환으로 연방 대배심 앞에서 증언했다.[58]
특히 보디빌더들은 근육량을 증가시킬 것이라는 믿음으로 외생 인슐린과 다른 약물을 사용하고 있다고 주장한다. 보디빌더들은 설탕이 든 식사를 하기 전에 최대 10IU의 일반 합성 인슐린을 주입하는 것으로 묘사되어 왔다.[56] 2008년 한 보고서는 인슐린이 때로는 아나볼릭 스테로이드와 성장 호르몬(GH)과 결합하여 사용되며, "선수들은 많은 양의 GH, IGF–I, 인슐린을 자가 투여함으로써 잠재적인 위해에 노출되고 있다"[59][60]고 제안했다. 인슐린 남용은 보디빌더 겐트 웨이크필드와 리치 피아나의 사망 원인 중 하나로 거론돼 왔다.[61]
인슐린, 인간 성장호르몬(HGH), 인슐린 유사 성장인자 1(IGF-1)은 아나볼릭 스테로이드만으로 제공되는 범위를 넘어 근육량을 늘리려는 사람들이 스스로 관리한다. 이들의 근거는 인슐린과 HGH가 성장을 촉진하기 위해 시너지 작용을 하고, IGF-1이 근골격계 성장의 일차적 매개체인 만큼 인슐린, HGH, IGF-1의 '집적'이 골격근에 시너지 성장 효과를 제공해야 한다는 것이다. 이 이론은 최근 몇 년 동안 경쟁 체중이 50파운드(23kg)를 초과하는 최고 수준의 보디빌더들이 과거 경쟁 체급보다 크고 심지어 체지방도 낮아 지지해왔다.[citation needed]
생물학적 유체에서의 검출
인슐린은 종종 혈청, 혈장, 혈액으로 측정되어 당뇨병 환자들의 치료를 감시하거나 입원한 사람들의 중독 진단을 확인하거나 의심스러운 죽음에 대한 의학적인 조사를 돕는다. 이용 가능한 수많은 유형의 인슐린, 다양한 투여 경로, 인슐린 의존성 당뇨병 환자의 항인슐린 항체 존재, 약물의 생체외 불안정성을 고려할 때, 결과 인슐린 농도의 해석은 복잡하다. 다른 잠재적 교란 요인으로는 생합성 인슐린 아날로그에 대한 상업용 인슐린 면역측정제의 광범위한 교차반응성, 고선량 정맥주사 인슐린을 항고혈압 약물의 과다 복용에 대한 해독제로서 사용하는 것, 그리고 인체 내에서 인슐린의 사후에 재분배하는 것을 들 수 있다. 인슐린 검사에 크로마토그래픽 기법을 사용하는 것은 양적 결과에 영향을 미치는 교차 반응성의 문제를 방지하고 시료 내 인슐린의 특정 유형을 식별하는 데 도움을 주기 위해 일부 상황에서 면역측정보다 선호될 수 있다.[62]
다른 당뇨병 치료제와의 결합
인슐린과 다른 당뇨병 치료제의 결합 치료는 당뇨가 있는 사람들에게 가장 유익하며, 여전히 남아있는 인슐린 분비 능력을 가지고 있다.[63] 2차 경구제 실패 후 제2형 당뇨병 환자를 치료할 때 인슐린 치료법과 설포닐루레아의 조합이 인슐린 단독보다 더 효과적이어서 포도당 프로파일 개선 및/또는 인슐린 요구 감소로 이어진다.[63]
역사
이것은 인슐린 의학적 사용의 역사에서 중요한 이정표의 연대기 입니다. 인슐린의 발견, 추출, 정화, 임상 사용 및 합성에 대한 자세한 내용은 인슐린을 참조하십시오.
- 1921 영양동화에서[64] 췌장의 역할에 관한 연구
- 1922년 프레데릭 본팅, 찰스 베스트, 제임스 콜립은 캐나다 토론토의 코너트 연구소에서 인간에게 소의 인슐린 추출물을 사용한다.[7]
- 1922년 레너드 톰슨은 인슐린 치료를 받은 최초의 인간이 된다.
- 1922년 제임스 D. 헤이븐스, 제임스 S 전 하원의원의 아들 Havenes는 인슐린 치료를 받은 최초의 미국인이 되었다.[65][66]
- 1922년 미국 국무장관의 딸 엘리자베스 휴스 고셋이 토론토에서 (공식적으로) 대접을 받은 최초의 미국인이 된다.[67][68]
- 1923 Eli Lilly는 Bingting 외 연구진보다 훨씬 순수한 소의 인슐린을 상업적으로 생산한다. 사용했었다
- 1923 오늘날의 사노피 아벤티스의 선구자 중 한 명인 파브르케 회흐스트(Farbwerke Hoechst)는 독일에서 소의 인슐린을 상업적으로 대량 생산한다.
- 1923년 한스 크리스티안 헤게돈, 덴마크에서 노디스크 인슐린 노동 수용소를 찾았다 – 오늘날 노보 노르디스크의 선구자
- 1923년 콘스탄스 콜리어는 스트라스부르에서[69] 인슐린 치료를 성공적으로 받은 후 건강을 되찾는다.
- 1926년 노르디스크는 인슐린을 비영리단체로 생산하는 덴마크 헌장을 받는다.
- 1936년 캐나다인 데이비드 M. 스콧과 앨버트 M. 피셔는 토론토에 있는 코너트 연구소에서 아연 인슐린 혼합물을 만들어 노보에게 허가했다.
- 1936 Haedorn은 인슐린에 프로타민을 첨가하는 것이 인슐린의 작용 기간을 연장한다는 것을 발견했다.
- 1946 Nordisk는 Isopane porcine 인슐린, 일명 Neutral Protamine Haedorn 또는 NPH 인슐린을 형성한다.
- 1946년 노르디스크는 프로토민과 인슐린 혼합물을 결정화한다.
- 1950년 NPH 인슐린 시장
- 1953년 Novo는 인슐린이 더 오래 지속되도록 아연을 첨가하여 Sente porcine과 소 인슐린을 만든다.
- 1955년 프레데릭 생거는 인슐린의 아미노산 염기서열을 결정한다.
- 1965년 왕잉라이, 천루쓰우 등에 의한 총합성에 의해 합성되었다.
- 1969 도로시 크로우풋 호지킨은 X선 결정학에 의해 인슐린의 결정 구조를 해결한다.
- 1973년 정제된 단일 화합물(MC) 인슐린 도입
- 1973년 U-100(militer당 100대)에 미국에서 인체용으로 판매된 인슐린을 공식적으로 '표준화'한 것이다. 그 이전에는 인슐린이 U-80(밀리리터당 80대)과 U-40 제제(밀리리터당 40대) 등 서로 다른 강도로 팔렸기 때문에 복용량 오류를 줄이고 사람을 위한 인슐린 처방 업무를 용이하게 하기 위한 효능을 '표준화'하려는 노력이 있었다. 다른 나라들도 그 뒤를 따랐다.
- 1978년 제넨텍은 대장균 박테리아에서 재조합 DNA 기법, 일라이 릴리의 면허를 이용해 생합성 인간 인슐린을 생산한다.
- 1981년 Novo Nordisk 화학적, 효소적으로 Porcine을 인간 인슐린으로 전환함
- 1982 Genentech 합성 인간 인슐린(위) 승인
- 1983년 Eli Lilly and Company는 재조합 DNA 기술인 Humulin과 함께 생체합성 인간 인슐린을 생산한다.
- 1985년 악셀 울리히가 인간 세포막 인슐린 수용체의 염기서열을 분석한다.
- 1988년 Novo Nordisk는 재조합형 생합성 인슐린을 생산한다.
- 1996 Lilly Humalog "Lispro" 인슐린 아날로그 승인.
- 2000 Sanofi Aventis Lantus 인슐린 "glargine" 아날로그가 미국과 유럽에서 임상용으로 승인되었다.
- 2004년 Sanofi Aventis Apidra 인슐린 "글루리신" 인슐린 아날로그가 미국에서 임상용으로 승인되었다.
- 2006 Novo Nordisk Levelmir "detemir" 인슐린 아날로그가 미국에서 임상용으로 승인되었다.
경제학
이 글은 갱신할 필요가 있다. 사용 하도록 이 2020년 2월). |
미국에서는 1991년부터 2019년까지 인슐린 단가가 꾸준히 상승했다.[70] 2002년부터 2013년까지 3배 증가했다.[71] 비용은 매달 미화 900달러까지 오를 수 있다.[71] 2016년 제약사들이 가격 인상을 위해 협력하는 것에 대한 우려가 제기됐다.[71] 2019년 1월 미국 하원 의원들은 인슐린 제조사 일라이 릴리와 코, 사노피, 노보 노디스크에 인슐린 가격을 급상승시킨 것에 대한 설명을 요청하는 서한을 보냈다. 미국에서 제1형 당뇨병을 앓고 있는 사람들의 연간 인슐린 비용은 2012년부터 2016년까지 이 기간 동안 2900달러에서 5700달러로 두 배 가까이 증가했다.[72]
국제보건계획연맹(IFF)에 따르면 미국인들은 상표명 처방약에 대해 캐나다를 포함한 전 세계 다른 나라보다 2배에서 6배 더 많은 돈을 지불한다. 캐나다는 다른 많은 선진국들과 마찬가지로 제약 비용에 대한 가격 통제를 가지고 있다.[73]
리서치
흡입
2006년 미국 식품의약국은 최초의 흡입성 인슐린인 엑수베라의 사용을 승인했다.[74] 인수 부족으로 2007년 3/4분기 현재 제조업체에 의해 시장에서 철수되었다.
흡입된 인슐린은 포도당 수치와 혈액 반감기를 조절한다는 측면에서 주입된 인슐린과 유사한 효능을 가지고 있다고 주장했다. 현재 흡입한 인슐린은 짧은 연기로 식사 전에 주로 복용하고 있으며, 야간에 장시간 작용하는 인슐린 주사가 여전히 필요한 경우가 많다.[75] 주사에서 흡입 인슐린으로 사람을 전환했을 때, 3개월 동안 HbA1c 수치에 유의미한 차이는 관찰되지 않았다. 사람들이 기준치에 비해 실험 기간 동안 체중 증가나 폐 기능 저하를 보이지 않았지만, 정확한 투약은 특정한 문제였다.[76]
2005년 영국에서 상업적으로 출시된 이후 국립보건임상우수연구소가 '정신과의사나 심리학자가 진단한 주사 공포증'이 있는 경우를 제외하고는 일상적인 사용을 권고하지 않았다(2006년 7월 기준).[75]
2008년 1월, 세계 최대의 인슐린 제조업체인 Novo Nordisk도 AERx iDMS가 인슐린 시스템을 흡입한 것으로 알려진 이 회사 자체의 흡입성 인슐린 버전에 대한 모든 추가 개발을 중단한다고 발표했다.[77] 마찬가지로, Eli Lilly와 Company는 2008년 3월에 흡입된 공기 인슐린을 개발하기 위한 노력을 끝냈다.[78] 그러나 MannKind 코퍼레이션(주요 소유주인 Alfred E. Mann)은 여전히 이 개념을 낙관하고 있다.[79]
경피
인슐린의 경피 전달에는 몇 가지 방법이 있다. 맥동성 인슐린은 췌장에 의한 인슐린의 생리학적 분비물을 흉내내면서 마이크로제트를 사용하여 인슐린을 사람에게 맥박이 뛴다.[80] 제트기 주사는 바늘 주사에 비해 인슐린 전달 피크와 지속시간이 달랐다. 일부 당뇨병 환자들은 피하 주사보다 제트 주사기를 선호할 수 있다.[81]
이온토포리스와[82] 초음파를 이용한 전기 모두 일시적으로 다공성 피부를 만드는 것으로 밝혀졌다. 인슐린 투여 측면은 실험적인 측면으로 남아 있지만, '잘못된 기기'의 혈당 검사 측면은 상업적으로 이용할 수 있다.
연구진이 피부를 통해 혈당 수치를 검사하고 피부의 모공을 통해 인슐린을 교정하는 시계 같은 장치를 개발했다. 비슷한 장치가 있지만 피부를 관통하는 "미크론들"에 의존하는 것은 2015년 동물 실험 단계에 있었다.[83]
인트라나살
인슐린 내 인슐린이 조사되고 있다.[84] 위험에 처한 아동과 청소년에서 인슐린이 제1형 당뇨병의 발병을 지연시키거나 예방할 수 있는지를 판단하는 무작위 통제 실험은 2016년에 결과가 나올 것으로 예상된다.[85]
입으로
입가에 의한 저혈당제의 기본적인 매력은 대부분의 사람들이 주사보다 알약이나 구강 액체를 선호한다는 것이다. 그러나 인슐린은 펩타이드 호르몬으로 위와 내장에서 소화되며 혈당 조절에 효과적이기 위해 현재 형태로는 구강으로 복용할 수 없다.
경구형 인슐린의 잠재적 시장은 어마어마할 것으로 추정되므로, 많은 연구소는 혈당에 측정 가능한 효과를 내기 위해 내장에서 포탈맥으로 온전한 인슐린을 충분히 이동하는 방법을 고안하려고 시도했다.[86]
현재 구강 이용 가능한 인슐린을 개발하기 위한 시도로 많은 파생화 및 제형 전략이 추진되고 있다.[87] 이러한 접근법들 중 많은 것들이 나노입자 전달 시스템을[88][89][90] 채택하고 있으며 몇몇은 임상시험에서 시험되고 있다.[91][92][93]
췌장 이식
또 다른 개선점은 정기적인 인슐린 투여를 피하기 위해 췌장이나 베타 세포를 이식하는 것이다. 이렇게 되면 자가 조절 인슐린 공급원이 된다. 췌장 전체를 (개별 장기로서) 이식하는 것은 어렵고 상대적으로 드물다. 간이나 신장 이식과 연계해 시행하는 경우가 많지만, 스스로 할 수 있다. 췌장 베타세포만 이식하는 것도 가능하다. 그러나 섬 이식은 수년간 실험성이 높았지만 캐나다 앨버타의 일부 연구자들은 초기 성공률(한 그룹에서 약 90%)이 높은 기술을 개발했다. 섬세포이식수술을 받은 사람의 거의 절반이 수술 후 1년 후 인슐린에 걸리지 않았으며, 2년차 말에는 7명 중 1명으로 줄었다. 그러나 시카고 일리노이대(UIC) 연구진은 섬세포 이식을 위한 에드먼턴 프로토콜 절차를 약간 수정하고 당뇨병 환자들에게 인슐린 독립성을 달성해 췌장 섬세포가 적지만 더 잘 기능하고 있다.[94] 그것이 인슐린 독립율을 향상시키는지 여부를 검증하기 위해서는 장기적인 연구가 필요하다.
베타 세포 이식은 가까운 미래에 실용화될 수도 있다. 또한, 일부 연구자들은 인슐린을 분비하기 위해 유전적으로 조작된 비베타 세포를 이식할 가능성을 연구했다.[95] 임상적으로 테스트할 수 있는 결과는 현재 실현과는 거리가 멀다. 연구실에서 자동 인슐린 전달을 위한 몇 가지 비이식적 방법이 개발되고 있지만, 임상적 승인에 가까운 방법은 없다.
참조
- ^ "Humulin S (Soluble) 100IU/ml solution for injection in cartridge - Summary of Product Characteristics (SmPC)". (emc). Retrieved 4 September 2020.
- ^ Harding MM, Hodgkin DC, Kennedy AF, O'Conor A, Weitzmann PD (March 1966). "The crystal structure of insulin. II. An investigation of rhombohedral zinc insulin crystals and a report of other crystalline forms". Journal of Molecular Biology. 16 (1): 212–26. doi:10.1016/S0022-2836(66)80274-7. PMID 5917731.
- ^ Abel JJ (February 1926). "Crystalline Insulin". Proceedings of the National Academy of Sciences of the United States of America. 12 (2): 132–6. Bibcode:1926PNAS...12..132A. doi:10.1073/pnas.12.2.132. PMC 1084434. PMID 16587069.
- ^ a b c d e f g h American Society of Health-System Pharmacists. "Insulin Human". www.drugs.com. Archived from the original on 22 October 2016. Retrieved 1 January 2017.
- ^ Mahoney BA, Smith WA, Lo DS, Tsoi K, Tonelli M, Clase CM (April 2005). "Emergency interventions for hyperkalaemia". The Cochrane Database of Systematic Reviews (2): CD003235. doi:10.1002/14651858.CD003235.pub2. PMC 6457842. PMID 15846652.
- ^ a b c British national formulary: BNF 69 (69 ed.). British Medical Association. 2015. pp. 464–472. ISBN 9780857111562.
- ^ a b "Frederick Banting, Charles Best, James Collip, and John Macleod". Science History Institute. June 2016. Retrieved 22 August 2018.
- ^ Fleishman JL, Kohler JS, Schindler S (2009). Casebook for The Foundation a Great American Secret. New York: PublicAffairs. p. 22. ISBN 978-0-7867-3425-2. Archived from the original on 2017-01-18.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ "The Top 300 of 2020". ClinCalc. Retrieved 11 April 2020.
- ^ "Insulin Human - Drug Usage Statistics". ClinCalc. 23 December 2019. Retrieved 11 April 2020.
- ^ Jones K (March 2000). "Insulin coma therapy in schizophrenia". Journal of the Royal Society of Medicine. 93 (3): 147–9. doi:10.1177/014107680009300313. PMC 1297956. PMID 10741319.
- ^ Ghazavi MK, Johnston GA (May–Jun 2011). "Insulin allergy". Clinics in Dermatology. 29 (3): 300–5. doi:10.1016/j.clindermatol.2010.11.009. PMID 21496738.
- ^ Ip, Ken Hiu-Kan; Koch, Karen; Lamont, Duncan (17 August 2020). "Cutaneous amyloidoma secondary to repeated insulin injections". Postgraduate Medical Journal. 97 (1149): postgradmedj–2020–138428. doi:10.1136/postgradmedj-2020-138428. PMID 32817579. S2CID 221221349.
- ^ Takiya L, Dougherty T. "Pharmacist's Guide to Insulin Preparations: A Comprehensive Review". Pharmacy Times. Archived from the original on 15 July 2011. Retrieved 2 August 2010.
- ^ a b Nasrallah SN, Reynolds LR (1 April 2012). "Insulin Degludec, The New Generation Basal Insulin or Just another Basal Insulin?". Clinical Medicine Insights. Endocrinology and Diabetes. 5: 31–7. doi:10.4137/CMED.S9494. PMC 3411522. PMID 22879797.
- ^ a b c Galdo JA, Thurston MM, Bourg CA (April 2014). "Clinical Considerations for Insulin Pharmacotherapy in Ambulatory Care, Part One: Introduction and Review of Current Products and Guidelines". Clinical Diabetes. 32 (2): 66–75. doi:10.2337/diaclin.32.2.66. PMC 4485243. PMID 26130864.
- ^ Papatheodorou I, Petrovs R, Thornton JM (November 2014). "Comparison of the mammalian insulin signalling pathway to invertebrates in the context of FOXO-mediated ageing". Bioinformatics. 30 (21): 2999–3003. doi:10.1093/bioinformatics/btu493. PMC 4201157. PMID 25064569.
- ^ "Insulin Basics". American Diabetes Association. Retrieved 22 August 2018.
- ^ McCall AL (March 2012). "Insulin therapy and hypoglycemia". Endocrinology and Metabolism Clinics of North America. 41 (1): 57–87. doi:10.1016/j.ecl.2012.03.001. PMC 4265808. PMID 22575407.
- ^ Davidson MB (July 2015). "Insulin Therapy: A Personal Approach". Clinical Diabetes. 33 (3): 123–35. doi:10.2337/diaclin.33.3.123. PMC 4503941. PMID 26203205.
- ^ Wendt, Diane (November 1, 2013). "Two tons of pig parts: Making insulin in the 1920s". National Museum of American History. Retrieved 22 August 2018.
- ^ Kehoe, John A. (1989). "The story of biosynthetic human insulin". In Sikdar, Subhas K.; Bier, Milan; Todd, Paul W. (eds.). Frontiers in Bioprocesssing. Boca Raton, FL: CRC Press. ISBN 9780849358395. Retrieved 22 August 2018.
- ^ a b c Crasto, Winston; Jarvis, Janet; Davies, Melanie (September 9, 2016). "Chapter 2 Existing insulin therapies". Handbook of Insulin Therapies. Springer. pp. 15–18. ISBN 9783319109398. Retrieved 22 August 2018.
- ^ Altman, Lawrence K. (October 30, 1982). "A New Insulin Given Approval For Use In U.S." The New York Times. Retrieved 23 August 2018.
- ^ Bowden, Mary Ellen (2018). "Old Brew, New Brew". Distillations. Science History Institute. 4 (2): 8–11. Retrieved August 21, 2018.
- ^ 노볼로그 환자 리플릿
- ^ Diabetes Atlas (2nd ed.). Brussels: International Diabetes Federation. 2004. Archived from the original on 2012-08-03.
- ^ Paul Brown (March 9, 1999). "Diabetics not told of insulin risk". Guardian. Archived from the original on February 4, 2017.
- ^ "Position Statement". Brussels: International Diabetes Federation. March 2005. Archived from the original on 2009-05-04.
- ^ "Overview". Vetsulin-Veterinary. Archived from the original on 2010-01-21.
- ^ a b c American Diabetes Association (20 December 2019). "Pharmacologic Approaches to Glycemic Treatment". Diabetes Care. 43 (Supplement 1): S98–S110. doi:10.2337/dc20-S009. PMID 31862752.
- ^ American Diabetes Association (20 December 2019). "Diabetes Technology: Standards of Medical Care in Diabetes—2020". Diabetes Care. 43 (Supplement 1): S77–S88. doi:10.2337/dc20-S007. PMID 31862750.
- ^ Sorli C (July 2014). "Identifying and meeting the challenges of insulin therapy in type 2 diabetes". Journal of Multidisciplinary Healthcare. 7: 267–82. doi:10.2147/JMDH.S64084. PMC 4086769. PMID 25061317.
- ^ Richter B, Neises G (January 2005). "'Human' insulin versus animal insulin in people with diabetes mellitus". The Cochrane Database of Systematic Reviews. 2010 (1): CD003816. doi:10.1002/14651858.CD003816.pub2. PMC 8406912. PMID 15674916.
- ^ IQwiG (German Institute for Quality and Efficiency in Health Care) (6 June 2007). "Rapid-acting insulin analogues in the treatment of diabetes mellitus type 1: Superiority Not Proven". Archived from the original on 19 July 2011. Retrieved 2 August 2010.
- ^ Banerjee S, Tran K, Li H, Cimon K, Daneman D, Simpson S, Campbell K (March 2007). "Short-acting insulin analogues for diabetes mellitus: meta-analysis of clinical outcomes and assessment of cost effectiveness". Canadian Agency for Drugs and Technologies in Health. 87: 1–55.
- ^ "Biodel Inc. Announces VIAject(TM) Data at Oral Presentation at the American Diabetes Association Meeting" (PDF). Archived from the original (PDF) on 2008-10-31.
- ^ "FDA Accepts VIAject NDA for Review". Archived from the original on 2011-08-06.
- ^ "Early definitions of a unit of insulin were based on a rabbit's physiological response. – Treating Diabetes". Treating Diabetes. Archived from the original on 8 September 2017. Retrieved 18 June 2017.
- ^ "Mission statement". WHO Expert Committee on Biological Standardization. Archived from the original on 2012-01-27.
- ^ Scheiner G, Boyer BA (July 2005). "Characteristics of basal insulin requirements by age and gender in Type-1 diabetes patients using insulin pump therapy". Diabetes Research and Clinical Practice. 69 (1): 14–21. doi:10.1016/j.diabres.2004.11.005. PMID 15955383.
- ^ Joslin EP (1934). A Diabetic Manual for the Mutual Use of Doctor and Patient. Philadelphia, PA: Lea & Febiger. pp. 108.
- ^ a b Munshi MN, Florez H, Huang ES, Kalyani RR, Mupanomunda M, Pandya N, Swift CS, Taveira TH, Haas LB (February 2016). "Management of Diabetes in Long-term Care and Skilled Nursing Facilities: A Position Statement of the American Diabetes Association". Diabetes Care. 39 (2): 308–18. doi:10.2337/dc15-2512. PMC 5317234. PMID 26798150.
- ^ McDonnell ME, Umpierrez GE (March 2012). "Insulin therapy for the management of hyperglycemia in hospitalized patients". Endocrinology and Metabolism Clinics of North America. 41 (1): 175–201. doi:10.1016/j.ecl.2012.01.001. PMC 3738170. PMID 22575413.
- ^ Corsino L, Dhatariya K, Umpierrez G (2000). "Management of Diabetes and Hyperglycemia in Hospitalized Patients". In De Groot LJ, Chrousos G, Dungan K, Feingold KR, Grossman A, Hershman JM, Koch C, Korbonits M, McLachlan R, New M, Purnell J, Rebar R, Singer F, Vinik A (eds.). Endotext. South Dartmouth (MA): MDText.com, Inc. PMID 25905318.
- ^ Zaman Huri H, Permalu V, Vethakkan SR (2 September 2014). "Sliding-scale versus basal-bolus insulin in the management of severe or acute hyperglycemia in type 2 diabetes patients: a retrospective study". PLOS ONE. 9 (9): e106505. Bibcode:2014PLoSO...9j6505Z. doi:10.1371/journal.pone.0106505. PMC 4152280. PMID 25181406.
- ^ Umpierrez GE, Palacio A, Smiley D (July 2007). "Sliding scale insulin use: myth or insanity?". The American Journal of Medicine. 120 (7): 563–7. doi:10.1016/j.amjmed.2006.05.070. PMID 17602924.
- ^ Hirsch IB (January 2009). "Sliding scale insulin—time to stop sliding" (PDF). JAMA. 301 (2): 213–4. doi:10.1001/jama.2008.943. PMID 19141770.
- ^ a b AMDA – The Society for Post-Acute and Long-Term Care Medicine (February 2014), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, AMDA – The Society for Post-Acute and Long-Term Care Medicine, archived from the original on 13 September 2014, retrieved 10 February 2013, 다음 중 하나를 인용한다.
- American Geriatrics Society 2012 Beers Criteria Update Expert Panel (April 2012). "American Geriatrics Society updated Beers Criteria for potentially inappropriate medication use in older adults". Journal of the American Geriatrics Society. 60 (4): 616–31. doi:10.1111/j.1532-5415.2012.03923.x. PMC 3571677. PMID 22376048.
- American Medical Directors Association (2010). "National Guideline Clearinghouse Diabetes management in the long term care setting". guideline.gov. Archived from the original on 20 August 2014. Retrieved 11 September 2014.
- Pandya N, Thompson S, Sambamoorthi U (November 2008). "The prevalence and persistence of sliding scale insulin use among newly admitted elderly nursing home residents with diabetes mellitus". Journal of the American Medical Directors Association. 9 (9): 663–9. doi:10.1016/j.jamda.2008.06.003. PMID 18992699.
- ^ a b Klein-Schwartz W, Stassinos GL, Isbister GK (March 2016). "Treatment of sulfonylurea and insulin overdose". British Journal of Clinical Pharmacology. 81 (3): 496–504. doi:10.1111/bcp.12822. PMC 4767194. PMID 26551662.
- ^ De León DD, Stanley CA (December 2013). "Determination of insulin for the diagnosis of hyperinsulinemic hypoglycemia". Best Practice & Research. Clinical Endocrinology & Metabolism. 27 (6): 763–9. doi:10.1016/j.beem.2013.06.005. PMC 4141553. PMID 24275188.
- ^ Thomas A, Thevis M, Delahaut P, Bosseloir A, Schänzer W (March 2007). "Mass spectrometric identification of degradation products of insulin and its long-acting analogues in human urine for doping control purposes". Analytical Chemistry. 79 (6): 2518–24. doi:10.1021/ac062037t. PMID 17300174.
- ^ Dotinga, Randy (August 24, 2001). "Athletes Turn to Insulin to Boost Performance Experts warn of danger to non-diabetics". HealthDayNews. Retrieved 22 August 2018.
- ^ Sonksen, P. (1 July 2001). "Insulin, growth hormone and sport". Journal of Endocrinology. 170 (1): 13–25. doi:10.1677/joe.0.1700013. PMID 11431133.
- ^ a b Evans, P J (1 August 2003). "Insulin as a drug of abuse in body building". British Journal of Sports Medicine. 37 (4): 356–357. doi:10.1136/bjsm.37.4.356. PMC 1724679. PMID 12893725.
- ^ Kakutani, Michiko (March 23, 2006). "Barry Bonds and Baseball's Steroids Scandal By". The New York Times. Retrieved 22 August 2018.
- ^ "Barry Bonds steroids timeline". ESPN.com. Dec 7, 2007. Retrieved 22 August 2018.
- ^ Holt RI, Sönksen PH (June 2008). "Growth hormone, IGF-I and insulin and their abuse in sport". British Journal of Pharmacology. 154 (3): 542–56. doi:10.1038/bjp.2008.99. PMC 2439509. PMID 18376417.
- ^ Reitman, Valerie (September 8, 2003). "Bodybuilders and insulin Some weightlifters are using the hormone to gain muscle, a practice that poses serious risks, doctors warn". Los Angeles Times. Retrieved 22 August 2018.
- ^ Crosbie, Jack (November 21, 2017). "35-Year-Old Bodybuilder's Sudden Death Raises Questions About Insulin Use Ghent Wakefield was an aspiring WWE wrestler". Men's Health. Retrieved 22 August 2018.
- ^ R. 바젤트, 인간 독성 약물 및 화학 물질 처리, 제8판, 생물 의학 간행물, 포스터 시티, CA, 2008, 페이지 775–779.
- ^ a b Scheen AJ, Castillo MJ, Lefèbvre PJ (1993). "Combination of oral antidiabetic drugs and insulin in the treatment of non-insulin-dependent diabetes". Acta Clinica Belgica. 48 (4): 259–68. doi:10.1080/17843286.1993.11718317. PMID 8212978.
- ^ "Recherche sur le rôle du pancréas dans l'assimilation nutritive The Discovery and Early Development of Insulin". insulin.library.utoronto.ca. Retrieved 26 March 2020.
- ^ Banting, Frederick G. (May 17–29, 1922). "Chart for James Havens". University of Toronto Libraries.
- ^ Woodbury, David Oakes (February 1963). "Please save my son!". University of Toronto Libraries.
- ^ Banting, Frederick G. (August 16, 1922). "Chart for Elizabeth Hughes". University of Toronto Libraries.
- ^ Zuger A (October 4, 2010). "Rediscovering the First Miracle Drug". New York Times. Archived from the original on December 16, 2014. Retrieved 2010-10-06.
- ^ University of Toronto Libraries (1923). "Miss Collier's recovery". University of Toronto Libraries.
- ^ Luo J, Avorn J, Kesselheim AS (October 2015). "Trends in Medicaid Reimbursements for Insulin From 1991 Through 2014". JAMA Internal Medicine. 175 (10): 1681–6. doi:10.1001/jamainternmed.2015.4338. PMID 26301721.
- ^ a b c Thomas, Katie (30 January 2017). "Drug Makers Accused of Fixing Prices on Insulin". The New York Times. Archived from the original on 8 September 2017. Retrieved 2 February 2017.
- ^ Abutaleb, Yasmeen (January 30, 2019). "U.S. lawmakers request info from insulin makers on rising prices". Reuters. Retrieved February 1, 2019.
- ^ "Here's Why Insulin and Other Drugs Are Cheaper in Canada". 28 July 2019.
- ^ "FDA approval of Exubera inhaled insulin". Archived from the original on 2008-12-26.
- ^ a b NICE (June 21, 2006). "Diabetes (type 1 and 2), Inhaled Insulin – Appraisal Consultation Document (second)". Archived from the original on July 7, 2006. Retrieved 2006-07-26.
- ^ Cefalu WT, Skyler JS, Kourides IA, Landschulz WH, Balagtas CC, Cheng S, Gelfand RA (February 2001). "Inhaled human insulin treatment in patients with type 2 diabetes mellitus". Annals of Internal Medicine. 134 (3): 203–7. doi:10.7326/0003-4819-134-3-200102060-00011. PMID 11177333. S2CID 25294223.
- ^ "Novo Nordisk refocuses its activities within inhaled insulin and discontinues the development of AERx". 14 January 2008. Archived from the original on 7 September 2012.
- ^ "Lilly Ends Effort to Develop an Inhaled Insulin Product". The New York Times. 8 March 2008.
- ^ Pollack A (16 November 2007). "Betting an Estate on Inhaled Insulin". The New York Times.
- ^ Arora A, Hakim I, Baxter J, Rathnasingham R, Srinivasan R, Fletcher DA, Mitragotri S (March 2007). "Needle-free delivery of macromolecules across the skin by nanoliter-volume pulsed microjets". Proceedings of the National Academy of Sciences of the United States of America. 104 (11): 4255–60. Bibcode:2007PNAS..104.4255A. doi:10.1073/pnas.0700182104. PMC 1838589. PMID 17360511.
- ^ Guo L, Xiao X, Sun X, Qi C (January 2017). "Comparison of jet injector and insulin pen in controlling plasma glucose and insulin concentrations in type 2 diabetic patients". Medicine. 96 (1): e5482. doi:10.1097/MD.0000000000005482. PMC 5228650. PMID 28072690.
- ^ Dixit N, Bali V, Baboota S, Ahuja A, Ali J (January 2007). "Iontophoresis - an approach for controlled drug delivery: a review". Current Drug Delivery. 4 (1): 1–10. doi:10.2174/156720107779314802. PMID 17269912.
- ^ Yu J, Zhang Y, Ye Y, DiSanto R, Sun W, Ranson D, Ligler FS, Buse JB, Gu Z (July 2015). "Microneedle-array patches loaded with hypoxia-sensitive vesicles provide fast glucose-responsive insulin delivery". Proceedings of the National Academy of Sciences of the United States of America. 112 (27): 8260–5. Bibcode:2015PNAS..112.8260Y. doi:10.1073/pnas.1505405112. PMC 4500284. PMID 26100900. Lay summary – ALN (24 June 2015).

- ^ Lalej-Bennis D, Boillot J, Bardin C, Zirinis P, Coste A, Escudier E, Chast F, Peynegre R, Selam JL, Slama G (August 2001). "Efficacy and tolerance of intranasal insulin administered during 4 months in severely hyperglycaemic Type 2 diabetic patients with oral drug failure: a cross-over study". Diabetic Medicine. 18 (8): 614–8. doi:10.1046/j.1464-5491.2001.00528.x. PMID 11553197. S2CID 26629144.
- ^ Wherrett DK (August 2014). "Trials in the prevention of type 1 diabetes: current and future". Canadian Journal of Diabetes. 38 (4): 279–84. doi:10.1016/j.jcjd.2014.05.004. PMC 4133140. PMID 25092646.
- ^ "Oral Insulin – Fact or Fiction? – Resonance – May 2003". Archived from the original on 2007-09-09. Retrieved 2007-09-23.
- ^ Kalra S, Kalra B, Agrawal N (November 2010). "Oral insulin". Diabetology & Metabolic Syndrome. 2: 66. doi:10.1186/1758-5996-2-66. PMC 2987915. PMID 21059246.
- ^ Card JW, Magnuson BA (December 2011). "A review of the efficacy and safety of nanoparticle-based oral insulin delivery systems". American Journal of Physiology. Gastrointestinal and Liver Physiology. 301 (6): G956–G967. doi:10.1152/ajpgi.00107.2011. PMID 21921287.
- ^ Chen MC, Sonaje K, Chen KJ, Sung HW (December 2011). "A review of the prospects for polymeric nanoparticle platforms in oral insulin delivery". Biomaterials. 32 (36): 9826–38. doi:10.1016/j.biomaterials.2011.08.087. PMID 21925726.
- ^ Fonte P, Araújo F, Reis S, Sarmento B (March 2013). "Oral insulin delivery: how far are we?". Journal of Diabetes Science and Technology. 7 (2): 520–31. doi:10.1177/193229681300700228. PMC 3737653. PMID 23567010.
- ^ Iyer H, Khedkar A, Verma M (March 2010). "Oral insulin - a review of current status". Diabetes, Obesity & Metabolism. 12 (3): 179–85. doi:10.1111/j.1463-1326.2009.01150.x. PMID 20151994. S2CID 24632760.
- ^ Pozzilli P, Raskin P, Parkin CG (February 2010). "Review of clinical trials: update on oral insulin spray formulation". Diabetes, Obesity & Metabolism. 12 (2): 91–6. doi:10.1111/j.1463-1326.2009.01127.x. PMID 19889002. S2CID 36965357.
- ^ "First Oral Insulin For Diabetics Takes Major Step Towards FDA Approval". Oramed.com. May 16, 2018. Retrieved 23 August 2018.
- ^ Gangemi A, Salehi P, Hatipoglu B, Martellotto J, Barbaro B, Kuechle JB, Qi M, Wang Y, Pallan P, Owens C, Bui J, West D, Kaplan B, Benedetti E, Oberholzer J (June 2008). "Islet transplantation for brittle type 1 diabetes: the UIC protocol". American Journal of Transplantation. 8 (6): 1250–61. doi:10.1111/j.1600-6143.2008.02234.x. PMID 18444920.
- ^ Zhu YL, Abdo A, Gesmonde JF, Zawalich KC, Zawalich W, Dannies PS (August 2004). "Aggregation and lack of secretion of most newly synthesized proinsulin in non-beta-cell lines". Endocrinology. 145 (8): 3840–9. doi:10.1210/en.2003-1512. PMID 15117881.
외부 링크
- "Insulin". Drug Information Portal. U.S. National Library of Medicine.
- "Insulin regular". Drug Information Portal. U.S. National Library of Medicine.
- "Insulin [Injection], biphasic". Drug Information Portal. U.S. National Library of Medicine.