다파글리플로진
Dapagliflozin | |||
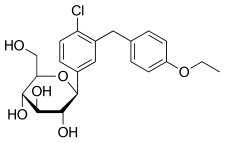 하워스 투영(하단) | |||
| |||
| 임상자료 | |||
|---|---|---|---|
| 발음 | /ˌd æp əɡ플로 ʊz ɪn/ DAP- ə-글리프-LOH-진 | ||
| 상호 | 포시가, 파시가, 에디스트라이드 등 | ||
| 기타이름 | BMS-512148; (1S)-1,5-안하이드로-1-C-{4-클로로-3-[(4-에톡시페닐)메틸]페닐}-D-글루시톨 | ||
| AHFS/Drugs.com | 모노그래프 | ||
| 라이센스 데이터 | |||
| 임신 카테고리 |
| ||
| 경로 행정부. | 입으로(태블릿) | ||
| 드럭 클래스 | SGLT2(Sodium-Glucose co-transporter 2) 억제제 | ||
| ATC코드 | |||
| 법적지위 | |||
| 법적지위 | |||
| 약동학적 자료 | |||
| 생체이용률 | 78%(10mg 투여 후) | ||
| 단백질결합 | ~91% | ||
| 신진대사 | UGT1A9(주), CYP(주)(부) | ||
| 대사산물 | 다파글리플로진 3-O-글루쿠로니드(비활성) | ||
| 제거 반감기 | ~12.9시간 | ||
| 배설 | 소변(75%), 대변(21%)[2] | ||
| 식별자 | |||
| |||
| CAS 번호 | |||
| 펍켐 CID | |||
| IUPHAR/BPS | |||
| 드럭뱅크 | |||
| 켐스파이더 | |||
| 유니아이 | |||
| 케그 | |||
| ChEBI | |||
| 쳄블 | |||
| CompTox 대시보드 (EPA) | |||
| ECHA 인포카드 | 100.167.331 | ||
| 화학 및 물리 데이터 | |||
| 공식 | C21H25ClO6 | ||
| 어금니 질량 | 408.88g·mol−1 | ||
| 3D 모델(JSMO) | |||
| |||
| |||
Farxiga(미국), Forxiga(유럽연합) 등의 상표명으로 판매되는 다파글리플로진은 제2형 당뇨병 치료에 사용되는 약물입니다.[2][3][5]그것은 또한 심부전과 만성 신장 질환을 가진 어른들을 치료하는데 사용됩니다.[6][7][3]
일반적인 부작용으로는 저혈당(저혈당), 요로 감염, 생식기 감염, 부피 고갈(몸속 수분 감소) 등이 있습니다.[8]당뇨병성 케톤산증은 제1형 당뇨병 환자에서 흔히 발생하는 부작용입니다.[9]심각하지만 드문 부작용으로는 포니어 괴저가 있습니다.[10]다파글리플로진은 SGLT-2(Sodium-Glucose co-transporter-2) 억제제로 소변과 함께 체내의 당분을 제거하여 작용합니다.[2]
브리스톨-마이어스 스퀴브가 아스트라제네카와 손잡고 개발했습니다.그것은 세계보건기구의 필수 의약품 목록에 올라있습니다.[11]2020년에는 2백만 건 이상의 처방을 받아 미국에서 217번째로 많이 처방된 약물이었습니다.[12][13]다파글리플로진은 일반의약품으로 판매되고 있습니다.
의료용
다파글리플로진은 식이, 운동, 그리고 보통 다른 포도당 강하제와 함께 제2형 당뇨병을 가진 성인의 혈당 조절을 개선하고, 제2형 당뇨병과 알려진 심혈관 질환 또는 다른 심혈관 위험 인자(고혈중 pr 포함)를 가진 성인의 심부전 입원 위험을 줄이기 위해 사용됩니다.고콜레스테롤, 흡연자).Dapagliflozin은 다른 SGLT2 억제제와 더불어 비당뇨병 및 제2형 당뇨병 성인의 신장 기능 저하 및 신부전 비율을 감소시키는 것으로 나타났습니다.[14][15]다파글리플로진은 LVEF가 40%[16] 미만인 제2형 당뇨병과 심부전이 있는 사람들에게도 선택 사항으로 고려됩니다.현재 당뇨병 상태와 관계없이 표준적인 의학적 치료와 함께 투여할 수 있습니다.최근 연구에 따르면 다파글리플로진과 엠파글리플로진과 같은 SGLT-2 억제제 부류의 다른 약물을 사용하면 HF가 악화되거나 CVD로 인한 사망 및 입원 위험을 줄일 수 있다고 합니다.[16][17]모든 SGLT-2 억제제는 죽상경화성 심혈관 질환자의 심부전 입원 위험을 감소시키는 데 유용하지만, 소수의 메타 분석 및 코호트 연구에서 다파글리플로진이 엠파글리플로진과 같은 다른 것보다 우수한 것으로 나타났습니다.[18][19][20]
또한 다파글리플로진은 심부전으로 인한 심혈관계 사망과 심부전으로 인한 입원의 위험을 줄이기 위해 박출률이 감소된 심부전 성인의 치료를 위해 사용됩니다.[6][7][3]
유럽 연합에서는 성인으로 표시됩니다.
2021년 11월, 유럽의약품청(EMA)은 다파글리플로진을 제1형 당뇨병 치료에 더 이상 사용해서는 안 된다고 발표했습니다.[5]
비당뇨기 만성 콩팥병에 미치는 영향
2021년 미국 식품의약국(FDA)과 EMA는 다파글리플로진의 적응증을 확장하여 만성 콩팥병(CKD)을 가진 비당뇨병 환자의 치료를 포함하였으며,[24][25] 임상시험에서 다음과 같은 효과를 나타냈습니다.
DIAMOND 시험(2017-2019)에서는 치료 기간 6주 동안 소변 내 과잉 단백질의 개선이 없었으며(단백뇨), 신장 여과율의 현저한 저하(다파글리플로진 중단 후 6주 이내에 가역적), 체중 1.5 kg의 상당한 평균 감소를 보였습니다.[26][27]
DAPA-CKD 시험(2017-2020)은 ACE 또는 ARB 치료를 이미 받은 환자의 평균 치료 기간 2.4년에서 신장 여과율이 지속적으로 감소하거나 신부전 또는 사망하는 사건이 위약군보다 약 8개월 늦게 치료군에서 통계적으로 발생했음을 보여주었습니다.그러나 치료 초기 12-16개월 동안 신장의 여과율은 위약군보다 치료군에서 더 나빴고, 그 후에만 위약군보다 치료군에서 약간 덜 음성이었습니다.[14][27]
역효과
다파글리플로진은 무거운 당뇨를 초래하기 때문에 (때로는 하루에 약 70그램까지) 급격한 체중 감소와 피로로 이어질 수 있습니다.포도당은 삼투성 이뇨제의 역할을 하며 (이 효과는 당뇨병에서 다뇨의 원인이 됨) 탈수증으로 이어질 수 있습니다.소변에 있는 포도당의 증가는 당뇨병과 관련된 감염, 특히 요로 감염과 진창을 악화시킬 수 있습니다.드물게, 다파글리플로진을 포함한 SGLT2 약물의 사용은 Fournier gangrene이라고도 불리는 회음부 괴사성 근막염과 관련이 있습니다.[28]
다파글리플로진은 저혈압 반응과도 관련이 있습니다.당뇨병성 케톤산증의 위험을 증가시킬 수 있다는 우려가 있습니다.[29]2017년 메타분석에 따르면 다파글리플로진과 같은 SGLT-2 억제제는 II형 당뇨병 환자에서 당뇨병성 케톤산증 발생 증가와 통계적으로 상관관계가 없는 것으로 나타났습니다.[30]그러나 DRACT-1 및 DRACT-2 실험에서 다파글리플로진이 다파글리플로진을 투여받은 I형 당뇨병 환자에서 추가적인 당뇨병 케톤산증 발생을 유발하는 것으로 나타났습니다.[31]
다파글리플로진은 탈수, 심각한 요로 감염, 생식기 효모 감염을 유발할 수 있습니다.[6]고령자, 신장 질환자, 저혈압자, 이뇨제 복용자 등은 용적 상태와 신장 기능을 평가해야 합니다.[6]대사성 산증이나 케톤산증(혈액 내 산 축적)의 징후와 증상이 있는 사람도 진단해야 합니다.[6]다파글리플로진은 인슐린과 결합했을 때 당뇨병과 저혈당을 가진 사람들에게 회음부근막염의 심각한 사례를 일으킬 수 있습니다.[6]
FDA는 수술 후 케톤산증(신체가 케톤이라고 불리는 높은 수준의 혈중 산을 생성하는 심각한 상태) 발생의 위험을 줄이기 위해 SGLT2 억제제 당뇨병 약의 처방 정보에 대한 변경을 승인하여 예정된 수술 전에 일시적으로 중단할 것을 권고했습니다.카나글리플로진, 다파글리플로진, 엠파글리플로진은 각각 최소 3일 전에, 에투글리플로진은 최소 4일 전에 중단해야 합니다.[32]
케톤산증의 증상으로는 메스꺼움, 구토, 복통, 피로, 호흡 곤란 등이 있습니다.[32]
다파글리플로진의 포도당 강하 효과는 신장 기능이 감소한 CKD 환자에서 감소하기 시작하며(eGFR <45mL/min) 혈당 조절에 효과적이지 않을 수 있습니다.그러나, 최근의 연구들이 신장 기능 저하를 감소시키는 것에 대한 재보호 효과를 보여주었기 때문에, 다파글리플로진은 당뇨병의 상태에 관계없이 신장 기능 저하를 감소시키는 데 여전히 사용될 수 있습니다.따라서, 다파글리플로진은 신장 기능 저하를 예방하기 위해 CKD를 가진 당뇨병 환자에서 사용될 수 있지만, 혈당 조절을 위해 추가적인 개입이 필요할 수 있습니다.[14][33]
화학
다파글리플록신의 최초 합성은 2002년 브리스톨 마이어스 스퀴브(Bristol Myers Squibb)가 출원한 특허에서 개시되었습니다.[34]
두 개의 주요 탄소 함유 단편은 아릴 리튬과 트리메틸실릴로 보호된 글루코놀락톤의 반응에 의해 결합됩니다.트리메틸실릴기는 메탄올에 메탄술폰산을 처리하여 제거됩니다.이는 아노머 중심부에 원치 않는 메톡시기를 갖는 중간체를 제공하며, 삼불화에테르산 붕소가 있는 상태에서 트리에틸실란과 반응하여 제거됩니다.이 경로와 의약품 제조를 위해 개발된 다른 경로가 검토되었습니다.[35]
작용기전
다파글리플로진은 신장에서 포도당 재흡수의 적어도 90%를 담당하는 나트륨-포도당 수송 단백질(SGLT2)의 아형 2를 억제합니다.이 수송 메커니즘을 차단하면 소변을 통해 혈당이 제거됩니다.[36]제2형 당뇨병과 정상적인 신장 기능이 부적절하게 조절된 환자에서 메트포르민 단독 요법에 비해 메트포르민과 함께 10 mg의 표준 치료 용량에서 다파글리플로진은 메트포르민과 함께 HbA1c를 0.54-0.84% 감소시켰습니다.[37][38][39]
심부전에서의 보호 효과는 주로 혈액역학적 효과에 기인하는데, 여기서 SGLT2 억제제는 삼투성 이뇨증과 자연증을 통해 혈관 내 부피를 잠재적으로 감소시킵니다.결과적으로 예압 및 후압이 감소하여 심장 작업량이 감소하고 좌심실 기능이 개선될 수 있습니다.[40]
선택성
SGLT2의 IC는50 SGLT1의 IC50(1.1 대 1390nmol/L)의 1,000분의 1 미만이므로 약물이 장내 포도당 흡수를 방해하지 않습니다.[41]
이름들
Dapagliflozin은 국제 비영리 명칭(INN)이고,[42] 미국 채택 명칭(USAN)입니다.[43]
다파글리플로진/메트포르민 확장-방출형 고정용량 조합 제품을 Xigduo XR이라고 합니다.[44][45][46]
2016년 7월, 삭사글립틴과 다파글립로진의 고정 용량 조합이 유럽 연합에서 의료용으로 승인되었으며 Qtern이라는 브랜드명으로 판매되고 있습니다.[47]이 복합제는 2017년 2월 미국에서 의료용 허가를 받았으며, Qtern이라는 브랜드로 판매되고 있습니다.[48][49]
2019년 5월, 다파글리플로진, 삭사글립틴, 메트포르민 하이드로클로라이드의 확장-방출 정제로서의 고정 용량 조합이 식이 및 운동과 병용할 경우 제2형 당뇨병 성인의 혈당 조절을 향상시키기 위해 미국에서 승인되었습니다.식약처,[50] 아스트라제네카에 Qternmet XR 허가이 복합의약품은 2019년 11월 유럽연합에서 사용 승인을 받았으며, Qtrilmet이라는 브랜드명으로 판매되고 있습니다.[51]
역사
2012년, EMA의 CHMP(Committee for Medical Products for Human Use)는 그 약에 대해 긍정적인 의견을 발표했습니다.[3]
Dapagliflozin은 2형 참가자들을 대상으로 한 여러 연구에서 효과가 있는 것으로 확인되었습니다.[3]유효성의 주요 척도는 혈당이 얼마나 잘 조절되는지를 나타내는 당화혈색소(HbA1c)의 수준이었습니다.[3]
제2형 당뇨병을 앓고 있는 840명의 참가자를 대상으로 한 두 연구에서, 단독으로 사용했을 때 다파글리플로진은 24주 후 위약(더미 치료)보다 HbA1c 수치를 0.66% 더 감소시켰습니다.[3]2,370명의 참가자를 대상으로 한 4개의 다른 연구에서 다파글리플로진을 다른 당뇨병 치료제에 추가하면 24주 후 위약을 추가하는 것보다 HbA1c 수치가 0.54–0.68% 더 감소했습니다.[3]
제2형 당뇨병을 가진 814명의 참가자를 대상으로 한 연구에서, 메트포르민과 함께 사용된 다파글리플로진은 메트포르민과 함께 사용된 설포닐우레아(당뇨병 치료제의 또 다른 종류)만큼 효과적이었습니다.[3]두 가지 조합 모두 52주 후 HbA1c 수치를 0.52% 감소시켰습니다.[3]
제2형 당뇨병을 앓고 있는 17,000명 이상의 참가자들이 참여한 한 장기 연구는 다파글리플로진이 심혈관 질환에 미치는 영향을 조사했습니다.[3]이 연구는 다파글리플로진의 효과가 SGLT2를 차단함으로써 효과가 있는 다른 당뇨병 약들의 효과와 일치한다는 것을 나타냈습니다.[3]
인슐린만으로 혈당이 충분히 조절되지 않는 1형 당뇨병 환자 1,648명을 대상으로 한 두 연구에서 다파글리플로진 5mg을 첨가하면 24시간 후 HbA1c 수치가 위약을 첨가하는 것보다 0.37%, 0.42% 더 감소했습니다.[3]
다파글리플로진은 2012년 11월 유럽연합에서 의료용으로 승인되었습니다.[3]유럽의 여러 나라에서 판매되고 있습니다.[52]
다파글리플로진은 2014년 1월 미국에서 의료용으로 승인되었습니다.[53][24]
2020년, 미국 FDA는 심혈관 사망 및 심부전 입원의 위험을 줄이기 위해 다파글리플로진의 적응증을 박출률이 감소된 심부전 성인에 대한 치료를 포함하도록 확대했습니다.[6]이것은 뉴욕 심장 협회의 기능적인 II-IV급 심부전을 가진 성인들을 박출률이 감소된 상태에서 치료하기 위해 승인된 이 특별한 약물 등급인 나트륨-글루코스 병용 수송 2 억제제 중 최초입니다.[6]
DAPA-HF와 DECELARE-TIMI 58 임상시험 결과, 박출률이 17% 감소한 심부전 성인의 생존율 향상에 위약 대비 다파글리플로진의 효과가 입증되었습니다.두 사람 모두 심부전, 심혈관계 사망, 모든 원인에 의한 사망률의 악화로 입원 건수가 감소한 것으로 나타났습니다.[54][55]
4,744명의 참가자를 대상으로 무작위로 이중맹검을 실시한 위약 대조 연구에서 다파글리플로진의 안전성과 효과를 평가했습니다.[6]참가자들의 평균 나이는 66세였고, 여성보다 남성(77%)이 더 많았습니다.[6]연구자들은 약의 효과를 알아보기 위해 심혈관계 사망, 심부전으로 인한 입원, 그리고 긴급한 심부전 방문의 발생 여부를 조사했습니다.[6]참가자들은 무작위로 다파글리플로진 10 mg 또는 위약(비활성 치료)을 하루에 한 번씩 투여받도록 배정되었습니다.[6]약 18개월 후, 다파글리플로진을 투여받은 사람들은 위약을 투여받은 사람들보다 심혈관계 사망, 심부전으로 인한 입원, 긴급한 심부전 방문이 적었습니다.[6]
2020년 7월 FDA는 아스트라제네카에 심장마비로 인한 성인의 심부전 또는 심혈관계 사망으로 인한 입원 위험을 줄이기 위해 다파글리플로진 개발에 대한 패스트트랙 지정을 승인했습니다.[56]
2020년 8월, 3상 DAPA-CKD 시험의 세부 결과에 따르면 관리 기준 위에 있는 다파글리플로진이 위약 대비 신장 기능 악화 또는 심혈관 또는 신장 사망 위험의 복합 측정치를 39% 감소시킨 것으로 보고되었습니다(p<0).0001) 만성 콩팥병 2-4기 및 요 알부민 배설량 상승 환자.결과는 제2형 당뇨병이 있는 환자와 없는 환자 모두에서 일치했습니다.[57]
FDA는 2021년 4월 질병 진행 위험이 있는 CKD 성인의 신장 기능 저하, 신부전, 심혈관계 사망, 심부전 입원 위험 감소 등으로 다파글리플로진의 적응증을 확대했습니다.[24]4,304명의 참가자를 대상으로 한 다중 센터 이중 맹검 연구에서 만성 신장 질환자의 신장 결과를 개선하고 심혈관 사망을 줄이기 위한 다파글리플로진의 효능을 평가했습니다.[24]
2023년 2월 EU는 좌심실 박출률(LVEF)[58][59]의 전체 스펙트럼에 걸친 심부전 환자를 대상으로 다파글리플로진을 확장 사용할 수 있도록 승인했습니다.
사회와 문화
법적지위
다파글리플로진의 제네릭 버전은 2022년 2월 미국 FDA 승인을 받았으나 2025년 10월까지 판매할 수 없습니다.[60][61][62]2023년 5월 캐나다에서 일반 버전이 승인되었습니다.[63]
2023년 1월 유럽의약품청(EMA)의 의약품위원회(CHMP)는 2012년 11월부터 EU에서 허가된 포르시가의 제네릭 버전에 대한 시판허가를 권고하며 긍정적인 의견을 채택했습니다.[64]다파글리플로진 비아트리스는 2023년 3월 유럽연합에서 의료용으로 승인되었습니다.[4]
조사.
체계적인 검토 결과 다파글리플로진은 HFrEF(즉, 울혈성 심부전) 및 당뇨병 환자의 심부전 입원, 심혈관 사망 및 모든 원인에 의한 사망률을 감소시켰습니다.[65]
참고문헌
- ^ "Dapagliflozin (Farxiga) Use During Pregnancy". Drugs.com. 30 August 2018. Archived from the original on 17 April 2021. Retrieved 5 May 2020.
- ^ a b c d "Farxiga- dapagliflozin tablet, film coated". DailyMed. National Institutes of Health, National Library of Medicine, U.S. Department of Health & Human Services. 3 February 2020. Archived from the original on 30 October 2020. Retrieved 5 May 2020.
- ^ a b c d e f g h i j k l m n o p q r s 이 출처인 © European Medicine Agency에서 텍스트를 복사했습니다.출처가 확인된 경우에는 복제가 승인됩니다.
- ^ a b "Dapagliflozin Viatris EPAR". European Medicines Agency. 4 April 2023. Retrieved 17 June 2023. 텍스트는 저작권이 있는 유럽의약품청(European Medicine Agency)의 출처에서 복사되었습니다.출처가 확인된 경우에는 복제가 승인됩니다.
- ^ a b "Forxiga (dapagliflozin) 5mg should no longer be used for the treatment of Type 1 Diabetes Mellitus". European Medicines Agency (EMA). 11 November 2021. Archived from the original on 11 November 2021. Retrieved 11 November 2021.
- ^ a b c d e f g h i j k l m "FDA approves new treatment for a type of heart failure". U.S. Food and Drug Administration (FDA) (Press release). 5 May 2020. Archived from the original on 6 May 2020. Retrieved 5 May 2020.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ a b National Institute for Health and Care Excellence (24 February 2021). "Dapagliflozin for treating chronic heart failure with reduced ejection fraction". NICE Technology Appraisal Auidance [TA679]. NICE. Archived from the original on 9 May 2021. Retrieved 9 May 2021.
- ^ Ptaszynska A, Johnsson KM, Parikh SJ, de Bruin TW, Apanovitch AM, List JF (October 2014). "Safety profile of dapagliflozin for type 2 diabetes: pooled analysis of clinical studies for overall safety and rare events". Drug Safety. 37 (10): 815–829. doi:10.1007/s40264-014-0213-4. PMID 25096959. S2CID 24064402.
- ^ Dandona P, Mathieu C, Phillip M, Hansen L, Tschöpe D, Thorén F, et al. (DEPICT-1 Investigators) (December 2018). "Efficacy and Safety of Dapagliflozin in Patients With Inadequately Controlled Type 1 Diabetes: The DEPICT-1 52-Week Study". Diabetes Care. 41 (12): 2552–2559. doi:10.2337/dc18-1087. PMID 30352894. S2CID 53027785.
- ^ Hu Y, Bai Z, Tang Y, Liu R, Zhao B, Gong J, Mei D (2020). "Fournier Gangrene Associated with Sodium-Glucose Cotransporter-2 Inhibitors: A Pharmacovigilance Study with Data from the U.S. FDA Adverse Event Reporting System". Journal of Diabetes Research. 2020: 3695101. doi:10.1155/2020/3695101. PMC 7368210. PMID 32695827.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ "The Top 300 of 2020". ClinCalc. Retrieved 7 October 2022.
- ^ "Dapagliflozin - Drug Usage Statistics". ClinCalc. Retrieved 7 October 2022.
- ^ a b c Heerspink HJ, Stefánsson BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF, et al. (October 2020). "Dapagliflozin in Patients with Chronic Kidney Disease". The New England Journal of Medicine. 383 (15): 1436–1446. doi:10.1056/NEJMoa2024816. PMID 32970396. S2CID 221887260.
- ^ Perkovic V, Jardine MJ, Neal B, Bompoint S, Heerspink HJ, Charytan DM, et al. (June 2019). "Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy". The New England Journal of Medicine. 380 (24): 2295–2306. doi:10.1056/NEJMoa1811744. hdl:1805/22369. PMID 30990260. S2CID 117730201.
- ^ a b McMurray JJ, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, et al. (November 2019). "Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction" (PDF). The New England Journal of Medicine. 381 (21): 1995–2008. doi:10.1056/NEJMoa1911303. PMID 31535829. S2CID 202687033.
- ^ Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. (October 2020). "Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure" (PDF). The New England Journal of Medicine. 383 (15): 1413–1424. doi:10.1056/NEJMoa2022190. PMID 32865377. S2CID 221383070.
- ^ Shi Z, Gao F, Liu W, He X (4 April 2022). "Comparative Efficacy of Dapagliflozin and Empagliflozin of a Fixed Dose in Heart Failure: A Network Meta-Analysis". Frontiers in Cardiovascular Medicine. 9: 869272. doi:10.3389/fcvm.2022.869272. PMC 9013819. PMID 35445086.
- ^ McGuire DK, Shih WJ, Cosentino F, Charbonnel B, Cherney DZ, Dagogo-Jack S, et al. (February 2021). "Association of SGLT2 Inhibitors With Cardiovascular and Kidney Outcomes in Patients With Type 2 Diabetes: A Meta-analysis". JAMA Cardiology. 6 (2): 148–158. doi:10.1001/jamacardio.2020.4511. PMC 7542529. PMID 33031522.
- ^ Zelniker TA, Wiviott SD, Raz I, Im K, Goodrich EL, Bonaca MP, et al. (January 2019). "SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials". Lancet. 393 (10166): 31–39. doi:10.1016/S0140-6736(18)32590-X. PMID 30424892. S2CID 53277899.
- ^ a b Cefalu WT, Leiter LA, de Bruin TW, Gause-Nilsson I, Sugg J, Parikh SJ (July 2015). "Dapagliflozin's Effects on Glycemia and Cardiovascular Risk Factors in High-Risk Patients With Type 2 Diabetes: A 24-Week, Multicenter, Randomized, Double-Blind, Placebo-Controlled Study With a 28-Week Extension". Diabetes Care. 38 (7): 1218–1227. doi:10.2337/dc14-0315. PMC 4831907. PMID 25852208.
- ^ a b Ferrannini E, Ramos SJ, Salsali A, Tang W, List JF (October 2010). "Dapagliflozin monotherapy in type 2 diabetic patients with inadequate glycemic control by diet and exercise: a randomized, double-blind, placebo-controlled, phase 3 trial". Diabetes Care. 33 (10): 2217–2224. doi:10.2337/dc10-0612. PMC 2945163. PMID 20566676.
- ^ a b Rossing P, Inzucchi SE, Vart P, Jongs N, Docherty KF, Jhund PS, et al. (January 2022). "Dapagliflozin and new-onset type 2 diabetes in patients with chronic kidney disease or heart failure: pooled analysis of the DAPA-CKD and DAPA-HF trials" (PDF). The Lancet. Diabetes & Endocrinology. 10 (1): 24–34. doi:10.1016/S2213-8587(21)00295-3. PMID 34856173. S2CID 244737266.
- ^ a b c d "FDA Approves Treatment for Chronic Kidney Disease". U.S. Food and Drug Administration (FDA) (Press release). 30 April 2021. Archived from the original on 30 April 2021. Retrieved 30 April 2021.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ 이 출처인 © European Medicine Agency에서 텍스트를 복사했습니다.출처가 확인된 경우에는 복제가 승인됩니다.
- ^ Cherney DZ, Dekkers CC, Barbour SJ, Cattran D, Abdul Gafor AH, Greasley PJ, et al. (July 2020). "Effects of the SGLT2 inhibitor dapagliflozin on proteinuria in non-diabetic patients with chronic kidney disease (DIAMOND): a randomised, double-blind, crossover trial" (PDF). The Lancet. Diabetes & Endocrinology. 8 (7): 582–593. doi:10.1016/S2213-8587(20)30162-5. PMID 32559474. S2CID 219948034.
- ^ a b Yau K, Dharia A, Alrowiyti I, Cherney DZ (July 2022). "Prescribing SGLT2 Inhibitors in Patients With CKD: Expanding Indications and Practical Considerations". Kidney International Reports. 7 (7): 1463–1476. doi:10.1016/j.ekir.2022.04.094. PMC 9263228. PMID 35812300.
- ^ "FDA warns about rare occurrences of a serious infection of the genital area with SGLT2 inhibitors for diabetes". U.S. Food and Drug Administration (FDA). 9 February 2019. Archived from the original on 13 December 2019. Retrieved 16 December 2019.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ "SGLT2 inhibitors: Drug Safety Communication - FDA Warns Medicines May Result in a Serious Condition of Too Much Acid in the Blood". U.S. Food and Drug Administration (FDA). 15 May 2015. Archived from the original on 27 October 2016. Retrieved 15 November 2016.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ Monami M, Nreu B, Zannoni S, Lualdi C, Mannucci E (August 2017). "Effects of SGLT-2 inhibitors on diabetic ketoacidosis: A meta-analysis of randomised controlled trials". Diabetes Research and Clinical Practice. 130: 53–60. doi:10.1016/j.diabres.2017.04.017. PMID 28570924.
- ^ Phillip M, Mathieu C, Lind M, Araki E, di Bartolo P, Bergenstal R, et al. (February 2021). "Long-term efficacy and safety of dapagliflozin in patients with inadequately controlled type 1 diabetes: pooled 52-week outcomes from the DEPICT-1 and -2 studies". Diabetes, Obesity & Metabolism. 23 (2): 549–560. doi:10.1111/dom.14248. PMC 7839492. PMID 33145944.
- ^ a b "FDA revises labels of SGLT2 inhibitors for diabetes to include warning". U.S. Food and Drug Administration. 19 March 2020. Archived from the original on 7 June 2020. Retrieved 6 June 2020.
 이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 기사는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ Kohan DE, Fioretto P, Tang W, List JF (April 2014). "Long-term study of patients with type 2 diabetes and moderate renal impairment shows that dapagliflozin reduces weight and blood pressure but does not improve glycemic control". Kidney International. 85 (4): 962–971. doi:10.1038/ki.2013.356. PMC 3973038. PMID 24067431.
- ^ 미국 특허 6515117B2, Ellsworth B, Washburn WN, SherPM, WuG, Meng W, "C-아릴 글루코사이드 SGLT2 억제제 및 방법", 공개, 2003-02-04, 아스트라제네카에 할당
- ^ Sagandira CR, Khasipo AZ, Sagandira MB, Watts P (2021). "An overview of the synthetic routes to essential oral anti-diabetes drugs". Tetrahedron. 96: 132378. doi:10.1016/j.tet.2021.132378.
- ^ "Molecule of the Month: Clarivate". Prous Science. November 2007. Archived from the original on 5 November 2007.
- ^ Bailey CJ, Gross JL, Pieters A, Bastien A, List JF (June 2010). "Effect of dapagliflozin in patients with type 2 diabetes who have inadequate glycaemic control with metformin: a randomised, double-blind, placebo-controlled trial". Lancet. 375 (9733): 2223–2233. doi:10.1016/S0140-6736(10)60407-2. PMID 20609968. S2CID 9168659.
- ^ Bailey CJ, Gross JL, Hennicken D, Iqbal N, Mansfield TA, List JF (February 2013). "Dapagliflozin add-on to metformin in type 2 diabetes inadequately controlled with metformin: a randomized, double-blind, placebo-controlled 102-week trial". BMC Medicine. 11 (1): 43. doi:10.1186/1741-7015-11-43. PMC 3606470. PMID 23425012. S2CID 16429125.
- ^ Henry RR, Murray AV, Marmolejo MH, Hennicken D, Ptaszynska A, List JF (May 2012). "Dapagliflozin, metformin XR, or both: initial pharmacotherapy for type 2 diabetes, a randomised controlled trial". International Journal of Clinical Practice. 66 (5): 446–456. doi:10.1111/j.1742-1241.2012.02911.x. PMID 22413962. S2CID 9934488.
- ^ Lan NS, Fegan PG, Yeap BB, Dwivedi G (October 2019). "The effects of sodium-glucose cotransporter 2 inhibitors on left ventricular function: current evidence and future directions". ESC Heart Failure. 6 (5): 927–935. doi:10.1002/ehf2.12505. PMC 6816235. PMID 31400090.
- ^ Schubert-Zsilavecz M, Wurglics M (2008–2009). "Dapagliflozin". Neue Arzneimittel.
- ^ "International Nonproprietary Names for Pharmaceutical Substances (INN). Recommended International Nonproprietary Names: List 59" (PDF). World Health Organization. 2008. p. 50. Archived (PDF) from the original on 18 May 2016. Retrieved 15 November 2016.
- ^ "Statement on a Nonproprietary Name Adopted by the USAN Council" (PDF). American Medical Association. Archived from the original (PDF) on 7 February 2012. Retrieved 15 November 2016.
- ^ "US FDA Approves Once-Daily Xigduo XR Tablets for Adults with Type 2 Diabetes". AstraZeneca. 30 October 2014. Archived from the original on 16 November 2016. Retrieved 15 November 2016.
- ^ "Drug Approval Package: Xigduo XR (dapagliflozin and metformin HCl) Extended-Release Tablets". U.S. Food and Drug Administration (FDA). 7 April 2015. Archived from the original on 20 February 2020. Retrieved 5 May 2020.
- ^ "Xigduo XR- dapagliflozin and metformin hydrochloride tablet, film coated, extended release". DailyMed. 3 February 2020. Archived from the original on 2 March 2021. Retrieved 5 May 2020.
- ^ "Qtern EPAR". European Medicines Agency (EMA). 17 September 2018. Archived from the original on 14 July 2020. Retrieved 7 May 2020.
- ^ "Drug Approval Package: Qtern (dapagliflozin and saxagliptin)". U.S. Food and Drug Administration (FDA). 10 October 2018. Archived from the original on 14 July 2020. Retrieved 8 May 2020.
- ^ "Qtern- dapagliflozin and saxagliptin tablet, film coated". DailyMed. 24 January 2020. Archived from the original on 14 July 2020. Retrieved 17 February 2020.
- ^ "Drug Approval Package: Qternmet XR". U.S. Food and Drug Administration (FDA). 27 January 2020. Archived from the original on 17 February 2020. Retrieved 17 February 2020.
- ^ "Qtrilmet EPAR". European Medicines Agency (EMA). 16 September 2019. Archived from the original on 29 December 2019. Retrieved 30 March 2020.
- ^ "Forxiga". Drugs.com. 4 May 2020. Archived from the original on 28 August 2021. Retrieved 5 May 2020.
- ^ "Drug Approval Package: Farxiga (dapagliflozin) Tablets NDA #202293". U.S. Food and Drug Administration (FDA). 24 December 1999. Archived from the original on 19 September 2020. Retrieved 5 May 2020.
- ^ McMurray JJ, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, et al. (November 2019). "Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction". The New England Journal of Medicine. 381 (21): 1995–2008. doi:10.1056/NEJMoa1911303. PMID 31535829. S2CID 202687033.
- ^ Kato ET, Silverman MG, Mosenzon O, Zelniker TA, Cahn A, Furtado RH, et al. (May 2019). "Effect of Dapagliflozin on Heart Failure and Mortality in Type 2 Diabetes Mellitus". Circulation. 139 (22): 2528–2536. doi:10.1161/CIRCULATIONAHA.119.040130. PMID 30882238. S2CID 81977866.
- ^ "FARXIGA Granted Fast Track Designation in the US for Heart Failure Following Acute Myocardial Infarction Leveraging an Innovative Registry-Based Trial Design" (Press release). AstraZeneca. 16 July 2020. Archived from the original on 20 July 2020. Retrieved 20 July 2020 – via Business Wire.
- ^ "FARXIGA Demonstrated Unprecedented Reduction in the Risk of Kidney Failure and Cardiovascular or Renal Death in Patients with Chronic Kidney Disease in the Phase III DAPA-CKD Trial" (Press release). AstraZeneca. 30 August 2020. Archived from the original on 31 August 2020. Retrieved 4 September 2020 – via Business Wire.
- ^ "Forxiga approved in EU for chronic heart failure". European Pharmaceutical Review. Retrieved 9 February 2023.
- ^ "Dapagliflozin Gets Expanded Heart Failure Indication in Europe". Medscape. Retrieved 9 February 2023.
- ^ "Drugs@FDA: Dapagliflozin". U.S. Food and Drug Administration (FDA). Archived from the original on 25 March 2022. Retrieved 25 March 2022.
- ^ Rudge D (24 February 2022). "Patent Blocks Zydus After Landmark US Approval For Dapagliflozin". Archived from the original on 10 June 2022. Retrieved 8 June 2022.
- ^ "Dapagliflozin – USA". 15 October 2021. Archived from the original on 10 June 2022. Retrieved 8 June 2022.
- ^ "JAMP Pharma Group receives Health Canada approval for PrJAMP Dapagliflozin, a new generic alternative for the treatment of type 2 diabetes" (Press release). JAMP Pharma. 16 May 2023. Retrieved 17 June 2023 – via Newswire.
- ^ "Dapagliflozin Viatris: Pending EC decision". European Medicines Agency. 26 January 2023. Retrieved 29 January 2023. 텍스트는 저작권이 있는 유럽의약품청(European Medicine Agency)의 출처에서 복사되었습니다.출처가 확인된 경우에는 복제가 승인됩니다.
- ^ Zhai M, Du X, Liu C, Xu H (30 June 2021). "The Effects of Dapagliflozin in Patients With Heart Failure Complicated With Type 2 Diabetes: A Meta-Analysis of Placebo-Controlled Randomized Trials". Frontiers in Clinical Diabetes and Healthcare. 2: 703937. doi:10.3389/fcdhc.2021.703937. PMC 10012068. PMID 36994345.




