피브리노겐
Fibrinogen| 피브리노겐 알파/베타사슬 패밀리 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 두 가지 다른 결합 리간드를 가진 토종 닭 피브리노겐의 결정 구조 | |||||||||
| 식별자 | |||||||||
| 기호. | Fib_alpha | ||||||||
| 팜 | PF08702 | ||||||||
| 인터프로 | IPR012290 | ||||||||
| SCOP2 | 1m1j/SCOPe/SUPFAM | ||||||||
| |||||||||
| 피브리노겐αC 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | 피브리노겐_aC | ||||||||
| 팜 | PF12160 | ||||||||
| 인터프로 | IPR021996 | ||||||||
| |||||||||
| 식별자 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 기호. | 피브리노겐_c | ||||||||
| 팜 | PF00147 | ||||||||
| 빠맘 클랜 | CL0422 | ||||||||
| 인터프로 | IPR002181 | ||||||||
| 프로 사이트 | PDOC00445 | ||||||||
| SCOP2 | 1fza/SCOPe/SUPFAM | ||||||||
| |||||||||
피브리노겐(인자 I)은 [1]모든 척추동물의 혈액에서 순환하는 간에서 생성되는 [2]당단백질 복합체이다.조직 및 혈관 손상 동안 트롬빈에 의해 효소적으로 섬유소로 변환된 다음 섬유소 기반의 혈전으로 변환됩니다.섬유소 응괴는 주로 출혈을 멈추기 위해 혈관을 막는 기능을 한다.피브린은 또한 트롬빈의 활성을 결합시키고 감소시킨다.때때로 항트롬빈 I이라고 불리는 이 활동은 [1]응고를 제한한다.또한 피브린은 혈소판 및 내피세포의 확산, 조직섬유아세포의 증식, 모세관 형성 및 혈관신생을 매개하여 혈관재생과 상처치유를 [3]촉진한다.
감소 및/또는 기능 장애 피브리노겐은 다양한 선천성 및 후천성 인간 피브리노겐 관련 질환에서 발생한다.이러한 장애는 개인이 심각한 병리학적 출혈과 혈전증 증세를 보일 수 있는 드문 상태의 그룹을 나타냅니다. 이러한 질환은 각각 혈액 [4][5]피브리노겐 수치를 보충하고 혈액 응고를 억제함으로써 치료됩니다.이러한 장애들은 또한 특정 간과 신장 [1]질환의 원인이 될 수 있다.
피브리노겐은 "양성" 급성상 단백질로, 즉 전신 염증, 조직 손상 및 기타 특정 사건에 반응하여 혈액 수치가 상승합니다.그것은 또한 다양한 암에서 증가한다.암 및 기타 조건뿐만 아니라 염증에서 피브리노겐의 높은 수치는 이러한 조건에 [6][7]동반되는 혈전증 및 혈관 손상의 원인이 될 수 있습니다.
유전자
피브리노겐은 주로 간세포 세포에 의해 만들어지고 혈액으로 분비된다.내피 세포는 또한 소량의 피브리노겐을 만드는 것으로 보고되었지만, 이 피브리노겐은 완전히 특징지어지지 않았다; 한때 피브리노겐을 만드는 것으로 여겨졌던 혈소판과 그 전구체인 골수 거핵구는 이제 흡수되고 저장되지만 [4][7]당단백질을 만들지 않는 것으로 알려져 있다.최종적으로 분비되는 간세포 유래 당단백질은 2개의 삼량체로 구성되며, 각 삼량체는 FGA 유전자에 의해 코드된 피브리노겐 알파 사슬(Aα 또는 α 사슬이라고도 함), FGB 유전자에 의해 코드된 피브리노겐 베타 사슬(Bβ 또는 β 사슬이라고도 함) 및 피브리노겐 사슬(또한 β 사슬이라고도 함)으로 구성된다.FGG 유전자에 의해 코드된 γ 사슬이라고 불린다.세 유전자 모두 인간 염색체 4의 긴 팔 또는 "q" 팔에 위치한다(각각 [1]4q31.3, 4q31.3, 4q32.1 위치).
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
FGA 유전자의 대체 스플라이싱은 순환 피브리노겐의 1~3%에서 Aα를 치환하는 Aα라는 이름의 작은 확장 아이소폼을 생성하고, FGG의 대체 스플라이싱은 순환 피브리노겐의 8~10%에서 δ를 치환하는 δ'라는 작은 아이소폼을 생성하며, FGB는 대체 스플라이싱되지 않는다.따라서 최종 피브리노겐 제품은 주로 Aα, Bβ 및 δ사슬로 구성되며, 각각 Aα 및/또는 δ사슬 대신 AαE 및/또는 δ'사슬을 함유하는 비율이 작다.세 유전자는 완전히 [8][9][10][11][12]이해되지 않은 메커니즘에 의해 조정되어 전사되고 번역된다.이들 3개의 피브리노겐 유전자의 조정된 전사는 염증 및 조직 손상과 같은 시스템 조건에 의해 빠르고 크게 증가한다.인터류킨 6 및 인터류킨 1β와 같은 이러한 전신 조건에서 생성된 사이토카인은 이 [11]전사를 상향 조절하는 역할을 하는 것으로 보인다.
구조.
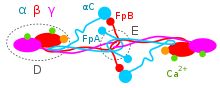
Aα, Bβ 및 γ 사슬은 내소체망(ER)에서 전사 및 좌표 변환되며 신호 펩타이드 부분이 제거되는 동안 펩타이드 사슬이 ER로 전달됩니다.ER 내에서 3개의 체인은 처음에는 Aαγ 및 Bβγ 이합체로 조립된 후 AαBβγ 삼합체로 조립되고, 마지막으로 (AαBβγ)2 헥시머로 조립된다. 즉, 다수의 디술피드 결합에 의해 결합된 2개의 AαBβγ 삼합체로 접합된다.헥시머는 글리코실화, 히드록실화, 황화 및 인산화되어 [10][12]혈액으로 분비되는 성숙한 피브리노겐 당단백질을 형성합니다.성숙한 피브리노겐은 직경이 8~15옹스트롬(O)으로 추정되는 매우 얇은 실로 결합된 3개의 결절의 길고 유연한 단백질 어레이로 배치된다.2개의 말단결절(D영역 또는 도메인)은 Bβ와 γ사슬로 구성되는 반면, 약간 작은 중심결절(E영역 또는 도메인)은 2개의 얽힌 Aα 알파사슬로 구성된다.그림자 길이를 측정한 결과 결절 직경이 50~70Ω 범위입니다.건조 분자의 길이는 475 ± 25 [14]ö이다.
피브리노겐 분자는 약 340~420 kDa(킬로달톤)[15]의 전형적인 분자량을 가진 가용성 혈장 당단백질로 순환한다(Aα verse AαE, γ 대 γ' 사슬 및 탄수화물 [~4~10%w/w]의 함량에 따라 다름).9 × 47.5 × 6 nm 크기의 막대 모양이며, 생리적 pH(등전점 ~ 5.5~6.5, 예를 들어 pH 5[16][17].8)에서 음의 순전하를 가진다.혈장 내 피브리노겐의 정상 농도는 150–400mg/dl이며, 병리학적 출혈 및/또는 혈전증과 관련된 수치보다 현저히 낮거나 그 이상이다.피브리노겐의 순환 반감기는 ~4일이다.[12]
혈전 형성
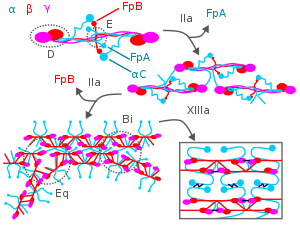
혈액응고 중에 트롬빈은 피브리노겐 중 Aα 및 Bβ 사슬의 N 말단을 공격하여 개별 피브린 가닥과 이들 사슬에서 파생된 2개의 작은 폴리펩타이드인 피브리노펩타이드 A 및 B를 형성한다.개별 섬유소 가닥은 중합되어 혈액인자 XIIIa에 의해 다른 섬유소 가닥과 가교되어 성숙한 섬유소 응고 [3][7][18]형성의 기초가 되는 광범위한 상호 연결된 섬유소 네트워크를 형성한다.피브리노겐은 섬유소를 형성할 뿐만 아니라 GpIIb/I와의 결합을 통해 혈소판 사이에 브릿지를 형성하고 활성화함으로써 혈액 응고를 촉진한다.IIa 표면막 피브리노겐 수용체.[18]
피브린은 혈전 형성을 제한하고 형성된 혈전을 적어도 두 가지 중요한 메커니즘에 의해 분해하는 데 관여한다.우선 트롬빈에 대한 3개의 저친화성 결합부위(피브린의 E도메인에 2개, D도메인에 1개)를 가지며, 이 결합시퀀스 트롬빈은 피브리노겐을 [18]공격하는 것으로부터 트롬빈을 억제한다.둘째, 섬유소의 Aα 사슬은 조직 플라스미노겐 활성제에 의해 활성화되는 플라스민의 최소 100배까지 가속된다.플라스민 분해 혈전.[5][18][3][7]플라즈민의 섬유소 공격은 D-다이머(DD 이합체라고도 함)를 방출한다.혈액에서 이러한 이합체의 검출은 섬유소 용해 임상시험으로 사용된다.[5]
피브리노겐 장애
피브리노겐의 양 및/또는 품질에 있어서의 몇 가지 장애는 병적인 출혈, 병적인 혈액 응고 및/또는 간, 신장 및 기타 조직에 피브리노겐의 침적을 일으킨다.
선천성 아피브리노겐혈증
선천성 아피브리노겐혈증은 드물고 일반적으로 상염색체 열성 유전 질환으로, 피브리노겐 부족(일반적으로 플라스마 피브리노겐 수치)으로 인해 혈액이 응고되지 않지만, 때로는 극히 낮은 수치(예: <10 mg/dl)에서 검출되기도 한다.이 심각한 질환은 보통 FGA, FGB, 또는 FBG 유전자의 모성 및 부성 둘 다의 돌연변이에 의해 발생합니다.돌연변이는 실질적으로 완전한 유전적 침투성을 가지며 기본적으로 모든 동종 접합체들은 출혈 및/또는 혈전증의 빈번하고 때로는 생명을 위협하는 증상을 경험한다.병리성 출혈은 출생 시 배꼽에서 [4]과다출혈이 나타나는 등 초기에 발생한다.
선천성 저섬유소원혈증
선천성 저섬유소원혈증은 피브리노겐의 감소로 인해 혈액이 정상적으로 응고되지 않을 수 있는 드문 유전 질환이다(플라스마 피브리노겐은 일반적으로 150 mg/dl 미만이다).이 장애는 두 부모 FGA, FGB, 또는 FBG 유전자 중 하나만 파괴적인 돌연변이를 나타내며 유전적 침투도가 낮습니다. 즉, 결함이 있는 유전자를 가진 일부 가족 구성원만 증상을 보입니다.혈장 피브리노겐 수치가 낮은 사람에게서 더 자주 발생하는 이 장애의 증상에는 보통 늦은 소아기나 성인기에 [4]시작되는 일시적인 출혈과 혈전증이 포함된다.
피브리노겐 저장병
피브링고겐 저장병은 극히 드문 질환이다.그것은 FGG 유전자의 한 복사본에 있는 특정 특정 유전 돌연변이가 그 피브리노겐 생성물이 간세포에 축적되어 손상시키는 선천성 저섬유소원혈증의 한 형태이다.FGA 또는 FGB 돌연변이는 보고되지 않았다.이러한 FGG 돌연변이의 증상은 침투도가 낮다.이 장애에서 검출된 혈장 피브리노겐 수치(일반적으로 <150mg/dl 이상)는 정상 유전자에 의해 만들어진 피브리노겐을 반영한다.피브리노겐 저장 질환은 비정상적인 출혈과 혈전증으로 이어질 수 있지만 [19]간경변으로 이어지는 경우도 있다.
선천성 섬유소 이상 혈증
선천성 피브리노겐혈증은 혈장 피브리노겐이 한쪽 부모로부터 물려받은 돌연변이 FGA, FGB 또는 FBG 유전자에 의해 만들어진 기능성 피브리노겐과 다른 한쪽 부모로부터 물려받은 정상 유전자에 의해 만들어진 정상 피브리노겐으로 구성된 희귀한 상염색체 우성 유전 질환이다.이 이중성을 반영하여 면역학적 방법으로 측정한 혈장 피브리노겐 수치는 정상(>150mg/dl)이지만 응고 형성 방법으로 측정한 경우에는 c. 50% 낮다.이 질환은 비정상적인 유전자를 가진 일부 사람들만이 비정상적인 출혈과 혈전증 [20]증상을 보일 정도로 침투도가 감소한다.
유전성 피브리노겐 Aα-사슬 아밀로이드증
유전성 피브리노겐 Aα-사슬 아밀로이드증은 FGA 유전자의 두 복사본 중 하나의 돌연변이에 의해 발생하는 상염색체 우성의 극히 희귀한 유전 질환이다.그것은 특정 돌연변이가 신장에 점차 축적되면서 혈액을 순환하는 비정상적인 섬유소 생성으로 이어지는 선천성 섬유소 이상 혈증의 한 형태이다.이 축적은 시간이 지남에 따라 가족성 신장 아밀로이드증의 한 형태로 이어진다.혈장 피브리노겐 수치는 다른 형태의 선천성 섬유소 이상 혈증과 유사하다.피브리노겐 Aα-사슬 아밀로이드증은 비정상적인 출혈이나 혈전증과 [21]관련이 없다.
후천성 섬유소 이상 혈증
후천성 피브리노겐혈증은 각종 후천성 질환에 의한 기능성 피브리노겐의 적어도 일부에 순환 피브리노겐이 구성되는 희귀 질환이다.잘 알려진 원인 중 하나는 간종, 만성 활성 간염, 간경변, 담도폐쇄로 인한 황달 등 심각한 간질환이다.병든 간은 정상적으로 기능하는 아미노산 배열을 가지고 있지만 골지 통과 중에 글리코실화(즉, 잘못된 양의 당 잔류물을 가지고 있음)되는 피브리노겐을 합성한다.잘못 당화된 피브리노겐은 기능 장애이며 출혈 및/또는 혈액 응고의 병리학적 증상을 일으킬 수 있습니다.잘 알려지지 않은 다른 원인으로는 혈장세포 이상증 및 혈액순환 이상 면역글로불린 또는 기타 단백질이 피브리노겐 기능을 방해하는 자가면역장애, 암 및 약물(이소트레티노인, 글루코코르티코이드, 항백혈제) [18]독성의 드문 사례가 있다.
선천성 저지혈증
선천성 저체질 섬유소원혈증은 면역학적으로 검출된 혈장 피브리노겐의 저준위(즉 <150mg/dl)가 기능성 피브리노겐의 적어도 일부에 구성되어 있는 희귀한 유전 질환이다.이 질환은 유전되는 피브리노겐 유전자의 전형적인 돌연변이를 반영하는데, 그 중 하나는 기능 장애가 있는 피브리노겐을 생성하는 반면 다른 하나는 적은 양의 피브리노겐을 생성한다.이 질환은 투과도가 감소하지만 선천성 섬유소 이상혈증보다 더 심각하지만 후자의 질환과 마찬가지로 출혈 및/또는 혈액 [22]응고의 병리학적 증상을 일으킨다.
크라이오피브리노겐혈증
크라이오피브리노겐혈증은 피브리노겐이 저온에서 침전돼 피브리노겐, 섬유소 및 기타 순환단백질의 혈관내 침전을 초래하는 후천성 질환이다.클리오글로불론혈증은 기초적인 관련 질환의 증거, 즉 일차적인 클리오글로불린혈증(본질적인 클리오글로불린혈증이라고도 함) 또는 훨씬 일반적으로 기초적인 질환의 증거, 즉 2차적인 클리오글로불론혈증과 함께 발생할 수 있다.2차 저온섬유소결혈증은 감염자(c.사례의 12%), 악성 또는 전마비 장애(21%), 혈관염(25%), 자가면역질환(42%)에서 발병할 수 있다.이 경우 크라이오피브리노겐종은 조직손상 및/또는 다른 증상을 일으킬 수도 있고 일으키지 않을 수도 있으며 이들 질환과 크라이오피브리노겐증의 실제 원인-효과 관계가 불분명하다.크라이오피브리노겐혈증은 특정 [23][24][25][26]약물의 섭취와 함께 발생할 수도 있다.
후천성 저섬유소겐혈증
후천성 저섬유소겐혈증은 외상, 파종성 혈관내 응고, 패혈증의 결과로 발생할 수 있는 과다섭취로 인한 순환성 섬유소 결핍증이다.또한 혈액 손실 및/또는 충전된 적혈구 또는 기타 피브리노겐 부족 전혈 [27]치환에 의한 수혈의 결과로 발생할 수 있다.
실험실 테스트
피브리노겐 장애의 임상 분석은 일반적으로 다음과 같은 연속적인 [28]단계를 사용하여 혈액 응고를 측정합니다.특히 높은 수치는 심혈관 질환과 관련이 있다(>3.43 g/l).[clarification needed]그것은 급성상 단백질이기 때문에 어떤 형태의 염증에서도 증가할 수 있다. 예를 들어, 치주 [29][30]질환의 초기 단계 동안 인간의 잇몸 조직에서 특히 두드러진다.
- 혈액 응고는 표준 테스트(예: 프로트롬빈 시간, 부분 트롬보플라스틴 시간, 트롬빈 시간 및/또는 렙틸라아제 시간)를 사용하여 측정됩니다.낮은 피브리노겐 수치와 기능 장애가 있는 피브리노겐은 대개 이러한 기간을 연장하는 반면, 피브리노겐의 부족(즉, 아프리노겐혈증)은 이러한 기간을 무한히 연장시킨다.
- 피브리노겐 수치는 면역측정법 [citation needed]또는 Clauss 피브리노겐 측정법 또는 프로트롬빈 기반 [31]방법과 같은 응고측정법에 의해 정맥혈액에서 분리된 혈장에서 측정된다.통상 레벨은 사용하는 방법에 따라 약 1.5~3g/l입니다.이러한 수치는 섬유소 이상혈증(1.5~3g/l)에서 정상이고, 저섬유소 이상혈증 및 저섬유소 이상혈증(1.5g/l 미만)에서 감소하며, 아프리노겐혈증에는 부재(0.02g/l 미만)에서 정상이다.
- 피브리노겐의 기능적 수준은 응고를 유도하는 혈장에서 측정된다.본 검사의 응고 피브리노겐 수치는 저섬유소겐혈증, 저섬유소겐혈증, 이상섬유소겐혈증에서는 감소되어야 하며 아프리노겐혈증에서는 검출되지 않아야 한다.
- 기능성 피브리노겐/항원성 피브리노겐 수치는 저섬유소원혈증, 저섬유소원혈증 및 이상섬유소원혈증에서 0.7g/l 미만이며, 아프리노겐혈증에는 적용되지 않는다.
- 피브리노겐 분석은 혈전탄성측정법으로 전혈 샘플에 대해서도 테스트할 수 있습니다.이 분석은 응고 중 및 후속 섬유질 분해 중 응고인자, 그 억제제, 항응고제 및 혈소판(특히 혈소판)의 상호작용을 조사합니다.이 테스트는 섬유소-혈소판 상호작용 및 섬유소 용해 속도에 대한 추가 정보를 제공하기 위해 지혈 효과 및 최대 응고 강도에 대한 정보를 제공합니다(혈소판 탄성 측정 참조).
- 시험관내 형성 응괴의 주사 전자 현미경법과 공초점 레이저 주사 현미경은 섬유소 응괴 밀도 및 구조에 대한 정보를 제공할 수 있다.
- 피브리노겐 흡수 시험 또는 피브리노겐 스캔은 이전에는 심정맥 혈전증을 검출하기 위해 사용되었다.본 방법에서는 전형적으로 방사성 요오드를 포함한 방사성 표지 피브리노겐을 개인에게 투여하고 혈전에 삽입하여 신티그래피로 검출한다.
고섬유소겐혈증
기능적으로 정상인 피브리노겐 수치는 임신 중 평균 4.5g/l로 증가하며, 이는 비임신자의 평균 3g/l에 비해 감소한다.그들은 또한 다양한 형태의 암, 특히 위암, 폐암, 전립선암, 난소암에서 증가할 수 있다.이러한 경우, 고섬유소겐혈증은 병리 혈전증의 발생에 기여할 수 있다.이동성 표피정맥 혈전증의 특정 패턴인 '트루소 증후군'은 이러한 [7][32]암의 다른 모든 징후와 증상보다 먼저 발생할 수 있다.또한 고섬유소겐혈증은 신생아의[33] 지속적인 폐고혈압과 수술 [34]후 혈전증의 원인으로 연관되어 있다.급성 또는 아급성 말초 동맥 및 동맥 바이패스 [35]폐색에 대한 카테터 유도 혈전용해 중 출혈 합병증의 예측 요인으로 높은 피브리노겐 수치가 제안되었다.그러나 2016년 1월까지 이용 가능한 문헌을 체계적으로 검토한 결과 카테터 유도 혈전용해 후 출혈 합병증 예측을 위한 혈장 피브리노겐 수준의 예측값은 [36]입증되지 않았다.
역사
1905년 Paul Morawitz는 피브리노겐에 [37]대해 설명했다.
레퍼런스
- ^ a b c d de Moerloose P, Casini A, Neerman-Arbez M (September 2013). "Congenital fibrinogen disorders: an update". Seminars in Thrombosis and Hemostasis. 39 (6): 585–595. doi:10.1055/s-0033-1349222. PMID 23852822.
- ^ Jiang Y, Doolittle RF (June 2003). "The evolution of vertebrate blood coagulation as viewed from a comparison of puffer fish and sea squirt genomes". Proceedings of the National Academy of Sciences of the United States of America. 100 (13): 7527–7532. Bibcode:2003PNAS..100.7527J. doi:10.1073/pnas.0932632100. PMC 164620. PMID 12808152.
- ^ a b c Mosesson MW (August 2005). "Fibrinogen and fibrin structure and functions". Journal of Thrombosis and Haemostasis. 3 (8): 1894–1904. doi:10.1111/j.1538-7836.2005.01365.x. PMID 16102057. S2CID 22077267.
- ^ a b c d Casini A, de Moerloose P, Neerman-Arbez M (June 2016). "Clinical Features and Management of Congenital Fibrinogen Deficiencies". Seminars in Thrombosis and Hemostasis. 42 (4): 366–374. doi:10.1055/s-0036-1571339. PMID 27019462.
- ^ a b c Undas A (September 2011). "Acquired dysfibrinogenemia in atherosclerotic vascular disease". Polskie Archiwum Medycyny Wewnetrznej. 121 (9): 310–319. PMID 21952526.
- ^ Davalos D, Akassoglou K (January 2012). "Fibrinogen as a key regulator of inflammation in disease". Seminars in Immunopathology. 34 (1): 43–62. doi:10.1007/s00281-011-0290-8. PMID 22037947. S2CID 14997530.
- ^ a b c d e Repetto O, De Re V (September 2017). "Coagulation and fibrinolysis in gastric cancer". Annals of the New York Academy of Sciences. 1404 (1): 27–48. Bibcode:2017NYASA1404...27R. doi:10.1111/nyas.13454. PMID 28833193. S2CID 10878584.
- ^ Neerman-Arbez M, de Moerloose P, Casini A (June 2016). "Laboratory and Genetic Investigation of Mutations Accounting for Congenital Fibrinogen Disorders". Seminars in Thrombosis and Hemostasis. 42 (4): 356–365. doi:10.1055/s-0036-1571340. PMID 27019463.
- ^ Duval C, Ariëns RA (July 2017). "Fibrinogen splice variation and cross-linking: Effects on fibrin structure/function and role of fibrinogen γ' as thrombomobulin II" (PDF). Matrix Biology. 60–61: 8–15. doi:10.1016/j.matbio.2016.09.010. PMID 27784620.
- ^ a b Vu D, Neerman-Arbez M (July 2007). "Molecular mechanisms accounting for fibrinogen deficiency: from large deletions to intracellular retention of misfolded proteins". Journal of Thrombosis and Haemostasis. 5 (Suppl 1): 125–131. doi:10.1111/j.1538-7836.2007.02465.x. PMID 17635718. S2CID 27354717.
- ^ a b Fish RJ, Neerman-Arbez M (September 2012). "Fibrinogen gene regulation". Thrombosis and Haemostasis. 108 (3): 419–426. doi:10.1160/TH12-04-0273. PMID 22836683.
- ^ a b c Asselta R, Duga S, Tenchini ML (October 2006). "The molecular basis of quantitative fibrinogen disorders". Journal of Thrombosis and Haemostasis. 4 (10): 2115–2129. doi:10.1111/j.1538-7836.2006.02094.x. PMID 16999847. S2CID 24223328.
- ^ a b c d Topaz O, et al. (2018). Cardiovascular thrombus. Academic Press. pp. 31–43. ISBN 9780128126165.
- ^ Hall CE, Slayter HS (January 1959). "The fibrinogen molecule: its size, shape, and mode of polymerization". The Journal of Biophysical and Biochemical Cytology. 5 (1): 11–16. doi:10.1083/jcb.5.1.11. PMC 2224630. PMID 13630928.
- ^ Fantl P, Ward HA (September 1965). "Molecular weight of human fibrinogen derived from phosphorus determinations". The Biochemical Journal. 96 (3): 886–889. doi:10.1042/bj0960886. PMC 1207232. PMID 5862426.
- ^ Marucco A, Fenoglio I, Turci F, Fubini B (2013). "Interaction of fibrinogen and albumin with titanium dioxide nanoparticles of different crystalline phases". Journal of Physics. Conference Series. 429 (1): 012014. Bibcode:2013JPhCS.429a2014M. doi:10.1088/1742-6596/429/1/012014. hdl:2318/130247.
- ^ Cieśla M, Adamczyk Z, Barbasz J, Wasilewska M (June 2013). "Mechanisms of fibrinogen adsorption at solid substrates at lower pH". Langmuir. 29 (23): 7005–7016. doi:10.1021/la4012789. PMID 23621148.
- ^ a b c d e Besser MW, MacDonald SG (2016). "Acquired hypofibrinogenemia: current perspectives". Journal of Blood Medicine. 7: 217–225. doi:10.2147/JBM.S90693. PMC 5045218. PMID 27713652.
- ^ Casini A, Sokollik C, Lukowski SW, Lurz E, Rieubland C, de Moerloose P, Neerman-Arbez M (November 2015). "Hypofibrinogenemia and liver disease: a new case of Aguadilla fibrinogen and review of the literature". Haemophilia. 21 (6): 820–827. doi:10.1111/hae.12719. PMID 25990487. S2CID 44911581.
- ^ Casini A, Neerman-Arbez M, Ariëns RA, de Moerloose P (June 2015). "Dysfibrinogenemia: from molecular anomalies to clinical manifestations and management". Journal of Thrombosis and Haemostasis. 13 (6): 909–919. doi:10.1111/jth.12916. PMID 25816717. S2CID 10955092.
- ^ Gillmore JD, Lachmann HJ, Rowczenio D, Gilbertson JA, Zeng CH, Liu ZH, et al. (February 2009). "Diagnosis, pathogenesis, treatment, and prognosis of hereditary fibrinogen A alpha-chain amyloidosis". Journal of the American Society of Nephrology. 20 (2): 444–451. doi:10.1681/ASN.2008060614. PMC 2637055. PMID 19073821.
- ^ Casini A, Brungs T, Lavenu-Bombled C, Vilar R, Neerman-Arbez M, de Moerloose P (May 2017). "Genetics, diagnosis and clinical features of congenital hypodysfibrinogenemia: a systematic literature review and report of a novel mutation". Journal of Thrombosis and Haemostasis. 15 (5): 876–888. doi:10.1111/jth.13655. PMID 28211264.
- ^ Grada A, Falanga V (February 2017). "Cryofibrinogenemia-Induced Cutaneous Ulcers: A Review and Diagnostic Criteria". American Journal of Clinical Dermatology. 18 (1): 97–104. doi:10.1007/s40257-016-0228-y. PMID 27734332. S2CID 39645385.
- ^ Chen Y, Sreenivasan GM, Shojania K, Yoshida EM (June 2015). "Cryofibrinogenemia After a Liver Transplant: First Reported Case Posttransplant and a Case-Based Review of the Nontransplant Literature". Experimental and Clinical Transplantation. 13 (3): 290–294. doi:10.6002/ect.2014.0013. PMID 24679054.
- ^ Caimi G, Canino B, Lo Presti R, Urso C, Hopps E (2017). "Clinical conditions responsible for hyperviscosity and skin ulcers complications". Clinical Hemorheology and Microcirculation. 67 (1): 25–34. doi:10.3233/CH-160218. hdl:10447/238851. PMID 28550239.
- ^ Michaud M, Pourrat J (April 2013). "Cryofibrinogenemia". Journal of Clinical Rheumatology. 19 (3): 142–148. doi:10.1097/RHU.0b013e318289e06e. PMID 23519183.
- ^ Fries D, Innerhofer P, Schobersberger W (April 2009). "Time for changing coagulation management in trauma-related massive bleeding". Current Opinion in Anesthesiology. 22 (2): 267–274. doi:10.1097/ACO.0b013e32832678d9. PMID 19390253. S2CID 10615690.
- ^ Lang T, Johanning K, Metzler H, Piepenbrock S, Solomon C, Rahe-Meyer N, Tanaka KA (March 2009). "The effects of fibrinogen levels on thromboelastometric variables in the presence of thrombocytopenia". Anesthesia and Analgesia. 108 (3): 751–758. doi:10.1213/ane.0b013e3181966675. PMID 19224779. S2CID 11733489.
- ^ Page RC, Schroeder HE (March 1976). "Pathogenesis of inflammatory periodontal disease. A summary of current work". Laboratory Investigation; A Journal of Technical Methods and Pathology. 34 (3): 235–249. PMID 765622.
- ^ Nagler M, Kremer Hovinga JA, Alberio L, Peter-Salonen K, von Tengg-Kobligk H, Lottaz D, et al. (September 2016). "Thromboembolism in patients with congenital afibrinogenaemia. Long-term observational data and systematic review" (PDF). Thrombosis and Haemostasis. 116 (4): 722–732. doi:10.1160/TH16-02-0082. PMID 27384135.
- ^ Lawrie AS, McDonald SJ, Purdy G, Mackie IJ, Machin SJ (June 1998). "Prothrombin time derived fibrinogen determination on Sysmex CA-6000". Journal of Clinical Pathology. 51 (6): 462–466. doi:10.1136/jcp.51.6.462. PMC 500750. PMID 9771446.
- ^ Salvi V (2003). Medical and Surgical Diagnostic Disorders in Pregnancy. Jaypee Brothers Publishers. p. 5. ISBN 978-81-8061-090-5.
- ^ Graves ED, Redmond CR, Arensman RM (March 1988). "Persistent pulmonary hypertension in the neonate". Chest. 93 (3): 638–641. doi:10.1378/chest.93.3.638. PMID 3277808.
- ^ Müller R, Musikić P (August 1987). "Hemorheology in surgery--a review". Angiology. 38 (8): 581–592. doi:10.1177/000331978703800802. PMID 3307545. S2CID 23209838.
- ^ "Results of a prospective randomized trial evaluating surgery versus thrombolysis for ischemia of the lower extremity. The STILE trial". Annals of Surgery. 220 (3): 251–266, discussion 266–268. September 1994. doi:10.1097/00000658-199409000-00003. PMC 1234376. PMID 8092895.
- ^ Poorthuis MH, Brand EC, Hazenberg CE, Schutgens RE, Westerink J, Moll FL, de Borst GJ (May 2017). "Plasma fibrinogen level as a potential predictor of hemorrhagic complications after catheter-directed thrombolysis for peripheral arterial occlusions". Journal of Vascular Surgery. 65 (5): 1519–1527.e26. doi:10.1016/j.jvs.2016.11.025. PMID 28274749.
- ^ Izaguirre Avila R (2005). "[The centennial of blood coagulation doctrine]". Archivos de Cardiologia de Mexico (in Spanish). 75 (Suppl 3): S3–118–29. PMID 16366177.
외부 링크
- 제니퍼 맥도월/인터프로: 이달의 단백질: 피브리노겐.
- Peter D'Eustachio / reactome : 피브리노겐 → 피브린 단량체 + 2 피브리노펩타이드 A + 2 피브리노펩타이드 B
- Khan Academy Medicine (YouTube) :응고 1 - 혈전을 만드는 방법은?
- PDB의 UniProt: P02671(피브리노겐 알파 체인)에서 PDBe-KB에 있는 모든 구조 정보의 개요.
- PDB for UniProt: P02675(피브리노겐 베타 체인)에서 PDBe-KB에 제공되는 모든 구조 정보의 개요.
- PDBe-KB에서 UniProt: P02679(피브리노겐 감마 사슬)에 대해 PDB에서 사용할 수 있는 모든 구조 정보의 개요.