라이프라이트그래스트
Lifitegrast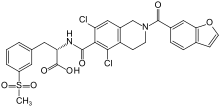 | |
| 임상자료 | |
|---|---|
| 상명 | 시드라 |
| 기타 이름 | SAR-118 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a616039 |
| 임신 , 카테고리 |
|
| 경로: 행정 | 안약 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.245.695 |
| 화학 및 물리적 데이터 | |
| 공식 | C29H24CL2N2O7S |
| 어금질량 | 615.48 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
시드라(/ˈzaɪdrə/)[1]라는 상표명으로 판매되는 라이프라이트그라스트는 각막염 시카라는 증후군인 안구건조증의 징후와 증상을 치료하는 약이다.Lifitegrast는 염증성 세포 결합을 억제하여 염증을 감소시킨다.[2]메이보미아선 기능장애, 염증성 건안구 등 건안치료를 위해 시클로스포린(Ikervis 또는 Restasis)과 함께 사용하는 경우가 많다.null
역효과
임상시험에서 흔히 볼 수 있는 부작용으로는 눈 자극, 불편함, 시야 흐림, 이상증(미각의 왜곡) 등이 있었다.[3]null
약리학
라이프라이트그래스트는 안약으로 공급된다.null
작용기전
Lifitegrast는 결합에서 세포간 접착 분자 1(ICAM-1)까지 통합 림프구 기능 관련 항원 1(LFA-1)을 억제한다.이 메커니즘은 T 림프구에 의해 매개되는 염증을 낮게 조절한다.[2][4]null
역사
라이프라이트그래스트는 당초 샤이어가 2013년 인수한 SARcode Bioscience가[5] 설계·개발한 것으로,[6] 2015년 3월 미국 식품의약국(FDA)에 신약 원서를 제출했다.FDA는 한 달 뒤 샤이어에게 우선 심사를 허가했고 2016년 1월 공급된 임상자료를 추가로 요청했고, 2016년 7월 11일 허가했다.[7][8]라이프라이트그래스트는 2018년 1월 캐나다 보건소에 의해 승인을 받았으며, 2018년 3월 현재 캐나다 약국에서 이용 가능하다.null
샤이어는 2018년 말 다케다제약에 인수됐다.[9]2019년 5월 노바티스는 라이프라이트그래스트와 관련된 자산을 매입하기로 합의했다.노바티스는 다케다에게 34억 달러의 선불금을 지급하고 후자의 제약회사는 19억 달러에 달하는 이정표 지불을 받을 자격이 있다.노바티스는 이 약이 2018년에 약 4억 달러의 수익을 올렸다고 언급했다.[10]null
참고 항목
- 레스타시스(각막하수막염 시카에 대한 시클로스포린 안약)
참조
- ^ "Patient information: Xiidra® (ZYE-druh) (lifitegrast ophthalmic solution) 5% for topical ophthalmic use" (PDF). Novartis. June 2020. Retrieved 2021-02-05.
- ^ a b Tauber J, Karpecki P, Latkany R, Luchs J, Martel J, Sall K, et al. (December 2015). "Lifitegrast Ophthalmic Solution 5.0% versus Placebo for Treatment of Dry Eye Disease: Results of the Randomized Phase III OPUS-2 Study". Ophthalmology. 122 (12): 2423–31. doi:10.1016/j.ophtha.2015.08.001. PMID 26365210.
- ^ Drugs.com: 시드라에 대한 환자 정보.
- ^ Murphy CJ, Bentley E, Miller PE, McIntyre K, Leatherberry G, Dubielzig R, et al. (May 2011). "The pharmacologic assessment of a novel lymphocyte function-associated antigen-1 antagonist (SAR 1118) for the treatment of keratoconjunctivitis sicca in dogs". Investigative Ophthalmology & Visual Science. 52 (6): 3174–80. doi:10.1167/iovs.09-5078. PMID 21330663.
- ^ Semba CP, Gadek TR (2016). "Development of lifitegrast: a novel T-cell inhibitor for the treatment of dry eye disease". Clinical Ophthalmology. 10: 1083–94. doi:10.2147/OPTH.S110557. PMC 4910612. PMID 27354762.
- ^ "Shire To Acquire Sarcode Bioscience, Expands Presence In Ophthalmology". 25 March 2013.
- ^ "FDA Approves Shire's Xiidra". 11 July 2016.
- ^ Drugs.com: 시드라(Lifeitegrast) FDA 승인 이력
- ^ "Takeda Completes Acquisition of Shire, Becoming a Global, Values-based, R&D-Driven Biopharmaceutical Leader". Takeda. January 8, 2019.
- ^ "Novartis to acquire Xiidra, expanding front-of-eye portfolio and strengthening leadership in eye care". Novartis (Press release). May 9, 2019.