비스무트(III)황화물
Bismuth(III) sulfide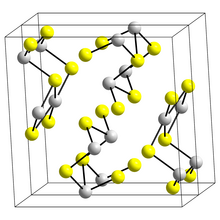 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 비스무트(III)황화물 | |
| 기타 이름 황화 비스무트 디비스무트 트리황화물 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.014.287 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
| |
| |
| 특성. | |
| Bi2S3 | |
| 어금질량 | 514.16 g/190 |
| 외관 | 갈색의 가루 |
| 밀도 | 6.78 g/cm3[1] |
| 녹는점 | 850C[1] 850 ˚ |
| 불용성인 | |
| 용해성 | 산으로 용해성. |
자기 감수성(magnetic susibility) | -123.0·10cm−63/192 |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 자극성 |
| GHS 라벨 표시: | |
 | |
| 경고 | |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 | |
| 관련 화합물 | |
기타 음이온 | 비스무트(III) 산화물 비스무트셀레나이드 비스무트 텔루라이드 |
기타 양이온 | 삼황화 비소 안티몬 트리황화 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
비스무트(III) 황화물은 비스무트와 유황의 화학 화합물이다. 광물 비스무틴트로서 자연에서 발생한다.
합성
비스무트(III) 황화물은 비스무트(III) 소금을 황화수소와 반응시켜 준비할 수 있다.
- 2Bi3+ +3H2S → Bi2S3 + 6H+
비스무트(III) 황화물은 또한 500 °C에서 96시간 동안 진공 실리카관에 있는 원소 비스무트와 원소 유황의 반응에 의해 준비될 수 있다.
- 2Bi + 3S → Bi2S3
특성.
비스무트(III) 황화물은 SbS23, stibnite와 함께 등구조적이다. 비스무트 원자는 두 개의 다른 환경에 있다. 두 환경 모두 7개의 좌표 비스무트 원자를 가지고 있다. 4개는 거의 평면 직사각형에 있고 3개는 더 떨어져서 불규칙한 7개의 조정 그룹을 만든다.[2]
그것은 냄새나는 황화수소 가스를 생산하기 위해 산과 반응할 수 있다.
비스무트(III) 황화물은 자연적으로 발생하는 황화물과 함께 일반적인 위장약 비스무트 서브실리실산염의 반응에 의해 체내에서 생성될 수 있다; 이것은 황화물이 입안에 있을 때 일시적인 검은 혀, 그리고 황화물이 대장에 있을 때 검은 대변을 일으킨다.
사용하다
그것은 많은 다른 비스무트 화합물을 생산하기 위한 시작 재료로 사용된다.[3]
참조
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ 웰스 A.F. (1984) 구조 무기 화학, 제5판 옥스퍼드 과학 간행물, ISBN 0-19-855370-6
- ^ 프라디오트 파트나이크. 무기 화학 약품 안내서. 맥그로힐, 2002 ISBN 0-07-049439-8