황산 은
Silver sulfate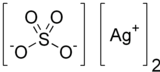 | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 황산 은(I) | |
| 기타 이름 황산 이실버 황산아르헨티나 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.030.581 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
| UN 번호 | 3077 |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| 아그소24 | |
| 어금질량 | 311.79 g·190−1 |
| 외관 | 무색 고체 |
| 냄새 | 무취 |
| 밀도 | 5.45 g/cm3(25°C) 4.84 g/cm3(660 °C)[1] |
| 녹는점 | 652.2–660 °C(1,206.0–1,220.0 °F; 925.4–933.1 K)[1][5] |
| 비등점 | 1,085 °C (1,985 °F; 1,358 K)[3][5] 분해 |
| 0.57 g/100 mL(0°C) 0.69 g/100 mL(10 °C) 0.83 g/100 mL(25 °C) 0.96 g/100 mL (40 °C) 1.33 g/100 mL (100 °C)[2] | |
용해성 제품(Ksp) | 1.2·10−5[1] |
| 용해성 | aq.산, 알코올, 아세톤, 에테르, 아세테, 아미드[2] 등에 용해된다. 에탄올에서[3] 불용성 |
| 황산내 용해성 | 8.4498 g/L(0.1 molH2SO4/LH2O)[2] 25.44 g/100 g(13°C) 31.56 g/100 g(24.5 °C) 127.01 g/100 g(96 °C)[3] |
| 에탄올 내 용해성 | 7.109 g/L(0.5 nEtOH/H2O)[2] |
| 아세트산 용해도 | 7AcOH/H2O.857 g/L(0.5 n)[2] |
자기 감수성(magnetic susibility) | -9.29·10cm−53/192[1] |
굴절률(nD) | nα = 1.756 nβ = 1.775 nγ = 1.782[4] |
| 구조 | |
| 정형외과, oF56[4] | |
| Fddd, 70번[4] | |
| 2/m 2/m 2/m[4] | |
a = 10.2699(5) å, b = 12.7069(7) å, c = 5.8181(3) å[4] α = 90°, β = 90°, γ = 90° | |
| 열화학 | |
열 용량 (C) | 131.4 J/몰·K[1] |
성 어금니 엔트로피 (S | 200.4 J/몰·K |
의 성 엔탈피 대형화 (ΔfH⦵298) | −715.9 kJ/mol[1] |
기브스 자유 에너지 (ΔfG˚) | −618.4 kJ/mol [1] |
| 위험 | |
| GHS 라벨 표시: | |
  [6] [6] | |
| 위험 | |
| H318, H410[6] | |
| P273, P280, P305+P351+P338, P501[6] | |
| NFPA 704(화재 다이아몬드) | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
황산은 AgSO라는24 공식을 가진 무기 화합물이다. 그것은 물에 용해성이 낮은 흰색 고체다.
준비 및 구조
황산은 질산 은의 수용액을 황산으로 처리했을 때 고체로서 침전된다.
- 2 AgNO3 + HSO24 → AgSO24 + 2 HNO3
질산염의 흔적을 배출하는 단계인 농축 황산에서 재분해하여 정제한다.[7] 황산은과 무수 황산나트륨은 같은 구조를 채택한다.[8]
황산 은(II)
은(은)의 합성.II) 단발성 은이온 대신 2분성 은이온을 가진 황산염(AgSO4)은 2010년[9] 은에 황산을 첨가하여 처음 보고되었다().II) 불소화(HF 탈출). 그것은 120 °C에서 산소의 진화와 피로황산염의 형성과 함께 외기적으로 분해되는 검은 고체다.
참조
- ^ a b c d e f g h Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c d e Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York: D. Van Nostrand Company. pp. 622–623.
- ^ a b c Anatolievich, Kiper Ruslan. "silver sulfate". Retrieved 2014-07-19.
- ^ a b c d e Morris, Marlene C.; McMurdie, Howard F.; Evans, Eloise H.; Paretzkin, Boris; Groot, Johan H. de; Hubbard, Camden R.; Carmel, Simon J. (June 1976). "13". Standard X-ray Diffraction Powder Patterns. Vol. 25. Washington: Institute for Materials Research National Bureau of Standards.
- ^ a b c "MSDS of Silver sulfate". Fisher Scientific, Inc. Retrieved 2014-07-19.
- ^ a b c 시그마알드리히 주식회사, 황산 은. 2014-07-19년에 검색됨.
- ^ O. Glemser; R. Sauer (1963). "Copper (I) Sulfate". In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 2pages=1042. NY, NY: Academic Press.
- ^ Zachariasen, W. H. (1932). "Note on the Crystal Structure of Silver Sulphate, Ag2SO4". Zeitschrift für Kristallographie - Crystalline Materials. 82 (1–6). doi:10.1524/zkri.1932.82.1.161.
- ^ Malinowski, P.; Derzsi, M.; Mazej, Z.; Jagličić, Z.; Gaweł, B.; Lasocha, W.; Grochala, W. (2010). "Ag(II)SO(4): A Genuine Sulfate of Divalent Silver with Anomalously Strong One-Dimensional Antiferromagnetic Interactions". Angewandte Chemie International Edition in English. 49 (9): 1683–1686. doi:10.1002/anie.200906863. PMID 20084660.



