뿌리결절
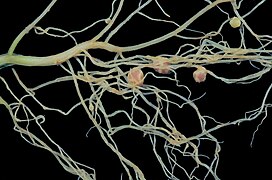
Root nodule뿌리 결절은 질소 고정 박테리아와 [1]공생하는 식물의 뿌리에서 발견됩니다.질소 제한 조건 하에서, 능력 있는 식물은 뿌리 [2]공포증으로 알려진 숙주 특이적인 박테리아 변종과 공생 관계를 형성합니다.이 과정은 로지드 [3]군락에서 발견되는 다른 종들뿐만 아니라 콩류 내에서 여러 번 진화했습니다.콩, 완두콩, 콩을 재배한다.
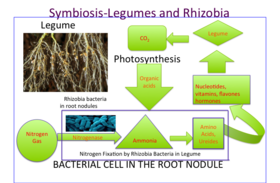
콩 뿌리 결절 내에서, 대기의 질소 가스 (N2)는 암모니아 (NH)로3 변환되고, 암모니아 (NH)는 아미노산 (단백질의 구성 요소), 뉴클레오티드 (DNA와 RNA의 구성 요소 및 중요한 에너지 분자 ATP), 그리고 비타민, 플라본, 호르몬과 같은 다른 세포 성분으로 동화됩니다.질소 가스를 고정하는 그들의 능력은 질소 비료에 대한 그들의 요구가 줄어들기 때문에 콩류를 이상적인 농업 생물로 만든다.실제로 질소 함량이 높으면 공생하는 식물에 아무런 이점이 없기 때문에 결절의 발달을 저해한다.결절의 질소 가스를 쪼개기 위한 에너지는 잎에서 옮겨진 설탕으로부터 옵니다.수크로스의 분해 생성물로서의 말산은 박테로이드의 직접 탄소원이다.결절 내 질소 고정은 산소에 매우 민감합니다.콩알은 동물 미오글로빈과 밀접한 관련이 있는 레가메모글로빈이라는 단백질을 함유하고 있어 호흡에 사용되는 산소가스의 확산을 촉진합니다.
공생
콩과
N2 고정에 기여하는 식물에는 칡, 정향, 콩, 알팔파, 루핀, 땅콩, 루이보스 등의 분류군이 있는 콩과인 파브과가 포함됩니다.그들은 결절 안에 뿌리 공포증이라고 불리는 공생 박테리아를 포함하고 있으며, 식물이 자라고 다른 식물들과 경쟁하는 데 도움을 주는 질소 화합물을 생산한다.식물이 죽으면, 고정된 질소가 방출되어 다른 식물들이 이용할 수 있게 되고, 이것은 [4][5]토양을 비옥하게 하는데 도움을 준다.대부분의 콩류는 이와 같은 연관성을 가지고 있지만, 몇몇 속(예: 스티프놀로비움)은 그렇지 않다.많은 전통적인 농업 관행에서, 밭은 이것을 이용하기 위해 주로 클로버와 같은 콩과 작물로 구성된 다양한 종류의 작물을 통해 순환된다.
Non-leguminous
질소 고정 뿌리 결절을 형성할 수 있는 식물의 대부분은 콩과인 파브과이지만, 몇 가지 예외가 있습니다.
- 올더와 베이베리 같은 방선동물들은 프랑키아 박테리아와의 공생 관계 덕분에 질소 고정 결절을 형성할 수 있습니다.이 식물들은 8개 [6]과에 분포하는 25개 속에 속합니다.1998년의 집계에 의하면, 이것은 약 200종을 포함하고 있으며, 근엽 공생체와 거의 같은 양의 질소 고정량을 차지한다.중요한 구조적 차이는 이러한 공생체에서는 박테리아가 [7]감염사로부터 절대 방출되지 않는다는 것이다.
- 대마초과의 열대속인 파라포니아는 뿌리 공포증과 상호작용하여 질소 고정 결절을 형성할 수 있다.관련 식물들이 활동하기 때문에,[8] 발전소는 진화 과정에서 "교환된 파트너"로 여겨진다.
질소를 고정하는 능력은 이 가족들에 보편적으로 존재하는 것과는 거리가 멀다.예를 들어, 장미과 122개 속 중 질소를 고정할 수 있는 것은 4개 속뿐입니다.이 모든 과는 Cucurbitales, Fagales, Rosales 과에 속하며, Fabales 과와 함께 유로화(유로화)의 질소 고정 분지(NFC)를 형성합니다.이 분류군에서, Fabales는 분기한 최초의 혈통이었다. 따라서 질소를 고정하는 능력은 플라시모형일 수 있고, 그 후 원래의 질소 고정 식물의 대부분의 후손에서 상실될 수 있다. 그러나, 이러한 모든 공통 조상의 초기 상태에서 기본적인 유전적, 생리학적 요건이 존재했을 수 있다.개미들 중 일부에서만 완전한 기능을 하도록 진화했습니다.
| 패밀리: 속 | ...... | ...... |
| ...... |
| ...... |
|
분류
결절의 두 가지 주요 유형은 콩과에서 설명되었습니다: 결정적과 [9]결정적이지 않습니다.
결정 결절은 글리신(콩), 페이즈오루스(일반 콩), 비냐(Vigna)와 같은 열대 콩의 특정 부족과 Lotus와 같은 온대 콩류에서 발견됩니다.이러한 결정결절은 개시 직후에 구형의 성숙한 결절의 결과로 세포 팽창에 기인한다.또 다른 유형의 결정 결절은 아라키스와 같은 다양한 허브, 관목, 나무에서 발견됩니다.이것들은 항상 측근 또는 부정근의 축삭과 관련되어 있으며, 뿌리털을 사용하지 않고 뿌리가 나오는 균열을 통해 감염 후에 형성된다.콩의 [10]결절과는 내부 구조가 상당히 다릅니다.
불확정결절은 온대지역이든 열대지역이든 세 아과의 콩류 대부분에서 발견된다.그것들은 피섬(pea), 메디카고(alfa), 트리폴리움(clover), 비시아(vicia)와 같은 파보이데아과 콩과와 같은 결절된 제왕절개류 콩과와 같은 모든 미모소이드 콩과에서 볼 수 있다.그들은 결절의 수명 동안 성장을 위한 새로운 세포를 생산하는 활동적인 정점근막을 유지하기 때문에 "미확정"이라는 이름을 얻었다.그 결과 결절은 대체로 원통형이며,[10] 광범위하게 분기될 수 있습니다.이들은 활발하게 성장하고 있기 때문에, 무한결절은 발달/상징의 [11][12][13]여러 단계를 구분하는 구역을 나타낸다.
- 존 I: 액티브한 메리스템.이것이 나중에 결절의 다른 구역으로 분화할 새로운 결절 조직이 형성되는 곳입니다.
- 구역 II: 감염 구역.이 구역은 세균으로 가득 찬 감염실로 가득 차 있다.식물 세포는 이전 구역보다 더 크고 세포 분열이 중단됩니다.
- 구역 III—질소 고정 구역.이 구역의 각 세포는 큰 중심 액포를 포함하고 세포질은 질소를 활발하게 고정시키는 완전히 분화된 박테로이드로 채워집니다.그 식물은 이 세포들에게 레그헤모글로빈을 공급하여 뚜렷한 분홍색을 만들어낸다.
- 존 IV: 노인성 존.식물 세포와 그 박테로이드 함량이 저하되고 있다.레그헤모글로빈의 헴 성분이 분해되면 결절 하부에 눈에 보이는 녹색이 나타납니다.
이것은 가장 널리 연구되고 있는 결절의 종류이지만, 땅콩과 친척의 결절과 표피를 통한 뿌리공포증의 직접적인 감염에 따라 결절이 형성되는 루핀과 같은 다른 중요한 작물의 세부 사항은 상당히 다르다.결절은 뿌리 주변에서 자라며 옷깃과 같은 구조를 형성합니다.이러한 결절과 땅콩 타입에서는 중앙 감염 조직이 균일하며 콩의 결절과 콩과 클로버와 같은 많은 불확정 타입에서 볼 수 있는 감염되지 않은 엘이 결여되어 있다.
액티노리잘형 결절은 비레짐에서 발견되는 현저한 다른 구조이다.이 형태에서, 뿌리 피질에서 유래한 세포는 감염된 조직을 형성하고, 프리노듈은 성숙한 결절의 일부가 된다.겉으로 보기에 큰 차이에도 불구하고, 단일 동종 [14]돌연변이에 의해 콩류에서 그러한 결절을 생성하는 것이 가능하다.
Nodulation
콩은 뿌리에서 플라보노이드라고 불리는 2차 대사물로 유기 화합물을 방출하는데, 이것은 뿌리 공포증을 그들에게 끌어당기고 또한 결절 인자를 생성하고 결절 [15][16]형성을 시작하기 위해 박테리아에서 결절 유전자를 활성화시킨다.이러한 결절 인자는 뿌리털 컬링을 시작합니다.컬링은 뿌리털의 끝부분이 Rhizobium 주변을 컬링하는 것으로 시작합니다.뿌리 끝에는, 감염 실이라고 불리는 작은 튜브가 형성되어 있는데, 이것은 뿌리 털이 계속 [17]말리면서 뿌리 표피 세포로 이동하는 경로를 제공합니다.
부분 컬링은 노드 [16]팩터만으로도 가능합니다.이는 결절 인자의 분리와 뿌리 털의 일부에 대한 적용으로 입증되었다.뿌리털은 응용하는 방향으로 컬링되며, 뿌리털이 박테리아 주위를 컬링하려는 움직임을 보여줍니다.심지어 옆 뿌리에 바르면 컬링이 발생했어요.이것은 [16]컬링의 자극을 일으키는 박테리아가 아니라 노드 팩터 그 자체라는 것을 증명했다.
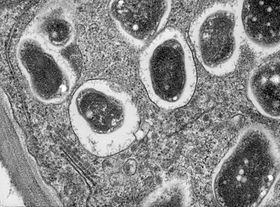
결절 인자가 뿌리에 의해 감지될 때, 많은 생화학적, 형태학적 변화가 일어납니다: 세포 분열이 뿌리를 만들기 위해 유발되고, 뿌리 털의 성장은 박테리아가 하나 이상의 박테리아를 완전히 캡슐화할 때까지 여러 번 구르도록 수정됩니다.캡슐화된 박테리아는 여러 번 분열하여 미세 콜로니를 형성합니다.이 미세콜로니에서 세균은 감염실을 통해 발달하는 결절 안으로 들어가 뿌리털을 통해 표피세포 기저부로 성장한 후 식물 유래의 공생체 막으로 둘러싸여 [18]질소를 고정하는 박테로이드로 분화한다.
효과적인 결절은 작물을 심은 후 약 4주 후에 이루어지며, 작물에 따라 결절의 크기와 모양이 달라집니다.콩이나 땅콩 같은 작물은 질소 필요량이 높기 때문에 붉은 클로버 같은 사료용 콩류보다 결절이 더 클 것이다.결절의 수와 내부 색상은 [19]식물의 질소 고정 상태를 나타냅니다.
결절은 외부(열, 산성 토양, 가뭄, 질산염)와 내부(결절의 자가 조절, 에틸렌)의 다양한 프로세스에 의해 제어된다.결절의[20] 자동조절은 잎을 포함한 체계적 과정을 통해 식물당 결절 수를 조절한다.잎조직은 알 수 없는 화학신호를 통해 뿌리의 초기 결절현상을 감지한 후 새롭게 발달하는 뿌리조직에서 더 이상의 결절발달을 제한한다.류신 리치 리피트(LRR) 수용체 키나아제(콩에서는 NARK, Lotus Japonicus에서는 HAR1, Medicago Trunkatula에서는 SUNN)는 결절의 자가 조절(AON)에 필수적이다.이러한 AON 수용체 키나아제에서 기능 상실을 초래하는 돌연변이는 과변조 또는 과변조를 초래한다.종종 뿌리 성장 이상은 AON 수용체 키나아제 활성의 상실을 동반하며, 이는 결절 성장과 뿌리 발달이 기능적으로 관련이 있음을 시사한다.결절 형성 메커니즘에 대한 조사 결과, 12–13 아미노산 단백질을 코드화한 ENOD40 유전자는 결절 형성 중에 상향 조절된다[3].
뿌리 구조에 연결
뿌리결절은 파바과 내에서 세 번 진화한 것으로 보이지만, 그 과 이외에서는 드물다.이러한 식물의 뿌리 결절 발달 경향은 뿌리 구조와 관련이 있는 것으로 보인다.특히 아브시스산에 대한 반응으로 측근을 발달시키는 경향은 뿌리결절의 [21]후발화를 가능하게 할 수 있다.
Nodule-like 구조
몇몇 곰팡이들은 그들의 식물 숙주의 뿌리에서 결핵성 외균근으로 알려진 결절 구조를 만들어냅니다.예를 들어, 수실루스 토멘토수스는 식물 숙주 로지폴 파인(Pinus contorta var)과 함께 이러한 구조물을 생산한다.라티폴리아)이 구조들은 상당한 양의 질소를 기여하고 소나무가 영양분이 부족한 곳에 [22]정착하도록 하는 질소 고정 박테리아를 숙주하는 것으로 나타났다.
갤러리
Vicia Faba 뿌리의 결절입니다.
콩뿌리.
호비니아 의사 아카시아 결절
파브과 뿌리 결절.
메디카고 이탤리카 결절이요
쿠페아(Vigna unguiculata spp.) 뿌리.
「 」를 참조해 주세요.
레퍼런스
- ^ Wagner SC (2011). "Biological Nitrogen Fixation". Nature Education Knowledge. 3 (10): 15.
- ^ Wang, Qi & Yang, Shengming (2017). "Host-secreted antimicrobial peptide enforces symbiotic selectivity in Medicago truncatula". PNAS. 114 (26): 6854–6859. doi:10.1073/pnas.1700715114. PMC 5495241. PMID 28607058.
- ^ Doyle, J. J. & Luckow, M. A. (2003). "The Rest of the Iceberg. Legume Diversity and Evolution in a Phylogenetic Context". Plant Physiology. 131 (3): 900–910. doi:10.1104/pp.102.018150. PMC 1540290. PMID 12644643.
- ^ Postgate, J. (1998). Nitrogen Fixation, 3rd Edition. Cambridge University Press, Cambridge UK.
- ^ Smil, V (2000). Cycles of Life. Scientific American Library.
- ^ Dawson, J. O. (2008). "Ecology of actinorhizal plants". Nitrogen-fixing Actinorhizal Symbioses. Nitrogen Fixation: Origins, Applications, and Research Progress. Vol. 6. Springer. pp. 199–234. doi:10.1007/978-1-4020-3547-0_8. ISBN 978-1-4020-3540-1. S2CID 85913801.
- ^ Jeff J. Doyle (1998). "Phylogenetic perspectives on nodulation: evolving views of plants and symbiotic bacteria". Trends in Plant Science. 3 (12): 473–778. doi:10.1016/S1360-1385(98)01340-5.
- ^ Op den Camp, Rik; Streng, A.; et al. (2010). "LysM-Type Mycorrhizal Receptor Recruited for Rhizobium Symbiosis in Nonlegume Parasponia". Science. 331 (6019): 909–912. Bibcode:2011Sci...331..909O. doi:10.1126/science.1198181. PMID 21205637. S2CID 20501765.
- ^ Martin Crespi & Susana Gálvez (2000). "Molecular Mechanisms in Root Nodule Development". Journal of Plant Growth and Regulation. 19 (2): 155–166. doi:10.1007/s003440000023. PMID 11038225. S2CID 22216527.
- ^ a b Sprent 2009, Legume 결절: 글로벌 관점.와일리-블랙웰
- ^ Fabrice Foucher & Eva Kondorosi (2000). "Cell cycle regulation in the course of nodule organogenesis in Medicago". Plant Molecular Biology. 43 (5–6): 773–786. doi:10.1023/A:1006405029600. PMID 11089876. S2CID 11658948.
- ^ Hannah Monahan-Giovanelli; Catalina Arango Pinedo & Daniel J. Gage (2006). "Architecture of Infection Thread Networks in Developing Root Nodules Induced by the Symbiotic Bacterium Sinorhizobium meliloti on Medicago truncatula". Plant Physiology. 140 (2): 661–670. doi:10.1104/pp.105.072876. PMC 1361332. PMID 16384905.
- ^ Willem Van de Velde; Juan Carlos Pérez Guerra; Annick De Keyser; Riet De Rycke; et al. (2006). "Aging in Legume Symbiosis. A Molecular View on Nodule Senescence in Medicago truncatula". Plant Physiology. 141 (2): 711–20. doi:10.1104/pp.106.078691. PMC 1475454. PMID 16648219.
- ^ Shen, Defeng; Xiao, Ting Ting; van Velzen, Robin; Kulikova, Olga; Gong, Xiaoyun; Geurts, René; Pawlowski, Katharina; Bisseling, Ton (June 2020). "A Homeotic Mutation Changes Legume Nodule Ontogeny into Actinorhizal-Type Ontogeny". The Plant Cell. 32 (6): 1868–1885. doi:10.1105/tpc.19.00739. PMC 7268803. PMID 32276984.
- ^ Eckardt NA (June 2006). "The Role of Flavonoids in Root Nodule Development and Auxin Transport in Medicago truncatula". The Plant Cell. 18 (7): 1539–1540. doi:10.1105/tpc.106.044768. PMC 1488913.
- ^ a b c Esseling JJ, Lhuissier FG, Emons AM (August 2003). "Nod factor-induced root hair curling: continuous polar growth towards the point of nod factor application". Plant Physiology. 132 (4): 1982–8. doi:10.1104/pp.103.021634. PMC 181283. PMID 12913154.
- ^ Slonczewski J, Foster JW (2017). Microbiology: An Evolving Science (Fourth ed.). New York. ISBN 978-0393614039. OCLC 951925510.
- ^ Mergaert, P.; Uchiumi, T.; Alunni, B.; Evanno, G.; Cheron, A.; Catrice, O.; et al. (2006). "Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis". PNAS. 103 (13): 5230–35. Bibcode:2006PNAS..103.5230M. doi:10.1073/pnas.0600912103. ISSN 1091-6490. PMC 1458823. PMID 16547129. Online.
- ^ Adjei, M. B. "Nitrogen Fixation and Inoculation of Forage Legumes" (PDF). University of Florida. Archived from the original (PDF) on December 2, 2016. Retrieved December 1, 2016.
- ^ Reid, DE; Ferguson, BJ; Hayashi, S; Lin, YH; Gresshoff, PM (October 2011). "Molecular mechanisms controlling legume autoregulation of nodulation". Annals of Botany. 108 (5): 789–95. doi:10.1093/aob/mcr205. PMC 3177682. PMID 21856632.
- ^ Yan Liang & Jeanne M. Harris (2005). "Response of root branching to abscisic acid is correlated with nodule formation both in legumes and nonlegumes". American Journal of Botany. 92 (10): 1675–1683. doi:10.3732/ajb.92.10.1675. PMID 21646084.
- ^ Paul, L.R.; Chapman, B.K.; Chanway, C.P. (2007). "Nitrogen Fixation Associated with Suillus tomentosus Tuberculate Ectomycorrhizae on Pinus contorta var. latifolia". Annals of Botany. 99 (6): 1101–1109. doi:10.1093/aob/mcm061. PMC 3243579. PMID 17468111.