황산염산화효소
Sulfite oxidase| 황산염 산화효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
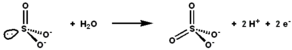 황산염 산화효소는 황산염과 물의 산화저감 반응을 촉진시켜 황산염을 산출한다. | |||||||||
| 식별자 | |||||||||
| EC 번호 | 1.8.3.1 | ||||||||
| CAS 번호. | 9029-38-3 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| 진 온톨로지 | 아미고 / 퀵고 | ||||||||
| |||||||||
| 수옥스 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | SUOX, 엔트레스:6821, 황산염 산화효소 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 606887 MGI: 2446117 호몰로진: 394 GeneCard: SUOX | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 12: 56 – 56.01Mb | Chr 10: 128.67 – 128.67Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
황산염 산화효소(EC 1.8.3.1)는 효모를 제외한 모든 진핵생물의 미토콘드리아 내 효소다.[citation needed] 황산염을 황산염으로 산화시키고 시토크롬 c를 통해 생산된 전자를 전자전달체인으로 전달해 산화인산화 ATP 생성을 가능하게 한다.[5][6][7] 이것이 황 함유 화합물의 신진대사의 마지막 단계로 황산염은 배설된다.
Sulfite oxidase는 몰리브도프테린 공효소와 헤메군(동물의 경우)을 활용한 야금이다. 사이토크롬 b5 중 하나로, 몰리브덴 옥소트란스페라제의 효소 슈퍼패밀리에 속하며, DMSO 환원효소, 크산틴 산화효소, 니트라이트 환원효소도 포함한다.
포유류에서 황산염의 발현량은 간, 신장, 심장 등에서 높으며 비장, 뇌, 골격근, 혈액에서도 매우 낮다.
구조
호모디머로서, 황산염 산화효소는 N-단자 영역과 C-단자 영역을 가진 두 개의 동일한 서브유닛을 포함한다. 이 두 영역은 루프를 형성하는 10개의 아미노산으로 연결되어 있다. N-단자 영역은 인접한 세 개의 대척점 베타 시트와 다섯 개의 알파 헬리컬을 가진 헤메 공동 인자(hememe coactor를 가지고 있다. C-단자 영역에는 13개의 베타 시트와 3개의 알파 헬리코스로 둘러싸인 몰리브도프테린 공동 계수가 있다. 몰리브도프테린 코팩터에는 시스틴에서 나오는 유황과 피라노프테린에서 나오는 엔에디티올레이트, 그리고 두 개의 단자 옥시겐이 접합되어 있는 Mo(VI) 센터가 있다. 이 몰리브덴 중심부에서 황산염의 촉매 산화가 일어난다.
엔에디티올레이트를 통해 몰리브덴 중심을 조정하는 피라노프테린 리간드. 몰리브데넘 중심은 사각 피라미드 기하학을 가지고 있으며, 위쪽이 아닌 아래쪽을 향한 황소 그룹의 방향에 의해 크산틴 산화효소 계열과 구별된다.
활성 사이트 및 메커니즘
황산염 활성 부위는 몰리밥도프테린 코팩터를 함유하고 있으며, 최고 산화상태인 +6(MoVI)에서 몰리브덴을 지원한다. 효소의 산화상태에서 몰리브덴은 시스틴 티올레이트, 몰리브도프테린의 디티올렌 그룹, 그리고 두 개의 단자 산소원자(옥소)에 의해 조정된다. 황산염과 반응하면 1개의 산소 원자가 황산염으로 옮겨져 황산염을 생성하며 몰리브덴 중심은 2개의 전자가 모에IV 감소하여 황산염을 대체하고, 2개의 양성자(H+)와 2개의 전자(e−)를 제거하면 활성 부위가 원상태로 되돌아간다. 이 산소 원자 전달 효소의 주요 특징은 전달되는 산소 원자가 다이옥시겐(O2)이 아닌 물에서 발생한다는 점이다.
전자는 몰리브덴에서 헤메 그룹으로 한 번에 하나씩 전달되며, 헤메 그룹은 시토크롬 c와 반응하여 효소를 다시 산화시킨다. 이 반응에서 나온 전자는 전자 전송 체인(ETC)으로 들어간다.
이 반응은 일반적으로 속도 제한 반응이다. 황산염과 효소의 반응에 따라 2전자가 감소한다. 효소의 재축소로 보이는 음전위는 산화 상태가 선호된다는 것을 보여준다.
모 효소 종류 중 황산염 산화효소가 가장 쉽게 산화된다. 낮은 pH 조건에서는 산화 반응이 부분적으로 속도 제한이 된다.
결핍증
황산 산화효소는 식품 내 황 함유 아미노산 시스테인과 메티오닌을 대사하기 위해 필요하다. 기능성 황산염 산화효소가 부족하면 황산염 산화효소 결핍으로 알려진 질환을 일으킨다. 이 희귀하지만 치명적인 질병은 신경 장애, 정신 지체, 신체적 기형, 뇌 기능 저하, 그리고 죽음을 초래한다. 기능성 황산염 산화효소가 부족한 이유로는 효소 내 몰리밥터인 공동 인자 부재와 점 돌연변이로 이어지는 유전적 결함이 있다.[8] G473D 돌연변이는 인간 황산염 산화효소의 조광과 카탈루션을 손상시킨다.[9][10]
참고 항목
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000139531 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000049858 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ D'Errico G, Di Salle A, La Cara F, Rossi M, Cannio R (January 2006). "Identification and characterization of a novel bacterial sulfite oxidase with no heme binding domain from Deinococcus radiodurans". J. Bacteriol. 188 (2): 694–701. doi:10.1128/JB.188.2.694-701.2006. PMC 1347283. PMID 16385059.
- ^ Tan WH, Eichler FS, Hoda S, Lee MS, Baris H, Hanley CA, Grant PE, Krishnamoorthy KS, Shih VE (September 2005). "Isolated sulfite oxidase deficiency: a case report with a novel mutation and review of the literature". Pediatrics. 116 (3): 757–66. doi:10.1542/peds.2004-1897. PMID 16140720. S2CID 6506338.
- ^ Cohen HJ, Betcher-Lange S, Kessler DL, Rajagopalan KV (December 1972). "Hepatic sulfite oxidase. Congruency in mitochondria of prosthetic groups and activity". J. Biol. Chem. 247 (23): 7759–66. doi:10.1016/S0021-9258(19)44588-2. PMID 4344230.
- ^ Karakas E, Kisker C (November 2005). "Structural analysis of missense mutations causing isolated sulfite oxidase deficiency". Dalton Transactions (21): 3459–63. doi:10.1039/b505789m. PMID 16234925.
- ^ Wilson HL, Wilkinson SR, Rajagopalan KV (February 2006). "The G473D mutation impairs dimerization and catalysis in human sulfite oxidase". Biochemistry. 45 (7): 2149–60. doi:10.1021/bi051609l. PMID 16475804.
- ^ Feng C, Tollin G, Enemark JH (May 2007). "Sulfite oxidizing enzymes". Biochim. Biophys. Acta. 1774 (5): 527–39. doi:10.1016/j.bbapap.2007.03.006. PMC 1993547. PMID 17459792.
추가 읽기
- 키스커, C. "설파이트 산화효소", 메서쉬킴트, A.; 휴버, R.; 폴로스, T.; 위그하르트, K. eds. Metaloproteins 핸드북, 제2권; John Wiley and Sons, Ltd: New York, 2002
- Feng C, Wilson HL, Hurley JK, et al. (2003). "Essential role of conserved arginine 160 in intramolecular electron transfer in human sulfite oxidase". Biochemistry. 42 (42): 12235–42. doi:10.1021/bi0350194. PMID 14567685.
- Lee HF, Mak BS, Chi CS, et al. (2002). "A novel mutation in neonatal isolated sulphite oxidase deficiency". Neuropediatrics. 33 (4): 174–9. doi:10.1055/s-2002-34491. PMID 12368985.
- Steinberg KK, Relling MV, Gallagher ML, et al. (2007). "Genetic studies of a cluster of acute lymphoblastic leukemia cases in Churchill County, Nevada". Environ. Health Perspect. 115 (1): 158–64. doi:10.1289/ehp.9025. PMC 1817665. PMID 17366837.
- Kimura K, Wakamatsu A, Suzuki Y, et al. (2006). "Diversification of transcriptional modulation: large-scale identification and characterization of putative alternative promoters of human genes". Genome Res. 16 (1): 55–65. doi:10.1101/gr.4039406. PMC 1356129. PMID 16344560.
- Wilson HL, Wilkinson SR, Rajagopalan KV (2006). "The G473D mutation impairs dimerization and catalysis in human sulfite oxidase". Biochemistry. 45 (7): 2149–60. doi:10.1021/bi051609l. PMID 16475804.
- Hoffmann C, Ben-Zeev B, Anikster Y, et al. (2007). "Magnetic resonance imaging and magnetic resonance spectroscopy in isolated sulfite oxidase deficiency". J. Child Neurol. 22 (10): 1214–21. doi:10.1177/0883073807306260. PMID 17940249. S2CID 24050167.
- Johnson JL, Coyne KE, Garrett RM, et al. (2002). "Isolated sulfite oxidase deficiency: identification of 12 novel SUOX mutations in 10 patients". Hum. Mutat. 20 (1): 74. doi:10.1002/humu.9038. PMID 12112661. S2CID 45465780.
- Woo WH, Yang H, Wong KP, Halliwell B (2003). "Sulphite oxidase gene expression in human brain and in other human and rat tissues". Biochem. Biophys. Res. Commun. 305 (3): 619–23. doi:10.1016/S0006-291X(03)00833-7. PMID 12763039.
- Feng C, Wilson HL, Tollin G, et al. (2005). "The pathogenic human sulfite oxidase mutants G473D and A208D are defective in intramolecular electron transfer". Biochemistry. 44 (42): 13734–43. doi:10.1021/bi050907f. PMID 16229463.
- Tan WH, Eichler FS, Hoda S, et al. (2005). "Isolated sulfite oxidase deficiency: a case report with a novel mutation and review of the literature". Pediatrics. 116 (3): 757–66. doi:10.1542/peds.2004-1897. PMID 16140720. S2CID 6506338.
- Astashkin AV, Johnson-Winters K, Klein EL, et al. (2008). "Structural studies of the molybdenum center of the pathogenic R160Q mutant of human sulfite oxidase by pulsed EPR spectroscopy and 17O and 33S labeling". J. Am. Chem. Soc. 130 (26): 8471–80. doi:10.1021/ja801406f. PMC 2779766. PMID 18529001.
- Dronov R, Kurth DG, Möhwald H, et al. (2008). "Layer-by-layer arrangement by protein-protein interaction of sulfite oxidase and cytochrome c catalyzing oxidation of sulfite". J. Am. Chem. Soc. 130 (4): 1122–3. doi:10.1021/ja0768690. PMID 18177044.
- Edwards MC, Johnson JL, Marriage B, et al. (1999). "Isolated sulfite oxidase deficiency: review of two cases in one family". Ophthalmology. 106 (10): 1957–61. doi:10.1016/S0161-6420(99)90408-6. PMID 10519592.
- Gerhard DS, Wagner L, Feingold EA, et al. (2004). "The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC)". Genome Res. 14 (10B): 2121–7. doi:10.1101/gr.2596504. PMC 528928. PMID 15489334.
- Rudolph MJ, Johnson JL, Rajagopalan KV, Kisker C (2003). "The 1.2 A structure of the human sulfite oxidase cytochrome b(5) domain". Acta Crystallogr. D. 59 (Pt 7): 1183–91. doi:10.1107/S0907444903009934. PMID 12832761.
- Feng C, Wilson HL, Hurley JK, et al. (2003). "Role of conserved tyrosine 343 in intramolecular electron transfer in human sulfite oxidase". J. Biol. Chem. 278 (5): 2913–20. doi:10.1074/jbc.M210374200. PMID 12424234.
- Neumann M, Leimkühler S (2008). "Heavy metal ions inhibit molybdoenzyme activity by binding to the dithiolene moiety of molybdopterin in Escherichia coli". FEBS J. 275 (22): 5678–89. doi:10.1111/j.1742-4658.2008.06694.x. PMID 18959753. S2CID 45452761.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2002). "Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences". Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899–903. doi:10.1073/pnas.242603899. PMC 139241. PMID 12477932.
- Wilson HL, Rajagopalan KV (2004). "The role of tyrosine 343 in substrate binding and catalysis by human sulfite oxidase". J. Biol. Chem. 279 (15): 15105–13. doi:10.1074/jbc.M314288200. PMID 14729666.
- Hakonarson H, Qu HQ, Bradfield JP, et al. (2008). "A novel susceptibility locus for type 1 diabetes on Chr12q13 identified by a genome-wide association study". Diabetes. 57 (4): 1143–6. doi:10.2337/db07-1305. PMID 18198356.
외부 링크
- 미국 국립 의학 도서관의 Sulfite+oxidase (MesH) 제목
- 사르카르 그룹의 연구활동
- PDBe-KB는 인간 황산염 산화효소, 미토콘드리아에 대해 PDB에서 이용할 수 있는 모든 구조 정보의 개요를 제공한다.







