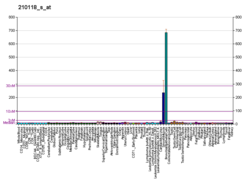
IL1A
IL1A| IL1A | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 에일리어스 | IL1A, IL-1A, IL1, IL1-ALPA, IL1F1, 인터류킨1α, IL-1α | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 외부 ID | OMIM: 147760 MGI: 96542 HomoloGene: 480 GeneCard: IL1A | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
헤마토포이에틴 1이라고도 불리는 인터류킨 1 알파(IL-1α)는 IL1A [5][6]유전자에 의해 인간에서 암호화되는 인터류킨 1 패밀리의 사이토카인이다.일반적으로 인터류킨 1은 발열과 패혈증을 촉진할 뿐만 아니라 염증을 일으키는 역할을 한다.IL-1α 억제제는 이러한 과정을 방해하고 질병을 치료하기 위해 개발되고 있다.
IL-1α는 호중구, 상피세포, 내피세포뿐만 아니라 활성화된 대식세포에 의해 주로 생성된다.그것은 대사, 생리적, 조혈 활동을 가지고 있고 면역 반응 조절에서 중심적인 역할 중 하나를 한다.그것은 인터류킨-1 [7][8]수용체에 결합한다.종양괴사인자 알파를 활성화하는 경로 상에 있다.
검출
인터류킨 1호는 1972년 [9][10][11]게리에 의해 발견되었다.그는 그것이 림프구 마이트겐이었기 때문에 그것을 림프구 활성화인자(LAF)라고 이름 붙였다.1985년이 되어서야 인터류킨 1은 현재 인터류킨 1 알파와 인터류킨 1 [6]베타라고 불리는 두 개의 다른 단백질로 구성되어 있다는 것이 발견되었다.
대체 이름
IL-1α는 섬유아세포활성화인자(FAF), 림프구활성화인자(LAF), B세포활성화인자(BAF), 백혈구내생중개인자(LEM), 표피세포유래흉선활성화인자(ETAF), 혈청아밀로이드유도인자(AmyloID) 또는 간세포자극인자(AF)로도 알려져 있다.분해유도인자(PIF)
합성 및 구조
IL-1α는 초기에 합성된 전구체의 구조가 신호 펩타이드 단편을 포함하지 않는다는 점에서 사이토카인족에서 유일한 구성원이다(IL-1β 및 IL-18도 동일).특정 단백질 분해 효소에 의한 N 말단 아미노산의 제거에 의해 처리된 후, 생성된 펩타이드는 "성숙" 형태라고 불립니다.칼슘 활성 시스테인 단백질 분해효소인 칼파인(Calpain)은 혈장막과 관련되어 IL-1α 전구체를 성숙한 [12]분자로 분해하는 데 주로 책임이 있다.IL-1α의 31kDa 전구체 형태와 18kDa 성숙 형태 모두 생물학적으로 활성입니다.
31kDa IL-1α 전구체는 거친 소포체와 관련된 리보솜에서 번역되는 대부분의 분비 단백질과는 달리 세포골격 구조(마이크로튜브)와 함께 합성된다.
IL-1α의 3차원 구조는 완전히 베타-완성된 가닥으로 구성된 개방된 배럴을 포함합니다.IL-1α의 성숙한 형태에 대한 결정 구조 분석 결과 IL-1 수용체에 결합하는 두 개의 부위가 있는 것으로 나타났다.배럴의 열린 꼭대기에는 IL-1β와 유사하지만 동일하지는 않은 1차 결합[13] 부위가 있습니다.
생산 및 셀룰러 소스
IL-1α는 상피세포로 구성되어 있다.정상인 표피에서 다량으로 발견되며 살아있는 표피 세포와 [13][14][15]각질층 사이에 1:1 비율로 분포한다.건강한 표피 각질세포에 의한 다량의 IL-1α 전구체의 구성 생산은 피부를 장벽으로 가정할 때 면역 반응에서 IL-1α의 중요한 역할을 방해하여 병원성 미생물의 체내 진입을 막는다.
IL-1α의 피부 장벽 기능 유지에 있어, 특히 [16]연령이 증가함에 따라, IL-1α의 핵심적인 역할은 표피에서 IL-1α 구성 생성에 대한 추가적인 설명입니다.
피부 각질세포, 일부 상피세포 및 중추신경계의 특정 세포를 제외하고, IL-1α(따라서 IL-1α 자체)를 코드하는 mRNA는 광범위한 생리학적, 대사적, 조혈학적, 면역학적 IL-1α 활동에도 불구하고 대부분의 세포 유형, 조직 및 혈액에서 건강에서 관찰되지 않는다.
자극할 때마다 다른 세포의 다양한, 제작하는 IL-1α,[17]의 그들 중에는 선행 모습이 섬유 아세포, 대식 세포, 과립구, 산호성 백혈구, 마스트 세포와 basophils, 내피 세포, 혈소판, monocytes과 골수성 세포 라인, 혈액 T-lymphocytes과 B-lymphocytes, astrocytes,은 IL-1α 유전자'도록 유도할 수 있다.아이나이 메산지아 세포, 랑게르한스 세포, 피부 수지상 세포, 자연 킬러 세포, 큰 과립 림프구, 미세글리아, 혈액 호중구, 림프절 세포, 산모 태반 세포 및 여러 다른 세포 유형.
IL1A는 노화 세포 표면에서 발견되며, 노화 관련 분비 표현형([18]SASP) 인자의 생성에 기여한다.
이러한 데이터는 IL-1α가 일반적으로 표피 사이토카인임을 시사한다.
상호 작용
IL1A는 HAX1 [19]및 NDN과 [20]상호 작용하는 것으로 나타났습니다.
IL-1α는 다른 사이토카인과 많은 상호작용이 있지만, 가장 일관되고 임상적으로 가장 관련이 있는 것은 TNF와의 상승성이다. IL-1α와 TNF는 둘 다 발열과 염증을 촉진하는 급성상 사이토카인이다.실제로 IL-1α와 TNFα 간의 상승 효과가 입증되지 않은 예는 거의 없습니다.여기에는 방사선 방호, 슈워츠만 반응, PGE2 합성, 질병 행동, 일산화질소 생산, 신경 성장인자 합성, 인슐린 저항성, 평균 체질량 손실, IL-8 및 케모카인 [21]합성이 포함된다.
IL1A의 mRNA 변환은 mTOR [22]활성에 크게 의존합니다.IL1A와 NF-δB는 정피드백 [23][18]루프에서 서로 유도한다.
조절 분자
IL-1α 활성에 가장 중요한 조절 분자는 IL-1Ra로, 보통 10배에서 100배 이상의 몰 [24]초과로 생성됩니다.IL-1R형 I의 수용성 형태는 IL-1α에 대한 친화력이 높고 5~10몰 초과로 제조된다.IL-10은 또한 IL-1α [25]합성을 억제한다.
생물학적 활동
시험관내
IL-1α는 피코몰에서 대퇴골 범위에 있는 세포에 생물학적 영향을 미친다.특히 IL-1α:
- 유도 IL-1α 분비를 위해 각질세포와 대식세포를 자극하는
- 프로콜라겐 I형 및 III형 합성을 유도하다
- 섬유아세포의 증식을 유발하고 콜라게나아제 분비를 유도하며 세포골격 재배치를 유도하고 IL-6 및 GCSF 분비를 유도한다.
- 시클로시게나아제 합성과 프로스타글란딘 PGE2 방출을 유도하는
- 열충격 단백질의 인산화를 일으키다
- 평활근세포, 각질세포의 증식을 일으키고 각질세포에 의한 다른 사이토카인의 분비를 촉진한다.
- 는 내피세포에 의한 TNFα 방출과 골세포에서 Ca2+ 방출을 유도합니다.
- 급성 단백질 분비를 위해 간세포를 자극하다
- CD4+세포 증식을 유도하고, IL-2 생산을 유도하며, CD8+/IL-1R+세포를 공동 자극하고, 성숙한 B세포와 면역글로불린 분비를 유도한다.
- 제한된 수의 종양세포를 죽인다
생체내
IL-1α는 유기체에 대한 감염이 시작된 직후 일련의 면역 시스템 반응 과정을 활성화합니다.특히 IL-1α:
- 섬유아세포의 증식을 촉진하다
- 단백질 분해효소 합성, 후속 근육 단백질 분해, 혈액 내 모든 유형의 아미노산 방출을 유도하고 급성상 단백질 합성을 자극한다.
- 구리를 증가시키고 혈액 속의 아연과 철분 농도를 감소시킴으로써 혈장의 금속 이온 성분을 변화시킨다
- mTOR[22][23] 활성의 결과로 노화 전지에 의한 SASP 인자의 생성을 유도한다.
- 혈중 호중구를 증가시키다
- 림프구 증식을 촉진하여 발열을 유발하다
국소 투여된 IL-1α는 또한 FGF 및 EGF의 발현과 후속 섬유아세포 및 각질세포 증식을 자극한다.이는 각질세포에 IL-1α 전구체가 대량 축적되어 있는 것과 더불어 국소적으로 방출되는 IL-1α가 중요한 역할을 하고 상처치유를 가속화할 수 있음을 시사한다.
IL-1α는 아마도 [26][27]헤모포에틴-1 [28]활성의 결과로 생쥐의 치사량의 γ-방사선에 대해 보호하는 것으로 알려져 있다.
적용들
제약
동물의 보호 연구를 모방하도록 [21]특별히 설계된 IL-1α에 대한 임상 시험이 수행되었습니다.IL-1α는 자가 골수이식을 [29]받는 동안 환자에게 투여되었다.자가 골수 또는 줄기세포 이식 0일차부터 50ng/kg IL-1α로 치료한 결과 과거 대조군에 비해 혈소판 감소증이 조기에 회복되었다.IL-1α는 현재 종양학적 [30]징후에서 잠재적 치료제로 임상시험에서 평가되고 있다.
항IL-1α 치료용 항체 MABp1은 고형종양의 [31]항종양 활성에 대한 임상시험에서 테스트되고 있습니다.IL-1α의 활동을 차단하는 것은 [32]여드름과 같은 피부 질환을 치료할 수 있는 잠재력을 가지고 있다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000115008 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000027399 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Nicklin MJ, Weith A, Duff GW (Jan 1994). "A physical map of the region encompassing the human interleukin-1 alpha, interleukin-1 beta, and interleukin-1 receptor antagonist genes". Genomics. 19 (2): 382–4. doi:10.1006/geno.1994.1076. PMID 8188271.
- ^ a b March CJ, Mosley B, Larsen A, Cerretti DP, Braedt G, Price V, Gillis S, Henney CS, Kronheim SR, Grabstein K (Aug 1985). "Cloning, sequence and expression of two distinct human interleukin-1 complementary DNAs". Nature. 315 (6021): 641–7. Bibcode:1985Natur.315..641M. doi:10.1038/315641a0. PMID 2989698. S2CID 4240002.
- ^ Bankers-Fulbright JL, Kalli KR, McKean DJ (1996). "Interleukin-1 signal transduction". Life Sciences. 59 (2): 61–83. doi:10.1016/0024-3205(96)00135-X. PMID 8699924.
- ^ Dinarello CA (Jun 1997). "Induction of interleukin-1 and interleukin-1 receptor antagonist". Seminars in Oncology. 24 (3 Suppl 9): S9–81–S9–93. PMID 9208877.
- ^ Gery I, Gershon RK, Waksman BH (Jul 1972). "Potentiation of the T-lymphocyte response to mitogens. I. The responding cell". The Journal of Experimental Medicine. 136 (1): 128–42. doi:10.1084/jem.136.1.128. PMC 2139184. PMID 5033417.
- ^ Gery I, Waksman BH (Jul 1972). "Potentiation of the T-lymphocyte response to mitogens. II. The cellular source of potentiating mediator(s)". The Journal of Experimental Medicine. 136 (1): 143–55. doi:10.1084/jem.136.1.143. PMC 2139186. PMID 5033418.
- ^ Gery I, Handschumacher RE (Mar 1974). "Potentiation of the T lymphocyte response to mitogens. III. Properties of the mediator(s) from adherent cells". Cellular Immunology. 11 (1–3): 162–9. doi:10.1016/0008-8749(74)90016-1. PMID 4549027.
- ^ Watanabe N, Kobayashi Y (Nov 1994). "Selective release of a processed form of interleukin 1 alpha". Cytokine. 6 (6): 597–601. doi:10.1016/1043-4666(94)90046-9. PMID 7893968.
- ^ a b Hauser C, Saurat JH, Schmitt A, Jaunin F, Dayer JM (May 1986). "Interleukin 1 is present in normal human epidermis". Journal of Immunology. 136 (9): 3317–23. PMID 3007615.
- ^ Gahring LC, Buckley A, Daynes RA (Oct 1985). "Presence of epidermal-derived thymocyte activating factor/interleukin 1 in normal human stratum corneum". The Journal of Clinical Investigation. 76 (4): 1585–91. doi:10.1172/JCI112141. PMC 424137. PMID 2997285.
- ^ Schmitt A, Hauser C, Jaunin F, Dayer JM, Saurat JH (1986). "Normal epidermis contains high amounts of natural tissue IL 1 biochemical analysis by HPLC identifies a MW approximately 17 Kd form with a P1 5.7 and a MW approximately 30 Kd form". Lymphokine Research. 5 (2): 105–18. PMID 3486328.
- ^ Barland CO, Zettersten E, Brown BS, Ye J, Elias PM, Ghadially R (Feb 2004). "Imiquimod-induced interleukin-1 alpha stimulation improves barrier homeostasis in aged murine epidermis" (PDF). The Journal of Investigative Dermatology. 122 (2): 330–6. doi:10.1046/j.0022-202X.2004.22203.x. PMID 15009713.
- ^ Feldmann M, Saklatvala J (2001). "Proinflammatory cytokines". In Durum SK, Oppenheim JJ, Feldmann M (eds.). Cytokine reference: a compendium of cytokines and other mediators of host defense. Boston: Academic Press. pp. 291–306. ISBN 978-0-12-252673-2.
- ^ a b Laberge R, Sun Y, Orjalo AV, Patil CK, Campisi J (2015). "MTOR regulates the pro-tumorigenic senescence-associated secretory phenotype by promoting IL1A translation". Nature Cell Biology. 17 (8): 1049–1061. doi:10.1038/ncb3195. PMC 4691706. PMID 26147250.
- ^ Yin H, Morioka H, Towle CA, Vidal M, Watanabe T, Weissbach L (Aug 2001). "Evidence that HAX-1 is an interleukin-1 alpha N-terminal binding protein". Cytokine. 15 (3): 122–37. doi:10.1006/cyto.2001.0891. PMID 11554782.
- ^ Hu B, Wang S, Zhang Y, Feghali CA, Dingman JR, Wright TM (Aug 2003). "A nuclear target for interleukin-1alpha: interaction with the growth suppressor necdin modulates proliferation and collagen expression". Proceedings of the National Academy of Sciences of the United States of America. 100 (17): 10008–13. Bibcode:2003PNAS..10010008H. doi:10.1073/pnas.1737765100. PMC 187743. PMID 12913118.
- ^ a b Dinarello CA (2001). "IL-1α". In Durum SK, Oppenheim JJ, Feldmann M (eds.). Cytokine reference: a compendium of cytokines and other mediators of host defense. Boston: Academic Press. pp. 307–318. ISBN 978-0-12-252673-2.
- ^ a b Wang R, Sunchu B, Perez VI (2017). "Rapamycin and the inhibition of the secretory phenotype". Experimental Gerontology. 94: 89–92. doi:10.1016/j.exger.2017.01.026. PMID 28167236. S2CID 4960885.
- ^ a b Wang R, Yu Z, Sunchu B, Perez VI (2017). "Rapamycin inhibits the secretory phenotype of senescent cells by a Nrf2-independent mechanism". Aging Cell. 16 (3): 564–574. doi:10.1111/acel.12587. PMC 5418203. PMID 28371119.
- ^ Arend WP, Malyak M, Guthridge CJ, Gabay C (1998). "Interleukin-1 receptor antagonist: role in biology". Annual Review of Immunology. 16: 27–55. doi:10.1146/annurev.immunol.16.1.27. PMID 9597123.
- ^ Moore KW, O'Garra A, de Waal Malefyt R, Vieira P, Mosmann TR (1993). "Interleukin-10". Annual Review of Immunology. 11: 165–90. doi:10.1146/annurev.iy.11.040193.001121. PMID 8386517.
- ^ Neta R, Douches S, Oppenheim JJ (Apr 1986). "Interleukin 1 is a radioprotector". Journal of Immunology. 136 (7): 2483–5. PMID 3512714.
- ^ Dorie MJ, Allison AC, Zaghloul MS, Kallman RF (May 1989). "Interleukin 1 protects against the lethal effects of irradiation of mice but has no effect on tumors in the same animals". Proceedings of the Society for Experimental Biology and Medicine. 191 (1): 23–9. doi:10.3181/00379727-191-42884. PMID 2654945. S2CID 7004908.
- ^ Constine LS, Harwell S, Keng P, Lee F, Rubin P, Siemann D (Mar 1991). "Interleukin 1 alpha stimulates hemopoiesis but not tumor cell proliferation and protects mice from lethal total body irradiation". International Journal of Radiation Oncology, Biology, Physics. 20 (3): 447–56. doi:10.1016/0360-3016(91)90056-A. PMID 1995530.
- ^ Smith JW, Longo DL, Alvord WG, Janik JE, Sharfman WH, Gause BL, Curti BD, Creekmore SP, Holmlund JT, Fenton RG (Mar 1993). "The effects of treatment with interleukin-1 alpha on platelet recovery after high-dose carboplatin". The New England Journal of Medicine. 328 (11): 756–61. doi:10.1056/NEJM199303183281103. PMID 8437596.
- ^ Korneev, KV; Atretkhany, KN; Drutskaya, MS; Grivennikov, SI; Kuprash, DV; Nedospasov, SA (January 2017). "TLR-signaling and proinflammatory cytokines as drivers of tumorigenesis". Cytokine. 89: 127–135. doi:10.1016/j.cyto.2016.01.021. PMID 26854213.
- ^ Reichert JM (2015). "Antibodies to watch in 2015". mAbs. 7 (1): 1–8. doi:10.4161/19420862.2015.988944. PMC 4622967. PMID 25484055.
- ^ Valente Duarte de Sousa IC (Oct 2014). "Novel pharmacological approaches for the treatment of acne vulgaris". Expert Opinion on Investigational Drugs. 23 (10): 1389–410. doi:10.1517/13543784.2014.923401. PMID 24890096. S2CID 19860451.
추가 정보
- Verweij CL, Bayley JP, Bakker A, Kaijzel EL (2002). "Allele specific regulation of cytokine genes: Monoallelic expression of the IL-lA gene". Allele specific regulation of cytokine genes: monoallelic expression of the IL-1A gene. Advances in Experimental Medicine and Biology. Vol. 495. pp. 129–39. doi:10.1007/978-1-4615-0685-0_17. ISBN 978-0-306-46656-4. PMID 11774556.
- Griffin WS, Mrak RE (Aug 2002). "Interleukin-1 in the genesis and progression of and risk for development of neuronal degeneration in Alzheimer's disease". Journal of Leukocyte Biology. 72 (2): 233–8. PMC 3835694. PMID 12149413.
- Arend WP (2003). "The balance between IL-1 and IL-1Ra in disease". Cytokine & Growth Factor Reviews. 13 (4–5): 323–40. doi:10.1016/S1359-6101(02)00020-5. PMID 12220547.
- Copeland KF (Dec 2005). "Modulation of HIV-1 transcription by cytokines and chemokines". Mini Reviews in Medicinal Chemistry. 5 (12): 1093–101. doi:10.2174/138955705774933383. PMID 16375755.
- Schmidt DR, Kao WJ (Jan 2007). "The interrelated role of fibronectin and interleukin-1 in biomaterial-modulated macrophage function". Biomaterials. 28 (3): 371–82. doi:10.1016/j.biomaterials.2006.08.041. PMID 16978691.
- Huynh-Ba G, Lang NP, Tonetti MS, Salvi GE (Apr 2007). "The association of the composite IL-1 genotype with periodontitis progression and/or treatment outcomes: a systematic review". Journal of Clinical Periodontology. 34 (4): 305–17. doi:10.1111/j.1600-051X.2007.01055.x. PMID 17378887.
외부 링크
- IL1A+단백질+미국국립의학도서관 의학 과목 제목(MeSH)