트롬빈
ThrombinThrombin (EC 3.4.21.5, fibrinogenase, thrombase, thrombofort, topical, thrombin-C, tropostasin, activated blood-coagulation factor II, blood-coagulation factor IIa, factor IIa, E thrombin, beta-thrombin, gamma-thrombin) is a serine protease, an enzyme that, in humans, is encoded by the F2 gene.[5][6] 프로트롬빈(응고 인자 II)은 응고 과정에서 트롬빈을 형성하도록 단백질 분해된다. 트롬빈은 용해성 피브리노겐을 불용성 피브린 가닥으로 전환시키는 세린 프로테아제 역할을 하며, 다른 많은 응고 관련 반응을 촉진시킨다.
역사
피브리노겐과 피브린에 대한 묘사가 끝난 뒤 알렉산더 슈미트는 1872년 피브리노겐을 피브린으로 전환하는 효소의 존재를 가설을 세웠다.[7]
프로트롬빈은 1894년 페켈하링에 의해 발견되었다.[8][9][10]
생리학
합성
트롬빈은 프로트롬빈에 있는 두 부위의 효소 분열에 의해 활성화된 인자 X(Xa)에 의해 생성된다. 인자 Xa의 활성은 프로트롬비나아제 콤플렉스로 불리는 활성화된 인자 V(Va)에 결합하여 크게 향상된다. 프로트롬빈은 간에서 생성되며, 분자의 N 종단부의 글루탐산 10-12개를 감마-카복시글루탐산(Gla)으로 변환하는 비타민K 의존 반응에서 공동번역적으로 변형된다.[11] 칼슘이 있는 곳에서 글라 잔류물은 프로트롬빈과 인광 빌리프제의 결합을 촉진한다. 비타민 K의 결핍이나 항응고제 와파린의 투여는 감마-카르복시글루탐산 잔류물의 생성을 억제하여 응고 폭포의 활성화를 늦춘다.
인간 성인의 경우, 안티트롬빈 활성의 정상 혈중 수치는 1.1단위/mL 정도로 측정되었다. 트롬빈 수치는 출생 후 꾸준히 증가하여 생후 1일 후 0.5단위/mL 내외에서 생후 6개월 후 0.9단위/mL 내외로 정상 성인 수준에 도달한다.[12]
작용기전
혈액 응고 경로에서 트롬빈은 인자 XI를 XIa로, V는 Va로, 피브리노겐은 피브린으로, XIII는 XIIA로 전환하는 작용을 한다.
인자 XIIA는 피브린의 리신과 글루타민 잔류물 사이의 공밸런트 결합 형성을 촉진하는 트랜스글루타미나제다. 공밸런스 결합은 피브린 응고의 안정성을 높인다. 트롬빈은 트롬보모둘린과 상호작용을 한다.[13][14]
또한 트롬빈은 응고 캐스케이드 내 활성의 일부로서 혈소판의 세포막에 프로테아제 활성 수용체 활성화를 통해 혈소판 활성화와 집적을 촉진한다.
부정적인 피드백
트롬보모둘린에 묶인 트롬빈은 응고 폭포의 억제제인 단백질 C를 활성화시킨다. 내피세포가 발현하는 적분막 단백질인 트롬보모둘린에 트롬빈을 결합한 후 단백질 C의 활성화가 크게 강화된다. 활성화된 단백질 C는 Va와 VIIIa 인자를 비활성화한다. 활성화된 단백질 C를 단백질 S에 결합하면 그 활성도가 다소 높아진다. 트롬빈은 또한 세린 프로테아제 억제제인 안티트롬빈에 의해 비활성화된다.
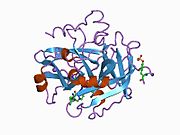
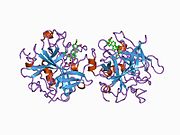
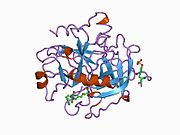
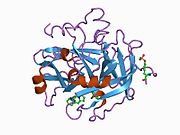
구조
프로트롬빈의 분자량은 약 7만 2천 Da이다. 촉매영역은 프로트롬빈 파편 1.2에서 방출되어 분자량이 36,000Da인 활성 효소 트롬빈을 생성한다. 구조적으로, 그것은 큰 PA 종족의 일원이다.
Prothrombin은 N-terminal Gla 도메인, 2 kringle 도메인, C-terminal trypsin 유사 serine protease 도메인 등 4개의 도메인으로 구성되어 있다. 인자 V를 공계자로 하는 인자 Xa는 Gla와 두 Kringle 도메인의 갈라짐(파편 1.2라고 하는 파편을 함께 형성)으로 이어지며 세린 프로테아제 도메인으로만 구성된 트롬빈을 떠난다.[16]
모든 세린 프로테아제의 경우와 마찬가지로 프로트롬빈은 내부 펩타이드 결합의 프로테롤리시스(proteolyis)에 의해 활성 트롬빈으로 전환되어 새로운 N-단자 Ile-NH3가 노출된다. 세린 프로테아제 활성화의 과거 모델은 헤비 체인의 새로 형성된 N-단자체를 촉매 잔류물의 정확한 준수를 촉진하는 β-바렐에 삽입하는 것을 포함한다.[17] 활성 트롬빈의 결정 구조와 달리 수소-중수소 교환 질량 분석 연구는 이 N-단자 Ile-NH3가 트롬빈의 apo 형태의 β-바렐에 삽입되지 않음을 보여준다. 그러나 혈보모듈린의 활성 파편을 결합하면 이 N단자 영역을 삽입하여 혈관의 활성 준수를 촉진하는 것으로 보인다.[18]
유전자
트롬빈(프로트롬빈) 유전자는 11번째 염색체(11p11-q12)에 위치한다.[5]
프로트롬빈 G20210A안 된다 혼동해서는 돌연변이와 세계에는 2인자 결핍의선천적 형태를 사람이 30명으로 추정되는데,[19]이를 2인자 돌연변이라고부르기도 하는 진단받은. 프로트롬빈 G20210A는 선천적이다.[20]
프로트롬빈 G20210A는 보통 다른 인자 돌연변이를 동반하지 않는다(즉, 가장 일반적인 것은 인자 V 라이덴이다). 이 유전자는 이질성(1쌍)을 물려받거나 훨씬 드물게 동질성(2쌍)을 물려받을 수 있으며 성별이나 혈액형과 관련이 없다. 동형 돌연변이는 이형 돌연변이보다 혈전증의 위험을 더 증가시키지만, 상대적으로 증가한 위험은 잘 기록되어 있지 않다. 경구 피임약과 같은 혈전증에 대한 다른 잠재적 위험은 첨가물이 될 수 있다. 이전에 보고된 염증성 장 질환(즉, 크론병이나 궤양성 대장염)과 프로트롬빈 G20210A 또는 인자 V 레이든 돌연변이의 관계는 연구에 의해 모순되었다.[21]
질병에서의 역할
프로트롬빈의 활성화는 생리적 병리적 응고에 매우 중요하다. 프로트롬빈과 관련된 다양한 희귀질환이 설명되었다(예: hypoprotrombinemia). 자가면역질환에서 항프로트롬빈 항체는 루푸스 항응고제(일명 항인산염증후군)의 형성에 한 요인이 될 수 있다. 고프로트롬빈혈증은 G20210A 돌연변이에 의해 발생할 수 있다.
강력한 혈관조영제 및 미토겐인 트롬빈은 경막하출혈에 이은 혈관조영술의 주요 요인으로 연루되어 있다. 뇌동맥류 파열로 인한 혈액이 뇌동맥 주위에 응고되어 트롬빈을 방출한다. 이는 혈관의 급성 및 장기적 축소를 유도하여 잠재적으로 뇌허혈과 경색(뇌졸중)을 유발할 수 있다.
혈전 형성의 역동적인 과정에서 핵심적인 역할을 넘어 트롬빈은 두드러진 친염증 성질을 가지고 있어 아테롬성 동맥경화의 시작과 진행에 영향을 미칠 수 있다. 모든 동맥 혈관벽 성분에서 풍부하게 발현되는 특정 세포막 수용체(단백질 활성 수용체: PAR-1, PAR-3, PAR-4)를 통해 작용하며, 트롬빈은 무신경화상 플라크에 염증, 백혈구 모집, 산화 스트레스 강화, 미그라티오 등 친히테로겐 작용을 할 수 있는 잠재력을 가지고 있다.n과 혈관 매끄러운 근육 세포의 증식, 세포사멸 및 혈관신생.[22][23][24]
트롬빈은 혈전의 생리학에 관련되어 있다. 그것의 존재는 응괴의 존재를 나타낸다. 2013년에는 생쥐를 대상으로 트롬빈의 유무를 검출하는 시스템이 개발되었다. '리포터 화학물질'에 부착된 펩타이드 코팅 산화철을 결합한 것이다. 펩타이드 한 개가 트롬빈 분자에 결합하면 보고서가 나와 소변에서 검출될 수 있는 곳에 나타난다. 인체시험은 실시되지 않았다.[25]
적용들
연구도구
높은 단백질 분해 특성으로 인해 트롬빈은 귀중한 생화학적 도구다. 트롬빈 갈라짐 현장(Leu-Val-Pro-Arg-Gly-Ser)은 일반적으로 재조합용융단백질 구조의 링커 영역에 포함된다. 용융단백질 정화 후 트롬빈을 사용하여 갈라진 부위의 아르기닌과 글리신 잔류물 사이를 선별적으로 가릴 수 있어 관심 단백질에서 정제 태그를 높은 특수도로 효과적으로 제거할 수 있다.
의약품 및 수술
프로트롬빈 복합 농축액과 신선한 냉동 플라즈마는 프로트롬빈의 결핍(대개 약물에 의한)을 교정하는 데 사용할 수 있는 프로트롬빈 풍부한 응고 인자 준비물이다. 증상은 와파린으로 인한 난치성 출혈을 포함한다.
프로트롬빈의 조작은 대부분의 항응고제의 작용모드의 중심이다. 와파린과 관련 약물은 프로트롬빈을 포함한 여러 응고 인자의 비타민 K 의존성 탄복제를 억제한다. 헤파린은 안티트롬빈과 트롬빈(인자 Xa)의 친화력을 높인다. 새로운 종류의 약물인 다이렉트 트롬빈 억제제는 활성 부지에 결합하여 트롬빈을 직접 억제한다.
재조합 트롬빈은 수용액으로 재조합하기 위한 분말로 이용 가능하다. 그것은 지혈의 보조제로서 수술 중에 국소적으로 적용될 수 있다. 모세혈관과 작은 정맥에서 나오는 경미한 출혈을 조절하는 데 유용할 수 있지만, 효과가 없으며, 대규모 또는 활발한 동맥 출혈에는 나타나지 않는다.[26][27][28]
식량생산
트롬빈은 피브리노겐과 결합해 고기의 결합제로 사용하기 위해 피브리멕스라는 상표명으로 판매되고 있다. 피브리멕스의 두 단백질은 모두 포르신이나 소의 혈액에서 유래한다.[29] 제조업체에 따르면, 그것은 새로운 종류의 혼합 육류를 생산하는 데 사용될 수 있다. 제조업체는 또한 이 제품을 전근육, 형태, 부분을 결합하는 데 사용할 수 있으며, 따라서 품질 저하 없이 생산 비용을 절감할 수 있다고 말한다.[30]
스웨덴 소비자 협회의 얀 베르토프트 사무총장은 "이 재구성된 고기와 실제 고기를 구별할 방법이 없기 때문에 소비자들을 오도할 위험이 있다"고 말했다.[29]
참고 항목
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000180210 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000027249 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Royle NJ, Irwin DM, Koschinsky ML, MacGillivray RT, Hamerton JL (May 1987). "Human genes encoding prothrombin and ceruloplasmin map to 11p11-q12 and 3q21-24, respectively". Somatic Cell and Molecular Genetics. 13 (3): 285–92. doi:10.1007/BF01535211. PMID 3474786. S2CID 45686258.
- ^ Degen SJ, Davie EW (September 1987). "Nucleotide sequence of the gene for human prothrombin". Biochemistry. 26 (19): 6165–77. doi:10.1021/bi00393a033. PMID 2825773.
- ^ Schmidt A (1872). "Neue Untersuchungen ueber die Fasserstoffesgerinnung". Pflügers Archiv für die gesamte Physiologie. 6: 413–538. doi:10.1007/BF01612263. S2CID 37273997.
- ^ Kaushansky K, Lichtman M, Prchal J, Levi M, Press O, Burns L, Caligiuri M (2015). Williams Hematology. McGraw-Hill. p. 1918. ISBN 9780071833011.
- ^ Quick AJ (1957). Hemorrhagic Diseases. Philadelphia: Lea and Febiger. pp. 451–490. OCLC 599096191.
- ^ Morawitz P (1905). "Die Chemie der Blutgerinnung". Ergeb Physiol. 4: 307–422. doi:10.1007/BF02321003. S2CID 84003009.
- ^ Knorre DG, Kudryashova NV, Godovikova TS (October 2009). "Chemical and functional aspects of posttranslational modification of proteins". Acta Naturae. 1 (3): 29–51. doi:10.32607/20758251-2009-1-3-29-51. PMC 3347534. PMID 22649613.
- ^ Andrew M, Paes B, Milner R, Johnston M, Mitchell L, Tollefsen DM, Powers P (July 1987). "Development of the human coagulation system in the full-term infant". Blood. 70 (1): 165–72. doi:10.1182/blood.V70.1.165.165. PMID 3593964.
- ^ Bajzar L, Morser J, Nesheim M (July 1996). "TAFI, or plasma procarboxypeptidase B, couples the coagulation and fibrinolytic cascades through the thrombin-thrombomodulin complex". The Journal of Biological Chemistry. 271 (28): 16603–8. doi:10.1074/jbc.271.28.16603. PMID 8663147.
- ^ Jakubowski HV, Owen WG (July 1989). "Macromolecular specificity determinants on thrombin for fibrinogen and thrombomodulin". The Journal of Biological Chemistry. 264 (19): 11117–21. doi:10.1016/S0021-9258(18)60437-5. PMID 2544585.
- ^ PDB: 1nl2; Huang M, Rigby AC, Morelli X, Grant MA, Huang G, Furie B, Seaton B, Furie BC (September 2003). "Structural basis of membrane binding by Gla domains of vitamin K-dependent proteins". Nature Structural Biology. 10 (9): 751–6. doi:10.1038/nsb971. PMID 12923575. S2CID 7751100.
- ^ Davie EW, Kulman JD (April 2006). "An overview of the structure and function of thrombin". Seminars in Thrombosis and Hemostasis. 32 Suppl 1: 3–15. doi:10.1055/s-2006-939550. PMID 16673262.
- ^ Huber R, Bode W (1978-03-01). "Structural basis of the activation and action of trypsin". Accounts of Chemical Research. 11 (3): 114–122. doi:10.1021/ar50123a006. ISSN 0001-4842.
- ^ Handley LD, Treuheit NA, Venkatesh VJ, Komives EA (November 2015). "Thrombomodulin Binding Selects the Catalytically Active Form of Thrombin". Biochemistry. 54 (43): 6650–8. doi:10.1021/acs.biochem.5b00825. PMC 4697735. PMID 26468766.
- ^ Degen SJ, McDowell SA, Sparks LM, Scharrer I (February 1995). "Prothrombin Frankfurt: a dysfunctional prothrombin characterized by substitution of Glu-466 by Ala". Thrombosis and Haemostasis. 73 (2): 203–9. doi:10.1055/s-0038-1653751. PMID 7792730.
- ^ Varga EA, Moll S (July 2004). "Cardiology patient pages. Prothrombin 20210 mutation (factor II mutation)". Circulation. 110 (3): e15–8. doi:10.1161/01.CIR.0000135582.53444.87. PMID 15262854.
- ^ Bernstein CN, Sargent M, Vos HL, Rosendaal FR (February 2007). "Mutations in clotting factors and inflammatory bowel disease". The American Journal of Gastroenterology. 102 (2): 338–43. doi:10.1111/j.1572-0241.2006.00974.x. PMID 17156138.
- ^ Borissoff JI, Spronk HM, Heeneman S, ten Cate H (June 2009). "Is thrombin a key player in the 'coagulation-atherogenesis' maze?". Cardiovascular Research. 82 (3): 392–403. doi:10.1093/cvr/cvp066. PMID 19228706.
- ^ Borissoff JI, Heeneman S, Kilinç E, Kassák P, Van Oerle R, Winckers K, Govers-Riemslag JW, Hamulyák K, Hackeng TM, Daemen MJ, ten Cate H, Spronk HM (August 2010). "Early atherosclerosis exhibits an enhanced procoagulant state". Circulation. 122 (8): 821–30. doi:10.1161/CIRCULATIONAHA.109.907121. PMID 20697022.
- ^ Borissoff JI, Spronk HM, ten Cate H (May 2011). "The hemostatic system as a modulator of atherosclerosis". The New England Journal of Medicine. 364 (18): 1746–60. doi:10.1056/NEJMra1011670. PMID 21542745.
- ^ Economist (2013-11-05). "Nanomedicine: Particle physiology". The Economist. Retrieved 2013-12-15.
- ^ Chapman WC, Singla N, Genyk Y, McNeil JW, Renkens KL, Reynolds TC, Murphy A, Weaver FA (August 2007). "A phase 3, randomized, double-blind comparative study of the efficacy and safety of topical recombinant human thrombin and bovine thrombin in surgical hemostasis". Journal of the American College of Surgeons. 205 (2): 256–65. doi:10.1016/j.jamcollsurg.2007.03.020. PMID 17660072.
- ^ Singla NK, Ballard JL, Moneta G, Randleman CD, Renkens KL, Alexander WA (July 2009). "A phase 3b, open-label, single-group immunogenicity and safety study of topical recombinant thrombin in surgical hemostasis". Journal of the American College of Surgeons. 209 (1): 68–74. doi:10.1016/j.jamcollsurg.2009.03.016. PMID 19651065.
- ^ Greenhalgh DG, Gamelli RL, Collins J, Sood R, Mozingo DW, Gray TE, Alexander WA (2009). "Recombinant thrombin: safety and immunogenicity in burn wound excision and grafting". Journal of Burn Care & Research. 30 (3): 371–9. doi:10.1097/BCR.0b013e3181a28979. PMID 19349898. S2CID 3678462.
- ^ a b "Sverige röstade ja till köttklister" [Sweden voted in favor of the meat paste] (in Swedish). Dagens Nyheter. 2010-02-09. Retrieved 2010-10-17.
- ^ "Welcome to Fibrimex". Fibrimex website. Sonac. Retrieved 2019-02-28.
추가 읽기
- Esmon CT (July 1995). "Thrombomodulin as a model of molecular mechanisms that modulate protease specificity and function at the vessel surface". FASEB Journal. 9 (10): 946–55. doi:10.1096/fasebj.9.10.7615164. PMID 7615164. S2CID 19565674.
- Wu H, Zhang Z, Li Y, Zhao R, Li H, Song Y, Qi J, Wang J (October 2010). "Time course of upregulation of inflammatory mediators in the hemorrhagic brain in rats: correlation with brain edema". Neurochemistry International. 57 (3): 248–53. doi:10.1016/j.neuint.2010.06.002. PMC 2910823. PMID 20541575.
- Lenting PJ, van Mourik JA, Mertens K (December 1998). "The life cycle of coagulation factor VIII in view of its structure and function". Blood. 92 (11): 3983–96. doi:10.1182/blood.V92.11.3983. PMID 9834200.
- Plow EF, Cierniewski CS, Xiao Z, Haas TA, Byzova TV (July 2001). "AlphaIIbbeta3 and its antagonism at the new millennium". Thrombosis and Haemostasis. 86 (1): 34–40. doi:10.1055/s-0037-1616198. PMID 11487023.
- Maragoudakis ME, Tsopanoglou NE, Andriopoulou P (April 2002). "Mechanism of thrombin-induced angiogenesis". Biochemical Society Transactions. 30 (2): 173–7. doi:10.1042/BST0300173. PMID 12023846.
- Howell DC, Laurent GJ, Chambers RC (April 2002). "Role of thrombin and its major cellular receptor, protease-activated receptor-1, in pulmonary fibrosis". Biochemical Society Transactions. 30 (2): 211–6. doi:10.1042/BST0300211. PMID 12023853. S2CID 32822567.
- Firth SM, Baxter RC (December 2002). "Cellular actions of the insulin-like growth factor binding proteins". Endocrine Reviews. 23 (6): 824–54. doi:10.1210/er.2001-0033. PMID 12466191.
- Minami T, Sugiyama A, Wu SQ, Abid R, Kodama T, Aird WC (January 2004). "Thrombin and phenotypic modulation of the endothelium". Arteriosclerosis, Thrombosis, and Vascular Biology. 24 (1): 41–53. doi:10.1161/01.ATV.0000099880.09014.7D. PMID 14551154.
- De Cristofaro R, De Candia E (June 2003). "Thrombin domains: structure, function and interaction with platelet receptors". Journal of Thrombosis and Thrombolysis. 15 (3): 151–63. doi:10.1023/B:THRO.0000011370.80989.7b. PMID 14739624.
- Tsopanoglou NE, Maragoudakis ME (February 2004). "Role of thrombin in angiogenesis and tumor progression". Seminars in Thrombosis and Hemostasis. 30 (1): 63–9. doi:10.1055/s-2004-822971. PMID 15034798.
- Bode W (2007). "Structure and interaction modes of thrombin". Blood Cells, Molecules & Diseases. 36 (2): 122–30. doi:10.1016/j.bcmd.2005.12.027. PMID 16480903.
- Wolberg AS (May 2007). "Thrombin generation and fibrin clot structure". Blood Reviews. 21 (3): 131–42. doi:10.1016/j.blre.2006.11.001. PMID 17208341.
- Degen S (1995). "Prothrombin". In High K, Roberts H (eds.). Molecular Basis of Thrombosis and Hemostasis. Marcel Dekker. p. 75. ISBN 9780824795016.
외부 링크
- 펩타이드제와 그 억제제를 위한 MEROPS 온라인 데이터베이스: S01.217
- Kujovich JL (February 2021). Adam MP, Ardinger HH, Pagon RA, et al. (eds.). "Prothrombin Thrombophilia". GeneReviews. Seattle WA: University of Washington, Seattle. PMID 20301327. NBK1148.
- Proteolysis Map-animation에 의한 YouTube의 응고방지 및 보호제도
- [1] PMAP: 단백질 분해 지도/트롬빈
- 트롬빈: 이달의 RCSB PDB 분자
- 프로트롬빈 구조
- PDBe-KB는 휴먼 트롬빈 PDB에서 이용할 수 있는 모든 구조 정보의 개요를 제공한다.
- PDBe-KB는 마우스 트롬빈에 대해 PDB에서 사용할 수 있는 모든 구조 정보의 개요를 제공한다.