리졸빈
Resolvin이 글은 대부분의 독자들이 이해하기에는 너무 기술적인 것일 수도 있다. 정보를 할 수 하십시오.(2018년 3월)(이 및 |
레졸빈은 주로 eicosapentaenoic acid(EPA)와 dHA(Docosahexaeno acid)를 비롯해 도코사펜타에노산(DPA), 클로파노돈산(Clupanodonic acid) 등 오메가-3 지방산으로부터 파생된 전문 프로레볼루션 매개체(SPMs)이다. 지역 조직에 작용하는 호르몬과 유사한 자가화합물로서, 리졸빈은 조직 손상 후 발생하는 염증에 이어 정상 세포 기능의 회복을 촉진하는 데 관여했다는 이유로 예비 조사를 받고 있다.[1][2] 레졸빈은 특수 프로리졸빙 매개체(SPMs)로 불리는 폴리불포화지방산(PUFA) 대사물의 종류에 속한다.[3][4]
생화학 및 생산
Resolvins(Rvs)는 그들이 형성되는 직선 체인 PUFA 및/또는 그들 구조의 고유한 측면을 기반으로 여러 하위 클래스에 속한다. 그22-carbon PUFA, DHA(i.e. 4Z,7Z,10Z,13Z,16Z,19Z)-docosahexaenoic 산)는 Resolvin D(RvDs)은 대사 물질,20-carbon PUFA, EPA(i.e.5Z,8Z,11Z,14Z,17Z-5,8,11,14,17-eicosapentaenoic 산성)의 resolvin 에스(RvEs)은 대사 물질, DPA이성질체의 resolvin Dn-6DPA(RvDsn-6DPA)은 대사 물질, osbond 산성(i.e. 4Z,7Z,10Z,13Z,16Z-.docosapentaenoic acid); the resolvin Dn-3DPA (RvDn-3DPA) are metabolites of the DPA isomer, clupanodonic acid (i.e. 7Z,10Z,13Z,16Z,19Z)-docosapentaenoic acid); and the resolvin Ts (RvTs) are metabolites of clupanodonic acid that, in contrast to (RvDsn-3DPA (all of which possess a 17S-hydroxyl residue), possess a 17R-hydroxyl residue. Certain isomers of RvDs are termed aspirin-triggered resolvin Ds (AT-RvDs) because their synthesis is initiated by a drug-modified COX2 enzyme to form 17(R)-hydroxyl rather than 17(S)-hydroxyl residue of the ReVEs; however, an as yet unidentified cytochrome P450 enzyme(s) may also forms this 17(R)-hydroxy intermediate and thereby contribute to thAT-RvEs의 e 프로덕션. RvDss를n-6DPA 제외한 모든 인용된 레졸빈은 오메가-3 지방산의 대사물이다.[3][4]
The following oxygenase enzymes may be responsible for metabolizing PUFA to resolvins: 15-lipoxygenase-1 (i.e. ALOX15), possibly 15-lipoxygenase-2 (i.e. ALOX15B), 5-lipoxygenase (i.e. ALOX5), cyclooxygenase-2 (i.e. COX-2), and certain Cytochrome P450 monooxygenases.[3][5]
Resolvin Ds
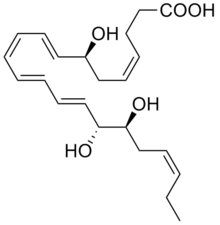
RvDs는 DHA의 폴리 하이드록실 대사물이다. 현재까지 히드록실 잔류물의 수, 위치, 치례성은 물론 6개의 이중결합에 대한 위치 및 시스-트랜스 이소머리즘이 다양한 6개의 RvDs가 설명되어 있다. These are: RvD1 (7S,8R,17S-trihydroxy-DHA), RvD2 (7S,16R,17S-trihydroxy-DHA), RvD3 (4S,7R,17S-trihydroxy-DHA), RvD4 (4S,5,17S-trihydroxy-DHA; chirality at position 5 not yet determined), RvD5 (7S,17S-dihydroxy-DHA), and RvD6 (4S,17S-dihydroxy-DHA). (The structures of these RvDs are further defined at Specialized proresolving mediators#DHA에서 파생된 Resolvins). These metabolites are formed by a wide range of cells and tissues by the initial metabolism of DHA to 7S-hydroperoxy-DHA and 4S-hydroperoxy-DHA by a 15-lipoxygenase (either ALOX15 or possibly ALOX15B) followed by the further metabolism of the two intermediates by ALOX5 to their 17-hydroperoxy derivatives; these di-hydroperoxy products are further 이러한 산소화합물 또는 비침습성 반응과 그들의 과산화 잔류물의 유비쿼터스 세포 과산화질소 변환에 의해 인용 RvDs로 변경된다.[3][5]
리졸빈 에스
RvEs는 EPA의 di-hydroxyl 대사물이다. To date, four RvEs have been described: RvE1 (5S,12R,18R-trihydroxy-EPA), 18S-Rv1 (5S,12R,18S-trihydroxy-EPA), RvE2 (5S,18R-dihydroxy-EPA), and RvE3 (17R,18R/S-dihydroxy-EPA). (RvEs의 구조는 전문 프로리졸빙 매개체#EPA에서 추가로 정의된다.) Resolvin Es are formed in manner similar to AT resolving Ts. COX-2 modified in activity by aspirin or atorvastatin or, alternatively, a microbial or possibly mammalian cytochrome P450 monoxygenase metabolizes EPA to its 18R-hydroperoxy derivative; this intermediate is then further metabolized by ALOX5 to a 5,6 epoxide which is hydrolyzed enzymaticRvE1 및 18S-RvE1과 비정전적으로 또는 RvE2로 감소하거나, 또는 18R-수소산화물이 17R,18S Visinal diol 제품인 RvE3로 변환된다.[3][5]
T 시리즈 리졸빈
Human platelets pretreated with aspirin or atorvastatin metabolize the omega-3 DPA, clupanodonic acid (DPAn-3) by aspirin-treated or atorvastatin-treated COX2 to a 13S-hydroperoxy intermediate (aspirin and atorvastatin change the activity of COX2 from a cyclooxygenase to an hydroxyperoxidase-forming enzyme. The intermediate is then passed to nearby human neutrophils which metabolize it, probably by ALOX5 enzyme activity, to four poly-hydroxyl metabolites: RvT1 (7,13R,20-trihydroxy-DPAn-3); RvT2 (7,8,13R-trihydroxy-DPAn-3); RvT3 (7,12,13R-trihydroxy-8Z,10E,14E,16Z,19Z-DPAn-3) and RvT4 (7,13R-dihydroxy-DPAn-3). 후속 연구 결과, 이 4가지 RvT는 또한 인간 중성미자와 혈관 내피세포의 혼합물에 의해 형성되며, 추가로 설치류와 인간의 감염된 조직에서 검출된다.[6][7]
삽입 메커니즘
조직손상에 이어 염증반응이 일어나면 조직 회복을 촉진하기 위한 보호 과정이다.[2] 염증의 분해능은 리졸빈을 포함한 다양한 전문 지질 매개체를 포함한다.[1][2] Resolvins are under laboratory research for their potential to act through G protein-coupled receptors (GPRs): 1) RvD1 and AT-RvD1 act through the Formyl peptide receptor 2, which is also activated by certain lipoxins and is therefore often termed the ALX/FPR2 receptor; 2) RvD1, AT-RVD1, RvD3, AT-RvD3, and RvD5 act through the GPR32 receptor which 이제 RVD1 수용체라고도 불린다. 3) RvD2는 GPR18 수용체를 통해 작용하며 현재 RvD2 수용체라고도 불린다. 4) RvE1의 RvE1과 18(S) 아날로그는 완전 활성제인 반면 RvE2는 CMKLR1 수용체의 부분 활성제다. 이 모든 수용체는 표준 GPR-이동 경로를 통해 모세포를 활성화한다.[4][8] RvE1, 18(S)-RvE1, RvE2 및 RvE2는 이러한 친염 매개체의 작용을 억제하여 LTB4 및 12-HETE의 R 스테레오소머와 같은 염증 유발 PUFA 대사물의 수용체인 Rekotriene B4 수용체 1을 억제한다.[5][8]
예비연구
EPA, DHA 및 DPA의 Resolvin 대사물과 DHA의 마레신 및 프로텍틴 D1 대사물은 염증에 대한 잠재적 영향에 대해 기초 연구를 수행하고 있다.[8] 한 인간 연구는 염증 반응을 유발하는 것으로 알려진 박테리아성 다당류와 도전하기 전이나 도전 후 어유 섭취 후 소변이나 혈장 분해효소 함량은 증가하지 않는다고 보고했다.[9] 식이 요법 PUFA나 어유 보조제를 복용하는 동안 암, 신장병 또는 낭포성 섬유증을 앓고 있는 사람들을 대상으로 한 예비 연구에서는 염증 바이오마커의 개선이 나타났으며, 이는 레졸빈에 의한 것일 수 있다.[1]
참조
- ^ a b c Moro, K; Nagahashi, M; Ramanathan, R; Takabe, K; Wakai, T (2016). "Resolvins and omega three polyunsaturated fatty acids: Clinical implications in inflammatory diseases and cancer". World Journal of Clinical Cases. 4 (7): 155–164. doi:10.12998/wjcc.v4.i7.155. PMC 4945585. PMID 27458590.
- ^ a b c Balta, M. G; Loos, B. G; Nicu, E. A (2017). "Emerging Concepts in the Resolution of Periodontal Inflammation: A Role for Resolvin E1". Frontiers in Immunology. 8: 1682. doi:10.3389/fimmu.2017.01682. PMC 5735081. PMID 29312286.
- ^ a b c d e Serhan, C. N.; Chiang, N; Dalli, J; Levy, B. D. (2014). "Lipid mediators in the resolution of inflammation". Cold Spring Harbor Perspectives in Biology. 7 (2): a016311. doi:10.1101/cshperspect.a016311. PMC 4315926. PMID 25359497.
- ^ a b c Duvall, M. G.; Levy, B. D. (2015). "DHA- and EPA-derived resolvins, protectins, and maresins in airway inflammation". European Journal of Pharmacology. 785: 144–55. doi:10.1016/j.ejphar.2015.11.001. PMC 4854800. PMID 26546247.
- ^ a b c d Qu Q, Xuan W, Fan GH (2015). "Roles of resolvins in the resolution of acute inflammation". Cell Biology International. 39 (1): 3–22. doi:10.1002/cbin.10345. PMID 25052386. S2CID 10160642.
- ^ Dalli J, Colas RA, Serhan CN (2013). "Novel n-3 immunoresolvents: structures and actions". Scientific Reports. 3: 1940. Bibcode:2013NatSR...3E1940D. doi:10.1038/srep01940. PMC 3672887. PMID 23736886.
- ^ Dalli J, Chiang N, Serhan CN (2015). "Elucidation of novel 13-series resolvins that increase with atorvastatin and clear infections" (PDF). Nature Medicine. 21 (9): 1071–5. doi:10.1038/nm.3911. PMC 4560998. PMID 26236990.
- ^ a b c Serhan, C. N. (2014). "Pro-resolving lipid mediators are leads for resolution physiology". Nature. 510 (7503): 92–101. Bibcode:2014Natur.510...92S. doi:10.1038/nature13479. PMC 4263681. PMID 24899309.
- ^ Skarke, C; Alamuddin, N; Lawson, J. A.; Li, X; Ferguson, J. F.; Reilly, M. P.; Fitzgerald, G. A. (2015). "Bioactive products formed in humans from fish oils". Journal of Lipid Research. 56 (9): 1808–20. doi:10.1194/jlr.M060392. PMC 4548785. PMID 26180051.