트롬버스
Thrombus| 트롬버스 | |
|---|---|
| 기타이름 | 혈전 |
 | |
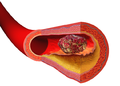
| 정맥 밸브를 차단한 혈전(혈전)의 다이어그램 | |
| 전문 | 혈관외과 |
| 증상 | 정신 상태의 급격한 변화, 흉통, 경련과 같은 느낌, 피로감, 실신, 팔 및/또는 다리의 부종 |
| 합병증 | 항응고제 복용으로 인한 출혈 위험, 호흡곤란, 심장마비, 뇌졸중 |
| 지속 | c. 3~6개월 |
| 종류들 | 표재성 혈전 정맥염 및 혈전 정맥염 이동체 |
| 원인들 | 동맥 손상, 패혈증 또는 바이러스 감염, 움직이지 않음 |
| 위험요소 | 입원, 부동, 비만, 임신, 신체적 외상 |
| 진단방법 | 자기공명혈관조영술, 초음파, 정맥조영술 |
| 예방 | 금연, 규칙적인 운동, 혈류 개선, 동반질환 관리 |
| 치료 | 항응고제: 에독사반, 틴자파린, 비분획 헤파린 |
| 약 | apixaban, edoxaban, and rivaroxaban |
| 죽음 | 매년 100,000–300,000 |
혈전(:pl. 혈전)은 구어적으로 혈전이라고 불리며 지혈 과정에서 혈액 응고 단계의 최종 산물입니다.혈전에는 플러그를 형성하는 응집 혈소판과 적혈구, 그리고 가교된 피브린 단백질의 그물망이라는 두 가지 성분이 있습니다.혈전을 구성하는 물질을 크루어라고 부르기도 합니다.혈전은 더 이상의 출혈을 막고 예방하기 위해 의도된 손상에 대한 건강한 반응이지만 혈전증에서 혈전이 순환계의 건강한 혈관을 통한 혈액의 흐름을 방해할 때 유해할 수 있습니다.
아주 작은 혈관과 작은 혈관으로 구성된 미세 순환에서 미세 혈전이라고 불리는 작은 혈전은 모세혈관의 혈액 흐름을 방해할 수 있습니다.이는 산소 공급 감소로 인한 호흡기 폐의 폐포에 특히 많은 문제를 일으킬 수 있습니다.미세먼지는 코로나19의 중증, 그리고 장기간의 코로나에서 특징적인 특징으로 밝혀졌습니다.[1]
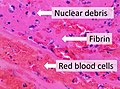
벽화 혈전은 큰 혈관이나 심장실의 벽에 달라붙는 혈전입니다.[2]그들은 신체에서 가장 큰 동맥인 대동맥에서 가장 흔하게 발견되고, 하행 대동맥에서 더 자주 발견되며, 대동맥 대동맥이나 복부 대동맥에서 덜 자주 발견됩니다.[2]그들은 혈류를 제한할 수 있지만 일반적으로 그것을 완전히 차단하지는 않습니다.그들은 밝은 선과 어두운 선(잔의 선으로 알려진)이 번갈아 나타나는 회색-적색으로 보입니다. 이 선들은 피브린 층에 갇힌 백혈구와 적혈구(어두운 선)의 띠를 나타냅니다.[3]
분류
혈전은 위치와 혈소판 및 적혈구(RBC)의 상대적인 양에 따라 크게 두 그룹으로 분류됩니다.[4]두 개의 주요 그룹은 다음과 같습니다.
- 동맥 또는 백색 혈전(혈소판이 우세한 것이 특징)
- 정맥 또는 적혈구(적혈구가 우세한 것이 특징).
마이크로클로트
아주 작은 혈관, 즉 모세혈관으로 구성된 미세 순환계에서 미세 혈전으로 알려진 작은 혈전(microthrombi)[5]은 모세혈관의 혈액 흐름을 방해할 수 있습니다.미세 혈전은 혈액 순환 내에서 형성되는 작은 혈액 덩어리로, 일반적으로 더 큰 혈전이 더 작은 조각으로 분해되는 결과입니다.이들은 작은 혈관의 막힘을 유발하고 혈류를 제한하여 조직 손상을 유발하고 잠재적으로 허혈성 사건을 유발할 수 있기 때문에 우려의 원인이 될 수 있습니다.
미세 혈전은 산소 공급 감소로 인해 호흡기계의 폐포에 특히 많은 문제를 일으킬 수 있습니다.미세먼지는 코로나19의 중증, 그리고 장기간의 코로나에서 특징적인 특징으로 밝혀졌습니다.[1][6]
벽화 혈전
벽화 혈전은 혈액의 정체로 인해 큰 혈관이나 심장실의 내벽에 형성되어 달라붙는 혈전을 말합니다.[2]그들은 신체에서 가장 큰 동맥인 대동맥에서 가장 흔하게 발견되고, 하행 대동맥에서 더 자주 발견되며, 대동맥 대동맥이나 복부 대동맥에서 덜 자주 발견됩니다.[2]그들은 혈류를 제한할 수 있지만 일반적으로 그것을 완전히 차단하지는 않습니다.벽화 혈전은 보통 죽상경화증으로 이미 손상된 혈관에서 발견되지 않습니다.[3]
벽화 혈전은 모든 심장실에 영향을 미칠 수 있습니다.좌심실에서 발견되는 경우는 심장마비 합병증의 결과인 경우가 많습니다.이 경우 혈전은 챔버에서 분리되어 동맥을 통해 운반되고 혈관을 막을 수 있습니다.[2]그들은 밝은 선과 어두운 선(잔의 선으로 알려진)이 번갈아 나타나는 회색-적색으로 보입니다. 이 선들은 피브린 층에 갇힌 백혈구와 적혈구(어두운 선)의 띠를 나타냅니다.[citation needed]
원인

150여 년 전에 혈전 형성은 혈류, 혈관 벽, 혈액 성분의 이상으로 인한 것이라고 제안했습니다.이 개념은 이제 비르초의 삼합법이라고 알려져 있습니다.세 가지 요인은 순환기 정체, 혈관벽 손상 및 과응고 상태를 포함하도록 더욱 개선되었으며, 이는 정맥 혈전색전증 및 기타 심혈관 질환의 위험 증가에 기여합니다.[4]
Virchow의 트라이어드는 혈전 형성의 병인에 대해 다음과 같이 설명합니다.[7][8]
- 내피 손상:혈소판 활성화 및 응집을 유발하는 내피(혈관 내부 표면) 손상
- 혈류역학적 변화(정지, 난류):혈액 정체는 혈소판/응고 인자와 혈관 내피 사이의 더 큰 접촉을 촉진합니다.내피 손상이 있는 혈관 내에서 급속한 혈액 순환(예: 빈맥으로 인해)이 발생하여 혈전 형성으로 이어질 수 있는 무질서한 흐름(난류)이 발생하는 [9]경우
- 고응고성(혈전증이라고도 하며, 혈전증을 일으키기 쉬운 혈액의 장애)[10]
파종성 혈관 내 응고(DIC)는 대부분의 혈관에 광범위한 미세 혈전 형성을 포함합니다.이것은 응고 인자의 과도한 소비와 신체의 가용 혈소판 및 응고 인자를 모두 사용하여 섬유소 용해를 활성화하기 때문입니다.그 결과 조직/장기의 출혈 및 허혈성 괴사가 발생합니다.원인은 패혈증, 급성 백혈병, 쇼크, 뱀에 물린 상처, 뼈가 부러진 지방색전증 또는 기타 심각한 외상입니다.DIC는 임신한 여성에게서도 나타날 수 있습니다.치료에는 혈액 내 응고 인자의 수준을 회복시키기 위해 신선한 냉동 혈장을 사용하고 추가적인 혈전 형성을 방지하기 위해 혈소판과 헤파린이 포함됩니다.[citation needed]
병태생리학

상처를 입지 않은 혈관이나 약간의 상처를 입은 혈관에서 일반적으로 발생하는 지혈 과정이 활성화되면서 혈전이 발생합니다.큰 혈관의 혈전은 그 혈관을 통과하는 혈류를 감소시킵니다(벽화 혈전이라고 함).작은 혈관에서는 혈류가 완전히 차단되어(폐쇄성 혈전이라고 함) 해당 혈관에서 공급되는 조직이 사망할 수 있습니다.혈전이 이탈하여 자유낙하 상태가 되면 색전증으로 간주됩니다.[citation needed]색전증이 혈관 안에 갇히면 혈류를 차단해 색전증이라고 합니다.색전증은 특정 위치에 따라 뇌졸중, 심장마비, 심지어 사망과 같은 더 큰 영향을 미칠 수 있습니다.[11]
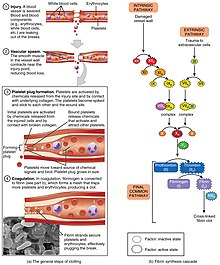
혈전 발생의 위험을 증가시키는 일부 질환은 심방세동(심장 부정맥의 한 형태), 심장판막 교체, 최근 심장마비(심근경색이라고도 함), 장기간의 활동 불능(심부정맥 혈전증 참조),혈액의 응고 능력에 유전적 또는 질병과 관련된 결함이 있습니다.[citation needed]
형성
혈소판 활성화는 혈관 내피를 손상시키는 손상을 통해 일어나 혈관 내에서 정상적으로 순환하는 단백질인 인자 VII라는 효소를 F3 유전자에 의해 암호화된 단백질인 조직 인자에 노출시킵니다.혈소판 활성화는 잠재적으로 연쇄반응을 일으켜 결국 혈전을 형성할 수 있습니다.[12]이 과정은 혈전 조절을 통해 조절됩니다.
-
동맥 플라크 위에 혈전 형성을 묘사하는 그림.
예방
항응고제는 혈전 형성을 방지하여 뇌졸중, 심장마비 및 폐색전증의 위험을 줄이는 데 사용되는 약물입니다.헤파린과 와파린은 기존 혈전의 형성과 성장을 억제하는 데 사용되는데, 전자는 급성 항응고제에, 후자는 장기 항응고제에 사용됩니다.[8]헤파린과 와파린의 작용 메커니즘은 응고 캐스케이드의 다른 경로에서 작용하기 때문에 다릅니다.[13]헤파린은 트롬빈과 인자 Xa를 비활성화시켜 작용하는 효소인 효소 억제제 안티트롬빈 III에 결합하여 활성화함으로써 작용합니다.[13]반면 와파린은 비타민K 의존성 응고인자 II, VII, IX, X를 합성하는 데 필요한 효소인 비타민K 에폭사이드 환원효소를 억제함으로써 작용합니다.[13][14]헤파린 및 와파린 요법을 사용한 출혈 시간은 각각 부분 트롬보플라스틴 시간(PTT) 및 프로트롬빈 시간(PT)으로 측정할 수 있습니다.[14]
치료
혈전이 형성되면 다른 약물을 사용하여 혈전 용해 또는 혈전 분해를 촉진할 수 있습니다.스트렙토키나아제는 연쇄상구균에 의해 생성되는 효소로 가장 오래된 혈전용해제 중 하나입니다.[14]이 약물은 관상 동맥 혈관의 혈전을 용해시키기 위해 정맥 주사로 투여할 수 있습니다.그러나 streptokinase는 전신 섬유소 용해 상태를 유발하고 출혈 문제를 유발할 수 있습니다.조직 플라스미노겐 활성화제(tPA)는 혈전에서 피브린의 분해를 촉진하지만 유리 피브리노겐은 촉진하지 않는 다른 효소입니다.[14]이 약은 형질전환 박테리아에 의해 만들어지며 플라스미노겐을 응고 용해 효소인 플라스민으로 전환시킵니다.[15]최근 연구에 따르면 tPA는 중추신경계에 독성 효과를 나타낼 수 있습니다.심각한 뇌졸중의 경우 tPA가 혈액-뇌 장벽을 통과하여 간질액으로 들어갈 수 있으며, 여기서 흥분독성이 증가하여 잠재적으로 혈액-뇌 장벽의 투과성에 영향을 미치고 [16]뇌출혈을 유발할 수 있습니다.[17]
피브린을 용해시켜 작용하는 동물에서 나오는 항응고제도 있습니다.예를 들어, 아마존 거머리인 Haementeria gilianii는 침샘에서 헤멘틴이라고 불리는 효소를 생산합니다.[18]
예후
혈전 형성은 전파, 색전, 용해, 조직화 및 재구화의 네 가지 결과 중 하나를 가질 수 있습니다.[19]
- 혈전의 전파는 심장 방향으로 발생하며 추가적인 혈소판과 피브린의 축적을 수반합니다.이것은 정맥의 전위 또는 동맥의 역행임을 의미합니다.
- 색전술은 혈전이 혈관벽에서 이탈하여 이동성을 갖게 되어 혈관계의 다른 부위로 이동할 때 발생합니다.정맥색전증(주로 하지의 깊은 정맥혈전증에서 발생)은 전신순환을 통해 심장의 오른쪽에 도달하고 폐동맥을 통해 이동하여 폐색전증을 유발합니다.고혈압이나 동맥경화로 인한 동맥 혈전증은 움직일 수 있으며, 그로 인한 색전증은 혈전 형성의 하류에 있는 동맥이나 동맥을 폐색시킬 수 있습니다.이것은 뇌중풍, 심근경색 또는 다른 기관이 영향을 받을 수 있다는 것을 의미합니다.
- 용해는 섬유소 용해 메커니즘이 혈전을 분해하고 혈류가 혈관으로 회복될 때 발생합니다.이는 관상동맥 폐색의 경우 tPA(Tissue Plasminogen Activator)와 같은 섬유소 용해제에 의해 도움을 받을 수 있습니다.섬유소 용해 약물에 대한 가장 좋은 반응은 혈전의 섬유소 망 구조가 완전히 개발되기 전인 몇 시간 이내입니다.
- 조직화 및 재조직화는 평활근 세포, 섬유아세포 및 내피가 섬유소가 풍부한 혈전으로 성장하는 것을 포함합니다.재관류가 진행되면 전체 혈전을 통한 혈류의 연속성을 위해 혈전을 통해 모세혈관 크기의 채널을 제공하지만 하류 조직의 대사 요구에 따라 충분한 혈류를 회복하지 못할 수 있습니다.[7]
참고 항목
참고문헌
- ^ a b Pretorius E, Vlok M, Venter C, Bezuidenhout JA, Laubscher GJ, Steenkamp J, Kell DB (August 2021). "Persistent clotting protein pathology in Long COVID/Post-Acute Sequelae of COVID-19 (PASC) is accompanied by increased levels of antiplasmin". Cardiovasc Diabetol. 20 (1): 172. doi:10.1186/s12933-021-01359-7. PMC 8381139. PMID 34425843.
- ^ a b c d e Singh, Davinder P.; Basit, Hajira; Malik, Ahmad; Mahajan, Kunal (5 November 2021). "Mural Thrombi". PMID 30484999. Retrieved 11 February 2022.
- ^ a b Karaolanis G, Moris D, Bakoyiannis C, Tsilimigras DI, Palla VV, Spartalis E, Schizas D, Georgopoulos S (August 2017). "A critical reappraisal of the treatment modalities of normal appearing thoracic aorta mural thrombi". Ann Transl Med. 5 (15): 306. doi:10.21037/atm.2017.05.15. PMC 5555985. PMID 28856146.
- ^ a b "Thrombus Formation – Virchow's triad & Types of Thrombi". Thrombosis Adviser. Bayer AG. Retrieved 20 March 2020.
- ^ "Medical Definition of micro thrombus". www.merriam-webster.com. Retrieved 22 February 2023.
- ^ Chen W, Pan JY (January 2021). "Anatomical and Pathological Observation and Analysis of SARS and COVID-19: Microthrombosis Is the Main Cause of Death". Biological Procedures Online. 23 (1): 4. doi:10.1186/s12575-021-00142-y. PMC 7816139. PMID 33472576. S2CID 255608747.
- ^ a b Kumar, Vinay; Abbas, Abul; Aster, Jon (2014). Robbins & Cotran Pathologic Basis of Disease (9th ed.). Philadelphia: Elsevier. ISBN 9781455726134. OCLC 879416939.
- ^ a b "Venous thromboembolism (VTE) McMaster Pathophysiology Review". www.pathophys.org. 26 September 2012. Retrieved 2018-11-03.
- ^ Kushner, Abigail; West, William P.; Pillarisetty, Leela Sharath (2020), "Virchow Triad", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 30969519, retrieved 2020-06-18
- ^ Ataga KI (10 May 2020). "Hypercoagulability and thrombotic complications in hemolytic anemias". Haematologica. 94 (11): 1481–1484. doi:10.3324/haematol.2009.013672. PMC 2770956. PMID 19880774.
- ^ Marieb, Elaina N. Human Anatomy and Physiology (11th ed.). Pearson.
- ^ Furie, Bruce; Furie, Barbara (2008). "Mechanisms of Thrombus Formation". The New England Journal of Medicine. 359 (9): 938–49. doi:10.1056/NEJMra0801082. PMID 18753650.
- ^ a b c Harter, K.; Levine, M.; Henderson, S. O. (2015). "Anticoagulation Drug Therapy: A Review". The Western Journal of Emergency Medicine. 16 (1): 11–17. doi:10.5811/westjem.2014.12.22933. PMC 4307693. PMID 25671002.
- ^ a b c d Whalen, Karen; Finkel, Richard S.; Panavelil, Thomas A. (2015). Lippincott Illustrated Reviews: Pharmacology (6th ed.). Philadelphia: Wolters Kluwer. ISBN 9781451191776. OCLC 881019575.
- ^ Saladin, Kenneth S. (2012). Anatomy & Physiology: The Unity of Form and Function (6th ed.). New York: McGraw-Hill. p. 710. ISBN 978-0-07-337825-1.
- ^ Fredriksson, L.; Lawrence, D. A.; Medcalf, R. L. (2016). "TPA modulation of the blood–brain barrier: A unifying explanation for the pleiotropic effects of tPA in the CNS?". Seminars in Thrombosis and Hemostasis. 43 (2): 154–168. doi:10.1055/s-0036-1586229. PMC 5848490. PMID 27677179.
- ^ Medcalf, R. (2011). "Plasminogen activation-based thrombolysis for ischaemic stroke: the diversity of targets may demand new approaches". Current Drug Targets. 12 (12): 1772–1781. doi:10.2174/138945011797635885. PMID 21707475.
- ^ Budzynski, A. Z. (1991). "Interaction of hementin with fibrinogen and fibrin". Blood Coagulation & Fibrinolysis. 2 (1): 149–52. doi:10.1097/00001721-199102000-00022. PMID 1772982.
- ^ Kumar, Vinay; et al. (2007). Robbins Basic Pathology (8th ed.). Philadelphia: Saunders/Elsevier. ISBN 978-1-4160-2973-1.
외부 링크
- Wayback Machine에 보관된 치명적인 혈전을 줄일 수 있는 근육 완화 약물 2009-02-04
- 대기 오염이 혈전을 유발합니다 – 미국 연구