돛대 세포
Mast cell| 돛대 세포 | |
|---|---|
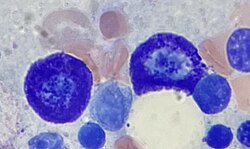 골수에 있는 두 개의 비만 세포 | |
| 세부 사항 | |
| 시스템. | 면역 체계 |
| 식별자 | |
| 라틴어 | 유방 세포 |
| 메쉬 | D008407 |
| TH | H2.00.03.010 |
| FMA | 66784 |
| 미세해부술의 해부학적 용어 | |
비만 세포는 히스타민과 헤파린이[1] 풍부한 많은 과립을 포함하는 결합 조직의 상주 세포이다.구체적으로는 면역 및 신경면역계의 일부인 골수줄기세포에서 유래한 과립구의 일종이다.비만 세포는 1877년 [2]Paul Ehrlich에 의해 발견되었다.알레르기와 무지외반증에 대한 그들의 역할로 가장 잘 알려져 있지만, 비만 세포는 상처 치유, 혈관 형성, 면역 내성, 병원균에 대한 방어, 그리고 뇌 [3][4]종양의 혈관 투과성에 밀접하게 관여하면서 중요한 보호 역할도 한다.
비만세포는 백혈구의 또 다른 종류인 호염기구와 생김새와 기능 면에서 매우 유사하다.비만 세포는 한때 조직에 상주하는 호염기구로 생각되었지만, 두 세포는 서로 다른 조혈 계통에서 발달하여 동일한 [5]세포가 될 수 없는 것으로 나타났다.
구조.
비만 세포는 혈액 속의 호염기성 과립구와 매우 유사합니다.둘 다 히스타민과 항응고제인 헤파린을 함유한 과립 세포입니다.그들의 핵은 호염기성 핵이 동그란 반면 비만 세포 핵은 둥글다는 점에서 다르다.면역글로불린E(IgE)의 Fc 영역은 비만세포와 호염기구와 결합하고 IgE의 파라토프가 항원에 결합할 때 세포가 히스타민과 다른 염증 [6]매개체를 방출하게 한다.이러한 유사성으로 인해 많은 사람들은 비만 세포가 조직에 "호모"된 호염기구라고 추측하고 있다.또한 이들은 CD34 분자를 발현하는 골수에서 공통 전구체를 공유한다.호염기구들은 이미 골수를 성숙하게 만드는 반면, 비만 세포는 미성숙한 형태로 순환하며 조직 부위에서 단 한번만 성숙합니다.미성숙한 비만세포가 정착한 부위는 아마도 그 정확한 [7]특성을 결정할 것이다.콘카나발린 A자극성 스플레노사이트에서 파생된 조건부 배지를 사용하여 마우스 마스트 세포의 [8]첫 번째 시험관내 분화 및 성장이 수행되었다.이후 T세포유래 인터류킨3이 비만세포 분화와 [9]성장에 필요한 조건부 배지에 존재하는 성분이라는 사실이 밝혀졌다.
설치류의 돛대 세포는 고전적으로 결합 조직형 돛대 세포와 점막 돛대 세포라는 두 가지 하위 유형으로 나뉩니다.후자의 활동은 T세포에 [10]의존합니다.
비만 세포는 혈관, 신경 및 림프관을 [11]특징적으로 둘러싼 대부분의 조직에 존재하며, 특히 입,[7] 결막, 코뿐만 아니라 피부, 폐 점막, 소화관 등 외부 세계와 내부 환경 사이의 경계 근처에서 두드러집니다.
기능.
비만 세포는 염증 과정에서 중요한 역할을 한다.활성화되면, 비만세포는 선택적으로 (편식 탈과립) 또는 염증을 유발하는 화합물인 "매개자" 또는 염증을 유발하는 화합물을 국소 [3][12]미세 환경으로 방출할 수 있다.비만세포는 면역글로불린E 수용체(예를 들어 FcriRI)와의 가교, 손상관련 분자패턴(DAMPs)에 대한 패턴인식 수용체를 통한 물리적 손상, 병원체 관련 분자패턴(PAMPs)에 대한 패턴인식 수용체를 통한 미생물 병원체 및 정맥류 등을 통해 알레르겐에 의해 탈과립할 수 있다.관련 G단백질 결합 수용체(예: 오피오이드 수용체를 통한 모르핀) 또는 배위자 게이트 이온 [3][12]채널을 통해 화합물을 생성한다.보체단백질은 비만세포의 막수용체를 활성화시켜 다양한 기능을 발휘할 [7]수도 있다.
비만세포는 항체의 가장 풍부한 구성원인 IgE의 Fc 영역에 대한 고친화성 수용체(FcεRI)를 발현한다.이 수용체는 매우 높은 친화력을 가지고 있어서 IgE 분자의 결합은 본질적으로 되돌릴 수 없다.그 결과, 비만 세포는 혈장 세포(면역계의 항체를 생산하는 세포)에 의해 생성되는 IgE로 코팅된다.IgE 항체는 전형적으로 하나의 특정 항원에 특이적이다.
알레르기 반응에서, 비만 세포는 알레르겐이 세포에 이미 코팅된 IgE에 결합할 때까지 비활성 상태를 유지합니다.다른 막 활성화 이벤트는 후속 탈과립을 위해 마스트 세포를 프라이밍하거나 FcδRI 신호 [13]전달과 시너지 작용을 할 수 있다.일반적으로 알레르겐은 단백질이나 다당류입니다.알레르겐은 항원 결합 부위에 결합하며, 항원 결합 부위는 비만 세포 표면에 결합된 IgE 분자의 가변 영역에 위치합니다.비만 세포를 활성화하기 위해서는 두 개 이상의 IgE 분자의 결합(가교 연결)이 필요한 것으로 보인다.가교 IgE 분자와 연관된 세포 결합 Fc 수용체의 세포 내 도메인 클러스터링은 활성화로 이어지는 비만 세포 내부의 복잡한 일련의 반응을 일으킨다.이 반응은 알레르기 측면에서 가장 잘 알려져 있지만 기생충과 [14]박테리아에 대한 방어 체계로 진화한 것으로 보인다.
돛대 세포 매개체
비만세포의 [12]세포 표면 수용체의 활성화에 따른 탈과립을 통해 자극 특이적인 비만세포 매개체 세트가 방출된다.비만 세포 탈과립 중에 세포 외 환경으로 방출되는 매개자의 예는 다음과 같다.[7][12][15]
- 트립타아제나 키마아제 등의 세린단백질가수분해효소
- 히스타민(마스트 세포당 2~5개의 피코그램)
- 세로토닌
- 프로테오글리칸, 주로 헤파린(항응고제로 활성)과 콘드로이틴 황산 프로테오글리칸
- 아데노신3인산(ATP)
- 리소좀효소
- 새로 형성된 지질 매개체(eicosanoids):
- 사이토카인
- 활성 산소종
히스타민은 모세혈관 후 정맥을 확장시키고 내피를 활성화시키며 혈관 투과성을 증가시킨다.이것은 국소 부종, 따뜻함, 홍반, 그리고 방출 부위로 다른 염증 세포의 흡인으로 이어진다.그것은 또한 신경 말단을 탈분극화시킨다.히스타민 방출의 피부 징후는 "플레어와 유청" 반응이다.모기에 물린 직후의 혹과 붉은색은 알레르겐에 [7]의한 돛대 세포에 도전한 지 몇 초 후에 일어나는 이 반응의 좋은 예입니다.
비만세포의 다른 생리활동은 훨씬 덜 알려져 있다.여러 줄의 증거는 비만 세포가 선천적 면역에서 상당히 근본적인 역할을 할 수 있음을 시사한다.그들은 중요한 사이토카인과 TNF-α와 같은 다른 염증 매개체들의 광범위한 배열을 정교하게 만들 수 있다; 그들은 광범위한 종류의 병원균을 인식하는 데 관여하는 것으로 생각되는 여러 "패턴 인식 수용체"를 표현한다; 그리고 돛대 세포가 없는 쥐들은 다양한 [citation needed]감염에 훨씬 더 취약한 것으로 보인다.
비만 세포 과립은 다양한 생물 활성 화학 물질을 운반합니다.이들 과립은 비만세포 의사포디아를 [16]통해 초과립화 과정에서 면역체계와 뉴런의 인접 세포로 전달되는 것으로 밝혀졌다.
신경계에서
면역계의 다른 조혈세포와 달리 비만세포는 신경면역계와 [4]상호작용하는 인간의 뇌에서 자연적으로 발생한다.뇌에서 돛대 세포는 뇌하수체 줄기, 송과선, 시상하부, 시상하부, 뇌수막 부근의 뇌수막 후부, 맥락막총 등 내장 감각(예: 통증) 또는 신경 내분비 기능을 매개하거나 혈액 뇌척수액 장벽을 따라 위치하는 많은 구조에 위치한다.이음매 [4]노크셉터비만 세포는 알레르기 반응, 선천적이고 적응적인 면역, 자가면역, 그리고 [4][17]염증과 같은 신체와 중추신경계에서 동일한 일반적인 기능을 한다.시스템 전반에서 비만 세포는 병원균이 장-뇌 [18][19]축에 영향을 미칠 수 있는 주 이펙터 세포 역할을 한다.
뱃속에서
소화관에서 점막 돛대 세포는 [20][18][19]양방향으로 소통하는 감각 신경 섬유에 가까운 곳에 위치한다.이 비만 세포는 처음 degranulate 차례로(예를 들어, 히스타민, 트립신 분해 효소, 세로토닌)는 sensitize, nociceptors의upregulate 막 표현 본능적인 구심성 신경 세포에 그들의 수용체를 통해(각각 HRH1, HRH2, HRH3, PAR2, 5-HT3)(즉, TRPV1),[20]활성화하면 신경성 염증, 강렬한 엄청난 속도로, 그들은 중재자들을 배출한다.센좌식성 및 장운동장애([20]즉, 연동장애) 결과입니다.신경 활성화는 신경펩타이드(존재 P 및 칼시토닌 유전자 관련 펩타이드) 시그널링을 비만 세포에 유도하고, 이들이 관련된 수용체에 결합하고, 별개의 매개자 세트(β-헥소사미니다아제, 사이토카인, 케모카인, PGD2, 류코트라이엔 및 에옥신)[20][12]의 탈과정을 유발한다.
생리학
고친화성 IgE 수용체 FcεR1의 구조
FcrR1은 비만세포 표면에 발현되는 고친화성 IgE 수용체이다.FcrR1은 1개의 알파(α) 사슬, 1개의 베타(β) 사슬 및 2개의 동일한 이황화물 연결 감마(β) 사슬로 이루어진 4량체이다.IgE의 결합 부위는 Ig와 유사한 두 개의 도메인을 포함하는 α 사슬의 세포 외 부분에 의해 형성된다.1개의 막 통과 도메인은 아스파라긴산 잔기를 포함하고, 1개의 도메인은 짧은 [21]세포질 꼬리를 포함한다.β 사슬은 세포질 영역에 단일 면역수용체 티로신 기반 활성화 모티브 ITAM을 포함한다.각 γ 사슬은 세포질 영역에 1개의 ITAM을 가진다.수용체로부터의 시그널링 캐스케이드는 β 및 β 사슬의 ITAM이 티로신에 의해 인산화될 때 개시된다.이 신호는 비만 세포의 [22]활성화에 필요하다.Type 2 도우미 T세포, (Th2) 및 기타 많은 세포형은 β 사슬이 없으므로 시그널링은 β 사슬에 의해서만 매개된다.이는 α 사슬이 소포체 유지 신호를 포함하고 있어 α 사슬이 ER에서 분해된 상태로 유지되기 때문입니다.α 사슬과 공감염 β 및 β 사슬의 결합은 ER 유지를 마스크하고 α β β 복합체를 골지 기기로 랫드의 혈장 막으로 내보낼 수 있도록 한다.사람의 경우 α 사슬 ER [21]보유의 균형을 맞추기 위해 γ 복합체만 필요하다.
알레르겐 과정
알레르겐 매개 FcrR1 가교신호는 림프구에 항원 결합을 일으키는 시그널링 이벤트와 매우 유사하다.Lyn 티로신 키나제는 FcrR1 β 사슬의 세포질 말단과 관련이 있다.항원은 FcrR1 분자를 가교하고, Lyn tyrosine kinase는 세포질에서 FcrR1 β 및 β 사슬의 ITAM을 인산화한다.인산화 시 Syk 티로신인산화효소는 γ사슬에 위치한 ITAM으로 유입된다.이것은 Syk 티로신 키나제의 활성화를 유발하여 [22]인산화시킨다.Syk는 여러 단백질을 표적으로 하고 활성화를 [23]유발하기 때문에 키나아제 활성을 증폭시키는 신호로 기능한다.이 항원 자극적 인산화 작용은 FcrR1 매개 신호 [24]캐스케이드에서 다른 단백질의 활성화를 유발한다.
탈과립과 융합
Syk인산화공정에서 활성화되는 중요한 어댑터 단백질은 T세포(LAT) 활성화를 위한 링커이다.LAT는 새로운 결합 부위를 [23]만들기 위해 인산화에 의해 수정될 수 있다.포스폴리파아제C 감마(PLC))는 일단 LAT에 결합하면 인산화되며, 이어서 포스파티딜이노시톨의 2인산 분해를 촉매하여 이노시톨트리인산(IP3)과 디아시글리세롤(DAG)을 생성하는데 사용된다.IP3는 칼슘 수치를 높이고 DAG는 단백질 키나제 C(PKC)를 활성화한다.PKC의 작성 방법은 이것뿐만이 아닙니다.티로신인산화효소 FYN은 PKC를 활성화하는 포스포이노시티드 3-키나아제에 결합하는 Grb2-관련결합단백질 2(Gab2)를 인산화한다.PKC는 미오신 경쇄 인산화 과립 운동을 활성화시켜 액틴-미오신 복합체를 분해하여 과립이 혈장 [22]막과 접촉할 수 있도록 한다.비만 세포 과립은 이제 혈장막과 융합할 수 있다.용해성 N-에틸말레이미드 감수성 융접 단백질 수용체 SNARE 복합체가 이 과정을 매개한다.다른 SNARE 단백질은 상호작용하여 융합을 촉매하는 다른 복합체를 형성한다.Rab3 구아노신 트리포스파타아제 및 Rab 관련 키나아제 및 포스파타아제들은 정지 중인 비만세포에서 과립막 융합을 조절한다.
MRGPRX2마스트세포수용체
인간 비만 세포 특이 G단백질 결합 수용체 MRGPRX2는 병원체 관련 분자 패턴(PAMPs)의 인식과 항균 반응 개시에 중요한 역할을 한다.MRGPRX2는 그램 양성 [25]박테리아에 의해 생성된 역량 자극 펩타이드(CSP) 1 - 쿼럼 감지 분자(QSM)와 결합할 수 있다.이것은 G단백질로의 신호 전달과 비만세포의 활성화로 이어진다.비만세포 활성화는 세균의 성장과 바이오필름 형성을 억제하기 위해 다른 면역세포의 신병을 촉진하는 ROS, TNF-α 및 PRGD2를 포함한 항균 매개체의 방출을 유도한다.
MRGPRX2 수용체는 가능한 치료 대상이며 작용제 화합물 48/80을 사용하여 약리학적으로 활성화되어 세균 [26]감염을 제어할 수 있습니다.또한 다른 QSM과 심지어 그램 음성 박테리아 신호도 이 수용체를 활성화할 수 있다는 가설이 있다.이는 특히 아직 정의되지 않은 쿼럼 감지 분자(기본 히스타민 자체?)의 존재로 인해 이들 환자가 모두 비만 세포 활성화 증후군을 가지고 있는 것이 인간 증상학에서 명확하게 나타나는 바르토넬라 만성 감염의 경우일 수 있다.이러한 환자들은 IgE 수용체 경로보다 덜 특이적인 경로인 MRGPRX2 경로로 인해 음식불내증에 걸리기 쉽다.이 환자들은 또한 박테리아가 숨겨진 세포 내 위치를 빠져나갈 때마다 주기적인 피부 거품과 피부 조영술을 보여준다.
효소
| 효소 | 기능. |
|---|---|
| 린티로신인산화효소 | 세포질 내 FcrR1 β 및 β 사슬의 ITAM을 인산화한다.이는 Syk Tyrosine 키나제를 γ사슬에 위치한 ITAMS로 유입시키는 원인이 된다.이것은 Syk 티로신 키나제의 활성화를 유발하여 인산화시킨다. |
| 시크티로신인산화효소 | 여러 단백질을 대상으로 하여 활성화를 일으킨다. |
| 포스포리파아제C | 포스파티딜이노시톨 4,5-이인산을 촉매한다. |
| 이노시톨삼인산 | 칼슘 수치를 높입니다. |
| 디아실글리세롤 | 단백질인산화효소C 활성화 |
| 핀 | GAB2 인산화 |
| GAB2 | 포스포이노시티드 3-키나아제 결합 |
| 포스포이노시티드3-키나아제 | 단백질인산화효소C 활성화 |
| 단백질인산화효소C | 액틴-미오신 복합체를 분해하는 미오신 경쇄 인산화 과립 운동을 활성화한다. |
| 랍관련인산화효소 및 포스파타아제 | 정지 중인 마스트 세포에서 세포 과립막 융합을 조절합니다. |
임상적 의의
기생충 감염
비만세포는 IgE 시그널링을 통해 특정 헬민스 및 원생동물과 같은 병원성 기생충에 의한 감염에 반응하여 활성화된다.
비만세포활성화장애
비만세포활성화장애(MCAD)는 병원성 감염과 무관하며 분비된 비만세포 중간체로부터 발생하는 유사한 증상을 수반하지만, 병태생리학, 치료방법 및 [27][28]증상 구별에 있어 약간 다르다.비만세포 활성화 장애의 분류는 [27][28]2010년에 제시되었다.
알레르기 질환
알레르기는 IgE 시그널링을 통해 매개되며 이는 비만세포의 [27]과립을 유발한다.최근에는 IgE의존성 "의사알레르기" 반응도 비만 세포의 MRGPRX2 수용체 활성화를 통해 매개되는 것으로 생각된다(예: 근육 이완제, 오피오이드, 이카티반트 및 플루오로퀴놀론).[29]
많은 형태의 피부와 점막 알레르기는 주로 비만 세포에 의해 매개된다; 그들은 천식, 습진, 가려움증, 알레르기 비염, 알레르기 결막염에 중추적인 역할을 한다.항히스타민제는 신경 말미에 대한 히스타민 작용을 차단함으로써 작용한다.크로모글리케이트 기반 약물(크로모글리케이트나트륨, 네도크로밀)은 비만 세포 탈과정에 필수적인 칼슘 채널을 차단하여 세포를 안정시키고 히스타민 및 관련 매개체의 방출을 방지합니다.류코트리엔 길항제(예: 몬텔루카스트와 자필루카스트)는 류코트리엔 매개체의 작용을 차단하고 알레르기 [7]질환에 점점 더 많이 사용되고 있다.
칼슘은 플루오르화나트륨에 이전에 노출된 후 비만 세포에서 히스타민의 분비를 유발합니다.분비 공정은 불소 활성화 공정과 칼슘 유도 분비 공정으로 나눌 수 있다.불소활성화 단계는 세포 내에서 고리형 아데노신 일인산(cAMP) 수치 상승을 동반하는 것으로 관찰되었다.달성된 높은 수준의 cAMP는 히스타민 방출 동안 지속됩니다.또한 카테콜아민은 불소 유도 히스타민 방출을 현저하게 변화시키지 않는 것으로 밝혀졌다.또한 불화나트륨 유도 히스타민 분비의 첫 번째 단계가 아닌 두 번째 단계가 테오필린에 [30]의해 억제되는 것으로 확인되었다.혈관확장 및 모세혈관의 투과성 증가는 H1 및 H2 수용체 [31]유형 모두의 결과이다.
히스타민의 자극은 산소세포의 히스타민(H2) 감수성 아데닐산환화효소를 활성화하고, H+수송 활성화 및 산소세포의 다른 [32]관련 변화에 관여하는 세포[cAMP]의 급격한 증가를 일으킨다.
무지외반증
무지외반증(견과류, 벌침 또는 약물 등 알레르겐에 대한 심각한 전신 반응)에서 비만세포의 전신 탈과정은 혈관확장 및 심하면 생명을 위협하는 [citation needed]쇼크 증상으로 이어진다.
히스타민은 아나필락시스 [31]동안 방출되는 혈관 확장 물질이다.
자가면역
비만세포는 자가면역, 관절의 염증성 질환과 관련된 병리학에 관여할 수 있다.그들은 관절(류마티스 관절염)과 피부(예: 수성 펨피고이드)로의 염증 세포의 모집에 관여하는 것으로 나타났으며, 이 활동은 항체와 보체 구성요소에 [33]의존한다.
유방세포증 및 클론장애
비만세포증은 너무 많은 비만세포(마스트구)와 [34]CD34+ 비만세포 전구체의 존재와 관련된 드문 복제성 비만세포 장애이다.c-Kit의 돌연변이는 유방세포증과 [27]관련이 있다.
모노클로널 장애
종양성 질환
비만세포종, 즉 비만세포 종양은 과도한 양의 탈과립 [27][28]생성물을 분비할 수 있다.그들은 개나 [35]고양이에게서 종종 볼 수 있다.비만 세포와 관련된 다른 종양 질환은 비만 세포 육종과 비만 세포 백혈병을 포함한다.
비만세포활성화증후군
비만세포활성화증후군(MCAS)은 재발하고 과도한 비만세포 탈과정을 수반하며 다른 비만세포 활성화 [27][28]장애와 유사한 증상을 일으키는 특발성 면역 장애이다.이 증후군은 치료 반응, 증상, 차이 진단 및 비만 세포 [27][28]탈과정의 바이오마커를 포함한 4가지 기준에 기초하여 진단된다.
역사
비만세포는 폴 에를리히가 1878년 박사학위 논문에서 독특한 염색 특성과 큰 과립에 기초해 처음 기술했다.이 과립들은 또한 그가 주변 조직에 영양을 공급하기 위해 존재한다는 잘못된 믿음으로 이끌었고, 그래서 그는 그것들을 [36][37]마스트젤렌이라고 이름 지었다.그들은 이제 면역체계의 일부로 여겨진다.
조사.
자폐증
자폐증에 대한 면역학적 기여에 대한 연구는 자폐 스펙트럼 장애(ASD) 어린이가 혈청 IgE와 만성 두드러기가 없는 경우 "알레르기성" 문제를 보일 수 있으며, 이는 환경 및 스트레스 트리거에 대한 반응으로 비알레르기성 비만 세포 활성화를 시사한다.이 비만 세포 활성화는 뇌 염증과 신경 발달 문제에 [38]기여할 수 있다.
조직학적 염색
톨루이딘 블루: 비만 세포 [39]과립의 성분인 산성 무코다당류와 글리코아미노글리칸의 가장 흔한 얼룩 중 하나.
비스마르크 갈색: 비만 세포 과립을 [40]갈색으로 염색합니다.
표면 마커: 비만 세포의 세포 표면 마커는 헤네버그에 [41]의해 상세하게 논의되었으며, 비만 세포의 일부가 CD34 항원에 양성이기 때문에 줄기세포 또는 전구 세포 분리에 우발적으로 포함될 수 있다고 주장했다.고전적인 비만 세포 마커는 고친화성 IgE 수용체, CD117(c-Kit), CD203c(대부분의 비만 세포군)를 포함한다.일부 분자의 발현은 비만세포 [42]활성화 과정에서 변할 수 있다.
「 」를 참조해 주세요.
- 알레르기
- 비만세포활성화증후군
- 디아민산화효소
- 과립구
- 음식불내증
- 히스타민
- 히스타민 불내증
- 히스타민N-메틸전달효소 또는 HNMT
레퍼런스
- ^ "labrocytes". Memidex. Archived from the original on 6 November 2018. Retrieved 19 February 2011.
- ^ Ehrlich, Paul (1878). "Beiträge zur Theorie und Praxis der Histologischen Färbung". Leipzig University.
- ^ a b c da Silva EZ, Jamur MC, Oliver C (2014). "Mast cell function: a new vision of an old cell". J. Histochem. Cytochem. 62 (10): 698–738. doi:10.1369/0022155414545334. PMC 4230976. PMID 25062998.
Mast cells can recognize pathogens through different mechanisms including direct binding of pathogens or their components to PAMP receptors on the mast cell surface, binding of antibody or complement-coated bacteria to complement or immunoglobulin receptors, or recognition of endogenous peptides produced by infected or injured cells (Hofmann and Abraham 2009). The pattern of expression of these receptors varies considerably among different mast cell subtypes. TLRs (1–7 and 9), NLRs, RLRs, and receptors for complement are accountable for most mast cell innate responses
- ^ a b c d Polyzoidis S, Koletsa T, Panagiotidou S, Ashkan K, Theoharides TC (2015). "Mast cells in meningiomas and brain inflammation". J Neuroinflammation. 12 (1): 170. doi:10.1186/s12974-015-0388-3. PMC 4573939. PMID 26377554.
MCs originate from a bone marrow progenitor and subsequently develop different phenotype characteristics locally in tissues. Their range of functions is wide and includes participation in allergic reactions, innate and adaptive immunity, inflammation, and autoimmunity [34]. In the human brain, MCs can be located in various areas, such as the pituitary stalk, the pineal gland, the area postrema, the choroid plexus, thalamus, hypothalamus, and the median eminence [35]. In the meninges, they are found within the dural layer in association with vessels and terminals of meningeal nociceptors [36]. MCs have a distinct feature compared to other hematopoietic cells in that they reside in the brain [37]. MCs contain numerous granules and secrete an abundance of prestored mediators such as corticotropin-releasing hormone (CRH), neurotensin (NT), substance P (SP), tryptase, chymase, vasoactive intestinal peptide (VIP), vascular endothelial growth factor (VEGF), TNF, prostaglandins, leukotrienes, and varieties of chemokines and cytokines some of which are known to disrupt the integrity of the blood-brain barrier (BBB) [38–40].
[The] key role of MCs in inflammation [34] and in the disruption of the BBB [41–43] suggests areas of importance for novel therapy research. Increasing evidence also indicates that MCs participate in neuroinflammation directly [44–46] and through microglia stimulation [47], contributing to the pathogenesis of such conditions such as headaches, [48] autism [49], and chronic fatigue syndrome [50]. In fact, a recent review indicated that peripheral inflammatory stimuli can cause microglia activation [51], thus possibly involving MCs outside the brain. - ^ Franco CB, Chen CC, Drukker M, Weissman IL, Galli SJ (2010). "Distinguishing mast cell and granulocyte differentiation at the single-cell level". Cell Stem Cell. 6 (4): 361–8. doi:10.1016/j.stem.2010.02.013. PMC 2852254. PMID 20362540.
- ^ Marieb EN, Hoehn K (2004). Human Anatomy and Physiology (6th ed.). San Francisco: Pearson Benjamin Cummings. p. 805. ISBN 978-0-321-20413-4.
- ^ a b c d e f Prussin C, Metcalfe DD (February 2003). "4. IgE, mast cells, basophils, and eosinophils". The Journal of Allergy and Clinical Immunology. 111 (2 Suppl): S486–94. doi:10.1067/mai.2003.120. PMC 2847274. PMID 12592295.
- ^ Razin E, Cordon-Cardo C, Good RA (April 1981). "Growth of a pure population of mouse mast cells in vitro with conditioned medium derived from concanavalin A-stimulated splenocytes". Proceedings of the National Academy of Sciences of the United States of America. 78 (4): 2559–61. Bibcode:1981PNAS...78.2559R. doi:10.1073/pnas.78.4.2559. PMC 319388. PMID 6166010.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Razin E, Ihle JN, Seldin D, et al. (March 1984). "Interleukin 3: A differentiation and growth factor for the mouse mast cell that contains chondroitin sulfate E proteoglycan". Journal of Immunology. 132 (3): 1479–86. PMID 6198393.
- ^ Denburg JA (1998). Allergy and allergic diseases: the new mechanisms and therapeutics. Totowa, NJ: Humana Press. ISBN 978-0-89603-404-4.[페이지 필요]
- ^ Pal, Sarit; Gasheva, Olga Y.; Zawieja, David C.; Meininger, Cynthia J.; Gashev, Anatoliy A. (March 2020). "Histamine-mediated autocrine signaling in mesenteric perilymphatic mast cells". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 318 (3): R590-604. doi:10.1152/ajpregu.00255.2019. PMC 7099465. PMID 31913658.
- ^ a b c d e Moon TC, Befus AD, Kulka M (2014). "Mast cell mediators: their differential release and the secretory pathways involved". Front Immunol. 5: 569. doi:10.3389/fimmu.2014.00569. PMC 4231949. PMID 25452755.
Two types of degranulation have been described for MC: piecemeal degranulation (PMD) and anaphylactic degranulation (AND) (Figures 1 and 2). Both PMD and AND occur in vivo, ex vivo, and in vitro in MC in human (78–82), mouse (83), and rat (84). PMD is selective release of portions of the granule contents, without granule-to-granule and/or granule-to-plasma membrane fusions. ... In contrast to PMD, AND is the explosive release of granule contents or entire granules to the outside of cells after granule-to-granule and/or granule-to-plasma membrane fusions (Figures 1 and 2). Ultrastructural studies show that AND starts with granule swelling and matrix alteration after appropriate stimulation (e.g., FcεRI-crosslinking).
그림 1: 마스트 셀로부터의 중개자 릴리스 2018년 4월 29일 웨이백 머신에 보관
그림 2: 비만 세포 분비 과립 생성 모델 웨이백 머신 2018년 4월 29일 아카이브
그림 3: 지질체 생체 형성2018년 4월 29일 Wayback Machine에 보관
표 2: 마스트 셀로부터의 자극 선택적 중재자 해방 2018년 4월 29일 웨이백 머신에 보관 - ^ Pulendran B, Ono SJ (May 2008). "A shot in the arm for mast cells". Nat. Med. 14 (5): 489–90. doi:10.1038/nm0508-489. PMID 18463655. S2CID 205378470.
- ^ Lee J, Veatch SL, Baird B, Holowka D (2012). "Molecular mechanisms of spontaneous and directed mast cell motility". J. Leukoc. Biol. 92 (5): 1029–41. doi:10.1189/jlb.0212091. PMC 3476239. PMID 22859829.
- ^ Ashmole I, Bradding P (May 2013). "Ion channels regulating mast cell biology". Clin. Exp. Allergy. 43 (5): 491–502. doi:10.1111/cea.12043. PMID 23600539. S2CID 1127584.
P2X receptors are ligand-gated non-selective cation channels that are activated by extracellular ATP. ... Increased local ATP concentrations are likely to be present around mast cells in inflamed tissues due to its release through cell injury or death and platelet activation [40]. Furthermore, mast cells themselves store ATP within secretory granules, which is released upon activation [41]. There is therefore the potential for significant Ca2+ influx into mast cells through P2X receptors. Members of the P2X family differ in both the ATP concentration they require for activation and the degree to which they desensitise following agonist activation [37, 38]. This opens up the possibility that by expressing a number of different P2X receptors mast cells may be able to tailor their response to ATP in a concentration dependent manner [37].
- ^ Wilhelm M, Silver R, Silverman AJ (November 2005). "Central nervous system neurons acquire mast cell products via transgranulation". The European Journal of Neuroscience. 22 (9): 2238–48. doi:10.1111/j.1460-9568.2005.04429.x. PMC 3281766. PMID 16262662.
- ^ Ren H, Han R, Chen X, Liu X, Wan J, Wang L, Yang X, Wang J (May 2020). "Potential therapeutic targets for intracerebral hemorrhage-associated inflammation: An update". J Cereb Blood Flow Metab. 40 (9): 1752–1768. doi:10.1177/0271678X20923551. PMC 7446569. PMID 32423330.
- ^ a b Budzyński J, Kłopocka M (2014). "Brain-gut axis in the pathogenesis of Helicobacter pylori infection". World J. Gastroenterol. 20 (18): 5212–25. doi:10.3748/wjg.v20.i18.5212. PMC 4017036. PMID 24833851.
In digestive tissue, H. pylori can alter signaling in the brain-gut axis by mast cells, the main brain-gut axis effector
- ^ a b Carabotti M, Scirocco A, Maselli MA, Severi C (2015). "The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems". Ann Gastroenterol. 28 (2): 203–209. PMC 4367209. PMID 25830558.
- ^ a b c d Wouters MM, Vicario M, Santos J (2015). "The role of mast cells in functional GI disorders". Gut. 65 (1): 155–168. doi:10.1136/gutjnl-2015-309151. PMID 26194403.
Functional gastrointestinal disorders (FGIDs) are characterized by chronic complaints arising from disorganized brain-gut interactions leading to dysmotility and hypersensitivity. The two most prevalent FGIDs, affecting up to 16–26% of worldwide population, are functional dyspepsia and irritable bowel syndrome. ... It is well established that mast cell activation can generate epithelial and neuro-muscular dysfunction and promote visceral hypersensitivity and altered motility patterns in FGIDs, postoperative ileus, food allergy and inflammatory bowel disease.
▸ Mast cells play a central pathophysiological role in IBS and possibly in functional dyspepsia, although not well defined.
▸ Increased mast cell activation is a common finding in the mucosa of patients with functional GI disorders. ...
▸ Treatment with mast cell stabilisers offers a reasonably safe and promising option for the management of those patients with IBS non-responding to conventional approaches, though future studies are warranted to evaluate efficacy and indications. - ^ a b Kinet JP (1999). "The high-affinity IgE receptor (FcεRI): from physiology to pathology". Annual Review of Immunology. 17: 931–72. doi:10.1146/annurev.immunol.17.1.931. PMID 10358778.
- ^ a b c Abbas AK, Lichtman AH, Pillai S (2011). "Role of Mast Cells, Basophils and Eosinophils in Immediate Hypersensitivity". Cellular and Molecular Immunology (7th ed.). New York, NY: Elsevier. ISBN 978-1-4377-1528-6.[페이지 필요]
- ^ a b Rivera J, Cordero JR, Furumoto Y, et al. (September 2002). "Macromolecular protein signaling complexes and mast cell responses: a view of the organization of IgE-dependent mast cell signaling". Molecular Immunology. 38 (16–18): 1253–8. doi:10.1016/S0161-5890(02)00072-X. PMID 12217392.
- ^ Li W, Deanin GG, Margolis B, Schlessinger J, Oliver JM (July 1992). "FcεR1-mediated tyrosine phosphorylation of multiple proteins, including phospholipase Cγ1 and the receptor βγ2 complex, in RBL-2H3 rat basophilic leukemia cells". Molecular and Cellular Biology. 12 (7): 3176–82. doi:10.1128/MCB.12.7.3176. PMC 364532. PMID 1535686.
- ^ Pundir, Priyanka; Liu, Rui; Vasavda, Chirag; Serhan, Nadine; Limjunyawong, Nathachit; Yee, Rebecca; Zhan, Yingzhuan; Dong, Xintong; Wu, Xueqing; Zhang, Ying; Snyder, Solomon H; Gaudenzio, Nicolas; Vidal, Jorge E; Dong, Xinzhong (July 2019). "A Connective Tissue Mast-Cell-Specific ReceptorDetects Bacterial Quorum-Sensing Moleculesand Mediates Antibacterial Immunity". Cell Host & Microbe. 26 (1): 114–122. doi:10.1016/j.chom.2019.06.003. PMC 6649664. PMID 31278040. Retrieved 7 July 2021.
- ^ Tatemoto, Kazuhiko; Nozaki, Yuko; Tsuda, Ryoko; Konno, Shinobu; Tomura, Keiko; Furuno, Masahiro; Ogasawara, Hiroyuki; Edamura, Koji; Takagi, Hideo; Iwamura, Hiroyuki; Noguchi, Masato; Naito, Takayuki (2006). "Immunoglobulin E-independent activation of mast cell is mediated by Mrg receptors". Biochemical and Biophysical Research Communications. 349 (4): 1322–1328. doi:10.1016/j.bbrc.2006.08.177. PMID 16979137. Retrieved 7 July 2021.
- ^ a b c d e f g Frieri M (2018). "Mast Cell Activation Syndrome". Clin Rev Allergy Immunol. 54 (3): 353–365. doi:10.1007/s12016-015-8487-6. PMID 25944644. S2CID 5723622.
Table 1
Classification of diseases associated with mast cell activation from Akin et al. [14]
1. Primary
a. Anaphylaxis with an associated clonal mast cell disorder
b. Monoclonal mast cell activation syndrome (MMAS), see text for explanation
2. Secondary
a. Allergic disorders
b. Mast cell activation associated with chronic inflammatory or neoplastic disorders
c. Physical urticarias (requires a primary stimulation)
d. Chronic autoimmune urticaria
3. Idiopathic (When mast cell degranulation has been documented; may be either primary or secondary. Angioedema may be associated with hereditary or acquired angioedema where it may be mast cell independent and result from kinin generation)
a. Anaphylaxis
b. Angioedema
c. Urticaria
d. Mast cell activation syndrome (MCAS)...
Recurrent idiopathic anaphylaxis presents with allergic signs and symptoms—hives and angioedema which is a distinguishing feature—eliminates identifiable allergic etiologies, considers mastocytosis and carcinoid syndrome, and is treated with H1 and H2 antihistamines, epinephrine, and steroids [21, 22]. - ^ a b c d e Akin C, Valent P, Metcalfe DD (2010). "Mast cell activation syndrome: Proposed diagnostic criteria". J. Allergy Clin. Immunol. 126 (6): 1099–104.e4. doi:10.1016/j.jaci.2010.08.035. PMC 3753019. PMID 21035176.
- ^ Kumar M, Duraisamy K, Chow BK (May 2021). "Unlocking the Non-IgE Mediated Pseudo-Allergic Reaction Puzzle with Mas-Related G-Protein Coupled Receptor Member X2 (MRGPRX2)". Cells. 10 (5): 1033. doi:10.3390/cells10051033. PMC 8146469. PMID 33925682.
- ^ Alm PE (April 1983). "Sodium fluoride evoked histamine release from mast cells. A study of cyclic AMP levels and effects of catecholamines". Agents and Actions. 13 (2–3): 132–7. doi:10.1007/bf01967316. PMID 6191542. S2CID 6977280.
- ^ a b Dachman WD, Bedarida G, Blaschke TF, Hoffman BB (March 1994). "Histamine-induced venodilation in human beings involves both H1 and H2 receptor subtypes". The Journal of Allergy and Clinical Immunology. 93 (3): 606–14. doi:10.1016/S0091-6749(94)70072-9. PMID 8151062.
- ^ Machen TE, Rutten MJ, Ekblad EB (February 1982). "Histamine, cAMP, and activation of piglet gastric mucosa". The American Journal of Physiology. 242 (2): G79–84. doi:10.1152/ajpgi.1982.242.2.G79. PMID 6175225.
- ^ Lee DM, Friend DS, Gurish MF, Benoist C, Mathis D, Brenner MB (September 2002). "Mast cells: a cellular link between autoantibodies and inflammatory arthritis". Science. 297 (5587): 1689–92. Bibcode:2002Sci...297.1689L. doi:10.1126/science.1073176. PMID 12215644. S2CID 38504601.
- ^ Horny HP, Sotlar K, Valent P (2007). "Mastocytosis: state of the art". Pathobiology. 74 (2): 121–32. doi:10.1159/000101711. PMID 17587883.
- ^ "Cutaneous Mast Cell Tumors". The Merck Veterinary Manual. 2006. Archived from the original on 23 May 2007. Retrieved 8 July 2007.
- ^ Ehrlich P (1878). Beiträge zur Theorie und Praxis der histologischen Färbung [Contribution to the theory and practice of histological dyes] (Dissertation) (in German). Leipzig University. OCLC 63372150.
- ^ "Mastocyte - Definition". Archived from the original on 3 February 2010. Retrieved 16 August 2010.[인용필수]
- ^ Theoharides TC, Angelidou A, Alysandratos KD, et al. (January 2012). "Mast cell activation and autism". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1822 (1): 34–41. doi:10.1016/j.bbadis.2010.12.017. PMID 21193035.
- ^ Blumenkrantz N, Asboe-Hansen G (May 1975). "A selective stain for mast cells". The Histochemical Journal. 7 (3): 277–82. doi:10.1007/BF01003596. PMID 47855. S2CID 32711203.
- ^ Tomov, N.; Dimitrov, N. (2017). "Modified bismarck brown staining for demonstration of soft tissue mast cells" (PDF). Trakia Journal of Sciences. 15 (3): 195–197. doi:10.15547/tjs.2017.03.001.
- ^ Heneberg P (November 2011). "Mast cells and basophils: trojan horses of conventional lin- stem/progenitor cell isolates". Current Pharmaceutical Design. 17 (34): 3753–71. doi:10.2174/138161211798357881. PMID 22103846.
- ^ Lebduska P, Korb J, Tůmová M, Heneberg P, Dráber P (December 2007). "Topography of signaling molecules as detected by electron microscopy on plasma membrane sheets isolated from non-adherent mast cells". Journal of Immunological Methods. 328 (1–2): 139–51. doi:10.1016/j.jim.2007.08.015. PMID 17900607.