내피
Endothelium| 내피 | |
|---|---|
 내피세포의 위치를 나타내는 다이어그램 | |
 | |
| 세부 사항 | |
| 시스템. | 순환계 |
| 위치 | 혈관 및 림프관 내부 표면 라이닝 |
| 식별자 | |
| 메쉬 | D004727 |
| TH | H2.00.02.02003 |
| FMA | 63916 |
| 미세해부술의 해부학적 용어 | |
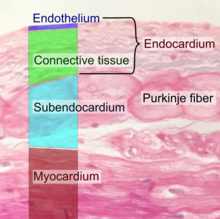
내피는 편평상피세포의 단층으로 혈관 및 [1]림프관의 내부 표면에 선을 그습니다.내피는 내강에서 순환하는 혈액이나 림프 그리고 혈관 벽의 나머지 부분들 사이에 인터페이스를 형성합니다.내피세포는 혈관과 조직 사이의 장벽을 형성하고 조직으로 들어오고 나가는 물질과 유체의 흐름을 조절합니다.
혈액과 직접 접촉하는 내피세포는 혈관내피세포라고 불리는 반면 림프와 직접 접촉하는 세포는 림프내피세포라고 알려져 있다.혈관내피세포는 심장에서 가장 작은 모세혈관에 이르는 순환계 전체에 선을 긋는다.
이 세포들은 신장의 사구체, 혈관 긴장, 지혈, 호중구 모집, 호르몬 밀매와 같은 유체 여과 기능을 포함한다.심장실 내부 표면의 내피를 심내막이라고 한다.기능 장애는 몸 전체에 심각한 건강 문제로 이어질 수 있습니다.
구조.
내피는 혈관 및 [1]림프관의 내부 표면에 늘어선 얇은 단일 평평한 세포층입니다.
내피는 중배엽에서 유래한다.혈액과 림프관 모세혈관은 모두 단층이라고 불리는 내피세포의 한 층으로 구성되어 있다.혈관의 직선 부분에서 혈관 내피 세포는 일반적으로 유체 [2][3]흐름 방향으로 정렬되고 늘어납니다.
용어.
해부학적 구조를 설명하는 데 사용되는 용어의 색인인 해부학의 기본 모델은 내피세포와 상피세포가 어떤 조직으로부터 발달했는지에 따라 구별하고, 케라틴 필라멘트가 아닌 비멘틴의 존재가 상피세포와 [4]이들을 분리한다고 명시한다.많은 사람들은 내피를 특수 상피 [5]조직으로 여겼다.
기능.
내피는 내강에서 순환하는 혈액이나 림프 그리고 혈관 벽의 나머지 부분들 사이에 인터페이스를 형성합니다.이것은 혈관과 조직 사이에 장벽을 형성하고 조직으로 들어오고 나가는 물질과 액체의 흐름을 조절합니다.이것은 물질의 통과와 백혈구의 혈류로의 통과를 통제한다.만성 염증의 경우처럼 내피의 투과성이 과도하게 또는 장기간 증가하면 조직의 붓기(부종)가 발생할 수 있습니다.변화된 장벽 기능은 암의 [6]침입에도 관련된다.
내피 세포는 다음을 포함한 혈관 기능의 많은 다른 측면에 관여합니다.
- 혈액 응고(혈전증 및 섬유소 용해)내피에는 응고 캐스케이드 내의 여러 인자를 비활성화하는 단백질 분해효소인 안티트롬빈 활성화의 보조인자로 작용하는 헤파란 황산염을 포함한 응고를 방지하는 물질이 함유되어 발현되기 때문에 일반적으로 혈액이 응고되지 않는 표면이 제공됩니다.
- 염증.[7]내피세포는 염증 중에 면역체계의[8] 백혈구에 신호를 활발하게 보냅니다
- 새로운 혈관의 형성(혈관 형성).
- 혈관 수축 및 혈관 확장이라고 하는 혈관의 수축 및 확대, 혈압 조절
혈관 형성
내피는 [citation needed]혈관신생이라 불리는 새로운 혈관의 형성에 관여합니다.혈관신생은 배아와 [9]태아의 장기발달과 손상된 부위의 회복을 위한 중요한 과정이다.이 과정은 조직 산소 감소(저산소증) 또는 불충분한 산소 장력에 의해 유발되며, 이는 내피 세포로 둘러싸인 혈관의 새로운 발달로 이어진다.혈관신생은 과정을 촉진하고 감소시키는 신호에 의해 조절됩니다.인테그린, 케모카인, 앤지오피에틴, 산소 감지제, 접합 분자 및 내인성 억제제를 [9]포함한 혈관신호 및 항혈관신생 신호.앤지오포에틴-2는 VEGF와 함께 세포 증식과 내피 세포의 이동을 촉진합니다.
혈관신생의 일반적인 개요는
- 혈관 내피 세포의 표면 수용체에 결합하는 활성화 신호.
- 활성화된 내피 세포는 단백질 분해 효소를 방출하여 기저막의 분해를 초래한다
- 내피세포는 혈관신생 자극의 근원을 향해 확장을 형성하기 위해 기존 혈관으로부터 이동하기 위해 자유로워지고 증식을 시작한다.
숙주의 면역 반응
내피세포는 다양한 면역유전자를 장기 특이적인 방식으로 [10]발현한다.이러한 유전자는 중요한 면역 매개자와 조혈성 면역 [11]세포와의 세포 통신을 촉진하는 단백질을 포함한다.내피세포는 후생유전자에서 구조세포 면역반응의 중요한 특징을 암호화하고, 따라서 면역학적 도전에 빠르게 반응할 수 있다.내피와 같은 비조혈세포에 의한 숙주 면역에 대한 기여는 "구조 면역"[12]이라고 불린다.
임상적 의의
내피 기능 장애 또는 적절한 내피 기능의 상실은 혈관 질환의 특징이며, 종종 아테롬성 동맥 [13]경화증의 발생 초기 주요 사건으로 간주됩니다.고혈압과 혈전을 일으키는 내피 기능 장애는 흡연자뿐만 아니라 관상동맥 질환, 당뇨병, 고혈압, 고콜레스테롤혈증 환자에서도 종종 나타난다.내피 기능 장애는 또한 미래의 심혈관 이상 현상을 예측할 수 있으며 류마티스 관절염과 전신 홍반성 [citation needed]낭창과 같은 염증 질환에도 존재하는 것으로 나타났다.
내피 기능 장애는 내피 [14][15]기능의 변화로 인한 것이다.지방(지질) 축적 후 염증에 의해 자극되면 내피세포가 활성화되며, [16]이는 면역세포의 유착을 자극하는 E-셀렉틴, VCAM-1, ICAM-1 등의 분자의 발현을 특징으로 한다.또한 세포 내 단백질 생성을 증가시키는 물질인 전사인자, 특히 AP-1 및 NF-δB가 활성화되어 염증을 [17][18]촉진하는 IL-1, TNFα, IFN, 등의 사이토카인의 발현을 증가시킨다.이러한 내피세포 상태는 지방질 및 지방단백질의 내막 축적을 촉진하여 아테롬성 동맥경화를 유발하고, 백혈구와 혈소판의 획득과 평활근세포의 증식을 촉진하여 지방줄기를 형성한다.내장에 병변이 형성되고 지속적인 염증이 내피 박리작용을 일으켜 내피장벽을 파괴하고 부상과 그에 따른 [19]기능장애를 일으킨다.이와는 대조적으로 염증 자극은 데우비퀴티나아제 A20(TNFAIP3)의 NF-δB 유도 발현도 활성화하며, 이는 내피 [20]장벽을 본질적으로 수리하는 것으로 나타났다.
내피 기능 장애의 주요 메커니즘 중 하나는 질소 산화물의 감소이며, 종종 L-아르기닌 자극 일산화물 합성을 방해하여 고혈압으로 이어지는 높은 수준의 비대칭 디메틸라르기닌에 기인한다.내피 기능 장애의 가장 일반적인 메커니즘은 활성 산소 종의 증가이며, 이것은 여러 메커니즘을 [21]통해 일산화질소의 생산과 활동을 저해할 수 있습니다.신호 전달 단백질 ERK5는 정상적인 내피 세포 [22]기능을 유지하기 위해 필수적이다.내피 손상의 또 다른 결과는 혈소판 응집과 아내피 부착을 촉진하는 폰 빌브란트 인자의 병리학적 양의 방출이며, 이로 인해 치명적일 수 있는 혈전 형성을 촉진한다.
혈관육종은 내피암으로 미국에서는 [23]연간 300건밖에 발생하지 않는다.그러나 일반적으로 5년 생존율이 35%[24]로 예후가 좋지 않다.
조사.
암의 내피
종양 혈관 구조를 형성하는 내피 세포는 뚜렷한 형태학적 특성, 생리학적 내피와 비교하여 다른 기원, 그리고 뚜렷한 분자적 특징을 가지고 있으며, 이것은 종양 혈관 형성의 새로운 바이오마커의 시행 기회를 제공하고 새로운 항혈관신생 약제성 대상을 제공할 수 있다.s.[25] 암 치료에서 항혈관신생 약물의 개발과 전달은 매우 유망한 경로이며 혈관 항상성을 회복하는 것은 허혈성 조직 질환의 치료에 큰 잠재력을 가지고 있다.
Covid-19의 내피
2020년 4월, COVID-19로 사망한 환자 3명의 내피 세포에서 바이러스 원소의 존재가 처음으로 보고되었다.취리히 대학과 하버드 의대 연구진은 이러한 발견을 다른 장기의 일반적인 내피염의 징후로 간주했다. 감염에 대한 내피의 염증 반응으로 당뇨병, 당뇨병, H와 같은 공병 환자의 다장기 부전을 이끌 수 있거나 최소한 기여할 수 있다.심혈관계 [27][28]질환이 있어요
역사
1958년, 토드는 인간의 혈관에 있는 내피가 섬유소 용해 작용을 [29][30]한다는 것을 증명했다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b 도란드 의학 사전의 "내피"
- ^ Eskin SG, Ives CL, McIntire LV, Navarro LT (July 1984). "Response of cultured endothelial cells to steady flow". Microvascular Research. 28 (1): 87–94. doi:10.1016/0026-2862(84)90031-1. PMID 6748961.
- ^ Langille BL, Adamson SL (April 1981). "Relationship between blood flow direction and endothelial cell orientation at arterial branch sites in rabbits and mice". Circulation Research. 48 (4): 481–8. doi:10.1161/01.RES.48.4.481. PMID 7460219.
- ^ "Endothelial cell". BioPortal. Stanford University. Archived from the original on 2013-10-02. Retrieved 2013-09-28.
- ^ Kovacic JC, Mercader N, Torres M, Boehm M, Fuster V (April 2012). "Epithelial-to-mesenchymal and endothelial-to-mesenchymal transition: from cardiovascular development to disease". Circulation. 125 (14): 1795–808. doi:10.1161/circulationaha.111.040352. PMC 3333843. PMID 22492947.
- ^ Escribano J, Chen MB, Moeendarbary E, Cao X, Shenoy V, Garcia-Aznar JM, et al. (May 2019). "Balance of mechanical forces drives endothelial gap formation and may facilitate cancer and immune-cell extravasation". PLOS Computational Biology. 15 (5): e1006395. arXiv:1811.09326. Bibcode:2019PLSCB..15E6395E. doi:10.1371/journal.pcbi.1006395. PMC 6497229. PMID 31048903.
- ^ Li X, Fang P, Li Y, Kuo YM, Andrews AJ, Nanayakkara G, et al. (June 2016). "Mitochondrial Reactive Oxygen Species Mediate Lysophosphatidylcholine-Induced Endothelial Cell Activation". Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (6): 1090–100. doi:10.1161/ATVBAHA.115.306964. PMC 4882253. PMID 27127201.
- ^ Vestweber D (November 2015). "How leukocytes cross the vascular endothelium". Nature Reviews. Immunology. 15 (11): 692–704. doi:10.1038/nri3908. PMID 26471775. S2CID 29703333.
- ^ a b Bouïs D, Kusumanto Y, Meijer C, Mulder NH, Hospers GA (February 2006). "A review on pro- and anti-angiogenic factors as targets of clinical intervention". Pharmacological Research. 53 (2): 89–103. doi:10.1016/j.phrs.2005.10.006. PMID 16321545.
- ^ Krausgruber T, Fortelny N, Fife-Gernedl V, Senekowitsch M, Schuster LC, Lercher A, et al. (July 2020). "Structural cells are key regulators of organ-specific immune responses". Nature. 583 (7815): 296–302. Bibcode:2020Natur.583..296K. doi:10.1038/s41586-020-2424-4. PMC 7610345. PMID 32612232. S2CID 220295181.
- ^ Armingol E, Officer A, Harismendy O, Lewis NE (November 2020). "Deciphering cell-cell interactions and communication from gene expression". Nature Reviews. Genetics. 22 (2): 71–88. doi:10.1038/s41576-020-00292-x. PMC 7649713. PMID 33168968.
- ^ Minton K (September 2020). "A gene atlas of 'structural immunity'". Nature Reviews. Immunology. 20 (9): 518–519. doi:10.1038/s41577-020-0398-y. PMID 32661408. S2CID 220491226.
- ^ Botts SR, Fish JE, Howe KL (December 2021). "Dysfunctional Vascular Endothelium as a Driver of Atherosclerosis: Emerging Insights Into Pathogenesis and Treatment". Frontiers in Pharmacology. 12: 787541. doi:10.3389/fphar.2021.787541. PMC 8727904. PMID 35002720.
- ^ Iantorno M, Campia U, Di Daniele N, Nistico S, Forleo GB, Cardillo C, Tesauro M (April 2014). "Obesity, inflammation and endothelial dysfunction". Journal of Biological Regulators and Homeostatic Agents. 28 (2): 169–76. PMID 25001649.
- ^ Reriani MK, Lerman LO, Lerman A (June 2010). "Endothelial function as a functional expression of cardiovascular risk factors". Biomarkers in Medicine. 4 (3): 351–60. doi:10.2217/bmm.10.61. PMC 2911781. PMID 20550469.
- ^ Lopez-Garcia E, Hu FB (August 2004). "Nutrition and the endothelium". Current Diabetes Reports. 4 (4): 253–9. doi:10.1007/s11892-004-0076-7. PMID 15265466. S2CID 24878288.
- ^ Blake GJ, Ridker PM (October 2002). "Inflammatory bio-markers and cardiovascular risk prediction". Journal of Internal Medicine. 252 (4): 283–94. doi:10.1046/j.1365-2796.2002.01019.x. PMID 12366601. S2CID 26400610.
- ^ Mizuno Y, Jacob RF, Mason RP (2011). "Inflammation and the development of atherosclerosis". Journal of Atherosclerosis and Thrombosis. 18 (5): 351–8. doi:10.5551/jat.7591. PMID 21427505.
- ^ Mäyränpää MI, Heikkilä HM, Lindstedt KA, Walls AF, Kovanen PT (November 2006). "Desquamation of human coronary artery endothelium by human mast cell proteases: implications for plaque erosion". Coronary Artery Disease. 17 (7): 611–21. doi:10.1097/01.mca.0000224420.67304.4d. PMID 17047445. S2CID 1884596.
- ^ Soni D, Wang DM, Regmi SC, Mittal M, Vogel SM, Schlüter D, Tiruppathi C (May 2018). "Deubiquitinase function of A20 maintains and repairs endothelial barrier after lung vascular injury". Cell Death Discovery. 4 (60): 60. doi:10.1038/s41420-018-0056-3. PMC 5955943. PMID 29796309.
- ^ Deanfield J, Donald A, Ferri C, Giannattasio C, Halcox J, Halligan S, Lerman A, Mancia G, Oliver JJ, Pessina AC, Rizzoni D, Rossi GP, Salvetti A, Schiffrin EL, Taddei S, Webb DJ (January 2005). "Endothelial function and dysfunction. Part I: Methodological issues for assessment in the different vascular beds: a statement by the Working Group on Endothelin and Endothelial Factors of the European Society of Hypertension". Journal of Hypertension. 23 (1): 7–17. doi:10.1097/00004872-200501000-00004. PMID 15643116.
- ^ Roberts OL, Holmes K, Müller J, Cross DA, Cross MJ (December 2009). "ERK5 and the regulation of endothelial cell function". Biochemical Society Transactions. 37 (Pt 6): 1254–9. doi:10.1042/BST0371254. PMID 19909257.
- ^ "Angiosarcoma - National Cancer Institute". www.cancer.gov. 2019-02-27. Retrieved 2021-08-10.
- ^ Young, Robin J.; Brown, Nicola J.; Reed, Malcolm W.; Hughes, David; Woll, Penella J. (October 2010). "Angiosarcoma". The Lancet. Oncology. 11 (10): 983–991. doi:10.1016/S1470-2045(10)70023-1. ISSN 1474-5488. PMID 20537949.
- ^ Milosevic, Vladan; Edelmann, Reidunn J.; Fosse, Johanna Hol; Östman, Arne; Akslen, Lars A. (2022), Akslen, Lars A.; Watnick, Randolph S. (eds.), "Molecular Phenotypes of Endothelial Cells in Malignant Tumors", Biomarkers of the Tumor Microenvironment, Cham: Springer International Publishing, pp. 31–52, doi:10.1007/978-3-030-98950-7_3, ISBN 978-3-030-98950-7, retrieved 2022-07-13
- ^ Van Hove AH, Benoit DS (2015). "Depot-Based Delivery Systems for Pro-Angiogenic Peptides: A Review". Frontiers in Bioengineering and Biotechnology. 3: 102. doi:10.3389/fbioe.2015.00102. PMC 4504170. PMID 26236708.
- ^ Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, Mehra MR, Schuepbach RA, Ruschitzka F, Moch H (May 2020). "Endothelial cell infection and endotheliitis in COVID-19". Lancet. 395 (10234): 1417–1418. doi:10.1016/S0140-6736(20)30937-5. PMC 7172722. PMID 32325026.
- ^ Sardu C, Gambardella J, Morelli MB, Wang X, Marfella R, Santulli G (May 2020). "Hypertension, Thrombosis, Kidney Failure, and Diabetes: Is COVID-19 an Endothelial Disease? A Comprehensive Evaluation of Clinical and Basic Evidence". J Clin Med. 9 (5): 1417. doi:10.3390/jcm9051417. PMC 7290769. PMID 32403217.
- ^ Todd AS (February 1958). "Fibrinolysis autographs". Nature. 181 (4607): 495–6. Bibcode:1958Natur.181..495T. doi:10.1038/181495b0. eISSN 1476-4687. PMID 13517190. S2CID 4219257.
- ^ Todd AS (September 1964). "Localization of fibrinolytic activity in tissues". British Medical Bulletin. 20 (3): 210–2. doi:10.1093/oxfordjournals.bmb.a070333. eISSN 1471-8391. PMID 14209761.
외부 링크
- 해부 사진: 순환/혈관/모세혈관1/모세혈관3 - 데이비스 캘리포니아 대학의 비교 기관, "모세혈관, 비모세혈관(EM, Low)"
- 조직 이미지: 21402ooa – 보스턴 대학교 조직학 학습 시스템
- 내피와 염증
- 워싱턴 대학교 혈소판 활성화
추가 정보
- 밀로세비치, V., 에델만, R.J., 포세, J.H., 외스트만, A., 악슬렌, L.A. (2022년)악성종양의 내피세포 분자표현형. 인: L.A., Watnick, R.S. (에드) 종양 미세환경 바이오마커스프링거, 참https://doi.org/10.1007/978-3-030-98950-7_3