형광
Fluorescence

형광은 빛이나 다른 전자기 방사선을 흡수한 물질에 의한 빛의 방출이다.그것은 발광의 일종이다.대부분의 경우, 방출된 빛은 흡수된 방사선보다 파장이 더 길고, 따라서 광자 에너지가 더 낮다.형광의 감지할 수 있는 예는 흡수된 방사선이 스펙트럼의 자외선 영역(인간의 눈에 보이지 않음)에 있는 반면 방출된 빛이 가시 영역에 있을 때 발생한다. 이는 형광 물질에 자외선에 노출되었을 때만 볼 수 있는 뚜렷한 색상을 제공한다.형광물질은 이후 한동안 빛을 계속 내보내는 형광물질과 달리 방사선원이 멈추면 거의 즉시 빛을 내지 않는다.
형광은 광물학, 보석학, 의학, 화학 센서(불광 분광학), 형광 라벨 표시, 염료, 생물학적 검출기, 우주선 검출, 진공 형광 표시장치, 음극선 튜브를 포함한 많은 실용적인 용도가 있다.가장 흔한 일상의 적용은 형광등과 LED 램프에 있는데, 형광 코팅은 UV나 청색 빛을 더 긴 파장으로 변환하여 백색광을 만들어 내는데, 이것은 심지어 전통적인 백열등과 구별할 수 없지만 매우 비효율적인 백열등과 구별할 수 없는 것처럼 보일 수 있다.
형광은 또한 자연에서 몇몇 광물과 많은 생물학적 형태에서 생명의 모든 왕국에 걸쳐 자주 발생한다.후자를 바이오 플루오르광이라고 할 수 있는데, 이는 불소가 (무기 염료나 얼룩이 아닌) 살아있는 유기체의 일부 또는 추출되었음을 나타낸다.그러나 형광은 대부분의 경우 인공적으로 합성될 수도 있는 특정 화학 물질에 기인하기 때문에 그 물질 자체를 형광물질로 설명하기에 충분하다.
역사
형광에 대한 초기 관찰은 1560년 베르나르디노 데 사하군(Bernardino de Sahagun), 1565년 니콜라스 모나르드(Nicolas Monardes)가 리눔 네프리티쿰(Kidney wood)으로 알려진 주입에서 설명하였다.그것은 프테로카르푸스 인디쿠스와 아이센하르티아 폴리스타치야라는 두 나무의 나무에서 유래되었다.[1][2][3][4]이 형광의 원인이 되는 화학적 화합물은 이 나무에서 발견된 플라보노이드 중 하나의 산화제인 matlaline이다.[1]
1819년 에드워드 D. 클라크와[5] 1822년 레네 저스트 하우이경은[6] 불소의 형광을 묘사했고, 데이비드 브루스터 경은 1833년[7] 엽록소에 대한 현상을 묘사했고 존 허셜 경은 1845년 키니네에 대해서도 그렇게 했다.[8][9]
조지 가브리엘 스톡스는 1852년 발표한 빛의 '정확성'(파장 변화) 논문에서 가시 스펙트럼의 보라색 끝을 넘어 보이지 않는 빛을 푸른 빛으로 바꾸는 플루오르스와 우라늄 유리의 능력을 설명했다.그는 이 현상을 형광증이라고 이름 지었다: "나는 거의 단어 하나에 동전을 붙이고, 비슷한 용어인 오팔레슈팅이 광물의 이름에서 유래되었기 때문에 불소수파[즉, 불소산염]에서 형광증이라고 부른다."[10]그 이름은 미네랄 플루오르산염(칼슘 이플루오라이드)에서 유래되었는데, 그 중 몇 가지 예에는 푸른 빛을 발산하는 형광 활성제 역할을 하는 이분성 유로피움의 흔적이 포함되어 있다.핵심 실험에서 그는 프리즘을 사용하여 햇빛으로부터 자외선을 분리했고, 그것에 의해 노출된 키니네의 에탄올 용액에 의해 방출되는 푸른 빛을 관찰했다.[11]
물리적 원리
메커니즘
형광은 흥분한 분자, 원자, 나노구조체가 전자 스핀의 변화 없이 광자의 배출을 통해 낮은 에너지 상태(보통 지상 상태)로 이완할 때 발생한다.초기 상태와 최종 상태가 다른 다중성(spin)을 가질 때 이 현상을 인광성이라고 한다.
대부분의 분자의 지상 상태는 S로0 표기된 싱글릿 상태다.주목할 만한 예외는 3중 접지 상태를 가진 분자 산소다.에너지 의 광자를 흡수하면 지반 상태의 동일한 다중성(spin) 상태, 보통 singlet (nn > 0)의 흥분 상태가 된다.해결책으로는 n > 1을 가진 상태에서는 내부 변환에 이어 진동 이완이 열로 소멸되는 등 비방사성 과정을 통해 용제 분자에게 에너지를 전달함으로써 첫 번째 흥분 상태(S)의1 최저 진동 수준으로 빠르게 이완한다.[12]그러므로, 가장 일반적으로 형광은 첫 번째 싱글렛 흥분 상태인 S에서1 발생한다.형광은 흥분 상태의 이완을 수반하는 광자의 방출이다.형광 광자는 흥분 상태를 생성하는 데 사용되는 광자의 에너지( 에 비해 에너지( 가 낮다
- 흥분:
- 형광(배출):
각 경우에 광자 에너지 은(는) = 에 따른 주파수 에 비례하며 여기서 h}은Planck의 상수이다
흥분된 상태 S는1 빛의 배출을 수반하지 않는 다른 메커니즘에 의해 이완될 수 있다.이러한 과정은 비방사성 과정이라 불리며 형광 방출과 경쟁하여 그 효율을 떨어뜨린다.[12]예를 들어 내부 변환, 트리플트 상태로의 시스템 간 교차, 다른 분자로의 에너지 전달 등이 있다.에너지 전달의 예로는 Förster 공명 에너지 전달이 있다.흥분된 상태로부터의 이완은 분자(취급자)가 흥분된 상태 수명 동안 형광 분자와 충돌하는 과정인 충돌 퀀싱을 통해서도 발생할 수 있다.분자 산소(O2)는 특이한 세 쌍둥이 지상 상태 때문에 형광의 극히 효율적인 진원이다.
양자수율
형광 양자 수율은 형광 과정의 효율성을 제공한다.흡수된 광자 수에 대한 방출 광자 수의 비율로 정의된다.[13][12]
가능한 최대 형광 양자 수율은 1.0(100%)이다. 각 광자가 흡수되면 광자가 방출된다.양자 수율이 0.10인 화합물은 여전히 꽤 형광물질로 간주된다.형광의 양자 수율을 정의하는 또 다른 방법은 흥분 상태 붕괴 비율이다.
여기서 는 방사선의 자발적 방출 속도 상수 및
흥분된 상태의 모든 비율의 합이다.흥분 상태 붕괴의 다른 비율은 광자 방출 이외의 메커니즘에 의해 발생하며, 따라서 흔히 "비방사성 속도"라고 불리며, 여기에는 동적 충돌 quenching, 근장 쌍극-디폴 상호작용(또는 공명에너지 전달), 내부 변환 및 시스템 간 교차 등이 포함될 수 있다.따라서 어떤 경로의 비율이 변경되면 흥분된 상태 수명과 형광 양자 수율에 모두 영향을 미칠 것이다.
형광 양자 수율은 표준과 비교하여 측정된다.[14]황산용액에 함유된 퀴닌염 퀴닌황산염은 가장 일반적인 형광기준으로 여겨졌으나,[15] 최근 연구에서는 이 용액의 형광 양자수확률이 온도에 의해 강한 영향을 받고 있으므로 더 이상 표준용액으로 사용되어서는 안 된다는 것이 밝혀졌다.0.1M 과염소산(ic=0.60)의 퀴닌은 45℃까지의 온도 의존성이 없으므로 신뢰할 수 있는 표준용액으로 간주할 수 있다.[16]
라이프타임
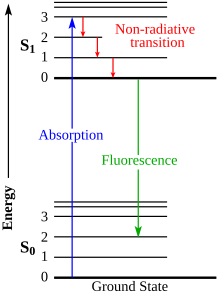
형광 수명은 분자가 광자를 방출하기 전에 흥분된 상태로 머무르는 평균 시간을 가리킨다.형광은 일반적으로 첫 번째 순서 운동학을 따른다.
여기서[ 1 은(는) t {\ [ S ]0 {0은 초기 농도, {\은 형광수명의 부패율 또는 역이다.이것은 기하급수적인 붕괴의 한 예다.다양한 복사 과정과 비복사 과정이 흥분 상태를 탈구시킬 수 있다.이러한 경우 총 붕괴율은 모든 비율에 대한 합이다.
여기서 {\ 는 총 이고, r d{\{nrad는 복사 붕괴율이다.1차 비율 상수가 모든 비율의 합계(평행 운동 모델)인 1차 화학 반응과 비슷하다.자발적 배출 속도 또는 다른 비율 중 어떤 것이라도 빠른 경우, 수명은 짧다.일반적으로 사용되는 형광 화합물의 경우, UV에서 근적외선까지 에너지를 사용하는 광자 방출에 대한 대표적인 흥분 상태 붕괴 시간은 0.5~20나노초 범위 내에 있다.형광 수명은 형광 공진 에너지 전달 및 형광-평생 영상 현미경 등 형광의 실제 적용에 중요한 매개변수다.
자블론스키 도표
자블론스키 도표는 흥분된 상태 분자를 위한 대부분의 이완 메커니즘을 묘사하고 있다.도표 옆에 있는 도표는 분자의 특정 흥분된 전자의 이완으로 인해 형광이 어떻게 발생하는지를 보여준다.[17]
형광 음이소트로피
불소포체는 불소포어의 전환 모멘트가 광자의 전기 벡터와 평행하면 광자에 의해 흥분하기 쉽다.[18]방출되는 빛의 양극화도 전환기에 따라 달라질 것이다.전환 모멘트는 불소포자 분자의 물리적 방향에 따라 달라진다.용액 내 불소포체의 경우 이는 방출된 빛의 강도와 양극화가 회전 확산에 따라 결정된다는 것을 의미한다.따라서 음이소트로피 측정은 형광 분자가 특정 환경에서 얼마나 자유롭게 움직이는지를 조사하는 데 사용될 수 있다.
형광 음이소트로피는 다음과 같이 정량적으로 정의될 수 있다.
여기서 은(는) 흥분광의 양극화에 평행한 방출 강도, 은 흥분광의 양극화에 직각인 방출 강도다.[12]
형광
강한 형광 색소는 흔히 "네온 색소"(원래는 1960년대 후반, 1970년대 초반의 "데이글로")라고 구어적으로 묘사되는 특이한 외관을 가지고 있다.이 현상은 헤르만 폰 헬름홀츠(Hermann von Helmholtz)가 '파르벤글루트(Farbenglut)', 랄프 M. 에반스(Ralph M. Evans)가 '플루오렌스(fluorence그것은 일반적으로 백색의 성분으로서 어떤 것이 될 것인가에 비례하여 색의 높은 밝기와 관련이 있다고 생각된다.형광은 입사 조명의 에너지를 더 짧은 파장에서 더 긴 파장(파란색에서 노란색으로)으로 이동시켜 형광 색상을 반사만으로 볼 수 있는 것보다 더 밝게(포화도가 높은) 보이게 할 수 있다.[19]
규칙.
형광을 다루는 몇 가지 일반적인 규칙이 있다.다음의 각 규칙에는 예외가 있지만 형광의 이해를 위한 유용한 지침이다(이 규칙들은 반드시 2-광자 흡수에는 적용되지 않는다).
카샤의 법칙
카샤의 법칙은 발광의 양자 수율은 신나는 방사선의 파장과는 무관하다는 것을 지시한다.[20]이것은 흥분된 분자들이 형광 방출이 일어나기 전에 보통 흥분 상태의 가장 낮은 진동 수준으로 부패하기 때문이다.카샤-바빌로프 규칙은 항상 적용되는 것은 아니며 많은 단순한 분자에서는 심각하게 위반된다.여전히 예외는 있지만 다소 신뢰할 수 있는 진술은 형광 스펙트럼이 흥미로운 방사선의 파장에 거의 의존하지 않는다는 것이다.[21]
미러 이미지 규칙
많은 불소포체에서 흡수 스펙트럼은 방출 스펙트럼의 미러 이미지다.[22]이는 거울 이미지 규칙으로 알려져 있으며, 전자 전환은 수직이며, 거리 변화 없이 에너지가 변화한다는 것을 자블론스키 다이어그램에서 수직선으로 나타낼 수 있는 것으로 기술한 프랑크-콘돈 원리와 관련이 있다.이는 핵이 움직이지 않고 흥분 상태의 진동 수준이 지상 상태의 진동 수준과 유사함을 의미한다.
스톡스 시프트
일반적으로 방출되는 형광등은 흡수된 빛보다 파장이 길고 에너지가 낮다.[23]스톡스 시프트라고 알려진 이 현상은 광자가 흡수되는 시간과 새로운 광자가 방출되는 시간 사이의 에너지 손실 때문이다.스톡스 시프트의 원인과 규모는 복잡할 수 있으며 불소포체와 그 환경에 의존한다.그러나 몇 가지 공통적인 원인이 있다.흥분 상태의 가장 낮은 진동 에너지 수준으로 비방사성 붕괴가 자주 발생한다.또 다른 요인은 형광의 방출이 종종 불소를 지상의 더 높은 진동 수준으로 남기는 것이다.
자연에서
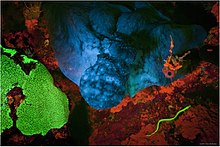
형광을 나타내는 많은 자연 화합물이 있고, 그것들은 많은 응용을 가지고 있다.녹색과 같은 심해 동물들은 형광 구조를 가지고 있다.
생물 발광 및 생물인산 발광과 비교
형광
형광은 형광 분자에 의한 가시광선 스펙트럼으로부터의 전자기 파장의 일시적 흡수, 그에 따른 낮은 에너지 수준에서 빛의 방출이다.살아있는 유기체에서 발생할 때, 그것은 때때로 바이오 플루오렌스라고 불린다.이는 방출되는 빛이 흡수되는 빛과 다른 색을 띠게 한다.자극적인 빛은 전자를 흥분시켜 에너지를 불안정한 수준으로 끌어올린다.이러한 불안정성은 불리하기 때문에, 전원이 공급된 전자는 불안정한 상태가 되는 즉시 안정된 상태로 되돌아간다.이러한 안정으로의 복귀는 형광등의 형태로 과잉 에너지를 방출하는 것과 일치한다.이 빛의 방출은 각성제 빛이 여전히 유기체/물체에 빛을 제공하고 있을 때에만 관측할 수 있으며 일반적으로 노란색, 분홍색, 주황색, 빨간색, 녹색 또는 보라색이다.형광은 종종 다음과 같은 형태의 생물학적 빛, 생물 발광 및 생물인광과 혼동된다.[24]브라질 대서양 숲에 사는 호박 두꺼비는 형광색이다.[25]
생물 발광
생물 발광은 유기체 내에서 화학적 반응에 의한 빛의 자연적 생산이라는 점에서 형광과는 다른 반면 형광은 환경으로부터 빛을 흡수하고 다시 방출하는 것이다.[24]반딧불이와 앵글러피쉬는 생물 발광 유기체의 두 가지 예다.[26]잠재적인 혼동을 더하기 위해, 어떤 유기체들은 생물 발광이 형광의 광원 역할을 하는 바다 팬지 레닐라 신장균과 같이 생물 발광과 형광이다.[27]
인광체
인광은 흥분 에너지 공급자로서 광 파장의 요구 조건에서의 형광과 유사하다.여기서의 차이는 전원이 공급된 전자의 상대적 안정성에 있다.형광과 달리 인광에서 전자는 안정감을 유지하며 자극적인 광원이 제거된 후에도 계속해서 '빛깔'을 내는 빛을 방출한다.[24]예를 들어 야광 스티커는 인광이지만, 진짜 생물인광 동물은 알려져 있지 않다.[28]
메커니즘
표피 염색체
형광을 보이는 색소세포를 형광색소세포라고 하며, 체적으로 일반 색소세포와 유사한 기능을 한다.이 세포들은 덴드리틱이며, 플루오솜이라고 불리는 색소를 함유하고 있다.이들 색소에는 K+(칼륨)[29][30] 이온에 의해 활성화되는 형광 단백질이 들어 있으며, 형광 색소체 내에서 이들의 움직임, 집적, 분산으로 인해 형광 패터닝이 일어난다.형광 세포는 멜라닌을 함유한 색소 세포인 멜라노포레스와 같은 다른 색소 세포와 동일하게 내분된다.단기 형광 패터닝과 신호는 신경계에 의해 제어된다.[29]형광 색소포체는 다른 색소포체들 중에서 표피 바로 아래의 피부(예: 물고기)에서 발견될 수 있다.
물고기의 표피 형광 세포도 멜라노포체와 거의 마찬가지로 α-MSH와 MCH 호르몬에 의한 호르몬 자극에 반응한다.이것은 형광 세포가 하루 종일 그들의 순환 리듬과 일치하는 색 변화를 가질 수 있다는 것을 암시한다.[31]물고기는 또한 포식자와의 상호작용이나 짝짓기 의식과 같은 환경 자극에 대한 코티솔 유도 스트레스 반응에 민감할 수 있다.[29]
계통유전학
진화 기원
생명의 나무에서 형광의 발생은 널리 퍼져 있으며, 신식동물과 어류에서 가장 광범위하게 연구되어 왔다.이 현상은 이 글의 뒷부분에서 논의된 다른 세자와 함께, 복수 세사에서 여러 번 진화한 것으로 보인다.형광은 방출되는 파장, 표시되는 패턴, 형광의 강도와 관련하여, 생태계 내에서조차 유전자형이 높고 표현적으로 가변적이다.일반적으로 위장술에 의존하는 종은 형광의 가장 큰 다양성을 보이는데, 이는 위장술이 형광의 사용 중 하나일 수 있기 때문일 것이다.[32]
일부 과학자들은 GFP와 GFP와 유사한 단백질이 빛에 의해 활성화되면서 시작되었다고 의심한다.이 전자들은 그 후 빛에너지를 필요로 하는 반응에 사용되었다.태양으로부터의 보호, 빛의 다른 파장으로의 변환, 또는 신호용과 같은 형광 단백질의 기능은 2차적으로 진화한 것으로 생각된다.[33]
적응함수
현재 형광과 형광 단백질의 기능적 중요성에 대해서는 비교적 거의 알려져 있지 않다.[33]그러나 형광은 신호와 통신, 짝짓기, 유인, 위장, 자외선 차단 및 항산화, 광촉매, 디노플라겔레이트 조절, 산호 건강에 중요한 기능을 제공할 수 있을 것으로 의심된다.[34]
아쿠아틱
물은 긴 파장의 빛을 흡수하기 때문에 이러한 파장에서 나오는 빛이 눈에 도달하기 위해 반사된다.따라서 시각광 스펙트럼에서 나오는 따뜻한 색은 깊이가 점점 깊어질 때 덜 생동감이 없어 보인다.물은 보라색보다 짧은 파장의 빛을 흩뿌리는데, 이는 더 차가운 색상이 광자의 영역에서 시야를 지배한다는 것을 의미한다.광도는 75m 깊이마다 10배씩 감소하므로 75m 깊이에서는 빛이 표면의 10%만큼 강렬하고 150m에서 표면의 1%에 불과하다.물은 어떤 깊이에 도달하는 물의 파장과 강도를 걸러내기 때문에, 그들이 흡수할 수 있는 빛의 파장과 강도로 인해 다른 단백질은 다른 깊이에 더 적합하다.이론적으로, 어떤 물고기의 눈은 1000m의 깊이의 빛을 감지할 수 있다.이러한 진딧물 영역의 깊은 곳에서 빛의 유일한 근원은 생물 발광이라는 과정에서 화학적 반응을 통해 빛을 발산하는 유기체 그 자체다.
형광은 단순히 한 파장에서 전자기 방사선을 흡수하고 다른 낮은 에너지 파장에서 방출하는 것으로 정의된다.[32]따라서 어떤 유형의 형광도 외부 광원의 존재 여부에 따라 달라진다.생물학적으로 기능적인 형광은 형광을 유발할 수 있는 충분한 빛이 있을 뿐만 아니라 다른 유기체가 탐지할 수 있는 충분한 빛이 있는 광자 영역에서 발견된다.[35]광자대의 시야는 자연적으로 푸른색을 띠기 때문에 형광의 색은 밝은 빨강, 오렌지, 노랑, 녹색으로 감지될 수 있다.녹색은 해양 스펙트럼에서 가장 많이 발견되는 색이고, 노란색은 두 번째, 주황색은 세 번째, 빨간색은 가장 희귀한 색이다.형광은 같은 유기체의 생물 발광의 부산물로서 진딧물 영역의 유기체에서 발생할 수 있다.진딧물 영역에 있는 어떤 형광물질은 유기체의 조직 생화학의 부산물일 뿐 기능적 목적을 가지고 있지 않다.그러나 심해 진딧물 구역에서 형광의 기능적·적응적 유의성의 일부 사례는 연구 활동 영역이다.[36]
포토존
물고기
얕은 물에서 사는 뼈다귀 물고기는 화려한 환경에서 생활하기 때문에 대체로 색시력이 좋다.그러므로 얕은 물에서 빨강, 주황, 녹색 형광은 특히 현상의 큰 표현적 분산을 고려할 때, 공통점과의 의사소통 수단 역할을 할 가능성이 가장 높다.[32]
상어, 도마뱀 물고기, 전갈 물고기, 짜개, 광어 등 형광을 보이는 많은 물고기들도 노란 안경 필터를 가지고 있다.[37]특정 물고기의 렌즈와 각막에 있는 노란색 안경 필터는 롱패스 필터로 기능한다.이러한 필터는 형광을 시각화하고 잠재적으로 이용할 수 있는 종을 가능하게 하여 시각적 대비와 이러한 시각적 전문화가 부족한 다른 물고기와 포식자에게 보이지 않는 패턴을 강화한다.[32]형광을 시각화하는 데 필요한 노란색 안경 필터를 보유한 물고기는 잠재적으로 그 구성원의 빛 신호를 이용할 수 있다.형광 패터닝은 복잡한 위장 기능을 가진 암호화된 무늬가 있는 어류에서 특히 두드러졌다.이러한 선들 중 많은 선들은 또한 그러한 패턴을 시각화할 수 있는 노란색의 긴 패스 안경 필터를 가지고 있다.[37]
형광의 또 다른 적응적 사용은 시력을 돕기 위해 광자의 주변 푸른 빛으로부터 주황색과 붉은 빛을 생성하는 것이다.붉은 빛은 물에 의한 적색 빛의 파장 감쇠로 인해 단거리에서만 볼 수 있다.[38]형광체가 있는 많은 어종들은 작고, 집단생활을 하거나, 구부러진/아포틱하며, 눈에 띄는 무늬를 가지고 있다.이 패터닝은 형광 조직에 의해 발생하며 종의 다른 구성원이 볼 수 있지만 다른 시각 스펙트럼에서는 패터닝이 보이지 않는다.이러한 특정 내 형광 패턴은 종내 신호와도 일치한다.개인의 시선의 방향성을 나타내기 위해 안광 링에 존재하는 패턴과 개인의 움직임의 방향성을 나타내기 위해 지느러미를 따라 존재하는 패턴이 있다.[38]현재 연구에서는 이 붉은 형광이 같은 종의 구성원들 사이의 사적인 의사소통에 이용되는 것으로 의심하고 있다.[29][32][38]바다 속 깊이에서 푸른 빛의 두드러기 때문에, 더 긴 파장의 붉은 빛과 빛이 뒤섞이고, 많은 포식성 암초 물고기는 이러한 파장의 빛에 대한 민감도가 거의 또는 전혀 없다.긴 파장에 대한 시각적 감수성이 발달한 요정 와세와 같은 물고기는 푸른 환경에 높은 대비를 주고 짧은 범위에서는 동의어에 눈에 띄는 적색 형광 신호를 표시할 수 있지만, 긴 파장으로 민감성을 줄인 다른 일반 물고기에는 상대적으로 보이지 않는다.그러므로 형광은 암초 어류에서 적응 신호와 종내 통신으로 사용될 수 있다.[38][39]
또한, 유기체의 눈을 둘러싸고 있는 형광 조직을 이용하여 진딧물 영역의 광자 영역이나 녹색 생물 발광에서 푸른 빛을 붉은 빛으로 변환시켜 시력을 보조하는 것이 제안된다.[38]
상어
새로운 불소포자가 상어의 두 종에서 설명되었는데, 이 상어는 원치 않는 브롬화 트립토판-키누레9개의 작은 분자 대사물 그룹 때문이었다.[40]
산호
형광은 산호에서 매우 다양한 기능을 제공한다.산호 속의 형광 단백질은 그렇지 않으면 사용할 수 없는 빛의 파장을 산호의 공생 해조류가 광합성을 할 수 있는 파장으로 바꾸어 광합성에 기여할 수 있다.[41]또한, 단백질은 광석출산의 수단으로 더 많은 혹은 더 적은 빛을 이용할 수 있게 되면서 수적으로 변동할 수 있다.[42]마찬가지로, 이 형광 단백질은 광합성에 의해 생성된 산소를 제거하는 항산화 능력을 가질 수 있다.[43]마지막으로, 형광성 단백질은 광합성을 조절함으로써 산호의 광합성 해조 공생의 활동을 조절하는 수단으로도 작용할 수 있다.[44]
두팔로포드
거의 투명해진 오징어의 두 종류인 알로투티스 수불라타와 롤리고 베로니스는 눈 위에 형광 반점이 있다.이 지점들은 위장 수단으로 사용될 수 있는 입사광선을 반영하지만, 학교 교육을 위해 다른 오징어들에게 신호를 보내기 위한 것일 수도 있다.[45]
해파리
바다에서의 형광의 또 다른 잘 연구된 예는 수력조 아에코레아 빅토리아 이다.이 해파리는 북미 서해안의 광자대에 서식하며 시모무라 오사무에 의해 녹색 형광 단백질(GFP)의 운반체로 확인되었다.이러한 녹색 형광 단백질의 유전자는 분리되어 있으며 다른 유전자의 발현을 나타내기 위해 유전학 연구에 널리 사용되고 있기 때문에 과학적으로 유의미하다.[46]
사마귀 새우
리시오스킬리나 글래브리오큘라 등 기공포자 갑각류인 사마귀 새우의 여러 종에는 더듬이 비늘과 포식자 및 다른 수컷에게 위협이 되는 동안 수컷이 나타나는 캐러피스(껍질)를 따라 노란 형광 표시를 하고 있다.표시장치에는 머리와 흉부를 올리고, 눈에 띄는 맹장 및 기타 맥실리피드를 펼치며, 눈에 띄는 타원형의 더듬이 비늘을 측면으로 확장해 동물이 더 커 보이고 노란 형광 표시를 강조한다.게다가 깊이가 증가함에 따라, 맨티스 새우 형광은 가시광선의 더 큰 부분을 차지한다.짝짓기 의식 동안, 사마귀 새우는 적극적으로 형광을 발하며, 이 형광의 파장은 그들의 눈 색소에 의해 감지된 파장과 일치한다.[47]
발광대, 투광대
시포노포스
시포노포래(Siphonophorae)는 특화된 메두소이드와 폴리프 동물원숭이로 구성된 망막 하이드로조아(Hydrozoa)의 해양동물 주문이다.1600m에서 2300m 사이의 진딧물 영역에 사는 에렌나속 등 일부 사이포노포어는 촉수성 텐티야의 광포체에서 황색에서 적색 형광까지 보인다.이 형광은 같은 광자로부터 발생하는 생물 발광의 부산물로 발생한다.사이포노포어는 먹이를 유인하는 미끼로 사용되는 깜박이는 패턴으로 형광을 나타낸다.[48]
드래곤피쉬
포식적인 심해 용어 말라코스테우스 니제르, 밀접하게 연관된 아리스토스토미아스속, 파키스토미아스 마이크로돈 종은 형광 붉은 액세서리 색소를 사용하여 자신의 생물 발광에서 방출되는 푸른 빛을 아황산 광자로부터 붉은 빛으로 변환한다.이 붉은 발광은 다른 동물들에게는 보이지 않는데, 이것은 이 용어가 포식자를 유인하거나 신호를 보내지 않고도 어두운 바다 깊이에서 빛을 더 낼 수 있게 해준다.[49]
지상파
양서류

형광은 양서류 사이에 널리 퍼져 있으며 개구리, 도롱뇽, 카실리아인의 여러 계열에 기록되어 있으나 그 범위는 크게 다르다.[50]
남미에서 널리 발견되는 물방울꽃개구리(히프시보아스 펑퍼투스)가 2017년 첫 형광 양서류로 본의 아니게 발견됐다.형광은 림프와 피부샘에서 발견된 새로운 화합물로 추적되었다.[51]주 형광 화합물은 Hyloin-L1이며, 보라색이나 자외선에 노출되면 청록색 빛을 낸다.이 발견의 배후에 있는 과학자들은 이 형광이 의사소통에 사용될 수 있다고 제안했다.그들은 형광이 개구리들 사이에 비교적 널리 퍼졌을 가능성이 있다고 추측했다.[52]불과 몇 달 후, 형광은 밀접하게 연관된 하이프시보아스 아틀란틱투스에게서 발견되었다.피부샘에서 분비되는 분비물과 연결되기 때문에, 그것들은 또한 그들이 있던 표면에 형광 표시를 남길 수 있다.[53]
2019년 브라질 남동부의 작은 호박 두꺼비(Brachypeceumus epipium)와 붉은 호박 두꺼비(B. pitanga) 등 다른 개구리 2마리가 자외선에 노출되면 피부를 통해 볼 수 있는 자연적으로 형광뼈가 있는 것으로 나타났다.[54][55]처음에는 이것은 형광들이 이미 방어 효과가 있는 색깔(그들은 독성이 있)을 보충했다 그것은 toadlets에 포식 시도unaffec 있는 것처럼 보이지만 나중에(종들 인정이나 잠재적인 파트너의 건강을 결정하는)[54]연구는 전 설명 같지는 않다, 선택하기 위해 연관된 것으로 예상되던.테드형광[형광]이 있는[형광] 상태로][56]
2020년 청색이나 자외선에 노출된 성인 개구리뿐만 아니라 올챙이, 도롱뇽, 까칠리아인에서도 녹색이나 황색 형광이 만연해 있는 것으로 확인됐다.그 범위는 종에 따라 크게 달라진다; 어떤 종에서는 매우 뚜렷하고 다른 종에서는 거의 눈에 띄지 않는다.그것은 피부 색소 침착, 점액질 또는 뼈에 근거할 수 있다.[50]
나비
제비꼬리(파필리오) 나비들은 형광 빛을 발산하는 복잡한 시스템을 가지고 있다.그들의 날개에는 방향 형광 빛을 제공하는 색소침투 크리스털이 포함되어 있다.이 결정들은 하늘색 빛(파장 약 420nm)으로부터 광채를 흡수할 때 형광 빛을 가장 잘 내는 기능을 한다.나비들이 가장 잘 보는 빛의 파장은 나비의 날개에 있는 결정체의 흡수에 해당한다.이것은 신호 용량을 향상시키는 기능을 한다.[57]
앵무새
앵무새들은 짝짓기 신호에 사용될 수 있는 형광색 깃털을 가지고 있다.버제리가르(멜롭시타쿠스 분쇄기)에 대한 짝선택 실험을 이용한 연구에서는 형광성 신호에 대한 설득력 있는 지지를 발견했는데, 수컷과 암컷 모두 형광성 실험 자극이 있는 새를 상당히 선호하는 것으로 나타났다.이 연구는 앵무새의 형광 깃털이 단순히 색소침착의 부산물이 아니라 적응된 성적 신호라는 것을 시사한다.형광 색소를 생성하는 경로의 복잡성을 고려하면 상당한 비용이 수반될 수 있다.따라서, 강한 형광을 보이는 개인은 관련 비용을 처리할 수 있기 때문에 높은 개인 품질을 나타내는 정직한 지표일 수 있다.[58]
거미류
거미는 자외선에 의해 형광 투과되며 다양한 형광물질을 가지고 있다.놀랍게도, 거미는 형광이 "유형적으로 널리 퍼지고, 가변적으로 표현되며, 진화적으로 취약하며, 아마도 선택 중에 있고, 특정 내 신호와 상호 특정 신호에 생태학적 중요성이 잠재적으로 있는" 유일한 그룹이다.앤드류스 외 연구진(2007) 형광은 거미 세제에 걸쳐 여러 번 진화해왔으며, 거미의 다양화 과정에서 새로운 형광체가 진화하고 있음을 밝힌다.어떤 거미에서는 자외선 단서가 포식자-선호작용, 특정 내 커뮤니케이션, 일치하는 형광 꽃으로 위장하는 데 중요하다.다른 생태학적 맥락은 형광표현이 거미의 암호화에 도움이 되는지 또는 포식자에게 더 잘 보이게 하는지에 따라 형광표현의 억제 또는 개선을 선호할 수 있다.따라서, 자연 선택은 거미 종에 걸친 형광의 표현에 영향을 미칠 수 있다.[59]
전갈은 또한 큐티클에 베타 카볼린이 존재하기 때문에 형광색이다.[60]
오리너구리속
2020년에 몇몇 견본 오리너구리에 대한 형광이 보고되었다.[61]
식물
많은 식물들은 아마도 가장 널리 분포된 형광 분자인 엽록소의 존재로 인해 형광물질이며, 다양한 흥분 파장 하에서 적색 배출을 생성한다.[62]엽록소의 이러한 속성은 생태학자들이 광합성 효율을 측정하기 위해 일반적으로 사용된다.[63]
미라빌리스 잘라파 꽃은 보라색, 형광색 베타시아닌과 노란색, 형광색 베타카난틴을 함유하고 있다.흰 빛 아래에서는 베타카신만 함유한 꽃의 일부가 노란색으로 나타나지만, 베타카닌과 베타시아닌이 모두 존재하는 지역에서는 내부 광선 여과 메커니즘으로 인해 꽃의 가시적 형광이 희미해진다.형광은 이전에 꽃가루 매개체의 역할을 하도록 제안되었지만, 나중에 형광에 의한 시각 신호는 꽃에 반사된 빛의 시각 신호에 비해 무시해도 된다는 것이 밝혀졌다.[64]
아바이오틱스
지질학, 광물학, 지질학

원석, 미네랄은 단파 자외선, 장파 자외선, 가시광선 또는 X-선 하에서 형광물질을 가지고 있거나 형광물질을 다르게 보일 수 있다.
많은 종류의 석회석과 호박은 단파 UV, 장파 UV, 가시광선 아래에서 형광한다.루비, 에메랄드, 다이아몬드는 장파 UV, 청색, 때로는 녹색 빛에서 붉은 형광을 보인다. 다이아몬드는 또한 X선 방사선에서도 빛을 방출한다.
광물의 형광물질은 광범위한 활성제에 의해 발생한다.어떤 경우에는 형광 방출이 가라앉지 않도록 액티베이터의 농도를 일정 수준 이하로 제한해야 한다.게다가, 광물에는 철이나 구리 같은 불순물이 없어야 형광성의 침하를 방지할 수 있다.최대 몇 퍼센트의 농도로 이루어진 이분망간은 석회질의 적색 또는 주황색 형광, 윌레마이트의 녹색 형광, 에스페라이트의 황색 형광, 울라스토나이트와 클리노헤드라이트의 주황색 형광의 원인이 된다.헥사발렌트 우라늄은 천왕성 계화(UO2+
2) 형태의 모든 농도에서 황색 녹색으로 형광하며, autunite 또는 Andersonite와 같은 광물의 형광의 원인이며, 저농도에서는 히알라이트 오팔의 일부 샘플과 같은 물질의 형광의 원인이 된다.낮은 농도의 3가 크롬은 루비의 적색 형광의 근원이다.이분 유황은 미네랄 플루오르사이트에서 볼 때 푸른 형광의 근원이다.테르비움, 디스프로시움 등 삼발란트 란타니드는 광물불소산염의 yttrofluorite 품종이 보여주는 크림색 황색 형광의 주요 활성제로 지르콘의 주황색 형광에 기여한다.파월라이트(칼슘 몰리브데이트)와 셸라이트(칼슘 텅스테이트)는 각각 본질적으로 노란색과 파란색으로 형광체를 만든다.고체 용액에 함께 존재할 때, 에너지는 고에너지 텅스텐에서 저에너지 몰리브덴으로 전달된다. 따라서 상당히 낮은 수준의 몰리브덴은 청색 대신 스키라이트용 황색 방출을 일으키기에 충분하다.다양한 미량 불순물의 존재에 영향을 받아 다양한 색상의 저철 스팔라이트(진크황화), 형광체 및 인광체.
원유(석유)는 중유와 타르의 경우 칙칙한 갈색에서 매우 가벼운 기름과 응축물의 경우 밝은 황색, 푸르스름한 흰색까지 다양한 색상으로 형광한다.이 현상은 드릴 컷팅과 코어 샘플에서 극소량의 오일을 식별하기 위해 석유 탐사 시추에 사용된다.
토양(휴머스)에서 유기물질의 분해에 의해 생성되는 허미산과 풀빅산도 복잡한 분자 구조에서 방향족 주기가 존재하기 때문에 형광을 발할 수 있다.[65]지하수에 용해된 유머 물질은 검출될 수 있으며 분광화상계리(spectrofluorimetry)가 특징이다.[66][67] [68]
유기액체
벤젠 또는 톨루엔에 용해된 무연탄 또는 스틸베인과 같은 유기 용액은 자외선 또는 감마선 조사와 함께 형광 투과된다.빛의 지속시간은 형광물질의 흥분상태의 수명에 따라 달라지기 때문에 이 형광체의 붕괴시간은 나노초 단위로 되어 있다.[69]
섬광은 입자(전자, 알파 입자, 이온 또는 고에너지 광자)의 통로에 의해 투명한 물질에서 생성되는 빛의 섬광을 정의한다.스틸베인과 파생상품은 그러한 입자를 검출하기 위해 섬광 계수기에 사용된다.스틸베인은 또한 염료 레이저에 사용되는 이득 매개체 중 하나이다.
대기
형광은 대기가 강력한 전자 폭격을 받을 때 대기에서 관찰된다.자연 오로라, 고고도 핵폭발, 로켓에 의한 전자총 실험과 같은 경우, 형성된 분자와 이온은 빛에 대한 형광 반응을 가진다.[70]
형광 물질을 나타내는 일반적인 물질
- 비타민 B2는 노란색을 발한다.
- 토닉 워터는 키니네의 존재로 인해 파란색을 띤다.
- 형광펜 잉크는 피라닌의 존재로 인해 형광색인 경우가 많다.
- 지폐, 우표, 신용카드에는 형광 보안 기능이 있는 경우가 많다.
새로운 기술에서.
2020년 8월 연구진은 음이온 결합 시안오스타 매크로사이클에 계향 염료를 혼합해 염료의 공간적·전자적 격리를 통한 고형광 염료 특성 전이를 가능하게 함으로써 지금까지 가장 밝은 형광 고체 광학 소재를 만들었다고 보고했다.공동저자에 따르면 이러한 물질은 태양에너지 수확, 생체이미징, 레이저와 같은 분야에 응용될 수 있다.[71][72][73][74]
적용들
조명

일반적인 형광등은 형광에 의존한다.유리관 안에는 부분 진공상태와 소량의 수은이 있다.관내의 전기는 수은 원자가 대부분 자외선을 방출하게 한다.튜브에는 인광이라고 불리는 형광 물질 코팅이 줄지어 있어 자외선을 흡수하고 가시광선을 재방출한다.형광등은 백열등 조명 요소보다 에너지 효율이 높다.그러나 전통적인 형광등의 불균일한 스펙트럼은 백열등이나 일광에 의해 조명될 때와는 다른 특정 색상을 보이게 할 수 있다.수은 증기 방출 스펙트럼은 254nm(인광에 대부분의 에너지를 공급하는)의 단파 UV 라인에 의해 지배되며, 436nm(파란색), 546nm(녹색), 579nm(황색-주황색)의 가시광 방출이 수반된다.이 세 선은 일반적인 흰색 형광등에서 방출되는 빛에 대해 손 분광기를 사용하여 흰색 연속체에 중첩된 것을 관찰할 수 있다.이와 동일한 가시 선은 3가 유로피움과 3가 테르비움의 방출 라인을 동반하고, 나아가 푸른 영역에서 2가 유로피움의 방출 연속체를 동반하며, 많은 소형 형광등과 전통적인 램프에서 사용되는 현대 삼색 인광 시스템의 더 불연속적인 광 방출로 구성된다.더 나은 색채 연출이 목표다.[75]
형광등은 1939년 뉴욕 세계 박람회에서 처음으로 일반인들이 이용할 수 있었다.그 이후 개선된 점은 인광, 수명 연장, 보다 일관된 내부 방전, 사용하기 쉬운 형상(예: 콤팩트 형광등)이 대부분이었다.일부 고강도 방전(HID) 램프는 고른 전기 효율과 인광 강화 기능을 결합하여 색상을 개선한다.[citation needed]
백색 발광다이오드(LED)는 1990년대 중반 반도체에서 방출된 청색 빛이 작은 칩에 쌓인 인광을 때리는 LED 램프로 이용 가능해졌다.인광을 통해 지속되는 푸른 빛과 인광에서 나오는 녹색에서 적색까지의 형광의 조합은 백색 빛의 순배출을 생성한다.[76]
야광 스틱은 형광 물질을 이용해 화학적 반응에서 나오는 빛을 흡수하고 다른 색의 빛을 발산하기도 한다.[75]
분석화학
많은 분석 절차에는 대개 하나의 흥미로운 파장과 단일 검출 파장을 갖는 형광 투시계의 사용이 포함된다.그 방법이 주는 민감성 때문에, 1조 당 1ppm의 낮은 형광 분자 농도를 측정할 수 있다.[77]
여러 파장의 형광은 HPLC 흐름에서 화합물을 검출하기 위해 배열 검출기에 의해 검출될 수 있다.또한 TLC 판은 화합물이나 색소 시약이 형광이면 시각화할 수 있다.형광은 볼츠만 분포에서 낮은 에너지 수준에서 원자의 비율이 클 때 가장 효과적이다.그러면 저에너지 원자에 의한 광자의 흥분과 방출 가능성이 높아져 분석이 더욱 효율적이다.
분광학
일반적으로 형광 분석의 설정은 광원을 포함하며, 광원은 많은 다른 파장의 빛을 방출할 수 있다.일반적으로 적절한 분석을 위해서는 단일 파장이 필요하므로 빛을 선택적으로 필터링하기 위해서는 흥분 단색기를 거쳐 그 선택된 파장을 샘플 셀을 통해 전달한다.에너지의 흡수 및 재배출 후에는 스톡스 시프트와 다양한 전자 전환으로 인해 많은 파장이 나타날 수 있다.그것들을 분리하고 분석하기 위해 형광 방사선은 방출 단색화기를 통과하고, 검출기에 의해 선택적으로 관측된다.[78]
생화학 및 의학

생명과학의 형광은 상대적으로 적은 세포성분이 자연적으로 형광(내성적 또는 자가유동성이라고 함)이기 때문에 일반적으로 흥분등에서 배경이 없는 특정 주파수에서 형광 방출에 의한 생물학적 분자의 추적이나 분석의 비파괴적 방법으로 사용된다.실제로 단백질이나 다른 성분은 작은 분자, 단백질 또는 양자점이 될 수 있는 형광 염료인 외부 불소포레로 "라벨링"할 수 있으며, 많은 생물학적 응용에서 큰 용도를 찾을 수 있다.[79]
염료의 정량화는 분광화계(spectrofluorometer)를 사용하여 수행되며 다음에서 추가 용도를 찾는다.
현미경 검사
- 평면 전체에서 형광 강도를 스캔할 때 조직, 세포 또는 세포 하부 구조의 형광 현미경을 가지고 있는데, 이는 항체에 형광물질을 부착하고 항체가 표본 내에서 표적 항원을 찾을 수 있게 함으로써 이루어진다.서로 다른 불소 형상을 가진 다중 항체에 라벨을 부착하면 단일 영상(복수 채널) 내에서 복수의 표적을 시각화할 수 있다.DNA 마이크로레이는 이것의 변형이다.
- 면역학:항체는 먼저 형광 화학 그룹을 부착하여 조제하며, 항체가 결합한 부위(예: 현미경 검체)는 형광에 의해 볼 수 있고, 심지어 정량화할 수 있다.
- FLIM(Fluorscence Lifetime Imaging Microscopy)은 형광 수명에 영향을 줌으로써 스스로 발현되는 특정 생체 분자 상호작용을 검출하는 데 사용될 수 있다.
- 세포 및 분자생물학: ImageJ와 같은 전문 소프트웨어를 사용하여 관심 항원을 선택적으로 검출하기 위한 형광표시 항체를 이용한 콜로컬레이션 검출.
기타 기법
- FRET(Förster community energy transfer, 형광 공명 에너지 전달이라고도 함)는 단백질 상호작용을 연구하고, 특정 핵산 시퀀스를 검출하여 바이오센서로 사용하는 반면, 형광 수명(FLIM)은 추가적인 정보 층을 제공할 수 있다.
- 생명공학: 형광등을 이용한 바이오센서가 가능한 형광 포도당 바이오센서로 연구되고 있다.
- 체인 종료 방법에 의한 DNA의 자동화된 염기서열; 각기 다른 네 개의 체인 종료 베이스 각각은 고유의 형광 태그를 가지고 있다.라벨이 붙은 DNA 분자가 분리되면서 형광 라벨은 UV 선원에 의해 흥분되고 분자를 종단하는 베이스의 정체는 방출된 빛의 파장에 의해 식별된다.
- FASS(불색 활성 셀 정렬).서로 다른 세포선(특히 동물 조직에서 격리된 세포선)의 분리에 사용되는 몇 가지 중요한 세포 분류 기술 중 하나이다.
- DNA 검출: 수용액에 포함된 복합 에티듐 브롬화물은 물에 의해 가라앉기 때문에 형광이 거의 없다.에티듐브로마이드의 형광은 DNA에 결합한 후 크게 강화되기 때문에 이 화합물은 아가로오스겔 전기영동체에서 DNA 조각의 위치를 시각화하는 데 매우 유용하다.간염된 에티듐은 DNA의 염기쌍 사이에 있을 때 소수성 환경에 있으며, 물에 의해 침식되지 않도록 보호되며, 이는 간염된 에티듐의 지역 환경에서 제외된다.브롬화 에티듐은 발암성이 있을 수 있다 – 거의 틀림없이 안전한 대안은 염료 SYBR 그린이다.
- FIGS(Fluorscence image-유도 수술)는 형광을 이용해 수술 중 적절한 라벨이 부착된 구조물을 검출하는 의료 영상 기술이다.
- 혈관 내 형광은 카테터 기반의 의료 영상 기법으로 형광을 이용해 아테롬성 동맥경화증과 비치료 혈관 스텐트 장치의 고위험 특징을 검출한다.[80]플라크 자가투과량은 관상동맥에서 광학 일관 단층 촬영과 결합하여 1인 연구로 사용되어 왔다.[81]분자 작용제는 또한 동맥 염증과 관련된 스텐트 피브린 축적과 효소 활성과 같은 특정한 특징들을 감지하는데 사용되었다.[82]
- SAFI(종종 변형 형광 영상)는 전자키네틱스 및 마이크로유체학에서 이미징 기법이다.[83]관심 있는 화학 종을 이동시켜 형광을 쉽게 가라앉히는 비전기화 염료를 사용한다.염료는 일반적으로 흐름의 모든 곳에서 시딩되며, 분석 물질에 의한 형광의 미분적 침윤이 직접 관찰된다.
- 독성 화학 물질 선별을 위한 형광 기반 검사.광학 측정은 환경에 민감한 형광 염료와 형광 스펙트럼 패턴을 생성하는 인간 피부 세포의 혼합물로 구성된다.[84]이러한 접근방식은 생물의학 연구와 제약 산업에서 실험동물의 필요성을 줄일 수 있다.
- 골격-마진 탐지:알리자린으로 얼룩진 표본과 특정 화석은 형광등 불빛에 비춰 뼈의 여백을 포함한 해부학적 구조를 볼 수 있다.[85]
포렌식
지문은 리무딘이나 DFO(1,8-Diafluoren-9-1)와 같은 형광 화합물로 시각화할 수 있다.혈액과 다른 물질들은 형광 시약에 의해 때때로 검출된다.섬유, 그리고 포렌식이나 다양한 수집품과의 관계에서 마주칠 수 있는 다른 물질들은 때때로 형광색이다.
비파괴시험
형광 침투제 검사는 부품 표면의 균열 및 기타 결함을 발견하는 데 사용된다.형광 염료를 이용한 염료 추적은 액체와 가스 배관 시스템에서 누수를 찾는 데 사용된다.
사이니지
형광 색상은 간판, 특히 도로 표지판에 자주 사용된다.형광 색상은 일반적으로 비형광 색보다 긴 범위에서 알아볼 수 있으며, 형광 주황색은 특히 눈에 띈다.[86]이 특성은 안전표지와 라벨에 빈번히 사용되게 되었다.
광학 광선화기
형광 화합물은 직물과 종이의 외관을 좋게 하기 위해 자주 사용되어 '화염' 효과를 일으킨다.광학 광학 광학기로 처리한 흰색 표면은 빛을 비추는 것보다 더 가시적인 빛을 발산할 수 있어 더 밝게 보인다.광택제가 방출하는 푸른 빛은 처리된 물질의 감소하는 푸른색을 보상하고 노란색이나 갈색에서 멀리 떨어진 색조를 흰색으로 바꾼다.광학용 경광등은 세탁 세제, 고광도 종이, 화장품, 고광도 의류 등에 사용된다.
참고 항목
- 흡수-배출 원자선 필터는 형광 현상을 사용하여 빛을 매우 효과적으로 여과한다.
- 블랙 라이트
- 블랙라이트 페인트
- 섬유광도측정학
- 형광 활성 및 흡수 전환 태그
- 형광 상관 분광법
- 형광 이미지 유도 수술
- 식물의 형광
- 형광 분광학
- 형광등
- 형광 멀티레이어 디스크
- 불소계
- 가시성이 높은 의류
- 통합형 불소계
- 레이저로 인한 형광
- 광원 목록
- 형광세균을 이용한 미생물 예술
- 뫼스바우어 효과, 감마선의 공명 형광
- 유기발광다이오드는 형광일 수 있다.
- 인광체
- 인광 열측정법, 온도 측정에 인광의 사용.
- 분광학
- 투포톤 흡수
- 바이브론 분광학
- 엑스선 형광
참조
- ^ a b Acuña, A. Ulises; Amat-Guerri, Francisco; Morcillo, Purificación; Liras, Marta; Rodríguez, Benjamín (2009). "Structure and Formation of the Fluorescent Compound of Lignum nephriticum" (PDF). Organic Letters. 11 (14): 3020–3023. doi:10.1021/ol901022g. PMID 19586062. Archived (PDF) from the original on 28 July 2013.
- ^ Safford, William Edwin (1916). "Lignum nephriticum" (PDF). Annual report of the Board of Regents of the Smithsonian Institution. Washington: Government Printing Office. pp. 271–298.
- ^ Valeur, B.; Berberan-Santos, M. R. N. (2011). "A Brief History of Fluorescence and Phosphorescence before the Emergence of Quantum Theory". Journal of Chemical Education. 88 (6): 731–738. Bibcode:2011JChEd..88..731V. doi:10.1021/ed100182h. S2CID 55366778.
- ^ Muyskens, M.; Ed Vitz (2006). "The Fluorescence of Lignum nephriticum: A Flash Back to the Past and a Simple Demonstration of Natural Substance Fluorescence". Journal of Chemical Education. 83 (5): 765. Bibcode:2006JChEd..83..765M. doi:10.1021/ed083p765.
- ^ Clarke, Edward Daniel (1819). "Account of a newly discovered variety of green fluor spar, of very uncommon beauty, and with remarkable properties of colour and phosphorescence". The Annals of Philosophy. 14: 34–36. Archived from the original on 17 January 2017.
The finer crystals are perfectly transparent. Their colour by transmitted light is an intense emerald green; but by reflected light, the colour is a deep sapphire blue
- ^ Hauy는 단지 Clarke가 검사한 불소 시료의 색상에 관한 Clarke의 관찰을 반복할 뿐이다.하우이, 디테레 드 미네랄로기, 2부작 (프랑스 파리:바첼리어와 후자드, 1822), 제1권, 페이지 512 웨이백머신 (Wayback Machine)플루오르산염은 Hauy에 의해 "chaux fluatée"라고 불리는데, "... 바이올렛트 파 레프렉션, et burder par slideflection, et burder derbyshire." ([fluorite의 색은] 반사에 의한 보라색, 그리고 [Derbyshire로부터의]에서 전송에 의한 녹색이다.)
- ^ Brewster, David (1834). "On the colours of natural bodies". Transactions of the Royal Society of Edinburgh. 12 (2): 538–545. doi:10.1017/s0080456800031203. Archived from the original on 17 January 2017. 542페이지에서 브루스터는 흰 빛이 엽록소의 알코올 용액을 통과할 때, 그것으로부터 붉은 빛이 반사된다고 언급한다.
- ^ Herschel, John (1845). "On a case of superficial colour presented by a homogeneous liquid internally colourless". Philosophical Transactions of the Royal Society of London. 135: 143–145. doi:10.1098/rstl.1845.0004. Archived from the original on 24 December 2016.
- ^ Herschel, John (1845). "On the epipŏlic dispersion of light, being a supplement to a paper entitled, "On a case of superficial colour presented by a homogeneous liquid internally colourless"". Philosophical Transactions of the Royal Society of London. 135: 147–153. doi:10.1098/rstl.1845.0005. Archived from the original on 17 January 2017.
- ^ 스토크스, G.G.(1852년)."Refrangibility의 빛의 변화에".왕립 협회 런던의 철학적 거래. 142:463–562. doi:10.1098/rstl.1852.0022.그 1월 17일 2017년에 원래에서 Archived.페이지 479에서 각주:"나는 거의, 가장 유사한 용어 유백광 광물질의 이름에서 파생된 것 fluor-spar에서 외모 형광 택시를 부르는 말을 만들어 내다. 경향이 있다.".
- ^ 스톡스(1852년), 페이지 472~473.스톡스는 473페이지의 각주를 통해 1843년에 키니네산 황산염은 자외선을 강하게 흡수한다는 것을 에드몽 베크렐이 관찰했다는 것을 인정한다(즉, 태양 스펙트럼에서 프라운호퍼의 H밴드 너머의 태양 복사).See: Edmond Becquerel (1843) "Des effets produits sur les corps par les rayons solaires" Archived 31 March 2013 at the Wayback Machine (On the effects produced on substances by solar rays), Comptes rendus, 17 : 882–884; on page 883, Becquerel cites quinine acid sulfate ("sulfate acide de quinine") as strongly absorbing ultraviolet light.
- ^ a b c d 발레리, 버나드, 베르베란산토스, 마리오(2012년).분자 형광: 원리와 응용.와일리-VCHISBN 978-3-527-32837-6. 페이지 64
- ^ 라코비치, 페이지 10
- ^ Levitus, Marcia (22 April 2020). "Tutorial: measurement of fluorescence spectra and determination of relative fluorescence quantum yields of transparent samples". Methods and Applications in Fluorescence. 8 (3): 033001. Bibcode:2020MApFl...8c3001L. doi:10.1088/2050-6120/ab7e10. ISSN 2050-6120. PMID 32150732. S2CID 212653274.
- ^ Brouwer, Albert M. (31 August 2011). "Standards for photoluminescence quantum yield measurements in solution (IUPAC Technical Report)". Pure and Applied Chemistry. 83 (12): 2213–2228. doi:10.1351/PAC-REP-10-09-31. ISSN 1365-3075. S2CID 98138291.
- ^ Nawara, Krzysztof; Waluk, Jacek (16 April 2019). "Goodbye to Quinine in Sulfuric Acid Solutions as a Fluorescence Quantum Yield Standard". Analytical Chemistry. 91 (8): 5389–5394. doi:10.1021/acs.analchem.9b00583. ISSN 0003-2700. PMID 30907575. S2CID 85501014.
- ^ 2013년 6월 9일 웨이백머신에 보관된 "형광 원리와 자외선-가시성 흡광도 원리를 위한 애니메이션"PharmaXChange.info.
- ^ 라코비치, 페이지 12-13
- ^ Schieber, Frank (October 2001). "Modeling the Appearance of Fluorescent Colors". Proceedings of the Human Factors and Ergonomics Society Annual Meeting. 45 (18): 1324–1327. doi:10.1177/154193120104501802. S2CID 2439728.
- ^ IUPAC. 카샤-바빌로프 규칙 – 화학 용어의 개요, 2차 개정. ("골드 북") 웨이백 머신에 2012년 3월 21일 보관.1997년, 맥노트와 A. 블랙웰 사이언티픽 출판사, 옥스포드, 윌킨슨이 편집한 책이다.
- ^ Hai, Q (2017). "Suppression of Kasha's rule as a mechanism for fluorescent molecular rotors and aggregation-induced emission". Nature Chemistry. 9 (1).
- ^ 라코비치, 페이지 6-8
- ^ 라코비치, 페이지 6-7
- ^ a b c "Fluorescence in marine organisms". Gestalt Switch Expeditions. Archived from the original on 21 February 2015.
- ^ "Fluorescence discovered in tiny Brazilian frogs". Business Standard India. Press Trust of India. 29 March 2019. Retrieved 30 March 2019.
- ^ Utsav (2 December 2017). "Top 10 Amazing Bioluminescent Animals on Planet Earth". Earth and World. Retrieved 30 March 2019.
- ^ Ward, William W.; Cormier, Milton J. (1978). "Energy Transfer Via Protein-Protein Interaction in Renilla Bioluminescence". Photochemistry and Photobiology. 27 (4): 389–396. doi:10.1111/j.1751-1097.1978.tb07621.x. S2CID 84887904.
- ^ "Firefly Squid - Deep Sea Creatures on Sea and Sky". www.seasky.org. Retrieved 30 March 2019.
- ^ a b c d Wucherer, M. F.; Michiels, N. K. (2012). "A Fluorescent Chromatophore Changes the Level of Fluorescence in a Reef Fish". PLOS ONE. 7 (6): e37913. Bibcode:2012PLoSO...737913W. doi:10.1371/journal.pone.0037913. PMC 3368913. PMID 22701587.
- ^ Fujii, R (2000). "The regulation of motile activity in fish chromatophores". Pigment Cell Research. 13 (5): 300–19. doi:10.1034/j.1600-0749.2000.130502.x. PMID 11041206.
- ^ Abbott, F. S. (1973). "Endocrine Regulation of Pigmentation in Fish". Integrative and Comparative Biology. 13 (3): 885–894. doi:10.1093/icb/13.3.885.
- ^ a b c d e Sparks, J. S.; Schelly, R. C.; Smith, W. L.; Davis, M. P.; Tchernov, D.; Pieribone, V. A.; Gruber, D. F. (2014). Fontaneto, Diego (ed.). "The Covert World of Fish Biofluorescence: A Phylogenetically Widespread and Phenotypically Variable Phenomenon". PLOS ONE. 9 (1): e83259. Bibcode:2014PLoSO...983259S. doi:10.1371/journal.pone.0083259. PMC 3885428. PMID 24421880.
- ^ a b Beyer, Steffen. "Biology of underwater fluorescence". Fluopedia.org.
- ^ Haddock, S. H. D.; Dunn, C. W. (2015). "Fluorescent proteins function as a prey attractant: experimental evidence from the hydromedusa Olindias formosus and other marine organisms". Biology Open. 4 (9): 1094–1104. doi:10.1242/bio.012138. ISSN 2046-6390. PMC 4582119. PMID 26231627.
- ^ Mazel, Charles (2017). "Method for Determining the Contribution of Fluorescence to an Optical Signature, with Implications for Postulating a Visual Function". Frontiers in Marine Science. 4. doi:10.3389/fmars.2017.00266. ISSN 2296-7745.
- ^ Matz, M. "Fluorescence: The Secret Color of the Deep". Office of Ocean Exploration and Research, U.S. National Oceanic and Atmospheric Administration. Archived from the original on 31 October 2014.
- ^ a b Heinermann, P (10 March 2014). "Yellow intraocular filters in fishes". Experimental Biology. 43 (2): 127–147. PMID 6398222.
- ^ a b c d e Michiels, N. K.; Anthes, N.; Hart, N. S.; Herler, J. R.; Meixner, A. J.; Schleifenbaum, F.; Schulte, G.; Siebeck, U. E.; Sprenger, D.; Wucherer, M. F. (2008). "Red fluorescence in reef fish: A novel signalling mechanism?". BMC Ecology. 8: 16. doi:10.1186/1472-6785-8-16. PMC 2567963. PMID 18796150.
- ^ Gerlach, T; Sprenger, D; Michiels, N. K. (2014). "Fairy wrasses perceive and respond to their deep red fluorescent coloration". Proceedings of the Royal Society B: Biological Sciences. 281 (1787): 20140787. doi:10.1098/rspb.2014.0787. PMC 4071555. PMID 24870049.
- ^ Park, Hyun Bong; Lam, Yick Chong; Gaffney, Jean P.; Weaver, James C.; Krivoshik, Sara Rose; Hamchand, Randy; Pieribone, Vincent; Gruber, David F.; Crawford, Jason M. (27 September 2019). "Bright Green Biofluorescence in Sharks Derives from Bromo-Kynurenine Metabolism". iScience. 19: 1291–1336. Bibcode:2019iSci...19.1291P. doi:10.1016/j.isci.2019.07.019. ISSN 2589-0042. PMC 6831821. PMID 31402257.
- ^ Salih, A.; Larkum, A.; Cox, G.; Kühl, M.; Hoegh-Guldberg, O. (2000). "Fluorescent pigments in corals are photoprotective". Nature. 408 (6814): 850–3. Bibcode:2000Natur.408..850S. doi:10.1038/35048564. PMID 11130722. S2CID 4300578. Archived from the original on 22 December 2015.
- ^ Roth, M. S.; Latz, M. I.; Goericke, R.; Deheyn, D. D. (2010). "Green fluorescent protein regulation in the coral Acropora yongei during photoacclimation". Journal of Experimental Biology. 213 (21): 3644–3655. doi:10.1242/jeb.040881. PMID 20952612.
- ^ Bou-Abdallah, F.; Chasteen, N. D.; Lesser, M. P. (2006). "Quenching of superoxide radicals by green fluorescent protein". Biochimica et Biophysica Acta (BBA) - General Subjects. 1760 (11): 1690–1695. doi:10.1016/j.bbagen.2006.08.014. PMC 1764454. PMID 17023114.
- ^ Field, S. F.; Bulina, M. Y.; Kelmanson, I. V.; Bielawski, J. P.; Matz, M. V. (2006). "Adaptive Evolution of Multicolored Fluorescent Proteins in Reef-Building Corals". Journal of Molecular Evolution. 62 (3): 332–339. Bibcode:2006JMolE..62..332F. doi:10.1007/s00239-005-0129-9. PMID 16474984. S2CID 12081922.
- ^ Mäthger, L. M.; Denton, E. J. (2001). "Reflective properties of iridophores and fluorescent 'eyespots' in the loliginid squid Alloteuthis subulata and Loligo vulgaris". The Journal of Experimental Biology. 204 (Pt 12): 2103–18. doi:10.1242/jeb.204.12.2103. PMID 11441052. Archived from the original on 4 March 2016.
- ^ Tsien, R. Y. (1998). "The Green Fluorescent Protein". Annual Review of Biochemistry. 67: 509–544. doi:10.1146/annurev.biochem.67.1.509. PMID 9759496. S2CID 8138960.
- ^ Mazel, C. H. (2004). "Fluorescent Enhancement of Signaling in a Mantis Shrimp". Science. 303 (5654): 51. doi:10.1126/science.1089803. PMID 14615546. S2CID 35009047.
- ^ Bou-Abdallah, F.; Chasteen, N. D.; Lesser, M. P. (2006). "Quenching of superoxide radicals by green fluorescent protein". Biochimica et Biophysica Acta (BBA) - General Subjects. 1760 (11): 1690–1695. doi:10.1016/j.bbagen.2006.08.014. PMC 1764454. PMID 17023114.
- ^ Douglas, R. H.; Partridge, J. C.; Dulai, K.; Hunt, D.; Mullineaux, C. W.; Tauber, A. Y.; Hynninen, P. H. (1998). "Dragon fish see using chlorophyll". Nature. 393 (6684): 423–424. Bibcode:1998Natur.393..423D. doi:10.1038/30871. S2CID 4416089.
- ^ a b Lamb, J.Y.; M.P. Davis (2020). "Salamanders and other amphibians are aglow with biofluorescence". Scientific Reports. 10 (1): 2821. Bibcode:2020NatSR..10.2821L. doi:10.1038/s41598-020-59528-9. PMC 7046780. PMID 32108141.
- ^ Wong, Sam (13 March 2017). "Luminous frog is the first known naturally fluorescent amphibian". Archived from the original on 20 March 2017. Retrieved 22 March 2017.
- ^ King, Anthony (13 March 2017). "Fluorescent frog first down to new molecule". Archived from the original on 22 March 2017. Retrieved 22 March 2017.
- ^ Taboada, C.; A.E. Brunetti; C. Alexandre; M.G. Lagorio; J. Faivovich (2017). "Fluorescent Frogs: A Herpetological Perspective". South American Journal of Herpetology. 12 (1): 1–13. doi:10.2994/SAJH-D-17-00029.1. S2CID 89815080.
- ^ a b Sandra Goutte; Matthew J. Mason; Marta M. Antoniazzi; Carlos Jared; Didier Merle; Lilian Cazes; Luís Felipe Toledo; Hanane el-Hafci; Stéphane Pallu; Hugues Portier; Stefan Schramm; Pierre Gueriau; Mathieu Thoury (2019). "Intense bone fluorescence reveals hidden patterns in pumpkin toadlets". Scientific Reports. 9 (1): 5388. Bibcode:2019NatSR...9.5388G. doi:10.1038/s41598-019-41959-8. PMC 6441030. PMID 30926879.
- ^ Fox, A. (2 April 2019). "Scientists discover a frog with glowing bones". ScienceMag. Retrieved 9 February 2020.
- ^ Rebouças, R.; A.B. Carollo; M.d.O. Freitas; C. Lambertini; R.M. Nogueira dos Santos; L.F. Toledo (2019). "Conservation Status of Brachycephalus Toadlets (Anura: Brachycephalidae) from the Brazilian Atlantic Rainforest". Diversity. 55 (1): 39–47. doi:10.3390/d11090150.
- ^ Vukusic, P; Hooper, I (2005). "Directionally controlled fluorescence emission in butterflies". Science. 310 (5751): 1151. doi:10.1126/science.1116612. PMID 16293753. S2CID 43857104.
- ^ Arnold, K. E. (2002). "Fluorescent Signaling in Parrots". Science. 295 (5552): 92. CiteSeerX 10.1.1.599.1127. doi:10.1126/science.295.5552.92. PMID 11778040.
- ^ Andrews, K; Reed, S. M.; Masta, S. E. (2007). "Spiders fluoresce variably across many taxa". Biology Letters. 3 (3): 265–7. doi:10.1098/rsbl.2007.0016. PMC 2104643. PMID 17412670.
- ^ Stachel, S. J.; Stockwell, S. A.; Van Vranken, D. L. (1999). "The fluorescence of scorpions and cataractogenesis". Chemistry & Biology. 6 (8): 531–539. doi:10.1016/S1074-5521(99)80085-4. PMID 10421760.
- ^ Spaeth, P (2020). "Biofluorescence in the platypus (Ornithorhynchus anatinus)". Mammalia. 85 (2): 179–181. doi:10.1515/mammalia-2020-0027.
- ^ McDonald, Maurice S. (2 June 2003). Photobiology of Higher Plants. John Wiley & Sons. ISBN 9780470855232. Archived from the original on 21 December 2017.
- ^ "5.1 Chlorophyll fluorescence – ClimEx Handbook". Retrieved 14 January 2020.
- ^ Iriel, A. A.; Lagorio, M. A. G. (2010). "Is the flower fluorescence relevant in biocommunication?". Naturwissenschaften. 97 (10): 915–924. Bibcode:2010NW.....97..915I. doi:10.1007/s00114-010-0709-4. PMID 20811871. S2CID 43503960.
- ^ Mobed, Jarafshan J.; Hemmingsen, Sherry L.; Autry, Jennifer L.; McGown, Linda B. (1 September 1996). "Fluorescence characterization of IHSS humic substances: Total luminescence spectra with absorbance correction". Environmental Science & Technology. 30 (10): 3061–3065. Bibcode:1996EnST...30.3061M. doi:10.1021/es960132l. ISSN 0013-936X. Retrieved 29 August 2021.
- ^ Milori, Débora MBP; Martin-Neto, Ladislau; Bayer, Cimélio; Mielniczuk, João; Bagnato, Vanderlei S (2002). "Humification degree of soil humic acids determined by fluorescence spectroscopy". Soil Science. 167 (11): 739–749. Bibcode:2002SoilS.167..739M. doi:10.1097/00010694-200211000-00004. ISSN 0038-075X. S2CID 98552138.
- ^ Richard, C; Trubetskaya, O; Trubetskoj, O; Reznikova, O; Afanas' Eva, G; Aguer, J-P; Guyot, G (2004). "Key role of the low molecular size fraction of soil humic acids for fluorescence and photoinductive activity". Environmental Science & Technology. 38 (7): 2052–2057. Bibcode:2004EnST...38.2052R. doi:10.1021/es030049f. ISSN 0013-936X. PMID 15112806.
- ^ Sierra, MMD; Giovanela, M; Parlanti, E; Soriano-Sierra, EJ (2005). "Fluorescence fingerprint of fulvic and humic acids from varied origins as viewed by single-scan and excitation/emission matrix techniques". Chemosphere. 58 (6): 715–733. Bibcode:2005Chmsp..58..715S. doi:10.1016/j.chemosphere.2004.09.038. ISSN 0045-6535. PMID 15621185.
- ^ Birks, J. B. (1962). "The Fluorescence and Scintillation Decay Times of Crystalline Anthracene". Proceedings of the Physical Society. 79 (3): 494–496. Bibcode:1962PPS....79..494B. doi:10.1088/0370-1328/79/3/306. S2CID 17394465.
- ^ Gilmore, F. R.; Laher, R. R.; Espy, P. J. (1992). "Franck–Condon Factors, r-Centroids, Electronic Transition Moments, and Einstein Coefficients for Many Nitrogen and Oxygen Band Systems". Journal of Physical and Chemical Reference Data. 21 (5): 1005. Bibcode:1992JPCRD..21.1005G. doi:10.1063/1.555910. Archived from the original on 9 July 2017.
- ^ "Chemists create the brightest-ever fluorescent materials". phys.org. Retrieved 6 September 2020.
- ^ "Scientists create the brightest fluorescent materials in existence". New Atlas. 7 August 2020. Retrieved 6 September 2020.
- ^ "Scientists create 'brightest known materials in existence'". independent.co.uk. Retrieved 6 September 2020.
- ^ Benson, Christopher R.; Kacenauskaite, Laura; VanDenburgh, Katherine L.; Zhao, Wei; Qiao, Bo; Sadhukhan, Tumpa; Pink, Maren; Chen, Junsheng; Borgi, Sina; Chen, Chun-Hsing; Davis, Brad J.; Simon, Yoan C.; Raghavachari, Krishnan; Laursen, Bo W.; Flood, Amar H. (6 August 2020). "Plug-and-Play Optical Materials from Fluorescent Dyes and Macrocycles". Chem. 6 (8): 1978–1997. doi:10.1016/j.chempr.2020.06.029. ISSN 2451-9294.
- ^ a b Harris, Tom (7 December 2001). "How Fluorescent Lamps Work". HowStuffWorks. Discovery Communications. Archived from the original on 6 July 2010. Retrieved 27 June 2010.
- ^ Chen, Lei; Lin, Chun-Che; Yeh, Chiao-Wen; Liu, Ru-Shi (22 March 2010). "Light Converting Inorganic Phosphors for White Light-Emitting Diodes". Materials. 3 (3): 2172–2195. Bibcode:2010Mate....3.2172C. doi:10.3390/ma3032172. ISSN 1996-1944. PMC 5445896.
- ^ Rye, H. S.; Dabora, J. M.; Quesada, M. A.; Mathies, R. A.; Glazer, A. N. (1993). "Fluorometric Assay Using Dimeric Dyes for Double- and Single-Stranded DNA and RNA with Picogram Sensitivity". Analytical Biochemistry. 208 (1): 144–150. doi:10.1006/abio.1993.1020. PMID 7679561.
- ^ Harris, Daniel C. (2004). Exploring chemical analysis. Macmillan. ISBN 978-0-7167-0571-0. Archived from the original on 31 July 2016.
- ^ 라코비치, 페이지 xxvi
- ^ Calfon MA, Vinegoni C, Ntziachristos V, Jaffer FA (2010). "Intravascular near-infrared fluorescence molecular imaging of atherosclerosis: toward coronary arterial visualization of biologically high-risk plaques". J Biomed Opt. 15 (1): 011107–011107–6. Bibcode:2010JBO....15a1107C. doi:10.1117/1.3280282. PMC 3188610. PMID 20210433.
- ^ Ughi GJ, Wang H, Gerbaud E, Gardecki JA, Fard AM, Hamidi E, et al. (2016). "Clinical Characterization of Coronary Atherosclerosis With Dual-Modality OCT and Near-Infrared Autofluorescence Imaging". JACC Cardiovasc Imaging. 9 (11): 1304–1314. doi:10.1016/j.jcmg.2015.11.020. PMC 5010789. PMID 26971006.
- ^ Hara T, Ughi GJ, McCarthy JR, Erdem SS, Mauskapf A, Lyon SC, et al. (2015). "Intravascular fibrin molecular imaging improves the detection of unhealed stents assessed by optical coherence tomography in vivo". Eur Heart J. 38 (6): 447–455. doi:10.1093/eurheartj/ehv677. PMC 5837565. PMID 26685129.
- ^ Shkolnikov, V; Santiago, J. G. (2013). "A method for non-invasive full-field imaging and quantification of chemical species" (PDF). Lab on a Chip. 13 (8): 1632–43. doi:10.1039/c3lc41293h. PMID 23463253. Archived (PDF) from the original on 5 March 2016.
- ^ Moczko, E; Mirkes, EM; Cáceres, C; Gorban, AN; Piletsky, S (2016). "Fluorescence-based assay as a new screening tool for toxic chemicals". Scientific Reports. 6: 33922. Bibcode:2016NatSR...633922M. doi:10.1038/srep33922. PMC 5031998. PMID 27653274.
- ^ Smith, W. Leo; Buck, Chesney A.; Ornay, Gregory S.; Davis, Matthew P.; Martin, Rene P.; Gibson, Sarah Z.; Girard, Matthew G. (20 August 2018). "Improving Vertebrate Skeleton Images: Fluorescence and the Non-Permanent Mounting of Cleared-and-Stained Specimens". Copeia. 106 (3): 427–435. doi:10.1643/cg-18-047. ISSN 0045-8511.
- ^ Hawkins, H. Gene; Carlson, Paul John and Elmquist, Michael(2000) "형광 오렌지 표지 평가" 2016년 3월 4일 텍사스 교통 연구소 보고서 2962-S에 보관되었다.
참고 문헌 목록
- Lakowicz, Joseph R. (1999). Principles of Fluorescence Spectroscopy. Kluwer Academic / Plenum Publishers. ISBN 978-0-387-31278-1.
추가 읽기
- The Story of Fluorescence. Raytech Industries. 1965.
외부 링크
| 위키미디어 커먼스는 플루오르센스와 관련된 미디어를 가지고 있다. |
- Fluorophores.org[permanent dead link], 형광 염료 데이터베이스
- FSU.edu, 형광의 기본 개념
- 데이비드 제임슨의 '나노 역사 형광학' 강의
- 다양한 형광 염료의 흥분 및 방출 스펙트럼
- 사진, 활성제 및 스펙트럼이 포함된 형광 광물 데이터베이스(fluomin.org)
- "바이오플루오린 나이트 다이브 – 다합/홍해 (이집트), 마스밧 베이/마슈라바, "로맨 록"유튜브. 2012년 10월 9일.
- 스테펜 O.바이엘. "FluoPedia.org: Publications".fluopedia.org.
- 스테펜 O.바이엘. "FluoMedia.org: Science".fluomedia.org.









 방사선의
방사선의 
![{\displaystyle \left[S_{1}\right]=\left[S_{1}\right]_{0}e^{-\Gamma t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9862f745e8c8e8f83083c7e8038c0a4c632b6c07)
![{\displaystyle \left[S_{1}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85875c6a1407cb88df37cff6cac722a1b488dbc2) (는)
(는) 
![{\displaystyle \left[S_{1}\right]_{0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ddfd576e02a185cecd193db9b729e228db24d84)


 총
총  복사
복사

 (는) 흥분광의 양극화에 평행한 방출 강도,
(는) 흥분광의 양극화에 평행한 방출 강도,  흥분광의 양극화에 직각인 방출 강도다.
흥분광의 양극화에 직각인 방출 강도다.







