인공 세포
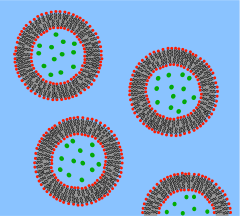
Artificial cell인공 세포, 합성 세포 또는 최소 세포는 생체 세포의 하나 또는 많은 기능을 모방하는 공학 입자입니다.종종, 인공 세포는 생물학적으로 활성화된 [1]물질을 둘러싸고 있는 생물학적 또는 고분자 막이다.이와 같이 리포좀, 폴리머좀, 나노입자, 마이크로캡슐, 그리고 많은 다른 입자들이 인공세포로 적합할 수 있다.
"인공 세포"와 "합성 세포"라는 용어는 다양한 분야에서 사용되며 이 기사의 다른 섹션에도 반영되어 있기 때문에 다른 의미를 가질 수 있습니다.일부 엄격한 정의는 "세포"라는 용어가 생물학적 세포와 직접 관련이 있고 따라서 이러한 구조물이 살아 있어야 하며(또는 살아있는 유기체의 일부), 나아가 "인공"이라는 용어가 이러한 구조물이 상향식, 즉 기본 구성요소에서 인공적으로 구축되었음을 암시한다는 가정에 기초하고 있다.이와 같이, 합성 생물학의 영역에서, 인공 세포는 에너지를 포착하고, 이온 구배를 유지하고, 고분자를 포함할 수 있을 뿐만 아니라 정보를 저장하고 복제할 [2]수 있는 완전한 합성 세포로 이해될 수 있다.이런 종류의 인공 세포는 아직 만들어지지 않았다.
그러나 다른 경우, "인공"이라는 용어는 전체 구조가 인공이라는 것을 의미하는 것이 아니라, 생물학적 세포의 특정 기능이나 구조를 수정, 단순화, 대체 또는 합성 개체로 보완할 수 있다는 생각을 나타낼 수 있다.
다른 분야에서, "인공 세포"라는 용어는 크기나 구조 면에서 다소 생물학적 세포와 유사하지만, 합성적으로 만들어지거나 심지어 비생물학적 구성요소로 완전히 만들어진 모든 구획을 가리킬 수 있다."인공 세포"라는 용어는 또한 약물 전달을 위한 구획과 같이 직접 적용되는 구조물에 사용된다.미세 캡슐화는 막 내 대사, 작은 분자의 교환 및 막 [3][4]내 큰 물질의 통과를 방지합니다.캡슐화의 주요 장점은 체내 모방 개선, 화물의 용해성 증가 및 면역 반응 감소입니다.특히 인공세포는 혈액융합에 [5]임상적으로 성공했다.
| 에 관한 일련의 기사의 일부 |
| 합성생물학 |
|---|
| 합성 생물 회로 |
| 게놈 편집 |
| 인공 세포 |
| 이종생물학 |
| 기타 토픽 |
살아있는 인공세포의 보텀업 엔지니어링
독일 병리학자인 루돌프 비르코는 생명이 세포에서 비롯될 뿐만 아니라 모든 세포는 다른 세포인 "옴니스 셀룰라"[6]에서 나온다는 생각을 내놓았다.지금까지 인공 셀을 만드는 대부분의 시도는 셀의 특정 작업을 모방할 수 있는 패키지만 만들었습니다.무세포 전사 및 번역 반응의 발전은 많은 유전자의 발현을 허용하지만, 이러한 노력은 완전히 작동하는 세포를 생산하는 것과는 거리가 멀다.
인공 세포를 만들기 위한 상향식 접근법은 완전히 무생물 물질로 된 프로토셀 드 노보를 만드는 것이다."셀"이라는 용어가 암시하는 바와 같이, 하나의 전제조건은 개별 셀 단위를 정의하는 일종의 구획의 생성이다.인지질 막은 살아있는 모든 생물 세포에서 선택적인 장벽으로 작용하기 때문에 경계를 [7]구분하는 것으로서 명백한 선택이다.과학자들은 세포 크기의 인지질 소포에 생체 분자를 봉합할 수 있고, 그렇게 함으로써, 이러한 분자들이 생물학적 세포에서와 비슷하게 작용하여 특정한 세포 [8]기능을 재생성하는 것을 관찰할 수 있다.유사한 방법으로 기능성 생물학적 구성 요소를 이러한 지질 구획에 캡슐화하여 (그러나 기초적인) 인공 세포의 합성을 달성할 수 있다.
합성 유전자 정보를 이용해 자가 재생이 가능한 DNA를 가진 인지질 이중층 소포를 만드는 것이 제안되었다.이러한 인공 세포의 세 가지 주요 요소는 지질막의 형성, 템플릿 과정을 통한 DNA 및 RNA 복제, 그리고 [9][10]막을 통한 활발한 이동을 위한 화학적 에너지의 수집이다.이 제안된 프로토셀에서 예견되고 마주치는 주요 장애물은 생명을 위한 모든 충분한 정보를 보유하는 최소한의 합성 DNA의 생성과 분자 자기 [11]조직과 같은 세포 발달에 필수적인 비유전적인 요소의 재생산이다.그러나 이러한 상향식 접근방식이 세포 수준에서 조직의 근본적인 질문과 생물학적 생명의 기원에 대한 통찰력을 제공할 것으로 기대된다.지금까지 생명체의 분자를 이용해 자기 재생이 가능한 완전한 인공세포가 합성된 적은 없으며, 현재 다양한 그룹이 이 목표를 위해 노력하고 있지만,[12] 이 목표는 여전히 먼 미래에 있다.
프로토셀을 만들기 위해 제안된 또 다른 방법은 원시 수프로 알려진 진화 과정에서 존재했다고 믿어지는 조건과 더 흡사하다.다양한 RNA 중합체를 소포에 캡슐화할 수 있고 이렇게 작은 경계 조건에서 화학 반응을 [13]시험할 수 있다.
윤리와 논쟁
프로토셀 연구는 "인공 생명체"[14]의 모호한 정의에 대한 비판자들을 포함하여 논란과 반대 의견을 만들어냈다.비록 프로토셀에 대한 가장 광범위한 우려가 통제되지 않은 [15]복제를 통한 인간의 건강과 환경에 대한 잠재적 위협이지만, 생명의 기본 단위의 창조는 가장 시급한 윤리적 관심사이다.
국제 연구 커뮤니티
2010년대 중반, 연구 커뮤니티는, 무생물 성분으로부터 생물 전체를 구성하는 작업이 단일 국가의 자원을 [16]넘어섰다는 것을 인정하면서, 합성 세포 연구 분야를 통일할 필요성을 인식하기 시작했다.
2017년에는 여러 국가의 국가 합성 세포 기구와 함께 합성 세포 구축을 위한 국제 Build-a-Cell 대규모 연구 협력이 시작되었습니다.[17]이러한 국가 조직에는 FabriCell,[18] MaxSynBio[19] 및 BaSyC가 [20]포함됩니다.유럽의 합성 세포 노력은 2019년에 SynCell로 통합되었다.EU의 이니셔티브.[21]
최소한의 살아있는 세포를 만들기 위한 하향식 접근법
J. Craig Venter 연구소의 회원들은 살아있는 유기체의 유전자를 최소 유전자 [22]세트로 복제하기 위해 하향식 계산 방식을 사용했다.2010년 연구팀은 유전자적으로 빈 [22]박테리아에 삽입된 생명체의 최소 필요조건으로 여겨지는 합성 DNA를 이용해 마이코플라스마 마이코이데스의 복제주(미코플라스마 라보토리엄)를 만드는 데 성공했다.하향식 생합성 과정이 연료용 수소를 생성하거나 대기 [15]중 과도한 이산화탄소를 포착하는 등 수익성 있는 기능을 수행할 수 있는 새로운 유전자를 삽입할 수 있도록 할 것으로 기대된다.수많은 규제, 대사 및 시그널링 네트워크는 완전히 특성화되어 있지 않습니다.이러한 하향식 접근법은 숙주 유기체가 [23]복잡하고 불완전하게 정의된 분자 구성을 가지고 있기 때문에 기본적인 분자 조절을 이해하는 데 한계가 있습니다.2019년 마이코플라스마 Syn3.0 세포 내 모든 경로에 대한 완전한 계산 모델이 발표되었으며, 이는 살아있는 최소 [24]유기체에 대한 최초의 완전한 실리콘 모델을 나타낸다.
생물학에 대한 막대한 투자는 Synthetic Genomics Inc.와 제휴한 ExxonMobil과 같은 대기업에 의해 이루어졌습니다.[25]ExxonMobil은 조류에서 나오는 연료를 개발하는 크레이그 벤터의 자체 생합성학 회사입니다.
2016년 현재, 미코플라스마 제니탈리움은 실험실 환경에서 배양될 수 있는 알려진 가장 작은 게놈을 가지고 있기 때문에 최소 세포를 엔지니어링하기 위한 출발점으로 사용되는 유일한 유기체이다; 야생형 품종은 482개이며, 필수적이지 않은 것으로 간주되는 정확히 100개의 유전자를 제거함으로써 향상된 성장률로 생존 가능한 변종을 낳았다.유전자 감소 대장균은 더 유용하다고 여겨지며 게놈의 15%를 [26]: 29–30 제거한 채 생존 가능한 변종이 개발되었습니다.
유전자적으로 비어 있는 숙주 [22]세포에 완전히 합성 게놈이 도입된 인공 세포의 변이가 생성되었다.세포질 성분과 숙주 세포로부터의 막이 유지되기 때문에 완전히 인공적인 것은 아니지만, 공학적 세포는 합성 게놈의 통제 하에 있으며 복제할 수 있다.
의료용 인공 세포
역사
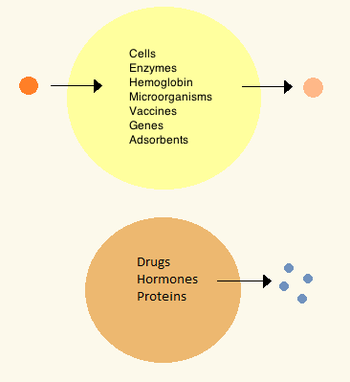
1960년대에 Thomas Chang은 나중에 "인공 세포"라고 부르는 마이크로 캡슐을 개발했는데, 그것은 인공 [27]물질로 만들어진 세포 크기의 구획이었기 때문이다.이 세포들은 나일론, 콜로디온 또는 가교 단백질의 초박막으로 구성되었고, 반투과성 특성은 작은 분자들이 세포 안팎으로 확산되도록 했다.이 세포들은 미크론 크기로 세포, 효소, 헤모글로빈, 자성 물질, 흡착제,[3] 단백질을 포함하고 있었다.
이후 인공세포는 100마이크로미터에서 나노미터까지 다양하며 미생물, 백신, 유전자, 약물, 호르몬, 펩타이드를 [3]운반할 수 있다.인공세포의 첫 임상적 사용은 [28]활성탄의 캡슐화에 의한 혈액융합이었다.
1970년대에 연구자들은 생분해성 마이크로캡슐에 효소, 단백질, 호르몬을 도입할 수 있었고, 나중에 레쉬-나이한 [29]증후군과 같은 질병에서 임상적으로 사용하게 되었다.장 씨의 초기 연구는 인공 적혈구에 초점을 맞췄지만 1990년대 중반에야 생분해성 인공 적혈구가 개발됐다.[30]생체 세포 캡슐화의 인공 세포는 당뇨병 환자의[31] 치료를 위해 1994년 클리닉에서 처음 사용되었으며, 그 이후 간세포, 성체 줄기세포 및 유전자 조작 세포와 같은 다른 유형의 세포들이 캡슐화되어 [32][33]조직 재생에 사용하기 위해 연구되고 있다.
자재
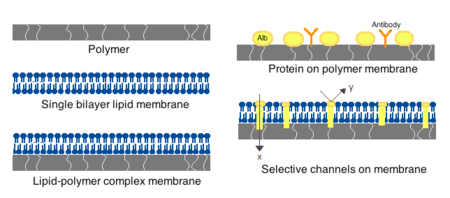
인공세포용 막은 단순 고분자, 가교단백질, 지질막 또는 고분자-지질 복합체로 구성될 수 있다.또한 알부민, 항원, Na/K-ATPase 캐리어 등의 표면단백질 또는 이온채널 등의 기공을 제시하도록 막을 제작할 수 있다.막 제조에 일반적으로 사용되는 재료는 알긴산염 등의 하이드로겔 중합체, 셀룰로오스 및 히드록시에틸 메타크릴레이트메틸 메타크릴레이트(HEMA-MMA), 폴리아크릴로니트릴폴리염화비닐(PAN-PVC) 등의 열가소성 고분자 및 상기 [4]변형을 포함한다.사용된 물질은 세포막의 투과성을 결정하며, 폴리머의 경우 분자량 차단(MWCO)[4]에 따라 달라집니다.MWCO는 모공을 자유롭게 통과할 수 있는 분자의 최대 분자량이며 영양소, 폐기물 및 기타 중요한 분자의 적절한 확산을 결정하는 데 중요합니다.친수성 고분자는 생체적합성이 있을 가능성이 있으며 고분자 미셀, 솔-겔 혼합물, 물리적 혼합물, 가교 입자 및 나노 [4]입자를 포함한 다양한 형태로 제작될 수 있습니다.특별한 관심사는 목표 전달에 사용하기 위해 pH 또는 온도 변화에 반응하는 자극 반응성 폴리머이다.이러한 폴리머는 거시적 주입을 통해 액체 형태로 투여될 수 있으며 pH 또는 온도 차이로 인해 현장에서 굳히거나 겔화될 수 있다.나노입자 및 리포좀 제제도 재료의 캡슐화 및 전달에 일상적으로 사용된다.리포좀의 가장 큰 장점은 세포와 세포 세포막에 융합하는 능력이다.
준비
인공 세포 준비 및 캡슐화를 위한 많은 변형이 개발되었습니다.전형적으로 나노 입자, 중합체 또는 리포좀과 같은 소포가 합성된다.에멀젼은 일반적으로 고압 균질화기 또는 마이크로유체화기와 같은 고압 장비를 사용하여 제조됩니다.니트로셀룰로오스에 대한 두 가지 마이크로 캡슐화 방법도 아래에 설명되어 있다.
고압 균질화
고압 균질기에서 오일/액체 서스펜션 내의 두 액체가 매우 높은 압력으로 작은 오리피스를 통해 강제됩니다.이 공정은 제품을 분할하여 1nm의 미세한 입자를 만들 수 있습니다.
미세 유체화
이 기술은 특허받은 마이크로플루이드라이저를 사용하여 균질화 장치보다 더 작은 입자를 만들 수 있는 더 많은 양의 균질 현탁액을 얻습니다.먼저 균질화기를 사용하여 거친 서스펜션을 만든 다음 고압으로 마이크로 유체 공급기로 펌핑됩니다.그런 다음 흐름은 원하는 입자 크기를 얻을 [34]때까지 상호작용 챔버에서 매우 빠른 속도로 반응하는 두 개의 흐름은 두 개의 스트림으로 분할됩니다.이 기술은 인지질 리포좀의 대규모 생산과 후속 물질 나노 캡슐화를 가능하게 한다.
드롭 방식
셀룰로오스 질산염 콜로디온 용액에 세포용액을 액체적으로 함유하는 방법.그 방울이 콜로디온을 통과할 때 콜로디온의 계면 중합 특성에 의해 막으로 코팅된다.세포는 나중에 파라핀으로 가라앉아 막이 굳고 최종적으로 식염수 용액이 현탁된다.적하법은 생체세포, 줄기세포, 유전공학 줄기세포를 캡슐화한 대형 인공세포를 만드는 데 사용된다.
유화법
에멀젼 방법은 캡슐화되는 물질이 일반적으로 더 작고 반응 챔버 바닥에 배치되어 콜로디온이 위에 첨가되고 원심분리되거나 에멀젼을 생성하기 위해 교란된다는 점에서 다릅니다.그런 다음 캡슐화된 물질을 식염수 용액에 분산시켜 부유시킨다.
임상 관련성
약물 방출 및 전달
약물 전달에 사용되는 인공 세포는 내용물이 막 밖으로 확산되거나 숙주 표적 세포에 의해 흡수되어 소화되는 것을 의도하기 때문에 다른 인공 세포와 다르다.나노캡슐, 나노입자, 중합체, 또는 [35]용어의 다른 변형으로 언급될 수 있는 서브미크론, 지질막 인공세포가 종종 사용된다.
효소 요법
효소 치료는 효소가 과잉 발현되거나, 과소 발현되거나, 결함이 있거나, 전혀 없는 유전자 대사 질환에 대해 활발하게 연구되고 있다.결함이 있는 효소의 과소발현 또는 발현 시에는 효소의 활성 형태를 체내에 도입하여 결손을 보상한다.한편 효소적 과발현은 경합하는 비기능성 효소, 즉 기질을 비활성제품으로 대사하는 효소의 도입에 의해 중화될 수 있다.효소는 인공세포 내에 배치되면[3] 유리효소에 비해 훨씬 더 오랜 기간 기능을 수행할 수 있으며 고분자 [36]결합에 의해 더욱 최적화될 수 있다.
인공 세포 캡슐화 하에서 연구된 첫 번째 효소는 생쥐의 림프육종 치료를 위한 아스파라긴아제였다.이 치료법은 [37]종양의 발생과 성장을 지연시켰다.이러한 초기 발견은 티로신 의존성 [38]흑색종에서 효소 전달을 위한 인공 세포 사용에 대한 추가 연구를 이끌었다.이 종양들은 성장을 위해 정상적인 세포보다 티로신에 더 많이 의존하며, 연구는 쥐의 티로신 수치를 낮추면 흑색종의 [39]성장을 억제할 수 있다는 것을 보여 주었다.티로시나아제 전달에 인공세포와 티로신을 소화시키는 효소의 사용은 더 나은 효소 안정성을 가능하게 하며 [40]식단에서 티로신 변성과 관련된 심각한 부작용 없이 티로신을 제거하는 데 효과적이다.
인공 세포 효소 치료는 또한 특정 암에서 ifosfamide와 같은 프로드러그의 활성화에 관심이 있다.이 프로드러그를 활성약물로 변환하는 시토크롬 p450 효소를 캡슐화한 인공세포를 췌장암에 축적하거나 종양부위 근처에 인공세포를 이식하도록 맞춤화할 수 있다.여기서 활성화된 ifosfamide의 국소 농도는 신체의 다른 부분보다 훨씬 높기 때문에 전신 [41]독성을 방지할 수 있다.치료법은 동물에서[42] 성공적이었고 임상 I/I에서 진행기 췌장암 환자들 사이에서 중위 생존율이 2배, 1년 [41]생존율이 3배 증가했다.
유전자 치료
유전자 질환의 치료에서 유전자 치료는 고통받는 개인의 세포에 유전자를 삽입, 변형 또는 제거하는 것을 목표로 한다.이 기술은 바이러스 벡터에 크게 의존하고 있어 삽입형 돌연변이 유발과 전신 면역 반응에 대한 우려를 불러일으키고 있어 임상시험에서 백혈병의[43][44] 발병과 사망을[45][46] 초래했다.나체 또는 플라스미드 DNA를 자체 전달 시스템으로 사용함으로써 벡터의 필요성을 회피하는 것 또한 시스템적으로 [4]주어졌을 때 낮은 전달 효율과 조직 표적화 불량과 같은 문제에 직면한다.
인공세포는 유전자 변형 비자율세포가 [47]생체내 재조합단백질을 전달하기 위해 캡슐화 및 이식되는 비바이러스 벡터로 제안되어 왔다.이러한 면역격리 유형은 돌연변이 [48]생쥐의 성장저지를 구한 생쥐 성장호르몬을 포함한 인공세포 전달을 통해 생쥐에게 효율적인 것으로 입증되었다.췌장암, 측삭경화증, 통증조절을 [4]위한 몇 가지 전략이 인간 임상시험으로 발전했다.
혈액융합
인공세포의 첫 임상적 사용은 [28]활성탄의 캡슐화에 의한 혈액융합이었다.활성탄은 많은 큰 분자를 흡착할 수 있는 능력을 가지고 있으며 오랫동안 실수로 인한 중독이나 과다복용으로 혈액에서 독성 물질을 제거하는 능력으로 알려져 왔다.그러나 숯 직접 투여를 통한 관류는 색전증 및 [49]혈소판 제거로 이어지기 때문에 독성이 있다.인공 세포는 초박막 [28]안에 위험한 화물을 보관하면서 독소가 세포 안으로 확산되도록 한다.
혈액 여과는 물리적 막에 의한 크기 분리를 통해서만 이루어지는 혈액 [3]투석보다 저렴하고 효율적인 해독 옵션으로 제안되어 왔다.혈액융합에서는 수천 개의 흡착제 인공세포가 환자의 혈액 관류를 하는 양 끝에 있는 두 개의 스크린을 사용하여 작은 용기 안에 보관됩니다.혈액이 순환하면서 독소나 약물이 세포 안으로 확산되어 흡수 물질에 의해 유지된다.인공세포의 막은 투석에 사용되는 것보다 훨씬 얇고, 크기가 작다는 것은 그들이 높은 막 표면적을 가지고 있다는 것을 의미한다.이것은 세포의 일부가 전체 인공 신장 [3]기계보다 100배 높은 이론적인 질량 전달을 가질 수 있다는 것을 의미한다.이 장치는 우발적 또는 자살적 중독으로 치료된 환자를 위한 일상적인 임상 방법으로 확립되었지만 이러한 장기의 [3]기능 일부를 수행함으로써 간 기능 부전 및 신부전 치료제로도 도입되었습니다.인공세포 표면에 알부민 등의 면역흡착물질을 부착함으로써 항체를 몸에서 제거할 수 있는 면역흡착에 사용할 수 있는 인공세포혈류도 제안되고 있다.이 원리는 골수이식을[50] 위해 혈장에서 혈액형 항체를 제거하고 저밀도 리포단백질을 [51]제거하기 위해 모노클로널 항체를 통한 고콜레스테롤혈증 치료에 사용되어 왔다.혈액융합은 혈액투석 제조업이 취약한 국가에서 특히 유용하다. 왜냐하면 이 장치는 신장기능부전 환자에게 더 저렴하고 사용되는 경향이 있기 때문이다.
캡슐화된 셀
인공 세포의 가장 일반적인 준비 방법은 세포 캡슐화를 통해서이다.캡슐화된 세포는 일반적으로 액체 셀 현탁액에서 제어된 크기의 물방울을 생성함으로써 달성되며, 액체 셀 현탁액은 빠르게 응고되거나 겔화되어 안정성을 더한다.안정화는 온도 변화 또는 재료 가교를 [4]통해 달성될 수 있습니다.셀이 인식하는 미세 환경은 캡슐화 시 변경됩니다.이는 일반적으로 단분자층 위에서 고분자막 내 고분자 골격의 현탁액으로 변합니다.이 기술의 단점은 세포를 캡슐화하면 세포의 생존력과 증식 및 [52]분화 능력이 떨어진다는 것이다.또한 마이크로캡슐 내에서 일정 시간이 경과한 후 세포는 산소 및 대사 [53]노폐물의 교환을 억제하는 클러스터를 형성하여 아포토시스 및 괴사를 초래함으로써 세포의 유효성을 제한하고 숙주의 면역체계를 활성화한다.인공 세포는 당뇨병 [54]치료용 랑게르한스 섬, 부갑상선 세포, 부신 피질 세포를 포함한 많은 세포를 이식하는 데 성공했다.
캡슐화 간세포
장기 기증자의 부족은 인공 세포를 간부전 대체 치료의 핵심 주체로 만든다.간세포 이식을 위한 인공세포의 사용은 동물성 간질환 및 생체 인공간 [55]장치 모델에서 간 기능을 제공하는 타당성과 유효성을 입증했다.연구는 간세포가 마이크로캐리어[56] 표면에 부착되어 폴리리신의 외피로 덮인 알긴산염 마이크로드롭의 3차원 매트릭스에 캡슐화된 간세포로 진화한 실험을 중단했다.이 전달 방법의 주요 장점은 치료 기간 동안 면역 억제 요법의 회피이다.간세포 캡슐화는 생물 인공 간에서 사용하기 위해 제안되었다.이 장치는 격리된 간세포가 내장된 원통형 챔버로 구성되며, 이 챔버를 통해 환자의 혈장이 혈류종류에서 외부로 순환됩니다.마이크로캡슐은 표면적 대 부피비가 높기 때문에 기질 확산에 큰 표면을 제공하며 다수의 간세포를 수용할 수 있다.유도 간 기능 부전 생쥐에 대한 치료는 [55]생존율이 유의미하게 증가하였다.인공 간 시스템은 아직 초기 개발 단계에 있지만 장기 이식을 기다리는 환자나 환자 자신의 간이 정상 기능을 회복할 수 있을 만큼 충분히 재생되는 동안 잠재력이 있습니다.지금까지 인공간 시스템과 간세포 이식을 이용한 말기 간질환 임상시험은 건강 지표는 개선됐지만 [57]생존은 아직 개선되지 않았다.이식 후 인공 간세포의 짧은 수명과 집적이 주요 장애물이다.줄기세포와 함께 캡슐화된 간세포는 배양에서 더 큰 생존력을 보이며 인공줄기세포의 이식[58] 및 이식 후 간 [59]재생도 나타났다.이와 같이 재생의학에서 캡슐화를 위한 줄기세포 사용에 대한 관심이 높아지고 있다.
캡슐화세균세포
살아있는 박테리아 세포 군체의 경구 섭취는 제안되었고 현재 장 미세 [60]꽃의 조절, 설사 [61]질환의 예방, H. 필로리 감염의 치료, [62]아토피 염증, 유당[63] 불내증, 면역 [64]조절 등의 치료를 위해 치료되고 있다.제안된 작용 메커니즘은 완전히 이해되지 않았지만 두 가지 주요 효과가 있는 것으로 여겨진다.첫 번째는 독소를 생성하는 박테리아와 경쟁하는 영양 효과입니다.두 번째는 식민지화에 대한 저항력과 면역반응을 [4]촉진하는 위생효과입니다.세균 배양물의 경구 전달은 종종 문제가 됩니다. 왜냐하면 세균 배양물은 면역체계의 표적이 되고 경구 섭취 시 종종 파괴되기 때문입니다.인공 세포는 체내에 모방물을 제공하고 선택적 또는 장기적인 방출을 제공함으로써 이러한 문제들을 해결하는데 도움을 줍니다. 따라서 위장 시스템에 [4]도달하는 박테리아가 생존할 수 있는 능력을 증가시킵니다.또한 펩타이드를 포함한 소분자가 치료 목적으로 [4]체내에 확산되도록 살아있는 세균세포 캡슐화를 설계할 수 있다.박테리아 전달에 성공한 것으로 입증된 막은 셀룰로오스 아세테이트와 알긴산염 [4]변종을 포함합니다.세균세포의 캡슐화에 의한 아로센을 가진 추가적인 용도에는 M의 도전으로부터 보호하는 것이 포함된다. 결핵과[65] 면역 [66]체계에서 세포를 분비하는 Ig의 상향 조절.이 기술은 전신 감염, 유해 대사 활동 및 유전자 이동의 [4]위험성에 의해 제한된다.하지만,[4] 더 큰 과제는 관심 부위로 충분한 생존 가능한 박테리아를 전달하는 것이다.
산소 운반체로서의 인공혈구
나노 크기의 산소 운반체는 적혈구의 다른 성분이 부족하지만 적혈구 대체물의 한 종류로 사용된다.그들은 합성 중합체 또는 정제된 동물, 인간 또는 재조합 헤모글로빈을 [67]둘러싼 인공막으로 구성되어 있다.헤모글로빈 분만은 수정 없이 전달될 경우 매우 독성이 강하기 때문에 전반적으로 여전히 어려운 과제입니다.일부 임상시험에서는 혈관압축 효과가 [68][69]관찰되었다.
인공 적혈구
혈액에 인공 세포를 사용하는 것에 대한 연구는 1980년대 에이즈 공포 이후 시작되었다.질병 전염 가능성을 우회하는 것 외에도, 인공 적혈구는 혈액형, 면역 반응, 42일의 짧은 저장 수명 같은 알로겐 수혈과 관련된 결점을 제거하기 때문에 바람직하다.헤모글로빈 대체물은 상온에서 1년 [3]이상 냉동상태에서 보관해도 된다.산소 운반체뿐만 아니라 세포와 관련된 효소로 이루어진 완전한 적혈구를 개발하려는 시도가 있었다.적혈구막을 초박막으로 대체하여[70] 1957년에 최초로 시도되었으며, 그 후 지질막과[71] 최근에는 생분해성 고분자막을 [3]통한 봉입이 이어졌다.지질 및 관련 단백질을 포함한 생물학적 적혈구막은 [72]대식세포 흡수와 전신 클리어런스를 바이패스함으로써 나노입자를 캡슐화하고 생체내 체류시간을 증가시키기 위해서도 사용할 수 있다.
인공 류코 폴리머솜
류코폴리머좀은 백혈구의 [73]접착성을 갖도록 설계된 중합체이다.중합체는 약물과 효소와 같은 많은 활성 분자를 캡슐화할 수 있는 이중층 시트로 구성된 소포입니다.백혈구의 점착성을 세포막에 부가함으로써 빠르게 흐르는 순환계 내에서 속도를 늦추거나 상피벽을 따라 굴릴 수 있다.
특이한 형태의 인공 세포
전자 인공 세포
2004년부터 2015년까지 John McCaskill에 의해 조정된 EU의 3개 프로젝트 중 전자 인공 셀의 개념이 확장되었습니다.
유럽 연합 집행 위원회는 연산과 인공 세포 진화의 발전 program[74]2004년 2008년 이들의 목표"미세한 self-organizing, 자기 복제, 전개할 수 있는 자치 단체가 간단한 유기고 될 수 있는 유전적으로 프로 무기 물질에서 빌드의 구축을 위한 초석을 마련하는 것에 따라(페이스.)를 후원했다.그램특정 [74]기능을 수행할 수 있습니다.PACE 프로젝트는 화학적으로 누락된 기능을 보완할 수 있는 인공 세포를 위한 미세 유체 생명 유지 시스템인 첫 번째 오메가 기계를 개발했다(Norman Packard, Steen Rasmussen, Mark Beadau 및 John McCaskill이 원래 제안한).궁극적인 목표는 복잡한 마이크로스케일 프로그램 가능한 환경에서 진화가 가능한 하이브리드 셀을 얻는 것이었다.오메가 머신의 기능은 단계적으로 제거될 수 있으며, 인공 세포 화학에 일련의 해결 가능한 진화 도전을 제기합니다.이 프로젝트는 인공 세포의 세 가지 핵심 기능(유전자 서브시스템, 격납 시스템 및 대사 시스템) 쌍 수준까지 화학적 통합을 달성했으며 격납과 유전자 [74]증폭의 통합을 위해 공간적으로 분해된 새로운 프로그램 가능한 미세 유체 환경을 생성했다.그 프로젝트는 유럽 생활 [75]기술 센터의 설립으로 이어졌다.
이 연구에 뒤이어, 2007년, John McCaskill은 Electronic Chemical Cell이라고 불리는 전자적으로 보완된 인공 세포에 집중하자고 제안했다.핵심 아이디어는 2차원 박막에서 국소 전용 전자 회로와 결합된 대규모 병렬 전극을 사용하여 새로운 화학 세포 기능을 보완하는 것이었습니다.전극 스위칭 및 감지 회로를 정의하는 로컬 전자 정보는 전자 게놈으로 기능하여 새로운 프로토콜의 분자 순차 정보를 보완할 수 있습니다.유럽 위원회와 함께 연구 제안이 성공적이었고 PACE 컨소시엄과 부분적으로 중복된 국제 과학자 팀이 2008-2012년 프로젝트 Electronic Chemical Cells에 대한 작업을 시작했다.이 프로젝트는 특히 미래 인공세포의 유전자 증식을 위한 인공공간제어시스템으로 특정 배열의 국소수송을 전자적으로 제어할 수 있고, 적절한 코팅 전극 어레이에 의해 신진대사의 핵심 과정이 전달될 수 있음을 입증했다.
마이크로스케일 전기화학 및 전기역동학을 마스터하는 초기 어려움과는 별도로 이 접근법의 주요 한계는 전자 시스템이 거시적 하드웨어의 견고한 비자율적 부분으로 상호 연결된다는 것이다.2011년 맥카스킬은 활성 전자 매체에 화학 물질을 넣는 대신 화학 매체에 미세 자율 전자 장치를 배치하는 등 전자와 화학의 기하학적 구조를 뒤집을 것을 제안했다.그는 두 개의 하프 셀 "레이블렛"에서 자체 조립하여 내부 화학 공간을 둘러싸는 100 µm 규모의 3세대 전자 인공 셀에 도전하고, 그것들이 담근 매체에 의해 구동되는 능동 전자 장치의 도움으로 기능하는 프로젝트를 조직했다.이러한 세포는 전자와 화학 성분을 모두 복제할 수 있으며, 특별한 사전 합성된 현미경 구성 요소가 제공하는 제약 조건 내에서 진화할 수 있습니다.2012년 9월에 이 프로젝트에 [76]대한 작업이 시작되었습니다.
지와누
지와누 원생세포는 세포와 같은 구조를 가진 합성 화학 입자로 기능적인 [77]생물성을 가지고 있는 것으로 보인다.1963년에 햇빛에 노출되는 동안 단순한 미네랄과 기초 유기물로부터 처음 합성된, 그것은 여전히 대사 능력, 반투과성 막, 아미노산, 인지질, 탄수화물, RNA 유사 [77][78]분자의 존재를 가지고 있는 것으로 보고되었다.그러나 Jeewanu의 성격과 특성은 아직 [77][78][79]명확히 밝혀지지 않았다.
「 」를 참조해 주세요.
레퍼런스
- ^ Buddingh' BC, van Hest JC (April 2017). "Artificial Cells: Synthetic Compartments with Life-like Functionality and Adaptivity". Accounts of Chemical Research. 50 (4): 769–777. doi:10.1021/acs.accounts.6b00512. PMC 5397886. PMID 28094501.
- ^ Deamer D (July 2005). "A giant step towards artificial life?". Trends in Biotechnology. 23 (7): 336–338. doi:10.1016/j.tibtech.2005.05.008. PMID 15935500.
- ^ a b c d e f g h i Chang TM (2007). Artificial cells : biotechnology, nanomedicine, regenerative medicine, blood substitutes, bioencapsulation, cell/stem cell therapy. Hackensack, N.J.: World Scientific. ISBN 978-981-270-576-1.[페이지 필요]
- ^ a b c d e f g h i j k l m Prakash S (2007). Artificial cells, cell engineering and therapy. Boca Raton, Fl: Woodhead Publishing Limited. ISBN 978-1-84569-036-6.
- ^ Gebelein CG (1983). Polymeric materials and artificial organs based on a symposium sponsored by the Division of Organic Coatings and Plastics Chemistry at the 185th Meeting of the American Chemical Society. Washington, D.C.: American Chemical Society. ISBN 978-0-8412-1084-4.[페이지 필요]
- ^ Virchow RL (1858). Die cellularpathologie in ihrer begründung auf physiologische und pathologische gewebelehre [Cellular pathology in its justification of physiological and pathological histology]. Zwanzig Vorlesungen gehalten wahrend der Monate Februar, Marz und April 1858 (in German). Berlin: Verlag von August Hirschwald. p. xv.
- ^ Kamiya K, Takeuchi S (August 2017). "Giant liposome formation toward the synthesis of well-defined artificial cells". Journal of Materials Chemistry B. 5 (30): 5911–5923. doi:10.1039/C7TB01322A. PMID 32264347.
- ^ Litschel T, Schwille P (May 2021). "Protein Reconstitution Inside Giant Unilamellar Vesicles". Annual Review of Biophysics. 50: 525–548. doi:10.1146/annurev-biophys-100620-114132. PMID 33667121. S2CID 232131463.
- ^ Szostak JW, Bartel DP, Luisi PL (January 2001). "Synthesizing life". Nature. 409 (6818): 387–390. doi:10.1038/35053176. PMID 11201752. S2CID 4429162.
- ^ Pohorille A, Deamer D (March 2002). "Artificial cells: prospects for biotechnology". Trends in Biotechnology. 20 (3): 123–128. doi:10.1016/S0167-7799(02)01909-1. hdl:2060/20020043286. PMID 11841864.
- ^ Noireaux V, Maeda YT, Libchaber A (March 2011). "Development of an artificial cell, from self-organization to computation and self-reproduction". Proceedings of the National Academy of Sciences of the United States of America. 108 (9): 3473–3480. Bibcode:2011PNAS..108.3473N. doi:10.1073/pnas.1017075108. PMC 3048108. PMID 21317359.
- ^ Rasmussen S, Chen L, Nilsson M, Abe S (Summer 2003). "Bridging nonliving and living matter". Artificial Life. 9 (3): 269–316. CiteSeerX 10.1.1.101.1606. doi:10.1162/106454603322392479. PMID 14556688. S2CID 6076707.
- ^ Gilbert W (20 February 1986). "Origin of life: The RNA world". Nature. 319 (6055): 618. Bibcode:1986Natur.319..618G. doi:10.1038/319618a0. S2CID 8026658.
- ^ Bedau M, Church G, Rasmussen S, Caplan A, Benner S, Fussenegger M, et al. (May 2010). "Life after the synthetic cell". Nature. 465 (7297): 422–424. Bibcode:2010Natur.465..422.. doi:10.1038/465422a. PMID 20495545. S2CID 27471255.
- ^ a b Parke EC (2009). Beadau MA (ed.). The ethics of protocells moral and social implications of creating life in the laboratory ([Online-Ausg.] ed.). Cambridge, Mass.: MIT Press. ISBN 978-0-262-51269-5.
- ^ "From chemicals to life: Scientists try to build cells from scratch". 28 July 2017. Retrieved 4 Dec 2019.
- ^ "Build-a-Cell". Retrieved 4 Dec 2019.
- ^ "FabriCell". Retrieved 8 Dec 2019.
- ^ "MaxSynBio - Max Planck Research Network in Synthetic Biology". Retrieved 8 Dec 2019.
- ^ "BaSyC". Retrieved 8 Dec 2019.
- ^ "SynCell EU". Retrieved 8 Dec 2019.
- ^ a b c Gibson DG, Glass JI, Lartigue C, Noskov VN, Chuang RY, Algire MA, et al. (July 2010). "Creation of a bacterial cell controlled by a chemically synthesized genome". Science. 329 (5987): 52–56. Bibcode:2010Sci...329...52G. doi:10.1126/science.1190719. PMID 20488990. S2CID 7320517.
- ^ Armstrong R (September 2014). "Designing with protocells: applications of a novel technical platform". Life. 4 (3): 457–490. doi:10.3390/life4030457. PMC 4206855. PMID 25370381.
- ^ Breuer M, Earnest TM, Merryman C, Wise KS, Sun L, Lynott MR, et al. (January 2019). "Essential metabolism for a minimal cell". eLife. 8. doi:10.7554/eLife.36842. PMC 6609329. PMID 30657448.
- ^ Sheridan C (September 2009). "Big oil bucks for algae". Nature Biotechnology. 27 (9): 783. doi:10.1038/nbt0909-783. PMID 19741613. S2CID 205270805.
- ^ EU Directorate-General for Health and Consumers (2016-02-12). Opinion on synthetic biology II: Risk assessment methodologies and safety aspects. Publications Office. doi:10.2772/63529. ISBN 9789279439162.
- ^ Chang TM (October 1964). "Semipermeable Microcapsules". Science. 146 (3643): 524–525. Bibcode:1964Sci...146..524C. doi:10.1126/science.146.3643.524. PMID 14190240. S2CID 40740134.
- ^ a b c Chang TM (1996). "Editorial: past, present and future perspectives on the 40th anniversary of hemoglobin based red blood cell substitutes". Artificial Cells Blood Substit Immobil Biotechnol. 24: ixxxvi. NAID 10005526771.
- ^ Palmour RM, Goodyer P, Reade T, Chang TM (September 1989). "Microencapsulated xanthine oxidase as experimental therapy in Lesch-Nyhan disease". Lancet. 2 (8664): 687–688. doi:10.1016/s0140-6736(89)90939-2. PMID 2570944. S2CID 39716068.
- ^ Chang TM (1997). Blood substitutes. Basel: Karger. ISBN 978-3-8055-6584-4.[페이지 필요]
- ^ Soon-Shiong P, Heintz RE, Merideth N, Yao QX, Yao Z, Zheng T, et al. (April 1994). "Insulin independence in a type 1 diabetic patient after encapsulated islet transplantation". Lancet. 343 (8903): 950–951. doi:10.1016/S0140-6736(94)90067-1. PMID 7909011. S2CID 940319.
- ^ Liu ZC, Chang TM (June 2003). "Coencapsulation of hepatocytes and bone marrow stem cells: in vitro conversion of ammonia and in vivo lowering of bilirubin in hyperbilirubemia Gunn rats". The International Journal of Artificial Organs. 26 (6): 491–497. doi:10.1177/039139880302600607. PMID 12894754. S2CID 12447199.
- ^ Aebischer P, Schluep M, Déglon N, Joseph JM, Hirt L, Heyd B, et al. (June 1996). "Intrathecal delivery of CNTF using encapsulated genetically modified xenogeneic cells in amyotrophic lateral sclerosis patients". Nature Medicine. 2 (6): 696–699. doi:10.1038/nm0696-696. PMID 8640564. S2CID 8049662.
- ^ Vivier A, Vuillemard JC, Ackermann HW, Poncelet D (1992). "Large-scale blood substitute production using a microfluidizer". Biomaterials, Artificial Cells, and Immobilization Biotechnology. 20 (2–4): 377–397. doi:10.3109/10731199209119658. PMID 1391454.
- ^ Jakaria MG, Sorkhdini P, Yang D, Zhou Y, Meenach SA (February 2022). "Lung cell membrane-coated nanoparticles capable of enhanced internalization and translocation in pulmonary epithelial cells". International Journal of Pharmaceutics. 613: 121418. doi:10.1016/j.ijpharm.2021.121418. PMC 8792290. PMID 34954003.
- ^ 박 외 1981년[full citation needed][page needed]
- ^ Chang TM (January 1971). "The in vivo effects of semipermeable microcapsules containing L-asparaginase on 6C3HED lymphosarcoma". Nature. 229 (5280): 117–118. Bibcode:1971Natur.229..117C. doi:10.1038/229117a0. PMID 4923094. S2CID 4261902.
- ^ Yu B, Chang TM (April 2004). "Effects of long-term oral administration of polymeric microcapsules containing tyrosinase on maintaining decreased systemic tyrosine levels in rats". Journal of Pharmaceutical Sciences. 93 (4): 831–837. doi:10.1002/jps.10593. PMID 14999721.
- ^ Meadows GG, Pierson HF, Abdallah RM, Desai PR (August 1982). "Dietary influence of tyrosine and phenylalanine on the response of B16 melanoma to carbidopa-levodopa methyl ester chemotherapy". Cancer Research. 42 (8): 3056–3063. PMID 7093952.
- ^ Chang TM (February 2004). "Artificial cell bioencapsulation in macro, micro, nano, and molecular dimensions: keynote lecture". Artificial Cells, Blood Substitutes, and Immobilization Biotechnology. 32 (1): 1–23. doi:10.1081/bio-120028665. PMID 15027798. S2CID 37799530.
- ^ a b Löhr M, Hummel F, Faulmann G, Ringel J, Saller R, Hain J, et al. (May 2002). "Microencapsulated, CYP2B1-transfected cells activating ifosfamide at the site of the tumor: the magic bullets of the 21st century". Cancer Chemotherapy and Pharmacology. 49 (Suppl 1): S21–S24. doi:10.1007/s00280-002-0448-0. PMID 12042985. S2CID 10329480.
- ^ Kröger JC, Benz S, Hoffmeyer A, Bago Z, Bergmeister H, Günzburg WH, et al. (1999). "Intra-arterial instillation of microencapsulated, Ifosfamide-activating cells in the pig pancreas for chemotherapeutic targeting". Pancreatology. 3 (1): 55–63. doi:10.1159/000069147. PMID 12649565. S2CID 23711385.
- ^ Carmen IH (April 2001). "A death in the laboratory: the politics of the Gelsinger aftermath". Molecular Therapy. 3 (4): 425–428. doi:10.1006/mthe.2001.0305. PMID 11319902.
- ^ Raper SE, Chirmule N, Lee FS, Wivel NA, Bagg A, Gao GP, et al. (1 September 2003). "Fatal systemic inflammatory response syndrome in a ornithine transcarbamylase deficient patient following adenoviral gene transfer". Molecular Genetics and Metabolism. 80 (1–2): 148–158. doi:10.1016/j.ymgme.2003.08.016. PMID 14567964.
- ^ Cavazzana-Calvo M, Hacein-Bey S, de Saint Basile G, Gross F, Yvon E, Nusbaum P, et al. (April 2000). "Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease". Science. 288 (5466): 669–672. Bibcode:2000Sci...288..669C. doi:10.1126/science.288.5466.669. PMID 10784449.
- ^ Hacein-Bey-Abina S, Von Kalle C, Schmidt M, McCormack MP, Wulffraat N, Leboulch P, et al. (October 2003). "LMO2-associated clonal T cell proliferation in two patients after gene therapy for SCID-X1". Science. 302 (5644): 415–419. Bibcode:2003Sci...302..415H. doi:10.1126/science.1088547. PMID 14564000. S2CID 9100335.
- ^ Chang PL, Van Raamsdonk JM, Hortelano G, Barsoum SC, MacDonald NC, Stockley TL (February 1999). "The in vivo delivery of heterologous proteins by microencapsulated recombinant cells". Trends in Biotechnology. 17 (2): 78–83. doi:10.1016/S0167-7799(98)01250-5. PMID 10087608.
- ^ al-Hendy A, Hortelano G, Tannenbaum GS, Chang PL (February 1995). "Correction of the growth defect in dwarf mice with nonautologous microencapsulated myoblasts--an alternate approach to somatic gene therapy". Human Gene Therapy. 6 (2): 165–175. doi:10.1089/hum.1995.6.2-165. PMID 7734517.
- ^ Dunea G, Kolff WJ (1965). "Clinical Experience with the Yatzidis Charcoal Artificial Kidney". Transactions of the American Society for Artificial Internal Organs. 11: 178–182. doi:10.1097/00002480-196504000-00035. PMID 14329080.
- ^ Bensinger WI, Buckner CD, Clift RA (1985). "Whole blood immunoadsorption of anti-A or anti-B antibodies". Vox Sanguinis. 48 (6): 357–361. doi:10.1111/j.1423-0410.1985.tb00196.x. PMID 3892895. S2CID 12777645.
- ^ Yang L, Cheng Y, Yan WR, Yu YT (2004). "Extracorporeal whole blood immunoadsorption of autoimmune myasthenia gravis by cellulose tryptophan adsorbent". Artificial Cells, Blood Substitutes, and Immobilization Biotechnology. 32 (4): 519–528. doi:10.1081/bio-200039610. PMID 15974179. S2CID 7269229.
- ^ Chang PL (1994). "Calcium phosphate-mediated DNA transfection". In Wolff JA (ed.). Gene Therapeutics. Boston: Birkhauser. pp. 157–179. doi:10.1007/978-1-4684-6822-9_9. ISBN 978-1-4684-6822-9.
- ^ Ponce S, Orive G, Gascón AR, Hernández RM, Pedraz JL (April 2005). "Microcapsules prepared with different biomaterials to immobilize GDNF secreting 3T3 fibroblasts". International Journal of Pharmaceutics. 293 (1–2): 1–10. doi:10.1016/j.ijpharm.2004.10.028. PMID 15778039.
- ^ Kizilel S, Garfinkel M, Opara E (December 2005). "The bioartificial pancreas: progress and challenges". Diabetes Technology & Therapeutics. 7 (6): 968–985. doi:10.1089/dia.2005.7.968. PMID 16386103.
- ^ a b Dixit V, Gitnick G (27 November 2003). "The bioartificial liver: state-of-the-art". The European Journal of Surgery. Supplement. 164 (582): 71–76. doi:10.1080/11024159850191481. PMID 10029369.
- ^ Demetriou AA, Whiting JF, Feldman D, Levenson SM, Chowdhury NR, Moscioni AD, et al. (September 1986). "Replacement of liver function in rats by transplantation of microcarrier-attached hepatocytes". Science. 233 (4769): 1190–1192. Bibcode:1986Sci...233.1190D. doi:10.1126/science.2426782. PMID 2426782.
- ^ Sgroi A, Serre-Beinier V, Morel P, Bühler L (February 2009). "What clinical alternatives to whole liver transplantation? Current status of artificial devices and hepatocyte transplantation". Transplantation. 87 (4): 457–466. doi:10.1097/TP.0b013e3181963ad3. PMID 19307780.
- ^ Liu ZC, Chang TM (March 2002). "Increased viability of transplanted hepatocytes when hepatocytes are co-encapsulated with bone marrow stem cells using a novel method". Artificial Cells, Blood Substitutes, and Immobilization Biotechnology. 30 (2): 99–112. doi:10.1081/bio-120003191. PMID 12027231. S2CID 26667880.
- ^ Pedraz JL, Orive G, eds. (2010). Therapeutic applications of cell microencapsulation (Online-Ausg. ed.). New York: Springer Science+Business Media. ISBN 978-1-4419-5785-6.
- ^ Mattila-Sandholm T, Blum S, Collins JK, Crittenden R, De Vos W, Dunne C, et al. (1 December 1999). "Probiotics: towards demonstrating efficacy". Trends in Food Science & Technology. 10 (12): 393–399. doi:10.1016/S0924-2244(00)00029-7.
- ^ Huang JS, Bousvaros A, Lee JW, Diaz A, Davidson EJ (November 2002). "Efficacy of probiotic use in acute diarrhea in children: a meta-analysis". Digestive Diseases and Sciences. 47 (11): 2625–2634. doi:10.1023/A:1020501202369. PMID 12452406. S2CID 207559325.
- ^ Isolauri E, Arvola T, Sütas Y, Moilanen E, Salminen S (November 2000). "Probiotics in the management of atopic eczema". Clinical and Experimental Allergy. 30 (11): 1604–1610. doi:10.1046/j.1365-2222.2000.00943.x. PMID 11069570. S2CID 13524021.
- ^ Lin MY, Yen CL, Chen SH (January 1998). "Management of lactose maldigestion by consuming milk containing lactobacilli". Digestive Diseases and Sciences. 43 (1): 133–137. doi:10.1023/A:1018840507952. PMID 9508514. S2CID 22890925.
- ^ Gill HS (1 May 1998). "Stimulation of the Immune System by Lactic Cultures". International Dairy Journal. 8 (5–6): 535–544. doi:10.1016/S0958-6946(98)00074-0.
- ^ Aldwell FE, Tucker IG, de Lisle GW, Buddle BM (January 2003). "Oral delivery of Mycobacterium bovis BCG in a lipid formulation induces resistance to pulmonary tuberculosis in mice". Infection and Immunity. 71 (1): 101–108. doi:10.1128/IAI.71.1.101-108.2003. PMC 143408. PMID 12496154.
- ^ Park JH, Um JI, Lee BJ, Goh JS, Park SY, Kim WS, Kim PH (September 2002). "Encapsulated Bifidobacterium bifidum potentiates intestinal IgA production". Cellular Immunology. 219 (1): 22–27. doi:10.1016/S0008-8749(02)00579-8. PMID 12473264.
- ^ Kim HW, Greenburg AG (September 2004). "Artificial oxygen carriers as red blood cell substitutes: a selected review and current status". Artificial Organs. 28 (9): 813–828. doi:10.1111/j.1525-1594.2004.07345.x. PMID 15320945.
- ^ Nelson DJ (1998). "Blood and HemAssistTM (DCLHb): Potentially a complementary therapeutic team". In Chang TM (ed.). Blood Substitutes: Principles, Methods, Products and Clinical Trials. Vol. 2. Basel: Karger. pp. 39–57.
- ^ Burhop KE, Estep TE (2001). "Hemoglobin induced myocardial lesions". Artificial Cells, Blood Substitutes, and Biotechnology. 29 (2): 101–106. doi:10.1080/10731190108951271. PMC 3555357.
- ^ "30th Anniversary in Artificial Red Blood Cell Research". Artificial Cells, Blood Substitutes and Biotechnology. 16 (1–3): 1–9. 1 January 1988. doi:10.3109/10731198809132551.
- ^ Djordjevich L, Miller IF (May 1980). "Synthetic erythrocytes from lipid encapsulated hemoglobin". Experimental Hematology. 8 (5): 584–592. PMID 7461058.
- ^ Hu CM, Zhang L, Aryal S, Cheung C, Fang RH, Zhang L (July 2011). "Erythrocyte membrane-camouflaged polymeric nanoparticles as a biomimetic delivery platform". Proceedings of the National Academy of Sciences of the United States of America. 108 (27): 10980–10985. Bibcode:2011PNAS..10810980H. doi:10.1073/pnas.1106634108. PMC 3131364. PMID 21690347.
- ^ Hammer DA, Robbins GP, Haun JB, Lin JJ, Qi W, Smith LA, et al. (1 January 2008). "Leuko-polymersomes". Faraday Discussions. 139: 129–41, discussion 213–28, 419–20. Bibcode:2008FaDi..139..129H. doi:10.1039/B717821B. PMC 2714229. PMID 19048993.
- ^ a b c "Programmable Artificial Cell Evolution" (PACE)". PACE Consortium.
- ^ "European center for living technology". European Center for Living Technology. Archived from the original on 2011-12-14.
- ^ "Microscale Chemically Reactive Electronic Agents". Ruhr Universität Bochum.
- ^ a b c Grote M (September 2011). "Jeewanu, or the 'particles of life'. The approach of Krishna Bahadur in 20th century origin of life research". Journal of Biosciences. 36 (4): 563–570. doi:10.1007/s12038-011-9087-0. PMID 21857103. S2CID 19551399.
- ^ a b Gupta VK, Rai RK (2013). "Histochemical localisation of RNA-like material in photochemically formed self-sustaining, abiogenic supramolecular assemblies 'Jeewanu'" (PDF). International Research Journal of Science and Engineering. 1 (1): 1–4.
- ^ Caren LD, Ponnamperuma C (1967). A review of some experiments on the synthesis of 'Jeewanu'. NASA Technical Memorandum X-1439. National Aeronautics and Space Administration. CiteSeerX 10.1.1.691.9322. OCLC 761398715.