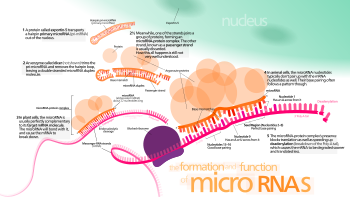
RNA유기사일런트복합체
RNA-induced silencing complexRNA 유도 사일런싱 복합체(RISC)는 다단백질 복합체, 특히 리보핵단백질이며, 전사 [1]및 번역 수준에서 다양한 경로를 통해 유전자 사일런싱에 기능합니다.마이크로RNA(miRNA)와 같은 단일 가닥 RNA(sssRNA) 조각이나 이중 가닥 작은 간섭 RNA(siRNA)를 사용하여 복합체는 유전자 [2]조절의 핵심 도구로서 기능합니다.RNA의 단일 가닥은 RISC가 상보적 메신저 RNA(mRNA) 전사체를 인식하는 템플릿 역할을 합니다.일단 발견되면, RISC의 단백질 중 하나인 Argonaute는 mRNA를 활성화하고 분해한다.이 과정은 RNA 간섭이라고 불리며 많은 진핵생물에서 발견됩니다; 이것은 이중 가닥 RNA의 [3][4][1]존재에 의해 유발되기 때문에 바이러스 감염에 대한 방어에 중요한 과정입니다.
검출
RISC의 생화학적 식별은 콜드 스프링 하버 [5]연구소의 그레고리 해넌과 그의 동료들에 의해 수행되었다.이것은 앤드류 파이어와 2006년 노벨 [3]생리의학상을 공동 수상한 크레이그 멜로에 의해 1998년에 RNA 간섭이 발견된 지 불과 몇 년 후였다.
Hannon과 그의 동료들은 Drosophila 세포에서 dsRNA에 의한 유전자 소음과 관련된 RNAi 메커니즘을 확인하려고 시도했다.드로소필라 S2 세포를 lacZ 발현 벡터로 트랜스펙트하여 β-갈락토시다아제 활성으로 유전자 발현을 정량화하였다.그 결과 대조군 dsRNA에 비해 lacZ dsRNA와의 공동 감염이 β-갈락토시다아제 활성을 유의미하게 감소시켰다.따라서 dsRNA는 배열보완성을 통해 유전자 발현을 조절한다.
그런 다음 S2 세포를 Drosophila cyclin E dsRNA로 트랜스펙트하였다.Cycline E는 S기로의 세포주기 진행에 필수적인 유전자이다.Cyclin E dsRNA는 G 단계(S 단계 이전)에서1 세포 주기를 정지시켰다.따라서 RNAi는 내인성 유전자를 목표로 할 수 있다.
또한 사이클린 E dsRNA는 사이클린 E RNA를 감소시켰을 뿐이며, 세포 주기의2 S, G 및 M 단계에서 작용하는 사이클린 A에 해당하는 dsRNA를 사용해도 유사한 결과가 나타났다.이는 RNAi의 특징적인 특징을 보여준다. 즉, mRNA의 감소된 수준은 추가된 dsRNA의 수준에 해당한다.
감소된 mRNA 수치를 관찰한 것이 mRNA가 직접 표적이 된 결과인지 테스트하기 위해, 드로소필라 S2 세포를 드로소필라 사이클린 E dsRNA 또는 lacZ dsRNA로 트랜스펙트 한 후 사이클린 E 또는 LACZ용 합성 mRNA로 배양했다.
사이클린 E dsRNA에 감염된 세포는 사이클린 E 전사체에서만 열화를 보였으며, lacZ 전사체는 안정적이었다.반대로, lacZ dsRNA로 감염된 세포는 lacZ 전사체에서만 열화를 보였고 사이클린 E 전사체에서는 열화를 보이지 않았다.그들의 결과는 Hannon과 그의 동료들이 RNAi가 '배열 특이적 핵산가수분해효소 활성'을 통해 표적 mRNA를 분해하는 것을 제안하도록 이끌었다.그들은 핵산가수분해효소 [5]RISC라고 불렀다.나중에 데바난드 사르코와 그의 동료 프라산나 K.버지니아 커먼웰스 대학의 Santhekadur와 Byoung Kwon Yoo는 RISC 활성과 암세포의 분자 메커니즘을 설명했고, 그들은 RISC의 또 다른 새로운 성분인 AEG-1[47]을 확인했다.
RNA 간섭의 기능
siRNA/miRNA의 통합
RNase III Dicer는 이중가닥 siRNA 또는 단일가닥 miRNA를 생성함으로써 RNA 간섭 과정을 시작하는 RISC의 중요한 구성원으로, 세포 내에서 dsRNA의 효소적 분할은 2-뉴클레오티드 3'[6][7]의 돌출된 길이로 21-23 뉴클레오티드의 짧은 siRNA 단편을 생성한다.또한 Dicer는 dsRNA를 모방하는 헤어핀 루프 구조를 형성하는 프리-miRNA를 마찬가지로 처리하며, 열역학적 [8][9][10][11]안정성에 기초하여 한쪽 스트랜드를 다른 스트랜드에 대한 가이드 스트랜드로 선택하는 비대칭 규칙 현상에 따라 dsRNA fragment를 RISC에 로드한다.새로 생성된 miRNA 또는 siRNA는 RISC가 [12][13]mRNA를 분해 대상으로 하는 단일 가닥 가이드 시퀀스로 작동합니다.
- 열역학적으로 안정성이 낮은 5' 끝 가닥은 단백질 Argonaute에 의해 선택되고 RISC에 [11][14]통합된다.이 가닥은 가이드 가닥으로 알려져 있으며 mRNA의 열화를 목표로 합니다.
- 다른 한 가닥(승객 가닥)은 RISC에 [15]의해 열화됩니다.
유전자 조절
RISC의 주요 단백질인 Ago2, SND1, AEG-1은 [16]복합체의 유전자 소음 기능에 중요한 역할을 한다.
RISC는 miRNA 또는 siRNA의 가이드 스트랜드를 사용하여 왓슨-크릭 염기쌍을 통해 mRNA 전사의 상보적인 3'-untranslated 영역(3'UTR)을 표적으로 하여 [17][1]다양한 방법으로 mRNA 전사의 유전자 발현을 조절한다.
mRNA 열화
RISC의 가장 잘 알려진 기능은 리보솜에 의해 번역될 수 있는 전사 수준을 감소시키는 표적 mRNA의 분해이다.아르고나이트 단백질에 의한 RISC 가이드 가닥과 상보적인 mRNA의 핵내분열은 RNAi 개시의 [18]핵심이다.mRNA 열화가 이루어지기 위해서는 다음 두 가지 주요 요건이 있습니다.
- 가이드 스트랜드와 표적 mRNA 배열 사이의 거의 완벽한 보완 일치, 그리고,
- 표적 mRNA를 [1]분해하는 '슬라이서'라고 불리는 촉매 활성 아르고나이트 단백질.
분할이 발생하면 mRNA 분해에는 크게 두 가지 경로가 있습니다.둘 다 mRNA의 폴리(A) 꼬리의 분해를 통해 시작되어 mRNA의 5' 캡을 제거합니다.
- 5'~3'의 전사 분해는 [19]P-보디라고 불리는 세포질에서 XRN1 핵산가수분해효소에 의해 일어난다.
- 성적표의 3'에서 5'까지 분해는 엑소좀과 스키 [18]콤플렉스가 수행한다.
번역 억제
RISC는 변환 시 리보솜 및 부속 요소의 부하를 조절하여 결합된 mRNA 트랜스크립트의 발현을 억제할 수 있습니다.트랜슬레이션 억제에서는 가이드스트랜드와 타깃mRNA의 [1]부분적인 시퀀스 일치만 필요합니다.
번역은 시작 단계에서 다음과 같이 규제할 수 있습니다.
- 진핵생물 번역 개시인자(eIF)가 5' cap에 결합하는 것을 방지한다.RISC는 3' 폴리(A) 테일을 데데닐화할 수 있으며, 이는 5'[2][17] 캡을 통해 억제에 기여할 수 있습니다.
- 60S 리보솜 서브유닛이 mRNA에 결합하는 것을 방지하면 [20]번역을 억제할 수 있다.
변환은, 개시 후의 스텝으로 다음의 방법으로 규제할 수 있습니다.
개시와 개시를 통한 변환 억제가 상호 배타적인지에 대해서는 아직 추측이 있습니다.
헤테로크로마틴 생성
일부 RISC는 유전자 궤적에서 헤테로크로마틴을 형성하기 위해 히스톤 메틸전달효소를 모집함으로써 유전자를 직접적으로 겨냥할 수 있다.이러한 RISC는 RNA 유도 전사 사일런싱 복합체(RITS)의 형태를 취합니다.가장 잘 연구된 예는 효모 [1][23][24]RITS입니다.
RITS는 중심색 반복의 인식을 통해 동원체에서 헤테로크로마틴 형성을 지시하는 것으로 나타났다.염색질 배열을 목표로 하는 siRNA(가이드 스트랜드)의 염기쌍화를 통해 히스톤 수식효소를 얻을 [25]수 있다.
메커니즘은 잘 이해되지 않지만 RITS는 초기 mRNA 전달을 저하시킨다.분해된 초기 전사물이 더 많은 siRNA를 [26]생성하기 위해 RNA의존성 RNA 중합효소(RdRp)에 의해 사용되기 때문에 이 메커니즘이 '자기강화 피드백 루프'로 작용한다고 제안되어 왔다.
디카 RNase에 의한 dsRNA 타겟의 siRNA로의 처리는 헤테로크로마틴 형성에 의한 유전자 사일런트 경로를 개시할 수 있다.AGO4로 알려진 아르고나이트 단백질은 이색계 서열을 정의하는 작은 RNA와 상호작용합니다.히스톤메틸전달효소(HMT) H3K9는 히스톤 H3를 메틸화해 메틸화 부위에 크로모도메인 단백질을 모집한다.DNA 메틸화는 헤테로크로마틴 배열이 확립되거나 [27]확산될 수 있기 때문에 유전자의 침묵을 유지한다.
DNA제거
RISC에 의해 생성된 siRNA는 원생동물인 테트라히메나에서 체세포 마크롱핵이 발달하는 동안 DNA를 분해하는 역할을 하는 것으로 보인다.이는 헤테로크로마틴 형성의 후생적 제어와 유사하며 유전자 [27]요소의 침입에 대한 방어로서 암시된다.
S. pombe 및 Arabidopsis의 헤테로크로마틴 형성과 유사하게, Argonaute 패밀리와 관련된 Tetrahymena 단백질은 내부 제거 배열(IES)로 알려진 표적 배열의 DNA 제거를 촉매한다.메틸전달효소 및 크로모도메인 단백질을 사용하여 IES는 헤테로크롬화되어 [27]DNA에서 제거된다.
RISC관련단백질
RISC의 전체 구조는 아직 해결되지 않았다.많은 연구에서 RISC의 다양한 크기와 컴포넌트가 보고되어 왔지만, 그 원인이 RISC 콤플렉스가 다수 존재하기 때문인지, 아니면 연구 결과에 [28]따라 사용되는 소스가 다르기 때문인지는 완전히 확실하지 않습니다.
| 복잡한 | 원천 | 이미 알려진 컴포넌트/외관 컴포넌트 | 예상 크기 | RNAi 경로의 외관 기능 |
|---|---|---|---|---|
| Dcr2-R2D2[29] | D. 멜라노가스터 S2 세포 | DCR2, R2D2 | 최대 250 kDa | dsRNA 처리, siRNA 결합 |
| RLC(A)[30][31] | D. 멜라노가스터 배아 | DCR2, R2D2 | NR | dsRNA 처리, siRNA 결합, RISC 전구체 |
| 홀로[30][31] RISC | D. 멜라노가스터 배아 | 이전 2, Dcr1, Dcr2, Fmr1/Fxr, R2D2, Tsn, Vig | 최대 80S | 표적-RNA 결합 및 절단 |
| RISC[5][32][33][34] | D. 멜라노가스터 S2 세포 | 아고2, Fmr1/Fxr, Tsn, Vig | 최대 500 kDa | 표적-RNA 결합 및 절단 |
| RISC[35] | D. 멜라노가스터 S2 세포 | 아고2 | 최대 140 kDa | 표적-RNA 결합 및 절단 |
| FMR1 관련 복합체[36] | D. 멜라노가스터 S2 세포 | L5, L11, 5S rRNA, Fmr1/Fxr, Ago2, Dmp68 | NR | 가능한 표적-RNA 결합 및 절단 |
| 최소[37][38][39][40] RISC | 헬라 셀 | eIF2C1(Ago1) 또는 eIF2C2(Ago2) | 최대 160 kDa | 표적-RNA 결합 및 절단 |
| miRNP[41][42] | 헬라 셀 | eIF2C2(ago2), Gemin3, Gemin4 | 최대 550 kDa | miRNA 어소시에이션, 타겟-RNA 결합 및 절단 |
이전에는 Argonaute, Dcr, Dicer, 포유동물 p68 RNA 언린다아제의 Dmp68, D. 멜라노가스터 오르솔로그, eIF2C1, 진핵생물 번역 개시인자 2C1, eIF2C2, 진핵생물 번역 개시인자 2C2, Fmr/fxoger, 멜라노가스터 오르솔로그.occal nuclease; Vig, vasa intronic 유전자.
그럼에도 불구하고, 아르고네이트 단백질이 존재하며 기능에 필수적이라는 것은 명백하다.또한 복합체 내 (아르고나이트 외에) 주요 단백질의 일부에 대한 통찰력이 있어 RISC가 그 기능을 수행할 수 있다.
아르고네이트 단백질
아르고나이트 단백질은 원핵생물과 진핵생물에서 발견되는 단백질의 한 종류이다.원핵생물에서 그들의 기능은 알려지지 않았지만 진핵생물에서는 RNAi를 [43]담당한다.인간 아르고네이트에는 8개의 패밀리가 있으며, 그 중 오직 아르고네이트 2만이 RISC의 [40]표적 RNA 분할에 배타적으로 관여한다.
RISC 로딩 복합체
RISC Loading Complex(RLC; RISC 로딩 콤플렉스)는 dsRNA fragment를 RISC에 로드하기 위해 필요한 필수 구조입니다.RLC는 dicer, 트랜스활성화 반응 RNA결합단백질(TRBP) 및 Argonaute 2로 구성됩니다.
- Dicer는 직접 RNAi를 적재할 dsRNA 단편을 생성하는 RNase III 엔도핵산가수분해효소이다.
- TRBP는 세 개의 이중 가닥 RNA 결합 도메인을 가진 단백질이다.
- Argonaute 2는 RNase이며 RISC의 촉매 중심입니다.
Dicer는 TRBP 및 Argonaute 2와 관련지어 Dicer에 의해 생성된 dsRNA fragment의 Argonaute [44][45]2로의 전송을 용이하게 한다.
보다 최근의 연구는 인간 RNA 헬리케이스 A가 RLC를 [46]촉진하는 데 도움을 줄 수 있다는 것을 보여주었다.
기타 단백질
최근에 확인된 RISC의 구성원은 SND1과 MTDH이다.[47] SND1과 MTDH는 종양유전자로 다양한 유전자 [48]발현을 조절한다.
| 단백질 | 단백질이 발견되는 종 |
|---|---|
| DCR1[30] | D. 흑색가스터 |
| DCR2[29][30][31] | D. 흑색가스터 |
| R2D2[30][31] | D. 흑색가스터 |
| 아고2[30][32][35][36] | D. 흑색가스터 |
| Dmp68[36] | D. 흑색가스터 |
| Fmr1/Fxr[30][33][36] | D. 흑색가스터 |
| Tsn[30][34] | D. 흑색가스터 |
| Vig[30][33] | D. 흑색가스터 |
| 폴리리보솜, 리보솜 성분[5][30][32][36][49] | D. 흑색가스터, T. 브루시 |
| eIF2C1(Ago1)[37] | 사피엔스 |
| eIF2C2(Ago2)[37][38][40][42] | 사피엔스 |
| 제민3[41][42] | 사피엔스 |
| 제민4[41][42] | 사피엔스 |
이전에는 Argonaute, Dcr, Dicer, 포유동물 p68 RNA 언린다아제의 Dmp68, D. 멜라노가스터 오르솔로그, eIF2C1, 진핵생물 번역 개시인자 2C1, eIF2C2, 진핵생물 번역 개시인자 2C2, Fmr/fxoger, 멜라노가스터 오르솔로그.
mRNA의 결합
활성화된 RISC 복합체가 세포에서 mRNA 표적을 어떻게 찾는지 아직 불분명하지만, 이 과정은 [50]mRNA에서 진행 중인 단백질 번역 이외의 상황에서 발생할 수 있는 것으로 나타났다.
메타조안에서 내생적으로 발현되는 miRNA는 보통 많은 유전자와 완벽하게 상보적이지 않기 때문에 번역 [51][52]억제를 통해 발현을 조절한다.그러나 식물에서는 mRNA를 대상으로 하는 공정의 특이성이 훨씬 높으며, 보통 각 miRNA는 1개의 mRNA에만 결합한다.특이성이 높을수록 mRNA 분해가 [53]발생할 가능성이 높다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f Pratt AJ, MacRae IJ (2009). "The RNA-induced silencing complex: A versatile gene-silencing machine". Journal of Biological Chemistry. 284 (27): 17897–17901. doi:10.1074/jbc.R900012200. PMC 2709356. PMID 19342379.
- ^ a b Filipowicz W, Bhattacharyya SN, Sonenber N (2008). "Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?". Nature Reviews Genetics. 9 (2): 102–114. doi:10.1038/nrg2290. PMID 18197166. S2CID 11824239.
- ^ a b Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC (1998). "Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans". Nature. 391 (6669): 806–811. Bibcode:1998Natur.391..806F. doi:10.1038/35888. PMID 9486653. S2CID 4355692.
- ^ Watson, James D. (2008). Molecular Biology of the Gene. San Francisco, CA: Cold Spring Harbor Laboratory Press. pp. 641–648. ISBN 978-0-8053-9592-1.
- ^ a b c d Hammond SM, Bernstein E, Beach D, Hannon GJ (2000). "An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells". Nature. 404 (6775): 293–296. Bibcode:2000Natur.404..293H. doi:10.1038/35005107. PMID 10749213. S2CID 9091863.
- ^ Zamore PD, Tuschl T, Sharp PA, Bartel DP (2000). "RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals". Cell. 101 (1): 25–33. doi:10.1016/S0092-8674(00)80620-0. PMID 10778853.
- ^ Vermeulen A, Behlen L, Reynolds A, Wolfson A, Marshall W, Karpilow J, Khvorova A (2005). "The contributions of dsRNA structure to Dicer specificity and efficiency". RNA. 11 (5): 674–682. doi:10.1261/rna.7272305. PMC 1370754. PMID 15811921.
- ^ Hutvagner, Gyorgy (2005). "Small RNA asymmetry in RNAi: Function in RISC assembly and gene regulation". FEBS Letters. 579 (26): 5850–5857. doi:10.1016/j.febslet.2005.08.071. ISSN 1873-3468. PMID 16199039.
- ^ Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD (2003). "Asymmetry in the assembly of the RNAi enzyme complex". Cell. 115 (2): 199–208. doi:10.1016/S0092-8674(03)00759-1. PMID 14567917.
- ^ Khvorova A, Reynolds A, Jayasena SD (2003). "Functional siRNAs and miRNAs exhibit strand bias". Cell. 115 (2): 209–216. doi:10.1016/S0092-8674(03)00801-8. PMID 14567918. S2CID 2500175.
- ^ a b Siomi H, Siomi MC (2009). "On the road to reading the RNA-interference code". Nature. 457 (7228): 396–404. Bibcode:2009Natur.457..396S. doi:10.1038/nature07754. PMID 19158785. S2CID 205215974.
- ^ Preall, Jonathan B.; Sontheimer, Erik J. (2005-11-18). "RNAi: RISC Gets Loaded". Cell. 123 (4): 543–545. doi:10.1016/j.cell.2005.11.006. ISSN 0092-8674. PMID 16286001.
- ^ "RNA interference overview Abcam". www.abcam.com. Retrieved 2021-03-07.
- ^ Preall, Jonathan B.; He, Zhengying; Gorra, Jeffrey M.; Sontheimer, Erik J. (2006-03-07). "Short Interfering RNA Strand Selection Is Independent of dsRNA Processing Polarity during RNAi in Drosophila". Current Biology. 16 (5): 530–535. doi:10.1016/j.cub.2006.01.061. ISSN 0960-9822. PMID 16527750.
- ^ Gregory RI, Chendrimada TP, Cooch N, Shiekhattar R (2005). "Human RISC couples microRNA biogenesis and posttranscriptional gene silencing". Cell. 123 (4): 631–640. doi:10.1016/j.cell.2005.10.022. PMID 16271387.
- ^ Santhekadur, Prasanna K.; Kumar, Divya P. (2020-06-01). "RISC assembly and post-transcriptional gene regulation in Hepatocellular Carcinoma". Genes & Diseases. 7 (2): 199–204. doi:10.1016/j.gendis.2019.09.009. ISSN 2352-3042. PMC 7083748. PMID 32215289.
- ^ a b Wakiyama M, Takimoto K, Ohara O, Yokoyama S (2007). "Let-7 microRNA-mediated mRNA deadenylation and translational repression in a mammalian cell-free system". Genes & Development. 21 (15): 1857–1862. doi:10.1101/gad.1566707. PMC 1935024. PMID 17671087.
- ^ a b ORBAN, TAMAS I.; IZAURRALDE, ELISA (April 2005). "Decay of mRNAs targeted by RISC requires XRN1, the Ski complex, and the exosome". RNA. 11 (4): 459–469. doi:10.1261/rna.7231505. ISSN 1355-8382. PMC 1370735. PMID 15703439.
- ^ Sen GL, Blau HM (2005). "Argonaute2/RISC resides in sites of mammalian mRNA decay known as cytoplasmic bodies". Nature Cell Biology. 7 (6): 633–636. doi:10.1038/ncb1265. PMID 15908945. S2CID 6085169.
- ^ Chendrimada TP, Finn KJ, Ji X, Baillat D, Gregory RI, Liebhaber SA, Pasquinelli AE, Shiekhattar R (2007). "MicroRNA silencing through RISC recruitment of eIF6". Nature. 447 (7146): 823–828. Bibcode:2007Natur.447..823C. doi:10.1038/nature05841. PMID 17507929. S2CID 4413327.
- ^ Petersen CP, Bordeleau ME, Pelletier J, Sharp PA (2006). "Short RNAs repress translation after initiation in mammalian cells". Molecular Cell. 21 (4): 533–542. doi:10.1016/j.molcel.2006.01.031. PMID 16483934.
- ^ Maroney PA, Yu Y, Fisher J, Nilsen TW (2006). "Evidence that microRNAs are associated with translating messenger RNAs in human cells". Nature Structural & Molecular Biology. 13 (12): 1102–1107. doi:10.1038/nsmb1174. PMID 17128271. S2CID 19106463.
- ^ Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal SI, Moazed D (2004). "RNAi-mediated targeting of heterchromatin by the RITS complex". Science. 303 (5658): 672–676. Bibcode:2004Sci...303..672V. doi:10.1126/science.1093686. PMC 3244756. PMID 14704433.
- ^ Verdel A, Jia S, Gerber S, Sugiyama T, Gygi S, Grewal SI, Moazed D (2004). "RITS acts in cis to promote RNA interference-mediated transcription and post-transcriptional silencing". Nature Genetics. 36 (11): 1174–1180. doi:10.1038/ng1452. PMID 15475954.
- ^ Shimada, Yukiko; Mohn, Fabio; Bühler, Marc (2016-12-01). "The RNA-induced transcriptional silencing complex targets chromatin exclusively via interacting with nascent transcripts". Genes & Development. 30 (23): 2571–2580. doi:10.1101/gad.292599.116. ISSN 0890-9369. PMC 5204350. PMID 27941123.
- ^ Sugiyama T, Cam H, Verdel A, Moazed D, Grewal SI (2005). "RNA-dependent RNA polymerase is an essential component of a self-enforcing loop coupling heterochromatin assembly to siRNA production". Proceedings of the National Academy of Sciences of the United States of America. 102 (1): 152–157. doi:10.1073/pnas.0407641102. PMC 544066. PMID 15615848.
- ^ a b c Mochizuki K, Gorovsky MA (2004). "Small RNAs in genome arrangement in Tetrahymena". Current Opinion in Genetics & Development. 14 (2): 181–187. doi:10.1016/j.gde.2004.01.004. PMID 15196465.
- ^ a b c Sontheimer EJ (2005). "Assembly and function of RNA silencing complexes". Nature Reviews Molecular Cell Biology. 6 (2): 127–138. doi:10.1038/nrm1568. PMID 15654322. S2CID 27294007.
- ^ a b Liu Q, Rand TA, Kalidas S, Du F, Kim HE, Smith DP, Wang X (2003). "R2D2, a bridge between the initiation and effector steps of the Drosophila RNAi pathway". Science. 301 (5641): 1921–1925. Bibcode:2003Sci...301.1921L. doi:10.1126/science.1088710. PMID 14512631. S2CID 41436233.
- ^ a b c d e f g h i j Pham JW, Pellio JL, Lee YS, Carthew RW, Sontheimer EJ (2004). "A Dicer-2-dependent 80S complex cleaves targeted mRNAs during RNAi in Drosophila". Cell. 117 (1): 83–94. doi:10.1016/S0092-8674(04)00258-2. PMID 15066284.
- ^ a b c d Tomari Y, Du T, Haley B, Schwarz DS, Bennett R, Cook HA, Koppetsch BS, Theurkauf WE, Zamore PD (2004). "RISC assembly defects in the Drosophila RNAi mutant armitage". Cell. 116 (6): 831–841. doi:10.1016/S0092-8674(04)00218-1. PMID 15035985.
- ^ a b c Hammond SM, Boettcher S, Caudy AA, Kobayashi R, Hannon GJ (2001). "Argonaute2, a link between genetic and biochemical analyses of RNAi". Science. 293 (5532): 1146–1150. doi:10.1126/science.1064023. PMID 11498593. S2CID 5271290.
- ^ a b c Caudy AA, Myers M, Hannon GJ, Hammond SM (2002). "Fragile X-related protein and VIG associate with the RNA interference machinery". Genes & Development. 16 (19): 2491–2496. doi:10.1101/gad.1025202. PMC 187452. PMID 12368260.
- ^ a b Caudy AA, Ketting RF, Hammond SM, Denli AM, Bathoorn AM, Tops BB, Silva JM, Myers MM, Hannon GJ, Plasterk RH (2003). "A micrococcal nuclease homologue in RNAi effector complexes". Nature. 425 (6956): 411–414. Bibcode:2003Natur.425..411C. doi:10.1038/nature01956. PMID 14508492. S2CID 4410688.
- ^ a b Rand TA, Ginalski K, Grishin NV, Wang X (2004). "Biochemical identification of Argonaute 2 as the sole protein required for RNA-induced silencing complex activity". Proceedings of the National Academy of Sciences of the United States of America. 101 (40): 14385–14389. Bibcode:2004PNAS..10114385R. doi:10.1073/pnas.0405913101. PMC 521941. PMID 15452342.
- ^ a b c d e Ishizuka A, Siomi MC, Siomi H (2002). "A Drosophila fragile X protein interacts with components of RNAi and ribosomal proteins". Genes & Development. 16 (19): 2497–2508. doi:10.1101/gad.1022002. PMC 187455. PMID 12368261.
- ^ a b c Martinez J, Patkaniowska A, Urlaub H, Luhrmann R, Tuschl T (2002). "Single-stranded antisense siRNAs guide target RNA cleavage in RNAi". Cell. 110 (5): 563–574. doi:10.1016/S0092-8674(02)00908-X. hdl:11858/00-001M-0000-0012-F2FD-2. PMID 12230974. S2CID 10616773.
- ^ a b Liu J, Carmell MA, Rivas FV, Marsden CG, Thomson JM, Song JJ, Hammond SM, Joshua-Tor L, Hannon GJ (2004). "Argonaute2 is the catalytic engine of mammalian RNAi". Science. 305 (5689): 1437–1441. Bibcode:2004Sci...305.1437L. doi:10.1126/science.1102513. PMID 15284456. S2CID 2778088.
- ^ Martinez J, Tuschl T (2004). "RISC is a 5′ phosphomonoester-producing RNA endonuclease". Genes & Development. 18 (9): 975–980. doi:10.1101/gad.1187904. PMC 406288. PMID 15105377.
- ^ a b c Meister G, Landthaler M, Patkaniowska A, Dorsett Y, Teng G, Tuschl T (2004). "Human Argonaute2 mediates RNA cleavage targeted by miRNAs and siRNAs". Molecular Cell. 15 (2): 1403–1408. doi:10.1016/j.molcel.2004.07.007. PMID 15260970.
- ^ a b c Mourelatos Z, Dostie J, Paushkin S, Sharma A, Charroux B, Abel L, Rappsilber J, Mann M, Dreyfuss G (2002). "miRNPs: a novel class of ribonucleoproteins containing numerous microRNAs". Genes & Development. 16 (6): 720–728. doi:10.1101/gad.974702. PMC 155365. PMID 11914277.
- ^ a b c d Hutvágner G, Zamore PD (2002). "A microRNA in a multiple-turnover RNAi enzyme complex". Science. 297 (5589): 2056–2060. Bibcode:2002Sci...297.2056H. doi:10.1126/science.1073827. PMID 12154197. S2CID 16969059.
- ^ Hall TM (2005). "Structure and function of Argonaute proteins". Cell. 13 (10): 1403–1408. doi:10.1016/j.str.2005.08.005. PMID 16216572.
- ^ Chendrimada TP, Gregory RI, Kumaraswamy E, Norman J, Cooch N, Nishikura K, Shiekhatter R (2005). "TRBP recruits the Dicer complex to Ago2 for microRNA processing and gene silencing". Nature. 436 (7051): 740–744. Bibcode:2005Natur.436..740C. doi:10.1038/nature03868. PMC 2944926. PMID 15973356.
- ^ Wang HW, Noland C, Siridechadilok B, Taylor DW, Ma E, Felderer K, Doudna JA, Nogales E (2009). "Structural insights into RNA processing by the human RISC-loading complex". Nature Structural & Molecular Biology. 16 (11): 1148–1153. doi:10.1038/nsmb.1673. PMC 2845538. PMID 19820710.
- ^ Fu Q, Yuan YA (2013). "Structural insights into RISC assembly facilitated by dsRNA-binding domains of human RNA helices A (DHX9)". Nucleic Acids Research. 41 (5): 3457–3470. doi:10.1093/nar/gkt042. PMC 3597700. PMID 23361462.
- ^ Yoo BK, Santhekadur PK, Gredler R, Chen D, Emdad L, Bhutia S, Pannell L, Fisher PB, Sarkar D (2011). "Increased RNA-induced silencing complex (RISC) activity contributes to hepatocellular carcinoma". Hepatology. 53 (5): 1538–1548. doi:10.1002/hep.24216. PMC 3081619. PMID 21520169.
- ^ Yoo BK, Emdad L, Lee SG, Su Z, Santhekadur P, Chen D, Gredler R, Fisher PB, Sarkar D (2011). "Astrocyte elevated gene (AEG-1): a multifunctional regulator of normal and abnormal physiology". Pharmacology & Therapeutics. 130 (1): 1–8. doi:10.1016/j.pharmthera.2011.01.008. PMC 3043119. PMID 21256156.
- ^ Djikeng A, Shi H, Tschudi C, Shen S, Ullu E (2003). "An siRNA ribonucleoprotein is found associated with polyribosomes in Trypanosoma brucei". RNA. 9 (7): 802–808. doi:10.1261/rna.5270203. PMC 1370447. PMID 12810914.
- ^ Sen GL, Wehrman TS, Blau HM (2005). "mRNA translation is not a prerequisite for small interfering RNA-mediated mRNA cleavage". Differentiation. 73 (6): 287–293. doi:10.1111/j.1432-0436.2005.00029.x. PMID 16138829.
- ^ Saumet A, Lecellier CH (2006). "Anti-viral RNA silencing: do we look like plants?". Retrovirology. 3: 3. doi:10.1186/1742-4690-3-3. PMC 1363733. PMID 16409629.
- ^ Bartel DP (2009). "MicroRNAs: target recognition and regulatory functions". Cell. 136 (2): 215–233. doi:10.1016/j.cell.2009.01.002. PMC 3794896. PMID 19167326.
- ^ Jones-Rhoades MW, Bartel DP, Bartel B (2006). "MicroRNAs and their regulator roles in plants". Annual Review of Plant Biology. 57: 19–53. doi:10.1146/annurev.arplant.57.032905.105218. PMID 16669754.
추가 정보
- Sontheimer, EJ (2005). "Assembly and function of RNA silencing complexes". Nature Reviews Molecular Cell Biology. 6 (2): 127–138. doi:10.1038/nrm1568. PMID 15654322. S2CID 27294007.
- Fu Q, Yuan YA (March 2013). "Structural insights into RISC assembly facilitated by dsRNA-binding domains of human RNA helicase A (DHX9)". Nucleic Acids Research. 41 (5): 3457–70. doi:10.1093/nar/gkt042. PMC 3597700. PMID 23361462.
- Schwarz DS, Tomari Y, Zamore PD (2004). "The RNA-induced silencing complex is a Mg2+-dependent endonuclease". Current Biology. 14 (9): 787–91. doi:10.1016/j.cub.2004.03.008. PMID 15120070.
외부 링크
- 미국 국립의학도서관의 RNA 유도+사일링+복합체(MeSH)