파보바이러스과
Parvoviridae| 파보바이러스과 | |
|---|---|
 | |
| 개 파보바이러스 전자 현미경 사진 | |
| 바이러스 분류 | |
| (순위 미지정): | 바이러스 |
| 영역: | 모노나비리아속 |
| 왕국: | 쇼토쿠비라에 |
| 문: | 코사비리코타 |
| 클래스: | 퀸토비레테스 |
| 주문: | 피코바이러스류 |
| 패밀리: | 파보바이러스과 |
| 속 | |
파르보바이러스는 파르보바이러스과를 구성하는 동물 바이러스 과이다.그들은 전형적으로 NS1이라고 불리는 복제 개시 단백질을 코드하는 두 개의 유전자와 바이러스 캡시드가 만들어지는 단백질을 포함하는 선형 단일 가닥 DNA 게놈을 가지고 있다.게놈의 코드 부분은 복제하는 동안 중요한 헤어핀 고리를 형성하는 양 끝의 텔로미어에 의해 측면으로 배치됩니다.파르보바이러스는 지름이 23~28나노미터로 대부분의 바이러스에 비해 작고 표면이 거친 20면체 캡시드에 둘러싸인 게놈을 포함하고 있다.
파르보바이러스는 세포내구증(endocytosis)에 의해 숙주세포로 들어가 세포가 복제 단계에 들어갈 때까지 기다리는 핵으로 이동한다.이 시점에서 게놈은 코팅되지 않고 부호화 부분이 복제된다.다음으로 바이러스 메신저 RNA(mRNA)가 전사 및 번역되어 NS1이 복제를 시작합니다.복제하는 동안, 머리핀은 반복적으로 펴지고, 복제되고, 다시 감겨지고, 복제의 방향을 바꾸어서 게놈을 따라 앞뒤로 진행되도록 합니다. 굴림 머리핀 복제라고 불리는 과정은 게놈의 수많은 복사본을 포함하는 분자를 생성합니다.자손 ssDNA 게놈은 이 콘크리트로부터 절제되어 캡시드로 포장된다.성숙한 바이러스들은 세포외분열이나 용해에 의해 세포를 떠난다.
파르보바이러스는 NS1과 관련된 복제 개시 단백질을 암호화하고 유사한 복제 메커니즘을 가지고 있기 때문에 루프를 형성하는 원형 게놈을 가진 ssDNA 바이러스의 후손으로 추정된다.비드나바이러스라고 불리는 또 다른 바이러스 그룹은 파르보바이러스의 후예로 보인다.이 과에는 3개의 아과, 26개 속, 126종이 알려져 있다.Parvoviridae는 Piccovirales목의 유일한 과로, Quintoviricetes강의 유일한 과이다.이 분류는 유두종 바이러스, 폴리오마바이러스, 쌍항바이러스도 포함하는 코사비리코타문에 분류된다.
동물의 다양한 질병은 파르보바이러스에 의해 발생한다.특히 개 파보바이러스와 고양이 파보바이러스는 각각 개와 고양이에게 심각한 질병을 일으킨다.돼지의 경우 돼지 파보바이러스가 불임의 주요 원인이다.인간의 파르보바이러스는 덜 심각하며, 가장 주목할 만한 두 가지는 어린이에게 5번째 질병을 포함한 다양한 질병을 일으키는 파르보바이러스 B19와 특히 어린 아이들에게 급성 호흡기 질환의 흔한 원인인 인간 보카바이러스 1이다.의학에서, 유전자 치료 중에 세포핵에 유전자를 전달하기 위한 중요한 벡터가 되었다.
동물성 파르보바이러스는 1960년대에 처음 발견되었는데, 여기에는 파르보바이러스 복제 연구에 자주 사용되는 쥐의 미세한 바이러스가 포함되어 있다.이 기간 동안 많은 AAV가 발견되었고, 시간이 지남에 따라 AAV에 대한 연구가 약의 한 형태로서의 이점을 밝혀냈다.가장 먼저 발견된 병원성 인간 파르보바이러스는 1974년 파보바이러스 B19로 1980년대 들어 다양한 질병과 연관됐다.파르보바이러스는 1971년 파르보 바이러스로 처음 분류됐지만 1975년 가족으로 승격됐다.그들은 바이러스의 작은 바이러스들을 가리키는 '작은' 또는 '작은'을 뜻하는 라틴어 parvum에서 이름을 따왔다.
게놈
파르보바이러스는 길이가 약 4-6 킬로베이스인 선형 단일 가닥 DNA 게놈을 가지고 있다.파르보 바이러스 게놈은 전형적으로 NS/rep 유전자와 VP/cap [1]유전자로 불리는 두 개의 유전자를 포함합니다.NS 유전자는 복제 개시 단백질인 비구조(NS) 단백질 NS1을 코드하고 VP 유전자는 바이러스 캡시드를 구성하는 바이러스 단백질(VP)을 코드한다.NS1은 N 말단 부근에 부위 특이적 결합 활성과 부위 특이적 니킹 활성을 모두 포함하는 HUH 슈퍼 패밀리 핵산가수분해효소 도메인과 C 말단을 향한 슈퍼 패밀리 3(SF3) 헬리케이스 도메인을 포함한다.대부분의 파르보바이러스는 바이러스 촉진제로부터의 전사를 상향 조절하는 C 말단 부근의 전사 활성화 도메인뿐만 아니라 바이러스 라이프 [2]사이클의 다른 측면에 관여하는 소수의 지지 단백질을 코드하는 대체 또는 중복 개방 읽기 프레임을 포함합니다.
게놈의 코드 부분은 머리핀 루프 구조로 접힌 불완전한 회문(palindrome)으로 구성된 길이가 약 116–550 뉴클레오티드(nt)인 말단 배열에 의해 양 끝에 측면으로 배치된다.이러한 헤어핀 루프에는 DNA 복제 및 패키징에 필요한 대부분의 cis-acting 정보가 포함되어 복제 중에 복제 방향을 변경하는 힌지 역할을 합니다.게놈이 이중가닥 형태로 변환되면 머리핀 [2][3]내부 및 그 인접한 염기서열을 포함하는 복제원위치가 생성된다.
성숙한 바이러스온의 게놈 DNA 가닥은 긍정적이거나 부정적일 수 있다.이것은 종마다 다르다. 어떤 것은 한 극성의 포장 가닥을 선호하고, 다른 것은 다양한 비율로 포장하고, 다른 것은 두 감지 가닥을 동일한 비율로 포장하기 때문이다.이러한 선호도는 자손 가닥이 합성되는 효율성을 반영하며, 이는 다시 특정 복제 발생 [2]부위의 효율성을 반영합니다.음의 센스 스트랜드의 3µ 말단(일반적으로 "3개의 프라임 엔드"라고 발음)과 양의 센스 스트랜드의 5µ 말단(일반적으로 "5개의 프라임 엔드"라고 발음)은 왼쪽 말단, 음의 센스 스트랜드의 5µ 말단 및 양의 센스 스트랜드의 3µ 말단은 오른쪽 [2][4][5]말단이라고 불립니다.
구조.
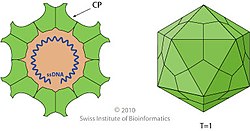
파르보바이러스의 비리온은 지름이 23~28나노미터(nm)이고 단단한 표면과 함께 20면체 형태의 캡시드 안에 둘러싸인 게놈으로 구성됩니다.캡시드는 VP 단백질 배열의 C 말단으로부터 파생된 구조적으로 등가 폴리펩타이드 사슬 60개로 구성되며, 60개의 비대칭, 표면 삼각 단위가 있는 20면체를 형성하기 위해 광범위하게 연동된다.이러한 유닛은 두 정점에서 3배 반지름 대칭을 가지며, 한 정점에서 5배 반지름 대칭을 가지며, 5배 정점에서 반대되는 선에서 2배 반지름 대칭을 가지며, 5배 정점의 점을 둘러싼 2/5 원형 접힘 벽을 가진다.캡시드 당 20개의 3배 정점, 30개의 2배 선, 12개의 5배 정점이 존재하며, 후자는 20면체의 [2]12개 정점에 해당한다.
캡시드 표면의 일반적인 특징은 각 2배축의 함몰부, 3배축을 둘러싼 융기된 돌출부, 5배축의 협곡과 같은 함몰부로 둘러싸인 5개의 베타배럴로[6] 이루어진 융기된 원통형 돌출부 등이다.이들 실린더 각각에는 캡시드의 외부를 내부로 연결하는 구멍이 있어 게놈의 출입을 중개합니다.게놈의 5' 말단에서 나온 약 20개의 뉴클레오티드는 5' 말단에 결합된 NS1의 복사본을 운반하는 캡시드 외부에 노출되어 있을 수 있으며, 이는 게놈이 합성되고 포장되는 [2]방법의 결과이다.
VP 단백질의 다양한 크기는 다른 파르보 바이러스에 대해 발현되며, 작은 VP2-5는 큰 VP1보다 더 높은 빈도로 발현된다.소형 VP는 잘라내기 때문에 N 단자 길이가 다른 공통 C 단자를 공유합니다.VP1의 경우 N 터미널은 복제 사이클에서 중요한 영역을 포함하도록 확장되며 일반적으로 캡시드당 5~10개씩 캡시드에 통합되어 캡시드 [1][2]조립을 담당하는 공통 C 터미널이 있습니다.
각 VP 모노머는 인접한 2개의 역평행 베타 시트에 배치된 8개의 스트랜드 젤리 롤 모티브라고 불리는 코어 베타 바렐 구조를 포함하고 있으며, 개별 스트랜드 뒤에 CHEF와 BIDG로 라벨이 부착되어 있으며, 후자는 캡시드의 내부 표면을 형성하고 있습니다.개별 베타 가닥은 길이, 순서 및 구성이 다양한 루프로 연결되며, 이러한 루프의 대부분은 외부 표면으로 확장되어 파르보바이러스의 고유하고 거친 표면을 제공합니다.관련된 파르보바이러스는 표면 토폴로지를 공유하고 VP단백질은 배열 동일성보다 더 크게 접히므로 캡시드와 캡시드 단백질의 구조는 계통 [1][2]발생의 유용한 지표이다.
라이프 사이클
파르보바이러스는 다양한 세포 수용체를 사용하여 숙주 세포에 결합하면서 세포 내 세포에 침입한다.엔도솜에서는 많은 파르보바이러스가 VP1 N-termini 상의 포스포리파아제 A2(PLA)2 도메인이 노출되어 비리온이 지질양층막을 투과할 수 있도록 배치변화를 일으킨다.바이러스들의 세포내 밀매는 다양하지만, 바이러스들은 결국 핵에 도착하고, 그 안에 있는 게놈은 캡시드에서 분리된다.생쥐의 미소 바이러스(MVM) 연구에 근거해, 게놈은 캡시드의 개구부 중 하나에서 캡시드로부터 3~5인치 방향으로 배출되어, [2]캡시드에 DNA의 5인치 말단이 부착되어 있다.
파르보바이러스는 세포를 S상이라고 불리는 DNA 복제 단계로 유도하는 능력이 없기 때문에 숙주 세포가 스스로 S상으로 진입할 때까지 핵에서 기다려야 한다.이것은 태아 세포와 같이 빠르게 분열하는 세포군을 파르보바이러스를 위한 훌륭한 환경으로 만든다.아데노 관련 바이러스(AAV)는 아데노 바이러스 또는 헤르페스 바이러스일 수 있는 도우미 바이러스에 의존하는데, 이는 코인 감염이 복제를 [2]허용하도록 세포 환경을 변화시키기 때문이다.공감염이 없을 경우 AAV의 게놈은 공감염이 [7]발생할 때까지 숙주 세포의 게놈에 통합된다.S상에 진입한 감염 세포는 바이러스 DNA를 합성하도록 강요당해 S상을 떠날 수 없다.파보바이러스는 감염이 [8]진행됨에 따라 점차적으로 커지는 복제 포시를 핵에 확립한다.
세포가 S상에 들어가 게놈이 코팅되지 않은 후 숙주 DNA 중합효소는 3µ 헤어핀의 3µ 말단을 프라이머로 사용하여 5µ 헤어핀의 [3][7][9]5µ 말단과 연결된 게놈 코드 부분의 상보적인 DNA 스트랜드를 합성한다.NS1을 코드하는 메신저 RNA(mRNA)는 DNA 중합효소에 의해 게놈에서 전사되어 캡 및 폴리아데닐화되어 호스트 리보솜에 의해 번역되어 NS1을 [2][5][10]합성한다.단백질이 여러 개의 공동 선형 프레임에 부호화되면 다른 유전자 [2]생성물을 번역하기 위해 대체 스플라이싱, 차선의 번역 개시 또는 누출 스캔이 사용될 수 있다.
파르보바이러스는 NS1에 의해 시작된 단일 방향의 가닥 치환 형태인 롤링 헤어핀 복제를 통해 게놈을 복제합니다.복제는 NS1이 1개의 머리핀 끝에 있는 듀플렉스 DNA 분자의 복제원사이트에 바인드되어 흠집이 생기면 시작됩니다.Nicking은 절단된 가닥의 3' 말단을 활성 수산기(-OH)로 방출하여 5' [7]말단에 NS1이 부착된 상태로 DNA 합성을 준비합니다[2].이 상처로 인해 인접한 머리핀이 선형으로 펴지고 확장됩니다.3μ-OH에서 NS1의 헬리케이스 활성을 이용하여 복제 포크를 확립하고, DNA 중합효소에 [10][11]의해 확장된 텔로미어를 복제한다.그런 다음 2개의 텔로미어 가닥이 원래 구성으로 다시 결합됩니다. 그러면 복제 포크가 다시 배치되어 템플릿이 다른 가닥으로 전환되고 [12][13]게놈의 반대 방향으로 이동합니다.
파보바이러스는 흰자리가 비슷한지 같은지, 호모텔로미어 파보바이러스라고 불리는지, 아니면 이종탄성 파보바이러스라고 불리는 다른지에 따라 다르다.일반적으로 AAV 및 B19와 같은 동질체 파르보바이러스는 앞서 언급한 과정을 통해 게놈의 양끝을 복제하고, 그들의 머리핀 배열은 더 큰(반전된) 말단 반복에 포함되어 있다.생쥐의 미세한 바이러스(MVM)와 같은 이종탄성 바이러스는 텔로미어의 정확한 방향을 복사할 [15]수 있도록 말단 분해능으로 한쪽 끝을 복제하고 접합 분해능이라고[2][14] 불리는 비대칭 프로세스를 통해 다른 한쪽 끝을 복제합니다.
비대칭 접합 분해 시 이중 확장형 텔로미어는 십자 모양으로 리폴드된다.십자형 오른쪽 팔의 아래쪽 가닥의 복제원점은 NS1에 의해 절단되어 십자형 팔의 아래쪽 팔은 직선적으로 늘어나는 형태로 전개된다.상처 부위에 설치된 복제 포크가 연장된 하부 암을 아래로 이동시켜 하부 암의 시퀀스를 복사한다.그런 다음 하부 암의 두 가닥을 다시 접어서 복제 포크의 위치를 조정하여 반대쪽 끝으로 되돌아가 프로세스에서 [16]상부 가닥을 바꿉니다.
머리핀 복제의 앞뒤로 이어지는 종단 간 패턴은 게놈의 [2][3]여러 복사본을 포함하는 콘센트머를 생성합니다.NS1은 주기적으로 이 분자에 흠집을 내고 말단 분해능과 접합 분해능의 조합을 통해 게놈의 개별 가닥을 콘크리트에서 [9][13]제거한다.절제된 게놈은 향후 복제를 위해 재활용되거나 자손 캡시드로 [7]포장될 수 있다.VP 단백질을 포함한 mRNA의 번역은 이러한 빈 캡시드로 [8]조립되는 핵에 캡시드 단백질의 축적을 이끈다.
게놈은 캡시드의 꼭지점 중 하나에 캡슐화되어 있으며,[2][5] 잠재적으로 게놈을 추출하는 데 사용되는 포털 반대쪽의 꼭지점에 캡슐화되어 있습니다.일단 완전한 비리온이 구성되면, 그것들은 핵이 붕괴되기 전에 핵에서 세포 외부로 내보내질 수 있다.감염의 후반부에 숙주 세포 환경의 혼란이 발생할 수도 있습니다.이것은 괴사 또는 세포자멸을 통해 세포 용해를 유발하며,[2][8] 이것은 바이러스들을 세포 밖으로 방출한다.
진화
파보바이러스는 고리를 이루는 원형 게놈을 가진 ssDNA 바이러스의 후예로 추정되는데, 이는 굴림 머리핀 복제와 유사한 원형 복제를 통해 복제된다.이러한 원형 ssDNA 바이러스는 HUH 엔도핵산가수분해효소 도메인 및 SF3 헬리케이스 [17]도메인 등 파르보바이러스의 복제 개시 단백질과 관련된 많은 특성을 가진 복제 개시 단백질을 암호화합니다.이러한 다른 복제 개시 단백질과 대조적으로 NS1은 롤링 서클 [8]복제의 핵심 부분인 결찰을 수행할 수 있는 흔적만을 보여준다.선형의 ssDNA 바이러스이기도 한 Bidnaviridae 과는,[17] 그 게놈이 Varidnaviria 영역의 바이러스와 관련된 DNA 트랜스포존의 일종인 Polinton의 게놈에 통합된 파보 바이러스의 후손으로 보인다.
SF3 헬리케이스의 계통발생학적 분석에 따르면 파르보바이러스는 진화사 초기에 두 갈래로 갈라졌으며, 그 중 하나는 하마파르보바이러스아과에 속하는 바이러스를 포함하고 있다.다른 한 가지는 다른 두 개의 아과인 덴소비리아과와 파르보비리아과로 [18]나뉘었다.Hamaparvovirinae 계통의 파르보바이러스는 모두 이질체질체이고, Densovirinae는 동질체질체이며, Parvovirinae는 다양하다.[2]텔로미어 염기서열은 상당한 복잡성과 다양성을 가지고 있으며, 이는 많은 종들이 추가적인 기능을 [7][10]수행하기 위해 텔로미어 염기서열을 함께 선택했음을 시사한다.파르보바이러스는 또한 유전자 돌연변이와 [2][9]재조합의 높은 비율을 가진 것으로 여겨진다.
분류
파르보바이러스는 파르보바이러스과를 구성한다.이 과는 퀸토비레아목의 유일한 과로, 퀸토비레목의 유일한 과이다.Quintoviricetes는 유두종 바이러스, 폴리오마바이러스, 비드나바이러스를 포함하는 Cossaviricota문에 속한다.코사비리코타는 모노나비리아 왕국에 속하는 쇼토쿠비라이 왕국에 포함된다.Parvoviridae는 Baltimore 분류 체계에서 그룹 II: ssDNA 바이러스에 속하며, mRNA 합성 방식에 따라 바이러스를 그룹화합니다.Parvoviridae에는 2020년 현재 3개의 아과, 26개 속, 126종이 알려져 있다(virinae는 아과를, -virus는 [18][19]속함을 나타낸다).
- 덴소바이러스과(11속, 21종)
- 아쿠암비덴소바이러스(3종)
- 블라탐비덴소바이러스(1종)
- 디시암비덴소바이러스(1종)
- 헤미암비덴소바이러스(2종)
- 이테라덴소바이러스(5종)
- 미니암비덴소바이러스(1종)
- 머스코덴소바이러스(1종)
- 페푸암비덴소바이러스(1종)
- 프로토암비덴소바이러스(2종)
- 진두암비덴소바이러스(3종)
- 테투암비덴소바이러스(1종)
- 하마파르보바이러스과 (5속, 21종)
- 브레비하마파르보바이러스(2종)
- 차파마파보바이러스(16종)
- 헤판하마파르보바이러스(1종)
- 이치타마파르보바이러스(1종)
- 펜스틸하마파르보바이러스(1종)
- 파보바이러스과 (10속 84종)
- 암도파보바이러스(5종)
- 아티파르보바이러스(1종)
- 아베파보바이러스(3종)
- 보카파르보바이러스(28종)
- 코피파보바이러스(7종)
- Dependoparvirus (11종)
- 에리트로파르보바이러스(7종)
- 로리파르보바이러스(1종)
- 프로토파보바이러스(15종)
- 테트라파르보바이러스(6종)
파르보바이러스는 단백질 배열의 최소 85%를 공유하면 같은 종에 배정된다.NS1 및 SF3 헬리케이스 도메인의 계통 발생과 NS1 배열 동일성 및 커버리지의 유사성에 기초하여 종은 한 속에서 함께 그룹화된다.만약 이러한 기준이 충족되지 않는다면, 공통의 조상이 뒷받침된다면 속은 여전히 확립될 수 있다.Densovirinae의 바이러스는 무척추동물을 감염시키고, Hamaparvirinae의 바이러스는 무척추동물을 감염시키며, Parvirinae의 바이러스는 척추동물을 [18]감염시킨다.
질병
인간에게 일으키는 질병은 가장 저명한 parvoviruses 있parvovirus B19과 인간 bocavirus 1.B19 감염은 종종 방법 중의 특징적 발진으로 인해 아이들이 다섯째 질병,immunocompromised명과 hemoglobinopathies,[20]내부 사람들에서 지속적인 빈혈 등 다양한 분야에서 드러낼 수 있증상이 없다. tran심각한 재생불량 위기, 임산부의 태아 수경, 관절염 등이 있습니다.인간 보카바이러스 1은 급성 호흡기 감염의 흔한 원인이며, 특히 어린 아이들에게서 쌕쌕거리는 것은 흔한 증상이다.인간의 다른 질병과 관련된 다른 파르보바이러스에는 인간 파르보바이러스 4와 인간 부파바이러스가 포함되지만, 이들 바이러스가 질병을 일으키는 방법은 [6]불분명하다.
인간의 파르보 바이러스와는 대조적으로 프로토파르보 바이러스속의 육식동물 감염 바이러스는 더 생명을 [2]위협한다.개 파보바이러스는 개에게 심각한 질병을 유발하며, 가장 흔한 증상은 출혈성 장염으로, 강아지의 사망률은 최대 70%이지만 보통 [21]성인의 사망률은 1% 미만이다.고양이 [22]파보바이러스는 고양이에게 범백혈구감소증과 [23][24]함께 심각한 질병을 일으킨다.돼지의 경우 돼지 파보바이러스는 태아의 [25]사망으로 이어지는 경우가 많아 불임의 주요 원인이다.
약에 사용
아데노 관련 바이러스는 단일 돌연변이에 의한 것과 같은 유전적인 질병을 치료하기 위한 유전자 치료의 중요한 매개체가 되었다.재조합 AAV(rAAV)는 바이러스 캡시드를 포함하고 있지만 완전한 바이러스 게놈이 없다.대신 캡시드에 포장된 전형적인 핵산은 프로모터 영역, 관심 유전자 및 터미네이터 영역을 포함하며, 모두 바이러스 게놈에서 파생된 2개의 반전 말단 반복 내에 포함되어 있습니다.rAAV는 본질적으로 세포막을 통과하여 핵산 화물을 [26][27]핵으로 전달할 수 있는 용기 역할을 합니다.
역사
파르보바이러스는 크기가 작기 때문에 다른 저명한 바이러스군에 비해 상대적으로 늦게 발견되었다.1950년대[28] 후반과 1960년대에,[29] [30]쥐의 미세한 바이러스를 포함한 다양한 동물 파르보바이러스가 발견되었고, 이 바이러스는 이후 굴림 머리핀 [31]복제를 연구하는데 널리 사용되어 왔다.이[32] 기간 동안 많은 AAV가 발견되었고 이에 대한 연구는 1980년대에 유전자 치료에서 그들의 첫 번째 사용을 이끌었다.시간이 지남에 따라 벡터 설계와 같은 측면의 개선으로 인해 특정 AAV 유전자 치료 제품이 2008년에 임상 효과에 도달하고 다음 해에 [27]승인되었습니다.
1974년, 이본 코사르트 등에 의해 최초의 병원성 인간 파르보바이러스가 발견되었다.B형 간염 바이러스의 표면 항원 검사에서 혈청 샘플 1개가 이상 소견을 보였으며 전자 현미경 검사에서 동물성 파르보바이러스와 유사한 바이러스가 검출되었다.이 바이러스는 패널 [20][33]B의 19번인 혈청 샘플을 코드화한 후 B19로 명명되었습니다.B19는 이후 1985년 국제바이러스분류위원회(ICTV)에 의해 종으로 인정받았고, 1980년대 내내 다양한 [33]질병과 점점 더 연관되게 되었다.
1971년 ICTV의 첫 번째 보고서에서 파르보바이러스는 [30][32]파르보바이러스속으로 분류되었다.그들은 1975년에 가족으로 승격되었고 2019년까지 상위 분류군에 배정되지 않은 채 남아 있다가 최고 등급인 [34]왕국에까지 상위 분류군에 배정되었다.이 과는 2019년에 Densovirinae와 Parvovirinae 사이의 "전통적인" 무척추동물-버테동물의 구별에서 벗어나 헬리케이스 계통발생을 기반으로 아과를 구별하여 새로운 아과인 Hamaparvirinae의 [18]설립으로 이어졌다.
어원학
파르보바이러스는 다른 대부분의 바이러스에 비해 작은 크기의 파르보 바이러스 바이러스들을 [2][20]지칭하는 라틴어 파르부스 또는 파르붐에서 이름을 따왔다.Parvoviridae라는 이름에서 -viridae는 바이러스 [35]계열에 사용되는 접미사입니다.피코비랄레스목은 이탈리아어로 작은 것을 뜻하는 피콜로(piccolo)에서 이름의 첫 부분을 따왔으며, 두 번째 부분은 바이러스 명령에 사용되는 접미사다.퀸토바이러스는 갈리시아어 'quinto'(5번째)에서 파보바이러스 B19에 의한 5번째 질병(에리세마 감염증)과 바이러스 [17]분류에 사용되는 접미사인 'viricetes'를 지칭하는 'viricetes'에서 이름의 첫 부분을 따왔다.
레퍼런스
- ^ a b c Mietzsch M, Pénzes JJ, Agbandje-McKenna M (20 April 2019). "Twenty-Five Years of Structural Parvovirology". Viruses. 11 (4): 362. doi:10.3390/v11040362. PMC 6521121. PMID 31010002.
- ^ a b c d e f g h i j k l m n o p q r s t u Cotmore SF, Agbandje-McKenna M, Canuti M, Chiorini JA, Eis-Hubinger AM, Hughes J, Mietzsch M, Modha S, Ogliastro M, Pénzes JJ, Pintel DJ, Qiu J, Soderlund-Venermo M, Tattersall P, Tijssen P (March 2019). "ICTV Virus Taxonomy Profile: Parvoviridae". J Gen Virol. 100 (3): 367–368. doi:10.1099/jgv.0.001212. PMC 6537627. PMID 30672729. Retrieved 24 January 2021.
- ^ a b c Kerr, Cotmore & Bloom 2005, 페이지 177.
- ^ Kerr, Cotmore & Bloom 2005, 페이지 172.
- ^ a b c Cotmore SF, Tattersall P (1 February 2013). "Parvovirus diversity and DNA damage responses". Cold Spring Harb Perspect Biol. 5 (2): a012989. doi:10.1101/cshperspect.a012989. PMC 3552509. PMID 23293137.
- ^ a b Qiu J, Söderlund-Venermo M, Young NS (January 2017). "Human Parvoviruses". Clin Microbiol Rev. 30 (1): 43–113. doi:10.1128/CMR.00040-16. PMC 5217800. PMID 27806994.
- ^ a b c d e Cotmore SF, Tattersall P (1996). "Parvovirus DNA replication" (PDF). Cold Spring Harbor Monograph Archive. 31: 799–813. doi:10.1101/0.799-813 (inactive 31 July 2022). Retrieved 24 January 2021.
{{cite journal}}: CS1 유지 : 2022년 7월 현재 DOI 비활성화 (링크) - ^ a b c d Kerr, Cotmore & Bloom 2005, 페이지 175.
- ^ a b c Martin DP, Biagini P, Lefeuvre P, Golden M, Roumagnec P, Varsani A (September 2011). "Recombination in eukaryotic single stranded DNA viruses". Viruses. 3 (9): 1699–1738. doi:10.3390/v3091699. PMC 3187698. PMID 21994803.
- ^ a b c Kerr, Cotmore & Bloom 2005, 페이지 173.
- ^ Kerr, Cotmore & Bloom 2005, 페이지 180.
- ^ Kerr, Cotmore & Bloom 2005, 페이지 179.
- ^ a b Kerr, Cotmore & Bloom 2005, 페이지 181.
- ^ Kerr, Cotmore & Bloom 2005, 페이지 171–172, 177, 179.
- ^ Kerr, Cotmore & Bloom 2005, 페이지 182.
- ^ Kerr, Cotmore & Bloom 2005, 페이지 182–184.
- ^ a b c Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH (18 October 2019). "Create a megataxonomic framework, filling all principal taxonomic ranks, for ssDNA viruses" (docx). ICTV. Retrieved 24 January 2021.
- ^ a b c d Penzes JJ, Soderlund-Venermo M, Canuti M, Eis-Huebinger AM, Hughes J, Cotmore SF. "Re-organize the family Parvoviridae" (docx). ICTV. Retrieved 24 January 2021.
- ^ "Virus Taxonomy: 2020 Release". International Committee on Taxonomy of Viruses (ICTV). March 2021. Retrieved 10 May 2021.
- ^ a b c Fonseca EK (February 2018). "Etymologia: Parvovirus". Emerg Infect Dis. 24 (2): 293. doi:10.3201/eid2402.ET2402. PMC 5782889.
- ^ Decaro N, Buonavoglia C (24 February 2012). "Canine parvovirus--a review of epidemiological and diagnostic aspects, with emphasis on type 2c". Vet Microbiol. 155 (1): 1–12. doi:10.1016/j.vetmic.2011.09.007. PMC 7173204. PMID 21962408.
- ^ Cotmore SF, McKenna MA, Chiorini JA, Gatherer D, Mukha DV, Pintel DJ, Qiu J, Soderland-Venermo M, Tattersall P, Tijssen P. "Rationalization and extension of the taxonomy of the family Parvoviridae" (PDF). ICTV. Retrieved 24 January 2021.
- ^ Parrish CR (March 1995). "Pathogenesis of feline panleukopenia virus and canine parvovirus". Baillieres Clin Haematol. 8 (1): 57–71. doi:10.1016/s0950-3536(05)80232-x. PMC 7134857. PMID 7663051.
- ^ "Feline panleukopenia". American Veterinary Medical Association. Retrieved 24 January 2021.
- ^ Mészáros I, Olasz F, Cságola A, Tijssen P, Zádori Z (20 December 2017). "Biology of Porcine Parvovirus (Ungulate parvovirus 1)". Viruses. 9 (12): 393. doi:10.3390/v9120393. PMC 5744167. PMID 29261104.
- ^ Naso MF, Tomkowicz B, Perry WL, Strohl WR (August 2017). "Adeno-Associated Virus (AAV) as a Vector for Gene Therapy". BioDrugs. 31 (4): 317–334. doi:10.1007/s40259-017-0234-5. PMC 5548848. PMID 28669112.
- ^ a b Wang D, Tai PW, Gao G (May 2019). "Adeno-associated virus vector as a platform for gene therapy delivery". Nat Rev Drug Discov. 18 (5): 358–378. doi:10.1038/s41573-019-0012-9. PMC 6927556. PMID 30710128.
- ^ Kilham L, Olivier LJ (April 1959). "A latent virus of rats isolated in tissue culture". Virology. 7 (4): 428–437. doi:10.1016/0042-6822(59)90071-6. PMID 13669314.
- ^ "Parvovirus". Stanford University. Retrieved 24 January 2021.
- ^ a b "ICTV Taxonomy history: Rodent protoparvovirus 1". ICTV. Retrieved 24 January 2021.
- ^ Kerr, Cotmore & Bloom 2005, 페이지 171-185.
- ^ a b "ICTV Taxonomy history: Adeno-associated dependoparvovirus A". ICTV. Retrieved 24 January 2021.
- ^ a b Heegaard ED, Brown KE (July 2002). "Human parvovirus B19". Clin Microbiol Rev. 15 (3): 485–505. doi:10.1128/cmr.15.3.485-505.2002. PMC 118081. PMID 12097253.
- ^ "ICTV Taxonomy history: Parvoviridae". ICTV. Retrieved 24 January 2021.
- ^ "ICTV Code". ICTV. Retrieved 24 January 2021.
참고 문헌
- Kerr J, Cotmore S, Bloom ME (25 November 2005). Parvoviruses. CRC Press. pp. 171–185. ISBN 9781444114782.