모델 지질 이중층
Model lipid bilayer모델 지질 이중층은 천연 세포막의 이중층 또는 핵과 같은 다양한 아세포 구조를 덮는 것과 대조적으로 시험관 내에서 조립된 이중층이다.그것들은 단순화되고 잘 통제된 환경에서 생물학적 막의 기본 특성을 연구하기 위해 사용되며, 인공 [1]세포 구축을 위한 상향식 합성 생물학에서 점점 더 많이 사용되고 있다.모델 이중층은 합성지질 또는 천연지질 중 하나로 만들 수 있다.가장 단순한 모델 시스템은 단일 순수 합성 지질만을 포함합니다.여러 합성지질 또는 천연지질의 혼합물을 사용하여 보다 생리적으로 관련된 모델 이중층을 만들 수 있습니다.
모델 이중층에는 여러 가지 유형이 있으며, 각각 실험적인 장점과 단점이 있습니다.최초로 개발된 시스템은 흑색 지질막 또는 "도색된" 이중층이었는데, 이는 양층층의 전기적 특성을 단순하게 나타낼 수 있지만 수명이 짧고 작업하기가 어려울 수 있습니다.지지된 이중층은 고체 기판에 고정되어 안정성을 높이고 벌크 솔루션에서는 불가능한 특성화 도구를 사용할 수 있습니다.이러한 장점은 막 단백질을 변성시킬 수 있는 원치 않는 기질 상호작용의 대가를 치른다.
흑지질막(BLM)
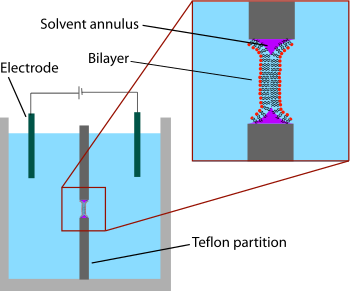
가장 먼저 개발된 모델 이중층 시스템은 "검은 지질막"으로도 알려진 "도색된" 이중층이었다.'도색'이란 이층들이 만들어지는 과정을 말한다.우선 테프론 등의 소수성 재료의 얇은 층에 작은 개구부를 형성한다.일반적으로 이 구멍의 지름은 수십 마이크로미터에서 수백 마이크로미터까지입니다.BLM을 형성하기 위해서는 먼저 브러시, 주사기 또는 유리 [2]어플리케이터를 사용하여 구멍에 이 용액을 도포하여 소수성 용매에 용해된 지질 용액으로 구멍 주변을 "사전 도장"합니다.사용되는 용제는 분할 계수가 매우 높아야 하며 즉각적인 파열을 방지하기 위해 상대적으로 점성이 있어야 한다.가장 일반적으로 사용되는 용제는 데칸과 스쿠알렌의 혼합물이다.
개구부를 건조시킨 후 챔버 양쪽에 소금용액(수상)을 첨가한다.그런 다음 조리개를 지질 용액(일반적으로 사전 도장에 사용된 용액과 동일)으로 "도색"합니다.지질/용제액적 중 한쪽 유기상과 수용상 사이의 계면에 지질단분자가 자발적으로 형성된다.개구부의 벽은 소수성이기 때문에 지질/용제 용액이 이 계면을 적셔 중앙의 물방울이 얇아집니다.액적 양면이 충분히 가까워지면 지질 단분자가 융합하여 소량의 용액을 신속하게 배제합니다.이 시점에서 개구부의 중앙에는 이중층이 형성되지만, 주변에는 상당한 용제 고리가 남아 있다.이 고리는 개구부가 [3]만들어지는 마이크로미터 두께 시트 10s와 ~5 nm의 이중층 사이의 가교 역할을 하여 안정성을 유지하기 위해 필요합니다.
'블랙' 이중층이란 막 두께가 수 나노미터에 불과해 반사광이 어둡기 때문에 뒷면에서 반사되는 빛이 전면에서 반사되는 빛을 파괴적으로 방해한다는 것을 말한다.사실, 이것은 이 기술이 분자 규모의 [4]두께의 막을 만든 최초의 단서 중 하나였다.검은색 지질막은 또한 전기 특성에 매우 적합합니다. 왜냐하면 이중층으로 분리된 두 개의 챔버에 모두 접근할 수 있기 때문에 큰 전극을 쉽게 배치할 수 있기 때문입니다.이러한 이유로 전기적 특성은 도장된 지질 이중층과 함께 사용되는 가장 중요한 방법 중 하나입니다.간단한 측정은 온전한 양층에는 저항(>GΩ)과 캐패시턴스(~2µF/cm2)가 크기 때문에 양층층이 형성될 때와 파손될 때를 나타낸다.전압 게이트 이온 채널의 연구에서 더욱 발전된 전기적 특성은 특히 중요했습니다.이온 채널과 같은 막 단백질은 유기 용매에 담그면 단백질이 변성되기 때문에 형성 중에 도장된 이중층에 직접 통합될 수 없습니다.대신, 단백질은 세제로 가용화되어, 이층 형성 후에 수용액에 첨가된다.세제 코팅은 이러한 단백질이 몇 분 동안 이층 안에 자발적으로 삽입되도록 합니다.또한 흑색 [5]지질막의 전기생리학 및 구조 연구를 결합한 초기 실험이 수행되었습니다.BLM 기술의 또 다른 변형인 쌍층 펀치에서는 작은 [6][7]막 패치를 분리하기 위해 유리 피펫(내경~10~40µm)을 쌍층 한쪽 전극으로 사용한다.이 패치 클램프 기술을 변경하면 준비 시간을 추가로 들여 높은 잠재력(최대 600mV)에서도 저소음 녹음이 가능합니다.
도장된 이중층과 관련된 주요 문제는 잔류 용매와 제한된 수명입니다.일부 연구자들은 두 층의 전단 사이에 끼인 용제 주머니가 정상적인 단백질 기능을 방해할 수 있다고 믿고 있다.이러한 한계를 극복하기 위해 Montal과 Mueller는 무거운 비휘발성 용제의 사용을 제거하는 수정된 증착 기술을 개발했습니다.이 방법에서는 개구부가 수면 위에서 시작하여 두 개의 유체 챔버를 완전히 분리합니다.각 챔버 표면에는 클로로포름 등의 휘발성 용매에 지질류를 도포하고 용매가 증발하기를 기다려 단분자를 형성한다.그런 다음 개구부는 공기-수 인터페이스를 통해 낮아지고, 분리된 챔버의 두 단층층이 서로 접히면서 [8]개구부를 가로지르는 이중층을 형성합니다.안정성 문제는 해결하기가 더 어려운 것으로 판명되었다.일반적으로 검은 지질막은 장기간의 실험을 배제하면서 1시간 이내에 생존한다.이 수명은 지지 [9]개구부를 정밀하게 구조화하거나, 화학적으로 지질과 가교하거나, 주변 용액을 겔화하여 양층층을 [10]기계적으로 지지함으로써 연장할 수 있습니다.이 지역에서는 작업이 진행 중이며 몇 시간의 수명이 실현될 것입니다.
서포트되는 지질양층(SLB)
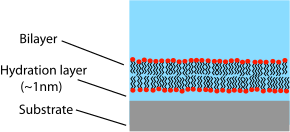
지지된 이중층은 밀폐된 셸에 감겨 있는 베시클 또는 세포막과 달리 고체 지지대 위에 놓인 평면 구조이다.이 때문에 이중층 윗면만 유리용액에 노출된다.이 레이아웃에는 지질 이중층 연구와 관련된 장점과 단점이 있습니다.지지된 이중층의 가장 큰 장점 중 하나는 안정성입니다.SLB는 높은 유량이나 진동에 노출되어도 대부분 그대로 유지되며, 검은색 지질막과 달리 구멍이 있다고 해서 전체 이중층이 파괴되는 것은 아닙니다.이러한 안정성 때문에 BLM 실험은 보통 [11]몇 시간으로 제한되는 반면 지지된 양층에서는 몇 주 또는 몇 개월 동안 지속할 수 있습니다.지원되는 이중층의 또 다른 장점은 평평한 단단한 표면에 있기 때문에 자유롭게 부유하는 샘플에서 수행될 경우 불가능하거나 낮은 분해능을 제공할 수 있는 많은 특성화 도구에 적응할 수 있다는 것입니다.
이 장점의 가장 명확한 예 중 하나는 샘플과 직접 물리적 상호작용을 필요로 하는 기계적 프로브 기법의 사용이다.원자력현미경법(AFM)은 지질상 분리,[12] 단일 단백질 분자 [13]흡착에 이은 막간 나노입자 형성, 그리고 표지 염료 없이도 nm 이하의 정확도로 단백질[14] 조립을 이미지화하기 위해 사용되어 왔다.최근 AFM은 단일 이중층의[15] 기계적 특성을 직접 조사하고 개별 막 [16]단백질에 대한 힘 스펙트럼 분석을 수행하기 위해 사용되었습니다.세포나 소포의 표면이 비교적 부드럽고 시간이 지남에 따라 표류하고 변동하기 때문에 지지된 양층층을 사용하지 않으면 이러한 연구는 어렵거나 불가능할 것이다.물리 탐침의 또 다른 예는 양층 [17]표면에서의 결합 동력을 연구하기 위해 석영 결정 마이크로 밸런스(QCM)를 사용하는 것이다.이중 편파 간섭계는 QCM [18]측정에 대한 보완 데이터를 제공하는 상호작용 또는 위상 전이 중 지질 이중층의 순서와 교란을 특징짓기 위한 고해상도 광학 도구이다.
현대의 많은 형광 현미경 기법들은 또한 단단하게 지지된 평면 표면을 필요로 한다.TIRF(Total Internal Reflection 형광 현미경 검사) 및 표면 플라스몬 공명(SPR)과 같은 에버넨트 현장 방법은 분석물 결합 및 이중층 광학 특성에 매우 민감한 측정을 제공할 수 있지만 샘플이 특수 광학 기능성 물질에서 지원되는 경우에만 작동합니다.지지된 양층에만 적용되는 다른 종류의 방법은 형광 간섭 조영 현미경(FLIC) 및 반사 간섭 조영 현미경(RICM) 또는 간섭 산란 현미경(iSCAT)[19][20]과 같은 광학 간섭에 기초한 방법이다.반사 표면 위에 이중층이 지지되면 이 인터페이스의 파괴적 간섭으로 인한 강도 변화를 사용하여 이중층 [21]내 불소 포자의 위치를 정확하게 계산할 수 있습니다.evanent 및 간섭 기술은 모두 1차원(z 또는 수직)에서만 하위 파장 분해능을 제공합니다.대부분의 경우 이 해결 방법만 있으면 됩니다.결국, 이중층은 한 차원에서만 매우 작습니다.가로로, 이중층은 많은 마이크로미터 또는 심지어 밀리미터까지 연장될 수 있습니다.그러나 동적 위상 재배열과 같은 특정 현상은 수평 서브 마이크로미터 길이 척도의 이중층에서 발생합니다.이러한 구조를 연구하기 위한 유망한 접근법은 Near field scanning optical microscopy(NSOM)[22]입니다.AFM과 마찬가지로 NSOM은 매우 국소적인 신호를 제공하기 위해 마이크로머신 팁의 스캔에 의존합니다.그러나 AFM과 달리 NSOM은 샘플과의 물리적 상호작용이 아닌 광학적 상호작용을 사용하여 섬세한 구조를 덜 교란시킬 수 있습니다.
지지된 이중층의 또 다른 중요한 기능은 동일한 기판 상에 여러 개의 격리된 영역을 생성하기 위해 표면을 패턴화하는 능력이다.이 현상은 스크래치 또는 금속 "코랄"을 사용하여 처음 입증되었으며, 인접한 영역 간의 혼합을 방지하면서도 한 [23][24]영역 내에서 자유롭게 확산할 수 있습니다.이후 연구는 미세유체학을 통합하여 안정된 조성 구배를 양층 [25]내에서 형성할 수 있다는 것을 증명함으로써 이 개념을 확장하여 잠재적으로 인공 지질막에 대한 위상 분리, 분자 결합 및 세포 반응에 대한 대규모 병렬 연구를 가능하게 했다.코랄 개념의 창조적 활용은 또한 시냅스 [26]계면에서 막 단백질의 동적 재구성에 대한 연구를 가능하게 했다.
지지된 이중층의 주요 한계 중 하나는 기판과의 원치 않는 상호작용의 가능성입니다.지지된 이중층은 일반적으로 기판 표면에 직접 접촉하지 않지만 매우 얇은 물 간격에 의해 분리됩니다.이 간격의 크기와 성질은 기질[27] 재료와 지질 종류에 따라 다르지만, 일반적으로 가장 일반적인 실험 [28][29]시스템인 실리카에서 지원되는 zwitterionic 지질은 약 1nm입니다.이 층은 매우 얇기 때문에 이중층과 기판 사이에 광범위한 유체역학적 결합이 있어 지지된 이중층의 확산계수가 동일한 조성의 자유 [30]이중층보다 낮다.이러한 "고정" 부위의 정확한 성격과 이유는 아직 불확실하지만 지지된 이중층 중 일정 비율도 완전히 움직이지 않게 됩니다.고품질 액상을 지원하는 이중층의 경우 일반적으로 부동률은 약 1~5%입니다.확산 계수와 이동 분율을 정량화하기 위해, 지지된 양층층을 연구하는 연구자들은 종종 FRAP 데이터를 보고할 것이다.
불필요한 기질 상호작용은 통합막 단백질, 특히 이층 코어 너머로 돌출된 큰 도메인을 포함할 때 훨씬 더 큰 문제이다.이중층과 기질 사이의 간격이 매우 얇기 때문에 이러한 단백질은 종종 기질 표면에서 변성되어 모든 [31]기능을 잃게 됩니다.이 문제를 회피하기 위한 한 가지 방법은 고분자 사슬로 묶인 이중층을 사용하는 것입니다.이러한 시스템에서 이중층은 스페이서로 작용하고 이론적으로 기판 상호작용 [32]변조를 방지하는 하이드로겔 또는 수화 폴리머의 느슨한 네트워크에서 지지됩니다.실제로 단백질의 일부 비율은 아마도 폴리머/[30]지질 앵커와의 상호작용 때문에 여전히 이동성과 기능을 상실할 것입니다.이 분야에서의 연구는 진행 중이다.
테더형 이중층 지질막(t-BLM)
t-BLM(tethered bilayer lipid membrane)을 사용하면 지질을 고체 [33]기질에 화학적으로 고정함으로써 지지막의 안정성을 더욱 높일 수 있다.
금은 불활성화학 및 금과의 공유결합을 위한 티올지질 때문에 기질로 사용될 수 있다.티올리피드는 금과 공유결합을 형성하는 티올 또는 이황화물기로 종단하는 친수성 스페이서에 의해 극성 두부 그룹으로 확장되는 지질유도체로 구성되어 자가조립단분자층(SAM)을 형성한다.
지지된 지질 이중층의 막내 이동성의 제한은 친수성 스페이서로서 벤질 이설피드(DPL)를 포함한 반막 스패닝 테더 지질[34] 및 피탄올리 사슬을 포함한 합성 고세균 아날로그 전막 스패싱을 도입함으로써 극복할 수 있다.에탄올 용액 또는 리포좀 [35]중 하나에서 지질 코팅된 금 기판을 외층 지질에 노광함으로써 이층 형성을 실현한다.
이 접근법의 장점은 약 4nm의 친수성 공간 때문에 기질과의 상호작용이 최소화되고 여분의 공간이 단백질 이온 채널을 이층 안으로 도입할 수 있다는 것이다.또한 스페이서 층은 2층 전체에 걸쳐 교류 전기 임피던스 측정을 쉽게 할 수 있는 이온[36] 리저버를 형성한다.
베시클스
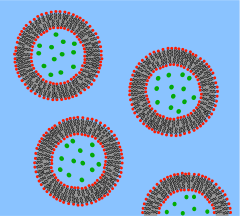
소포는 구형의 껍데기로 감겨진 지질 이중층이며, 소량의 물을 감싸고 소포 바깥의 물에서 분리합니다.세포막과 이러한 근본적인 유사성 때문에, 소포는 지질 이중층의 특성을 연구하기 위해 광범위하게 사용되어 왔다.소포가 자주 사용되는 또 다른 이유는 비교적 만들기 쉽기 때문이다.만약 탈수된 지질 샘플이 물에 노출되면 그것은 자연스럽게 [37]소포를 형성할 것이다.이러한 초기 소포는 일반적으로 다층(다벽)이며 수십 나노미터에서 [38]몇 마이크로미터까지 다양한 크기를 가집니다.이러한 초기 소포를 작은 단층 소포(SUV)로 알려진 균일한 직경의 작은 단일 벽 소포로 부수기 위해서는 초음파 처리 또는 막을 통한 압출과 같은 방법이 필요합니다.SUV의 지름은 일반적으로 50~[39]200nm입니다.또는 소포를 합성하는 대신 세포 배양이나 조직 [40]샘플에서 소포를 분리하는 것이 가능합니다.소포는 지질, 단백질 그리고 많은 다른 분자들을 세포 내부 또는 세포 밖으로 운반하는데 사용된다.이 자연적으로 분리된 소포는 다른 지질과 단백질의 복잡한 혼합물로 구성되어 있어 특정한 생물학적 현상을 연구하는 데 더 큰 사실성을 제공하지만, 기본적인 지질 특성에 대한 연구에는 단순한 인공 소포가 선호됩니다.
인공 SUV는 대량으로 제작될 수 있기 때문에 격자 간격을[41] 결정하는 X선 회절 및 위상 [42]전이를 결정하는 차동 주사 열량 측정과 같은 벌크 재료 연구에 적합합니다.이중 편광 간섭계는 라벨이 없는 분석 [43]형식으로 단일라멜 및 다일라멜 구조와 소포에 대한 삽입 및 중단을 측정할 수 있다.또한 소포에 형광 염료를 부착하여 민감한 FLET 기반 융접 [44]분석을 가능하게 할 수 있습니다.
형광 라벨에도 불구하고, 단순히 SUV가 너무 작다는 이유만으로 SUV에서 상세한 이미지를 촬영하는 것은 종종 어렵습니다.이 문제와 싸우기 위해, 연구원들은 거대한 단층 소포를 사용한다.GUV는 기존 형광 현미경으로 연구하기에 충분한 크기(1~200µm)이며 대부분의 생체 세포와 동일한 크기 범위 내에 있다.따라서, 그것들은 분자 및 세포 생물학에서 시험관내 연구를 위한 세포막의 모방으로 사용된다.인공지질계에서 지질 뗏목에 대한 많은 연구가 이러한 [45]이유로 GUV를 통해 수행되었다.지지된 이중층에 비해, GUV는 결함을 유발하거나 막의 특성에 영향을 미치거나 단백질을 변성시킬 수 있는 단단한 표면이 없기 때문에 보다 "자연적인" 환경을 나타낸다.따라서 GUV는 체외에서 막-리모델링 및 기타 단백질-막 상호작용을 연구하기 위해 자주 사용된다.이러한 소포 내에 단백질 또는 다른 생물학적 반응물을 캡슐화하기 위한 다양한 방법이 존재하며, GUV는 세포와 유사한 [46]막 환경에서 세포 기능의 시험관 내 재생(및 조사)을 위한 이상적인 시스템이다.이러한 방법에는 균일한 [47]크기의 소포를 대량 생산할 수 있는 미세 유체학 방법이 포함됩니다.
드롭렛 인터페이스 바이레이어
DIB(Droplet Interface Bilayer)는 인지질로 둘러싸인 물방울로 접촉 [48][49]시 이중층을 형성합니다.물방울은 기름에 둘러싸여 있고 인지질들은 물이나 [48]기름에 분산되어 있다.그 결과 인지질들은 각 [48]유수계면에서 자연스럽게 단분자층을 형성한다.DIB는 비대칭 이중층을 형성하고 단백질 및 단백질 채널을 재구성할 수 있는 능력을 가진 조직상 물질을 생성하기 위해 형성되거나 전기생리학 연구에 사용될 [50][51][52][53][54]수 있다.확장 DIB 네트워크는 액체 미세 유체 소자를 사용하거나 액체 [54][55]프린터를 사용하여 형성할 수 있습니다.
미셀, 이목 및 나노디스크
세제 미셀은[56] 지질 이중층이 없지만 막 단백질을 정제하고 연구하기 위해 일반적으로 사용되는 또 다른 종류의 모형 막이다.수용액에서 미셀은 친수성 머리가 용매에 노출되고 소수성 꼬리가 중앙에 있는 양친매성 분자의 집합체이다.미셀은 막 단백질을 부분적으로 캡슐화하고 소수성 표면을 용매로부터 보호함으로써 가용화할 수 있다.
이셀은 모델 [57]막의 관련 종류로, 전형적으로 두 개의 지질로 구성되어 있으며, 그 중 하나는 지질 이중층을 형성하는 반면 다른 하나는 주변의 용제 분자로부터 양층 중심을 보호하는 양친매성 미셀과 같은 어셈블리를 형성합니다.바이셀은 미셀에 의해 캡슐화되고 가용화된 이중층의 세그먼트라고 생각할 수 있다.이소체는 리포좀보다 훨씬 작기 때문에 큰 소포가 선택사항이 아닌 NMR 분광법과 같은 실험에 사용될 수 있다.
나노디스크는 지질이나 세제층이 아닌 양친매성 단백질 코팅으로 둘러싸인 이중층으로 구성됩니다.나노디스크는 저농도의 이목 및 미셀보다 안정적이며 크기가 매우 잘 정의되어 있습니다(단백질 피막의 종류에 따라 10~20nm).나노디스크에 의해 수용되어 용해되는 막단백질은 다양한 생물물리학적 [59][60]기술에 의해 연구될 수 있다.
레퍼런스
- ^ Salehi-Reyhani A, Ces O, Elani Y (July 2017). "Artificial cell mimics as simplified models for the study of cell biology". Experimental Biology and Medicine. 242 (13): 1309–1317. doi:10.1177/1535370217711441. PMC 5528198. PMID 28580796.
- ^ Mueller P, Rudin DO, Tien HT, Wescott WC (June 1962). "Reconstitution of cell membrane structure in vitro and its transformation into an excitable system". Nature. 194 (4832): 979–80. Bibcode:1962Natur.194..979M. doi:10.1038/194979a0. PMID 14476933. S2CID 2110051.
- ^ White SH (April 1972). "Analysis of the torus surrounding planar lipid bilayer membranes". Biophysical Journal. 12 (4): 432–45. Bibcode:1972BpJ....12..432W. doi:10.1016/s0006-3495(72)86095-8. PMC 1484121. PMID 5019479.
- ^ Tien HT, Carbone S, Dawidowicz EA (1966). "Formation of "black" lipid membranes by oxidation products of cholesterol". Nature. 212 (5063): 718–719. Bibcode:1966Natur.212..718T. doi:10.1038/212718a0. S2CID 34363724.
- ^ Beerlink A, Mell M, Tolkiehn M, Salditt T (November 2009). "Hard X-Ray Phase Contrast Imaging of Black lipid membranes". Applied Physics Letters. 95 (20): 203703. Bibcode:2009ApPhL..95t3703B. doi:10.1063/1.3263946.
- ^ Andersen OS (February 1983). "Ion movement through gramicidin A channels. Single-channel measurements at very high potentials". Biophysical Journal. 41 (2): 119–33. Bibcode:1983BpJ....41..119A. doi:10.1016/S0006-3495(83)84414-2. PMC 1329161. PMID 6188500.
- ^ Ingolfson H, Kapoor R, Collingwood SA, Andersen OS (November 2008). "Single molecule methods for monitoring changes in bilayer elastic properties". Journal of Visualized Experiments. 21 (21): e1032. doi:10.3791/1032. PMC 2954507. PMID 19066527.
- ^ Montal M, Mueller P (December 1972). "Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties". Proceedings of the National Academy of Sciences of the United States of America. 69 (12): 3561–6. Bibcode:1972PNAS...69.3561M. doi:10.1073/pnas.69.12.3561. PMC 389821. PMID 4509315.
- ^ Beerlink A, Wilbrandt PJ, Ziegler E, Carbone D, Metzger TH, Salditt T (May 2008). "X-ray structure analysis of free-standing lipid membranes facilitated by micromachined apertures". Langmuir: The ACS Journal of Surfaces and Colloids. 24 (9): 4952–8. doi:10.1021/la703704x. PMID 18370435.
- ^ Malmstadt N, Jeon TJ, Schmidt JJ (January 2008). "Long‐Lived Planar Lipid Bilayer Membranes Anchored to an In Situ Polymerized Hydrogel". Advanced Materials. 20 (1): 84–9. doi:10.1002/adma.200700810.
- ^ Purrucker O, Hillebrandt H, Adlkofer K, Tanaka M (2001). "Deposition of highly resistive lipid bilayer on silicon-silicon dioxide electrode and incorporation of gramicidin studied by ac impedance spectroscopy". Electrochimica Acta. 47 (5): 791–798. doi:10.1016/s0013-4686(01)00759-9.
- ^ Lin WC, Blanchette CD, Ratto TV, Longo ML (January 2006). "Lipid asymmetry in DLPC/DSPC-supported lipid bilayers: a combined AFM and fluorescence microscopy study". Biophysical Journal. 90 (1): 228–37. Bibcode:2006BpJ....90..228L. doi:10.1529/biophysj.105.067066. PMC 1367021. PMID 16214871.
- ^ Roiter Y, Ornatska M, Rammohan AR, Balakrishnan J, Heine DR, Minko S (March 2008). "Interaction of nanoparticles with lipid membrane". Nano Letters. 8 (3): 941–4. Bibcode:2008NanoL...8..941R. doi:10.1021/nl080080l. PMID 18254602.
- ^ Engel A, Müller DJ (September 2000). "Observing single biomolecules at work with the atomic force microscope". Nature Structural Biology. 7 (9): 715–8. doi:10.1038/78929. PMID 10966636. S2CID 20571172.
- ^ Steltenkamp S, Müller MM, Deserno M, Hennesthal C, Steinem C, Janshoff A (July 2006). "Mechanical properties of pore-spanning lipid bilayers probed by atomic force microscopy". Biophysical Journal. 91 (1): 217–26. Bibcode:2006BpJ....91..217S. doi:10.1529/biophysj.106.081398. PMC 1479081. PMID 16617084.
- ^ Oesterhelt F, Oesterhelt D, Pfeiffer M, Engel A, Gaub HE, Müller DJ (April 2000). "Unfolding pathways of individual bacteriorhodopsins". Science. 288 (5463): 143–6. Bibcode:2000Sci...288..143O. doi:10.1126/science.288.5463.143. PMID 10753119.
- ^ Ebara Y, Okahata (December 1994). "A kinetic study of concanavalin A binding to glycolipid monolayers by using a quartz-crystal microbalance". Journal of the American Chemical Society. 116 (25): 11209–12. doi:10.1021/ja00104a001.
- ^ Mashaghi A, Swann M, Popplewell J, Textor M, Reimhult E (May 2008). "Optical anisotropy of supported lipid structures probed by waveguide spectroscopy and its application to study of supported lipid bilayer formation kinetics". Analytical Chemistry. 80 (10): 3666–76. doi:10.1021/ac800027s. PMID 18422336.
- ^ Andrecka J, Spillane KM, Ortega-Arroyo J, Kukura P (December 2013). "Direct observation and control of supported lipid bilayer formation with interferometric scattering microscopy". ACS Nano. 7 (12): 10662–70. doi:10.1021/nn403367c. PMID 24251388.
- ^ de Wit G, Danial JS, Kukura P, Wallace MI (October 2015). "Dynamic label-free imaging of lipid nanodomains". Proceedings of the National Academy of Sciences of the United States of America. 112 (40): 12299–303. Bibcode:2015PNAS..11212299D. doi:10.1073/pnas.1508483112. PMC 4603517. PMID 26401022.
- ^ Crane JM, Kiessling V, Tamm LK (February 2005). "Measuring lipid asymmetry in planar supported bilayers by fluorescence interference contrast microscopy". Langmuir: The ACS Journal of Surfaces and Colloids. 21 (4): 1377–88. doi:10.1021/la047654w. PMID 15697284.
- ^ Hollars CW, Dunn RC (July 1998). "Submicron structure in L-alpha-dipalmitoylphosphatidylcholine monolayers and bilayers probed with confocal, atomic force, and near-field microscopy". Biophysical Journal. 75 (1): 342–53. Bibcode:1998BpJ....75..342H. doi:10.1016/s0006-3495(98)77518-6. PMC 1299703. PMID 9649391.
- ^ Groves JT, Ulman N, Boxer SG (January 1997). "Micropatterning fluid lipid bilayers on solid supports". Science. New York, N.Y. 275 (5300): 651–3. doi:10.1126/science.275.5300.651. PMID 9005848. S2CID 30939780.
- ^ Groves JT, Ulman N, Cremer PS, Boxer SG (1998). "Substrate−Membrane Interactions: Mechanisms for Imposing Patterns on a Fluid Bilayer Membrane". Langmuir. 14 (12): 3347–50. doi:10.1021/la9711701.
- ^ Kam L, Boxer SG (2003). "Spatially Selective Manipulation of Supported Lipid Bilayers by Laminar Flow: Steps Toward Biomembrane Microfluidics". Langmuir. 19 (5): 1624–1631. doi:10.1021/la0263413.
- ^ Parthasarathy R, Jackson BL, Lowery TJ, Wong AP (2004). "Nonequilibrium Adhesion Patterns at Lipid Bilayer Junctions". Journal of Physical Chemistry B. 108 (2): 649–57. doi:10.1021/jp035543k.
- ^ Mager MD, Almquist B, Melosh NA (November 2008). "Formation and characterization of fluid lipid bilayers on alumina". Langmuir. 24 (22): 12734–7. doi:10.1021/la802726u. PMID 18942863.
- ^ König BW, Krueger S, Orts WJ, Majkrzak CF, Berk NF, Silverton JV, Gawrisch K (1996). "Neutron reflectivity and atomic force microscopy studies of a lipid bilayer in water adsorbed to the surface of a silicon single crystal". Langmuir. 12 (5): 1343–1350. doi:10.1021/la950580r.
- ^ Johnson SJ, Bayerl TM, McDermott DC, Adam GW, Rennie AR, Thomas RK, Sackmann E (February 1991). "Structure of an adsorbed dimyristoylphosphatidylcholine bilayer measured with specular reflection of neutrons". Biophysical Journal. 59 (2): 289–94. Bibcode:1991BpJ....59..289J. doi:10.1016/S0006-3495(91)82222-6. PMC 1281145. PMID 2009353.
- ^ a b Kühner M, Tampé R, Sackmann E (July 1994). "Lipid mono- and bilayer supported on polymer films: composite polymer-lipid films on solid substrates". Biophysical Journal. 67 (1): 217–26. Bibcode:1994BpJ....67..217K. doi:10.1016/s0006-3495(94)80472-2. PMC 1225352. PMID 7918990.
- ^ Castellana ET, Cremer PS (November 2006). "Solid supported lipid bilayers: From biophysical studies to sensor design". Surface Science Reports. 61 (10): 429–444. Bibcode:2006SurSR..61..429C. doi:10.1016/j.surfrep.2006.06.001. PMC 7114318. PMID 32287559.
- ^ Wong JY, Park CK, Seitz M, Israelachvili J (September 1999). "Polymer-cushioned bilayers. II. An investigation of interaction forces and fusion using the surface forces apparatus". Biophysical Journal. 77 (3): 1458–68. Bibcode:1999BpJ....77.1458W. doi:10.1016/s0006-3495(99)76993-6. PMC 1300433. PMID 10465756.
- ^ Naumann R, Jonczyk A, Kopp R, van Esch J, Ringsdorf H, Knoll W, Gräber P (1995). "Incorporation of Membrane Proteins in Solid-Supported Lipid Layers". Angew. Chem. 34 (18): 2056–2058. doi:10.1002/anie.199520561.
- ^ Cornell BA, Braach-Maksvytis VL, King LG, Osman PD, Raguse B, Wieczorek L, Pace RJ (June 1997). "A biosensor that uses ion-channel switches". Nature. 387 (6633): 580–3. Bibcode:1997Natur.387..580C. doi:10.1038/42432. PMID 9177344. S2CID 4348659.
- ^ Lang H, Duschl C, Vogel H (1994). "A new class of thiolipids for the attachment of lipid bilayers on gold surfaces". Langmuir. 10: 197–210. doi:10.1021/la00013a029.
- ^ Cornell BA, Krishna G, Osman PD, Pace RD, Wieczorek L (August 2001). "Tethered-bilayer lipid membranes as a support for membrane-active peptides". Biochemical Society Transactions. 29 (Pt 4): 613–7. doi:10.1042/BST0290613. PMID 11498038.
- ^ Bangham AD, Horne RW (January 1964). "Negative staining of phospholipids and their structural modification by surface-active agents as observed in the electron microscope". Journal of Molecular Biology. 8 (5): 660–668. doi:10.1016/S0022-2836(64)80115-7. PMID 14187392.
- ^ Lasic DD (November 1988). "The mechanism of vesicle formation". The Biochemical Journal. 256 (1): 1–11. doi:10.1042/bj2560001. PMC 1135360. PMID 3066342.
- ^ F Szoka와 D Papahadjopoulos."지질 소포(리포좀)의 비교 특성과 준비 방법"생물물리학 및 생물공학 연차검토. 9. (1980) 467-508.
- ^ Trimble WS, Cowan DM, Scheller RH (June 1988). "VAMP-1: a synaptic vesicle-associated integral membrane protein". Proceedings of the National Academy of Sciences of the United States of America. 85 (12): 4538–42. Bibcode:1988PNAS...85.4538T. doi:10.1073/pnas.85.12.4538. PMC 280466. PMID 3380805.
- ^ Papahadjopoulos D, Miller N (September 1967). "Phospholipid model membranes. I. Structural characteristics of hydrated liquid crystals". Biochimica et Biophysica Acta (BBA) - Biomembranes. 135 (4): 624–38. doi:10.1016/0005-2736(67)90094-6. PMID 4167394.
- ^ Träuble H, Haynes DH (December 1971). "The volume change in lipid bilayer lamellae at the crystalline-liquid crystalline phase transition". Chemistry and Physics of Lipids. 7 (4): 324–35. doi:10.1016/0009-3084(71)90010-7.
- ^ Popplewell JF, Swann MJ, Freeman NJ, McDonnell C, Ford RC (January 2007). "Quantifying the effects of melittin on liposomes". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1768 (1): 13–20. doi:10.1016/j.bbamem.2006.05.016. PMID 17092481.
- ^ Lei G, MacDonald RC (September 2003). "Lipid bilayer vesicle fusion: intermediates captured by high-speed microfluorescence spectroscopy". Biophysical Journal. 85 (3): 1585–99. Bibcode:2003BpJ....85.1585L. doi:10.1016/S0006-3495(03)74590-1. PMC 1303334. PMID 12944275.
- ^ Dietrich C, Bagatolli LA, Volovyk ZN, Thompson NL, Levi M, Jacobson K, Gratton E (March 2001). "Lipid rafts reconstituted in model membranes". Biophysical Journal. 80 (3): 1417–28. Bibcode:2001BpJ....80.1417D. doi:10.1016/S0006-3495(01)76114-0. PMC 1301333. PMID 11222302.
- ^ Litschel T, Schwille P (March 2021). "Protein Reconstitution Inside Giant Unilamellar Vesicles". Annual Review of Biophysics. 50: 525–548. doi:10.1146/annurev-biophys-100620-114132. PMID 33667121. S2CID 232131463.
- ^ Matosevic S, Paegel BM (March 2011). "Stepwise synthesis of giant unilamellar vesicles on a microfluidic assembly line". Journal of the American Chemical Society. 133 (9): 2798–800. doi:10.1021/ja109137s. PMC 3048828. PMID 21309555.
- ^ a b c Bayley H, Cronin B, Heron A, Holden MA, Hwang WL, Syeda R, et al. (December 2008). "Droplet interface bilayers". Molecular BioSystems. 4 (12): 1191–208. doi:10.1039/b808893d. PMC 2763081. PMID 19396383.
- ^ Funakoshi K, Suzuki H, Takeuchi S (December 2006). "Lipid bilayer formation by contacting monolayers in a microfluidic device for membrane protein analysis". Analytical Chemistry. 78 (24): 8169–74. doi:10.1021/ac0613479. PMID 17165804.
- ^ Hwang WL, Chen M, Cronin B, Holden MA, Bayley H (May 2008). "Asymmetric droplet interface bilayers". Journal of the American Chemical Society. 130 (18): 5878–9. doi:10.1021/ja802089s. PMID 18407631.
- ^ Leptihn S, Thompson JR, Ellory JC, Tucker SJ, Wallace MI (June 2011). "In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers". Journal of the American Chemical Society. 133 (24): 9370–5. doi:10.1021/ja200128n. PMID 21591742.
- ^ Najem JS, Dunlap MD, Rowe ID, Freeman EC, Grant JW, Sukharev S, Leo DJ (September 2015). "Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers". Scientific Reports. 5: 13726. Bibcode:2015NatSR...513726N. doi:10.1038/srep13726. PMC 4562232. PMID 26348441.
- ^ Gross LC, Heron AJ, Baca SC, Wallace MI (December 2011). "Determining membrane capacitance by dynamic control of droplet interface bilayer area". Langmuir. 27 (23): 14335–42. doi:10.1021/la203081v. PMID 21978255.
- ^ a b Villar G, Graham AD, Bayley H (April 2013). "A tissue-like printed material". Science. 340 (6128): 48–52. Bibcode:2013Sci...340...48V. doi:10.1126/science.1229495. PMC 3750497. PMID 23559243.
- ^ Restrepo Schild V, Booth MJ, Box SJ, Olof SN, Mahendran KR, Bayley H (April 2017). "Light-Patterned Current Generation in a Droplet Bilayer Array". Scientific Reports. 7: 46585. Bibcode:2017NatSR...746585R. doi:10.1038/srep46585. PMC 5394532. PMID 28417964.
- ^ Seddon AM, Curnow P, Booth PJ (November 2004). "Membrane proteins, lipids and detergents: not just a soap opera". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1–2): 105–17. doi:10.1016/j.bbamem.2004.04.011. PMID 15519311.
- ^ Cavagnero S, Dyson HJ, Wright PE (April 1999). "Improved low pH bicelle system for orienting macromolecules over a wide temperature range". Journal of Biomolecular NMR. 13 (4): 387–91. doi:10.1023/a:1008360022444. PMID 10353198. S2CID 22774774.
- ^ Ritchie TK, Grinkova YV, Bayburt TH, Denisov IG, Zolnerciks JK, Atkins WM, Sligar SG (2009). "Chapter 11 - Reconstitution of membrane proteins in phospholipid bilayer nanodiscs". Methods in Enzymology. 464: 211–31. doi:10.1016/s0076-6879(09)64011-8. ISBN 9780123749697. PMC 4196316. PMID 19903557.
- ^ Roos C, Kai L, Haberstock S, Proverbio D, Ghoshdastider U, Ma Y, et al. (2014). "High-level cell-free production of membrane proteins with nanodiscs". Cell-Free Protein Synthesis. Methods in Molecular Biology. Vol. 1118. pp. 109–30. doi:10.1007/978-1-62703-782-2_7. ISBN 978-1-62703-781-5. PMID 24395412.
- ^ Roos C, Kai L, Proverbio D, Ghoshdastider U, Filipek S, Dötsch V, Bernhard F (February 2013). "Co-translational association of cell-free expressed membrane proteins with supplied lipid bilayers". Molecular Membrane Biology. 30 (1): 75–89. doi:10.3109/09687688.2012.693212. PMID 22716775. S2CID 207503256.