DNA마이크로어레이
DNA microarrayDNA 마이크로어레이(일반적으로 DNA 칩 또는 바이오 칩이라고도 함)는 고체 표면에 부착된 미세한 DNA 반점의 집합입니다.과학자들은 DNA 마이크로어레이를 사용하여 많은 유전자의 발현 수준을 동시에 측정하거나 게놈의 여러 영역을 유전자형으로 만든다.각 DNA 스팟은 프로브(또는 리포터 또는 올리고)로 알려진 특정 DNA 배열의 피코몰(10몰)을−12 포함합니다.이것들은 높은 끈 조건 하에서 cDNA 또는 cRNA 샘플(타깃이라고도 함)을 교배시키는 데 사용되는 유전자 또는 다른 DNA 요소의 짧은 단면일 수 있습니다.프로브-타깃 교배는 일반적으로 불소, 은 또는 화학발광 표적을 검출하여 검출하고 정량화하여 표적 내 핵산 배열의 상대적 풍부도를 결정한다.원래 핵산 배열은 약 9cm × 12cm의 매크로 배열이었으며,[1] 최초의 컴퓨터화된 이미지 기반 분석은 1981년에 발표되었다.그것은 패트릭 오에 의해 발명되었다. 예를 들어 심혈관 질환, 암, 병원균 및 GWAS 분석의 다형성에 대한 SNP 어레이가 있습니다.그것은 또한 구조적 변이의 식별과 유전자 발현 측정에도 사용된다.
원칙
마이크로어레이의 핵심 원리는 두 개의 DNA 가닥 간의 교배이며, 상보적인 핵산 배열은 상보적인 뉴클레오티드 염기쌍 사이에 수소 결합을 형성함으로써 서로 특별히 짝을 이루는 특성이다.뉴클레오티드 배열에서 많은 수의 상보적 염기쌍은 두 가닥 사이의 보다 긴밀한 비공유 결합을 의미한다.비특이적 결합 시퀀스를 씻어낸 후에는 강하게 쌍을 이룬 가닥만 하이브리드 상태로 유지됩니다.프로브 시퀀스에 결합하는 형광 라벨이 부착된 타깃 시퀀스는 하이브리드화 조건(온도 등)과 하이브리드화 후 세척에 따라 다른 신호를 생성합니다.스폿(피처)으로부터의 신호의 총 세기는, 그 스폿에 존재하는 프로브에의 타겟샘플 바인딩의 양에 의해서 다릅니다.마이크로어레이는 상대적인 정량화를 사용합니다.상대적인 정량화에서는, 피쳐의 명암과 다른 조건하에서 같은 피쳐의 명암을 비교하고, 그 위치에 의해서 피쳐의 식별을 알 수 있습니다.
용도 및 종류

배열에는 여러 종류가 있으며, 가장 큰 차이는 배열이 표면에 공간적으로 배치되어 있는지 또는 코드화된 구슬 위에 배치되어 있는지 여부입니다.
- 전통적인 고체상 배열은 유리, 플라스틱 또는 실리콘 바이오 칩(일반적으로 게놈 칩, DNA 칩 또는 유전자 배열로 알려져 있음)과 같은 고체 표면에 수천 개의 동일하고 특정한 탐침이 부착되어 있는 특징이라고 불리는 질서 있는 현미경 "반점"의 집합체입니다.이러한 특징 중 수천 개를 단일 DNA 마이크로 어레이의 알려진 위치에 배치할 수 있습니다.
- 대체 비드 배열은 각각 특정 프로브와 2개 이상의 염료 비율을 가진 현미경 폴리스티렌 비즈 집합으로, 표적 시퀀스에 사용되는 형광 염료를 방해하지 않습니다.
DNA 마이크로어레이는 DNA(비교 유전체 교배에서와 같이)를 검출하거나 단백질로 변환되거나 변환되지 않을 수 있는 RNA(역전사 후 cDNA로서 가장 일반적으로)를 검출하는 데 사용될 수 있다.cDNA를 통해 유전자 발현을 측정하는 과정을 발현 분석 또는 발현 프로파일링이라고 합니다.
응용 프로그램은 다음과 같습니다.
| 응용 프로그램 또는 테크놀로지 | 개요 |
|---|---|
| 유전자 발현 프로파일링 | mRNA 또는 유전자 발현 프로파일링 실험에서 유전자 발현에 대한 특정 치료, 질병 및 발달 단계의 영향을 연구하기 위해 수천 개의 유전자의 발현 수준을 동시에 모니터링합니다.예를 들어 마이크로어레이 기반의 유전자 발현 프로파일링은 감염 중의 유전자 발현과 비감염 세포 또는 [2]조직의 유전자 발현을 비교함으로써 병원체 또는 다른 유기체에 반응하여 발현이 변화하는 유전자를 동정하기 위해 사용할 수 있다. |
| 비교 유전자 교배 | 패트릭 브라운, 조나단 폴락, 애쉬 알리자데와 [3][4]스탠포드 대학 동료들이 원래 설명한 바와 같이 서로 다른 세포 또는 밀접하게 관련된 유기체의 게놈 함량을 평가하는 것. |
| 유전자 아이디 | 식품 및 사료(GMO[1]와 같은), 세포 배양 내 마이코플라스 또는 질병 검출을 위한 병원균의 ID를 검사하는 소형 마이크로어레이로, 대부분 PCR과 마이크로어레이 기술을 결합합니다. |
| 칩에 염색질 면역 침강 | 특정 단백질에 결합된 DNA 배열은 해당 단백질(ChIP)을 면역침착함으로써 분리될 수 있으며, 그 후 이들 단편은 게놈 전체의 단백질 결합부위 점유의 결정을 가능하게 하는 마이크로어레이(타일 어레이 등)로 교배될 수 있다.면역침전 단백질로는 히스톤 변성(H3K27me3, H3K4me2, H3K9me3 등), 폴리콤군 단백질(PRC2:Suz12, PRC1:후생유전학적 경관을 연구하기 위한 YY1) 및 트리토락스 그룹 단백질(Ash1) 또는 전사경관을 연구하기 위한 RNA 중합효소 II. |
| DamID | ChIP와 마찬가지로 관심단백질에 의해 결합되는 게놈 영역을 분리하여 결합부위 점유율을 결정하기 위한 마이크로어레이 탐침에 사용할 수 있다.ChIP와 달리 DamID는 항체를 필요로 하지 않지만 단백질 결합 부위 근처에서 아데닌 메틸화를 사용하여 해당 영역을 선택적으로 증폭시키고, 박테리아 DNA 아데닌 메틸전달효소에 융합된 미량의 단백질을 발현함으로써 도입된다. |
| SNP 검출 | 집단 [5]내 또는 집단 간의 대립 유전자 간 단일 뉴클레오티드 다형성 확인.유전자형성, 법의학적 분석, 질병 소인 측정, 약물 후보 식별, 개인 또는 암 체세포 돌연변이 평가, 헤테로 접합성 손실 평가, 유전자 연계 분석 등 여러 가지 마이크로 어레이 응용 프로그램이 SNP 검출을 이용한다. |
| 대체 스플라이싱 검출 | 엑손 접합 어레이 설계는 유전자에 대해 예측 엑손의 예상 또는 잠재적 스플라이스 부위에 특정한 프로브를 사용한다.그것은 전형적인 유전자 발현 배열(유전자당 1-3개의 프로브)과 게놈 타일 배열(유전자당 수백 또는 수천개의 프로브)에 대한 중간 밀도 또는 커버리지이다.그것은 유전자의 대체 스플라이스 형태의 발현을 분석하는데 사용된다.엑손 어레이는 기존의 또는 예측된 유전자에 대해 각각의 개별 엑손을 검출하도록 설계된 프로브를 사용하여 다른 설계를 가지고 있으며 다른 스플라이싱 아이소폼 검출에 사용할 수 있다. |
| 융합유전자 마이크로어레이 | 융합 유전자 마이크로 어레이는 예를 들어 암 검체로부터 융합 전사물을 검출할 수 있다.이 원리는 대체 스플라이싱 마이크로어레이를 기반으로 하는 것입니다.올리고 설계 전략은 키메라 전사 접합부의 측정과 개별 융합 파트너의 외부 측정의 결합을 가능하게 합니다. |
| 타일 배열 | 게놈 타일 배열은 게놈 관심 영역을 조밀하게 나타내도록 설계된 겹치는 탐침으로 구성됩니다. 때로는 전체 인간 염색체만큼 크기도 합니다.그 목적은 이전에 알려지거나 예측되지 않았을 수 있는 대화록이나 대체적으로 결합된 형태의 발현을 경험적으로 감지하는 것이다. |
| 이중사슬 B-DNA 마이크로어레이 | 오른손 이중사슬 B-DNA 마이크로어레이는 고정화된 온전한 이중사슬 DNA의 특정 영역을 결합하는 데 사용될 수 있는 새로운 약물과 생물학적 특성을 나타내기 위해 사용될 수 있다.이 접근법은 유전자 [6][7]발현을 억제하는데 사용될 수 있다.또한 다양한 환경 조건 하에서 구조의 특성화를 허용합니다. |
| 이중사슬 Z-DNA 마이크로어레이 | 왼손 이중사슬 Z-DNA 마이크로어레이를 사용하여 오른손 B-DNA 유전자의 긴 연장 내에 위치한 대체 Z-DNA 구조의 짧은 염기서열을 식별할 수 있다(예: 전사 증강, 재조합, RNA 편집).[6][7]마이크로어레이는 또한 다양한 환경 조건 하에서 구조를 특성화할 수 있습니다. |
| 다중사슬 DNA 마이크로어레이(트리플렉스-DNA 마이크로어레이 및 4중-DNA 마이크로어레이) | 다가닥 DNA와 RNA 마이크로어레이는 이러한 다가닥 핵산 배열에 결합하는 새로운 약물을 식별하기 위해 사용될 수 있다.이 접근법은 유전자 [6][7][8][9]발현을 억제하는 능력을 가진 새로운 약물과 생물학적 물질을 발견하는데 사용될 수 있다.이러한 마이크로 어레이는 또한 다양한 환경 조건 하에서 구조를 특성화할 수 있습니다. |
특정 작물에 맞춘 특수 배열이 분자 사육 응용 분야에서 점점 더 인기를 끌고 있습니다.미래에는 번식작업에서 [10]시험되는 불필요한 묘목의 수를 줄이기 위해 초기 단계에서 묘목을 선별하는 데 사용될 수 있을 것이다.
제조
마이크로어레이는 검사 대상 프로브 수, 비용, 맞춤 요건 및 과학적 질문 유형에 따라 다양한 방법으로 제조할 수 있습니다.시판 벤더의 어레이는 10개 이하의 프로브 또는 500만 개 이상의 마이크로 스케일프로브를 탑재할 수 있습니다.
스팟형 어레이와 현장형 통합
마이크로어레이는 유리 슬라이드에 가는 핀을 사용한 인쇄, 미리 만들어진 마스크를 사용한 사진 리소그래피, 동적 마이크로미러 소자를 사용한 사진 리소그래피, 잉크젯 [11][12]인쇄 또는 마이크로 전극 어레이의 전기 화학 등 다양한 기술을 사용하여 제작할 수 있습니다.
점착 마이크로어레이에서 프로브는 올리고뉴클레오티드, cDNA 또는 mRNA에 대응하는 PCR 생성물의 작은 조각이다.프로브는 어레이 표면에 증착하기 전에 합성된 후 유리에 "스팟"됩니다.일반적인 접근법은 로봇팔에 의해 제어되는 일련의 미세한 핀 또는 바늘을 이용하는데, 로봇팔은 DNA 프로브를 포함한 웰에 담근 후 어레이 표면의 지정된 위치에 각 프로브를 부착합니다.프로브의 "그리드"는 준비된 프로브의 핵산 프로파일을 나타내며 실험 또는 임상 샘플에서 파생된 보완적 cDNA 또는 cRNA "타겟"을 받을 준비가 되어 있다.이 기술은 전 세계 연구자들이 자체 연구실에서 "사내" 인쇄된 마이크로어레이를 생산하기 위해 사용합니다.이러한 어레이는, 각 실험 마다 간단하게 커스터마이즈 할 수 있습니다.이는 연구자가 어레이상의 프로브와 인쇄 장소를 선택하고, 자신의 연구실(또는 콜라보레이션 시설)에서 프로브를 합성해, 어레이를 특정할 수 있기 때문입니다.그런 다음 하이브리드화를 위해 라벨이 지정된 자체 샘플을 생성하고 샘플을 어레이에 하이브리드화한 다음 최종적으로 자체 장비로 어레이를 스캔할 수 있습니다.이를 통해 각 연구에 맞게 맞춤형으로 사용할 수 있는 비교적 저렴한 마이크로 어레이를 제공할 수 있으며, 연구자가 관심을 갖지 않는 방대한 수의 유전자를 나타낼 수 있는 고가의 상용 어레이를 구입하는 비용을 절감할 수 있습니다.사내에서 점점이 찍힌 마이크로어레이가 시판되고 있는 올리고뉴클레오티드 [13]어레이와 같은 수준의 감도를 제공하지 않을 수 있음을 나타내는 출판물이 있습니다.이는 아마도 올리고 어레이의 공업용 제조에 비해 배치 크기가 작고 인쇄 효율이 떨어졌기 때문일 수 있습니다.
올리고뉴클레오티드 마이크로어레이에서 프로브는 알려진 또는 예측된 열린 판독 프레임의 시퀀스의 일부와 일치하도록 설계된 짧은 배열입니다.올리고뉴클레오티드 프로브가 "스팟" 마이크로어레이에 자주 사용되지만, "올리고뉴클레오티드 어레이"라는 용어는 종종 특정 제조 기술을 언급합니다.올리고뉴클레오티드 어레이는 단일 유전자 또는 유전자 스플라이스 변이군을 나타내도록 설계된 짧은 올리고뉴클레오티드 배열을 온전한 배열을 축적하는 대신 어레이 표면에 직접 합성함으로써 제조된다.시퀀스는 원하는 목적에 따라 더 길어질 수도 있고(애질런트 설계와 같은 60m 프로브), 더 짧아질 수도 있습니다(Affymetrix에 의해 생산된 25m 프로브). 긴 프로브는 개별 표적 유전자에 더 특수하고 짧은 프로브는 어레이 전체에서 더 높은 밀도로 발견될 수 있으며 제조 비용이 저렴합니다.올리고뉴클레오티드 어레이를 제조하기 위해 사용되는 기술 중 하나는 실리카 기판상의 포토 리소그래피 합성(Affymetrix)을 포함한다.실리카 기판에서는 빛과 빛에 민감한 마스킹제가 어레이 [14]전체에 걸쳐 한 번에 하나의 뉴클레오티드를 '구축'하기 위해 사용된다.각 적용 가능한 프로브는 어레이를 단일 뉴클레오티드 용액으로 목욕시키기 전에 선택적으로 "마스크 해제"된 후 마스킹 반응이 일어나 다른 뉴클레오티드 노광에 대비하여 다음 프로브 세트를 마스크 해제한다.여러 번 반복하면 모든 프로브의 시퀀스가 완전히 구성됩니다.최근 NimbleGen Systems의 마스크리스 어레이 합성은 다수의 [15]프로브에 유연성을 겸비하고 있습니다.
2채널 검출과 1채널 검출

2색 마이크로어레이 또는 2채널 마이크로어레이는 일반적으로 비교할 두 개의 샘플(예: 질병 조직 대 건강한 조직)에서 준비된 cDNA와 교배되며, 두 개의 다른 형광체로 [16]라벨이 표시된다.cDNA 라벨링에 일반적으로 사용되는 형광염료로는 형광발광파장이 570nm(광스펙트럼의 녹색 부분에 해당)인 Cy3와 형광발광파장이 670nm(광스펙트럼의 적색 부분에 해당)인 Cy5가 있다.두 개의 Cy 레이블 cDNA 샘플을 혼합하여 단일 마이크로 어레이로 혼합한 다음 마이크로 어레이 스캐너에서 스캔하여 정의된 파장의 레이저 빔으로 들뜬 후 두 개의 형광을 시각화합니다.각 형광체의 상대적 강도는 비율 기반 분석에 사용되어 상향 조절 [17]및 하향 조절 유전자를 식별할 수 있다.
올리고뉴클레오티드 마이크로어레이는 종종 RNA 스파이크인과 교배하도록 설계된 제어 프로브를 운반합니다.스파이크인과 제어 프로브 간의 하이브리드화 정도는 타깃 프로브에 대한 하이브리드화 측정을 정규화하는 데 사용됩니다.2색 배열에서는 드물게 유전자 발현 절대수준이 결정될 수 있지만 샘플 내 서로 다른 지점 간 및 샘플 간의 상대적 발현 차이는 2색 시스템에 적합한 데이터 분석방법이다.이러한 마이크로 어레이의 공급업체로는 Dual-Mode 플랫폼을 사용하는 애질런트, 측색 Silverquant 레이블링을 위한 DualChip 플랫폼을 사용하는 Eppendorf, Arrayit을 사용하는 TeleChem International 등이 있습니다.
단일 채널 마이크로어레이 또는 단색 마이크로어레이에서는 어레이는 라벨이 부착된 타깃과의 하이브리드화의 상대적인 레벨을 나타내는 각 프로브 또는 프로브 세트에 강도 데이터를 제공한다.그러나, 그것들은 실제로 유전자의 풍부함 수준을 나타내는 것이 아니라, 같은 실험에서 처리되었을 때 다른 샘플이나 조건에 비해 상대적으로 풍부함을 나타낸다.각 RNA 분자는 실험의 증폭, 라벨링 및 교배 단계 동안 프로토콜 및 배치 특이적 편견을 경험하여 동일한 미세 배열에 대한 유전자 간의 비교를 유익하지 않게 합니다.동일한 유전자에 대한 두 조건의 비교는 두 개의 분리된 단일 색소 교배를 필요로 한다.일반적인 단일 채널 시스템으로는 Affymetrix "Gene Chip", Illumina "Bead Chip", 애질런트 단일 채널 어레이, Applied Microarays "CodeLink" 어레이 및 에펜도르프 "DualChip & Silverquant"가 있습니다.단일 염료 시스템의 한 가지 강점은 각 어레이 칩이 하나의 샘플에만 노출되기 때문에 다른 샘플에서 파생된 원시 데이터에 이상 샘플이 영향을 미칠 수 없다는 것입니다(단일 저품질 샘플이 높은 쿼아라도 전체 데이터 정밀도에 크게 영향을 미칠 수 있는 2색 시스템과는 반대).lity) 또 다른 장점은 배치 효과를 고려하는 한 데이터가 다른 실험의 배열과 더 쉽게 비교된다는 것입니다.
상황에 따라서는 1채널 마이크로 어레이만이 선택될 수 있습니다.를 들어i을 비교할 필요가 있다고 하면, 샘플이 참조로 사용되지 않는 한 2개의 채널 어레이를 사용하여 필요한 실험 횟수가 빠르게 실현되지 않습니다.
| 표본수 | 일채널 마이크로어레이 | 2채널 마이크로어레이 | 2채널 마이크로어레이(기준 포함) |
|---|---|---|---|
| 1 | 1 | 1 | 1 |
| 2 | 2 | 1 | 1 |
| 3 | 3 | 3 | 2 |
| 4 | 4 | 6 | 3 |
표준 프로토콜
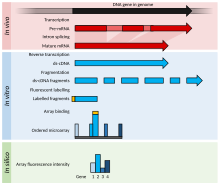
이것은 DNA 마이크로어레이 실험의 예로서, RNA나 다른 대체 실험에 대한 수정 사항을 나열하면서 DNA 마이크로어레이 실험을 더 잘 설명하기 위한 특정 사례에 대한 세부 사항을 포함합니다.
- 비교할 두 표본(쌍 비교)이 성장/획득됩니다.이 예제에서는 처리된 검체(사례)와 처리되지 않은 검체(대조군)를 나타냅니다.
- 관심 핵산은 정제됩니다. 즉, 발현 프로파일링을 위한 RNA, 비교 교배를 위한 DNA 또는 후생유전학 또는 조절 연구를 위해 면역촉진(ChIP-on-chip)된 특정 단백질에 결합된 DNA/RNA가 될 수 있습니다.이 예에서 전체 RNA는 대부분의 RNA를 분리하는 Guanidinium 티오시아네이트-페놀-클로로포름 추출(예: Trizol)에 의해 (핵 및 세포질 모두) 분리되며, 올바르게 수행되면 더 나은 순도를 갖는다.
- 정제된 RNA는 품질(모관 전기영동법)과 양(예: NanoDrop 또는 NanoPhotometer 분광계 사용)에 대해 분석됩니다.재료가 허용 가능한 품질이고 충분한 양이 존재하는 경우(예를 들어 > 1μg, 마이크로 어레이 플랫폼에 따라 필요한 양이 다르더라도) 실험을 진행할 수 있다.
- 라벨이 부착된 제품은 역전사를 통해 생성되며, 그 후 PCR 증폭(옵션)이 실행됩니다.RNA는 polyT primer(mRNA만 증폭) 또는 random primer(random primer, 대부분 rRNA인 모든 RNA를 증폭)로 역전사됩니다. miRNA 마이크로어레이는 올리고뉴클레오티드를 정제된 작은 RNA(분획기로 격리됨)에 결합시킨 다음 역전사 및 증폭됩니다.
- 라벨은 역전사 단계 중 또는 수행될 경우 증폭 후에 추가됩니다.감지 라벨은 마이크로 어레이에 따라 달라집니다. 예를 들어 라벨이 RT 믹스와 함께 추가된 경우 cDNA는 안티센스이고 마이크로 어레이 프로브는 감지됩니다(음성 대조군의 경우 제외).
- 라벨은 일반적으로 형광체이며, 1대의 기계만이 무선 라벨을 사용합니다.
- 라벨은 직접(미사용) 또는 간접(결합 단계 필요)일 수 있습니다.2채널 어레이의 경우 아미노알릴-UTP(aminoallyl-UTP, aaUTP) 및 NHS 아미노반응성 염료(시아닌 염료 등)를 사용하여 교배 전에 결합 단계를 발생시키고, 단일채널 어레이의 경우 교배 후에 비오틴 및 라벨 부착 스트렙타비딘을 사용하여 결합 단계를 발생한다.변형된 뉴클레오티드(일반적으로 1aUTP: 4 TTP(티미딘 3인산)의 비율로)는 보통 뉴클레오티드와 낮은 비율로 효소적으로 첨가되며, 일반적으로 60개의 염기 중 1개가 된다.그런 다음 aaDNA를 컬럼으로 정제한다(Tris는 아민기를 포함하므로 인산염 완충용액을 사용한다).아미노알릴기는 반응성 염료와 반응하는 핵산염기에 부착된 긴 링커 상의 아민기이다.
- 그런 다음 라벨이 표시된 샘플은 SDS, SSC, 덱스트란 황산염, 차단제(Cot-1 DNA, 연어 정자 DNA, 송아지 흉선 DNA, PolyA 또는 PolyT), Denhardt 용액 또는 포름아민으로 구성될 수 있는 자체 하이브리드화 용액과 혼합됩니다.
- 혼합물은 변성되어 마이크로 어레이의 핀홀에 추가됩니다.구멍은 밀폐되고 마이크로 어레이는 마이크로 어레이가 회전하여 혼합되는 hyb 오븐 또는 핀 홀의 압력에 의해 마이크로 어레이가 혼합되는 믹서에 혼성됩니다.
- 하룻밤 하이브리드화 후 비특이적 결합은 모두 씻어낸다(SDS 및 SSC).
- 마이크로 어레이는 레이저를 사용하여 염료를 자극하고 검출기로 방출 수준을 측정하는 기계에 의해 건조되고 스캔됩니다.
- 영상이 템플릿으로 그리드되고 각 피쳐의 명암(여러 픽셀로 구성됨)이 수량화됩니다.
- 원시 데이터는 정규화됩니다. 가장 간단한 정규화 방법은 두 채널의 특징의 총 강도가 같도록 배경 강도와 규모를 빼거나 기준 유전자의 강도를 사용하여 모든 강도에 대한 t 값을 계산하는 것입니다.보다 정교한 방법으로는 Affymetrix 칩(단일 채널, 실리콘 칩, 현장 합성 짧은 올리고뉴클레오티드)에 대한 z 비율, 황토 및 로우리스 회귀 분석 및 RMA(강성 멀티칩 분석)가 있습니다.
마이크로어레이 및 생물정보학

저렴한 마이크로 어레이 실험의 출현은 몇가지 구체적인 생물 정보학 도전:, 플랫폼과 독립 집단과 데이터의 숫자 형식(표준화);데이터(데이터 분석)의 통계 처리;각각의 페이지의 주 사상의 복제 실험 설계(실험 설계)의 다발성 수준[표창 필요한]그 mRNA에 옷측정(주석), 방대한 양의 데이터 및 공유 기능(데이터 웨어하우징)을 제공합니다.
실험 설계
유전자 발현의 생물학적 복잡성 때문에, 발현 프로파일링 기사에서 논의되는 실험 설계의 고려사항은 통계적으로나 생물학적으로 유효한 결론을 데이터에서 도출하기 위해서는 매우 중요하다.
마이크로 어레이 실험을 설계할 때 고려해야 할 세 가지 주요 요소가 있습니다.첫째, 생물학적 샘플의 복제는 실험에서 결론을 도출하기 위해 필수적이다.둘째, 기술적 복제물(예: 각 실험 단위에서 얻은 두 개의 RNA 샘플)은 정밀도를 정량화하는 데 도움이 될 수 있다.생물학적 복제물은 독립적인 RNA 추출을 포함한다.기술 리플리케이트는 동일한 추출의 2개의 에쿼트일 수 있습니다.셋째, 각 cDNA 클론 또는 올리고뉴클레오티드의 스팟은 마이크로어레이 슬라이드에 복제물(적어도 중복물)로 존재하며, 각 잡종의 기술적 정밀도를 측정하기 위해 제공됩니다.실험의 독립 단위를 식별하고 통계적 [19]유의성의 과대 추정치를 방지하기 위해 샘플 준비 및 취급에 대한 정보를 논의하는 것이 중요하다.
표준화
마이크로 어레이 데이터는 플랫폼 제작, 검사 프로토콜 및 분석 방법이 표준화되지 않아 교환이 어렵습니다.이는 생물정보학에서 상호운용성 문제를 제기한다.다양한 풀뿌리 오픈 소스 프로젝트는 비독점 칩으로 생성된 데이터의 교환과 분석을 용이하게 하기 위해 노력하고 있습니다.
예를 들어, 「마이크로 어레이 실험의 최소 정보」체크리스트는, 존재해야 할 상세도의 정의에 도움이 되어, 많은 저널이 마이크로 어레이 결과를 짜넣는 논문의 제출 요건으로 채택하고 있습니다.그러나 MIAME에서는 정보의 형식을 기술하고 있지 않기 때문에 많은 형식이 MIAME 요건을 지원할 수 있지만 2007년 현재 완전한[update] 의미 준수를 검증할 수 있는 형식은 없습니다."MicroArray Quality Control (MAQC) Project"는 미국 식품의약국(FDA)이 표준 및 품질 관리 지표를 개발하기 위해 시행하고 있으며, 이를 통해 최종적으로 의약품 발견, 임상 관행 및 규제 [20]의사결정에 MicroArray 데이터를 사용할 수 있게 됩니다.MGED Society는 유전자 발현 실험 결과 표현 및 관련 주석을 위한 표준을 개발했습니다.
데이터 분석
마이크로 어레이 데이터 세트는 일반적으로 매우 크며 분석 정밀도는 여러 변수의 영향을 받습니다.통계적 과제에는 배경 소음의 영향과 데이터의 적절한 정규화를 고려하는 것이 포함된다.정규화 방법은 특정 플랫폼에 적합할 수 있으며, 상용 플랫폼의 경우 분석은 [21]독점적일 수 있습니다.통계 분석에 영향을 미치는 알고리즘은 다음과 같습니다.
- 이미지 분석: 그리드, 스캔한 이미지의 스폿 인식(세그먼트 알고리즘), 저품질 및 저강도 기능의 제거 또는 마킹(플래깅이라고 함).
- 데이터 처리: 백그라운드 감산(글로벌 또는 로컬 배경 기반), 스폿 강도 및 강도 비율 결정, 데이터 시각화(MA 그림 참조), 비율의 로그 변환, 강도 비율의 글로벌 또는 로컬 정규화, 스텝 검출 [22]알고리즘을 사용한 다른 카피 번호 영역으로의 분할.
- 클래스 검출 분석:때로는 비감독 분류 또는 지식 발견이라고 불리는 이 분석적 접근법은 마이크로어레이(물체, 환자, 마우스 등) 또는 유전자가 집단으로 함께 군집하는지 식별하려고 시도합니다.함께 군집하는 자연적으로 존재하는 개체 그룹(마이크로 어레이 또는 유전자)을 식별하면 이전에는 존재하지 않았던 새로운 그룹을 발견할 수 있습니다.지식 발견 분석 중에 다양한 비감독 분류 기술을 DNA 마이크로 어레이 데이터와 함께 사용하여 [23]배열의 새로운 클러스터(클래스)를 식별할 수 있습니다.이러한 접근 방식은 가설에 기반하지 않고 데이터에서 "최적의" 수의 클러스터를 찾기 위한 반복 패턴 인식 또는 통계 학습 방법에 기초한다.비감독 분석 방법의 예로는 자기 조직 지도, 신경 가스, k-평균 클러스터 분석,[24] 계층적 클러스터 분석, 게놈 신호 처리 기반 클러스터 분석 및 모델 기반 클러스터 분석이 있다.이러한 방법 중 일부의 경우 사용자는 객체 쌍 간의 거리 측정도 정의해야 합니다.일반적으로 Pearson 상관 계수가 사용되지만,[25] 문헌에서 몇 가지 다른 측정이 제안되고 평가되었습니다.클래스 발견 분석에 사용되는 입력 데이터는 일반적으로 변동계수가 낮은 값 또는 섀넌 엔트로피 등의 높은 값을 바탕으로 높은 정보성(저소음)을 가진 유전자 목록에 기초한다.비감독 분석에서 얻은 가장 가능성이 높거나 최적의 군집 수를 결정하는 것을 군집 유효성이라고 합니다.클러스터 유효성에 대해 일반적으로 사용되는 메트릭으로는 실루엣 지수, 데이비스-볼딘 [26]지수, 던 지수 또는 Hubert의(\ \ 통계량이 있습니다.
- 클래스 예측 분석:감독 분류라고 불리는 이 접근방식은 테스트 객체의 가장 가능성이 높은 클래스 멤버십을 예측하기 위해 미래의 미지의 테스트 객체가 입력될 수 있는 예측 모델을 개발하기 위한 기초를 확립한다.클래스 예측을 위한 감독 분석은[23] 선형 회귀, k-근접 이웃, 학습 벡터 양자화, 의사결정 트리 분석, 랜덤 포레스트, 나이브 베이즈, 로지스틱 회귀, 커널 회귀, 인공 신경 네트워크, 지원 벡터 기계, 전문가 혼합 및 감독 신경 가스와 같은 기술의 사용을 포함한다.또한 유전자 알고리즘, 공분산 매트릭스 자가 적응, 입자 군집 최적화 및 개미 군집 최적화와 같은 다양한 메타 휴리스틱 방법이 사용된다.클래스 예측을 위한 입력 데이터는 일반적으로 고전 가설 테스트(다음 섹션), 지니 다양성 지수 또는 정보 게인(엔트로피)을 사용하여 결정되는 클래스 예측 유전자의 필터링된 목록에 기초한다.
- 가설 중심 통계 분석:유전자 발현에서 통계적으로 유의한 변화의 확인은 일반적으로 다중[28] 비교 또는 클러스터 [29]분석을 고려한 마이크로 어레이 데이터 세트에 맞춘 t-테스트, 분산 분석, 베이지안[27] 방법Mann-Whitney 테스트 방법을 사용하여 식별된다.이러한 방법은 데이터에 존재하는 변동과 실험 반복실험 횟수를 기반으로 통계적 검정력을 평가하고 분석에서 [30]유형 I 및 유형 II 오류를 최소화하는 데 도움이 됩니다.
- 치수 축소:분석가는 종종 데이터 [23]분석 전에 차원(세대) 수를 줄입니다.여기에는 주성분 분석(PCA), 또는 커널 PCA, 확산 맵, 라플라시안 고유 맵, 국소 선형 임베딩, 국소 보존 투영 및 Sammon의 매핑을 이용한 비선형 다양체 학습(거리 메트릭 학습)과 같은 선형 접근법이 포함될 수 있다.
- 네트워크 기반 방법: 유전자 네트워크의 기본 구조를 고려하는 통계 방법. 유전자 [31]생성물 간의 연관성 또는 인과적 상호작용 또는 의존성을 나타낸다.가중 유전자 공발현 네트워크 분석은 공발현 모듈 및 모듈 내 허브 유전자를 동정하기 위해 널리 사용된다.모듈은 셀 유형 또는 경로에 대응할 수 있습니다.고도로 연결된 모듈 내 허브는 각각의 모듈을 가장 잘 나타냅니다.
마이크로 어레이 데이터는 데이터의 차원을 감소시켜 이해를 돕고 보다 집중적인 [32]분석을 지원하기 위한 추가 처리가 필요할 수 있습니다.다른 방법으로는 적은 수의 생물학적 또는 기술적 복제로 구성된 데이터를 분석할 수 있다. 예를 들어, 로컬 풀링 오류(LPE) 테스트는 불충분한 [33]복제를 보상하기 위해 유사한 발현 수준을 가진 유전자의 표준 편차를 풀링한다.
주석
프로브와 검출될 것으로 예상되는 mRNA의 관계는 [34]단순하지 않습니다.일부 mRNA는 다른 mRNA를 검출해야 하는 어레이 내의 프로브를 크로스 하이브리드화할 수 있습니다.또한 mRNA는 배열 또는 분자 특이적인 증폭 편향을 경험할 수 있다.셋째, 특정 유전자의 mRNA를 검출하도록 설계된 탐침은 그 유전자와 잘못 연관되어 있는 게놈 EST 정보에 의존하고 있을 수 있다.
데이터 웨어하우징
마이크로 어레이 데이터는 다른 유사한 데이터 세트에 비해 더 유용한 것으로 나타났습니다.데이터셋과 관련된 방대한 데이터량, 특수 형식(예: MIAME) 및 큐레이션 작업에는 데이터를 저장할 특수 데이터베이스가 필요합니다.InterMine 및 BioMart와 같은 다수의 오픈 소스 데이터 웨어하우징 솔루션은 다양한 생물학적 데이터셋을 통합하기 위한 특정 목적을 위해 생성되었으며 분석을 지원합니다.
대체 테크놀로지
대규모 병렬 시퀀싱의 진보는 RNA-Seq 기술의 발달로 이어져 유전자 [35][36]발현을 특징짓고 정량화하는 전체 전사체 산탄총 접근법을 가능하게 했다.마이크로어레이 자체가 설계되기 전에 참조 게놈과 트랜스크립텀을 이용할 수 있어야 하는 마이크로어레이와는 달리,[36] RNA-Seq는 게놈 배열이 아직 이루어지지 않은 새로운 모델 유기체에도 사용될 수 있다.
용어집
- 배열 또는 슬라이드는 열과 행으로 배열된 2차원 그리드에 공간적으로 배열된 피쳐 집합입니다.
- 블록 또는 서브어레이: 스팟의 그룹.일반적으로 1개의 인쇄 라운드로 작성됩니다.여러 개의 서브어레이/블럭이 어레이를 형성합니다.
- 케이스/컨트롤: 제어로서 선택된 조건(건강한 조직 또는 상태 등)과 변경된 조건(병든 조직 또는 상태 등)을 비교하는 2색 어레이 시스템에 특히 적합한 실험 설계 패러다임.
- 채널: 개별 형광구에 대해 스캐너에 기록된 형광 출력으로, 자외선일 수도 있습니다.
- 염료 플립 또는 염료 스왑 또는 불소 반전: 실험에서 염료 편향을 설명하기 위해 두 개의 염료와 DNA 표적의 상호 라벨링.
- 스캐너: 레이저로 형광을 선택적으로 들뜨게 하고 필터(광학) 광전자 증배 시스템으로 형광을 측정함으로써 마이크로 어레이 슬라이드의 형광 강도를 검출하고 정량화하는 데 사용되는 장치입니다.
- 스폿 또는 특징: 어레이 슬라이드의 작은 영역에 특정 DNA 샘플의 피코몰이 포함되어 있습니다.
- 기타 관련 용어는 다음을 참조하십시오.
「 」를 참조해 주세요.
- Transcriptomics 테크놀로지
- 매직십
- 마이크로 어레이 분석 기술
- 마이크로 어레이 데이터베이스
- Cy3 및 Cy5와 같은 시아닌 염료는 마이크로어레이와 함께 일반적으로 사용되는 형광체이다.
- 유전자 칩 분석
- 마이크로어레이의 유의성 분석
- 메틸화 특이 올리고뉴클레오티드 마이크로어레이
- 마이크로 유체 공학 또는 랩 온 칩
- 병원체학
- 표현형 마이크로어레이
- 시스템 생물학
- 전체 게놈 배열 분석
레퍼런스
- ^ Taub, Floyd (1983). "Laboratory methods: Sequential comparative hybridizations analyzed by computerized image processing can identify and quantitate regulated RNAs". DNA. 2 (4): 309–327. doi:10.1089/dna.1983.2.309. PMID 6198132.
- ^ Adomas A; Heller G; Olson A; Osborne J; Karlsson M; Nahalkova J; Van Zyl L; Sederoff R; Stenlid J; Finlay R; Asiegbu FO (2008). "Comparative analysis of transcript abundance in Pinus sylvestris after challenge with a saprotrophic, pathogenic or mutualistic fungus". Tree Physiol. 28 (6): 885–897. doi:10.1093/treephys/28.6.885. PMID 18381269.
- ^ Pollack JR; Perou CM; Alizadeh AA; Eisen MB; Pergamenschikov A; Williams CF; Jeffrey SS; Botstein D; Brown PO (1999). "Genome-wide analysis of DNA copy-number changes using cDNA microarrays". Nat Genet. 23 (1): 41–46. doi:10.1038/12640. PMID 10471496. S2CID 997032.
- ^ Moran G; Stokes C; Thewes S; Hube B; Coleman DC; Sullivan D (2004). "Comparative genomics using Candida albicans DNA microarrays reveals absence and divergence of virulence-associated genes in Candida dubliniensis". Microbiology. 150 (Pt 10): 3363–3382. doi:10.1099/mic.0.27221-0. PMID 15470115.
- ^ Hacia JG; Fan JB; Ryder O; Jin L; Edgemon K; Ghandour G; Mayer RA; Sun B; Hsie L; Robbins CM; Brody LC; Wang D; Lander ES; Lipshutz R; Fodor SP; Collins FS (1999). "Determination of ancestral alleles for human single-nucleotide polymorphisms using high-density oligonucleotide arrays". Nat Genet. 22 (2): 164–167. doi:10.1038/9674. PMID 10369258. S2CID 41718227.
- ^ a b c Gagna, Claude E.; Lambert, W. Clark (1 May 2009). "Novel multistranded, alternative, plasmid and helical transitional DNA and RNA microarrays: implications for therapeutics". Pharmacogenomics. 10 (5): 895–914. doi:10.2217/pgs.09.27. ISSN 1744-8042. PMID 19450135.
- ^ a b c Gagna, Claude E.; Clark Lambert, W. (1 March 2007). "Cell biology, chemogenomics and chemoproteomics - application to drug discovery". Expert Opinion on Drug Discovery. 2 (3): 381–401. doi:10.1517/17460441.2.3.381. ISSN 1746-0441. PMID 23484648. S2CID 41959328.
- ^ Mukherjee, Anirban; Vasquez, Karen M. (1 August 2011). "Triplex technology in studies of DNA damage, DNA repair, and mutagenesis". Biochimie. 93 (8): 1197–1208. doi:10.1016/j.biochi.2011.04.001. ISSN 1638-6183. PMC 3545518. PMID 21501652.
- ^ Rhodes, Daniela; Lipps, Hans J. (15 October 2015). "G-quadruplexes and their regulatory roles in biology". Nucleic Acids Research. 43 (18): 8627–8637. doi:10.1093/nar/gkv862. ISSN 1362-4962. PMC 4605312. PMID 26350216.
- ^ Rasheed, Awais; Hao, Yuanfeng; Xia, Xianchun; Khan, Awais; Xu, Yunbi; Varshney, Rajeev K.; He, Zhonghu (2017). "Crop Breeding Chips and Genotyping Platforms: Progress, Challenges, and Perspectives". Molecular Plant. Chin Acad Sci+Chin Soc Plant Bio+Shanghai Inst Bio Sci (Elsevier). 10 (8): 1047–1064. doi:10.1016/j.molp.2017.06.008. ISSN 1674-2052. PMID 28669791. S2CID 33780984.
- ^ J 생화학 바이오피스의 방법.2000년 3월 16일;42(3):105-10.DNA 인쇄: 표준 잉크젯 프린터를 사용하여 핵산을 고체 지지대로 옮깁니다.골드만 T, 곤잘레스 JS
- ^ Lausted C; et al. (2004). "POSaM: a fast, flexible, open-source, inkjet oligonucleotide synthesizer and microarrayer". Genome Biology. 5 (8): R58. doi:10.1186/gb-2004-5-8-r58. PMC 507883. PMID 15287980.
- ^ Bammler T, Beyer RP; Consortium, Members of the Toxicogenomics Research; Kerr, X; Jing, LX; Lapidus, S; Lasarev, DA; Paules, RS; Li, JL; Phillips, SO (2005). "Standardizing global gene expression analysis between laboratories and across platforms". Nat Methods. 2 (5): 351–356. doi:10.1038/nmeth754. PMID 15846362. S2CID 195368323.
- ^ Pease AC; Solas D; Sullivan EJ; Cronin MT; Holmes CP; Fodor SP (1994). "Light-generated oligonucleotide arrays for rapid DNA sequence analysis". PNAS. 91 (11): 5022–5026. Bibcode:1994PNAS...91.5022P. doi:10.1073/pnas.91.11.5022. PMC 43922. PMID 8197176.
- ^ Nuwaysir EF; Huang W; Albert TJ; Singh J; Nuwaysir K; Pitas A; Richmond T; Gorski T; Berg JP; Ballin J; McCormick M; Norton J; Pollock T; Sumwalt T; Butcher L; Porter D; Molla M; Hall C; Blattner F; Sussman MR; Wallace RL; Cerrina F; Green RD (2002). "Gene Expression Analysis Using Oligonucleotide Arrays Produced by Maskless Photolithography". Genome Res. 12 (11): 1749–1755. doi:10.1101/gr.362402. PMC 187555. PMID 12421762.
- ^ Shalon D; Smith SJ; Brown PO (1996). "A DNA microarray system for analyzing complex DNA samples using two-color fluorescent probe hybridization". Genome Res. 6 (7): 639–645. doi:10.1101/gr.6.7.639. PMID 8796352.
- ^ Tang T; François N; Glatigny A; Agier N; Mucchielli MH; Aggerbeck L; Delacroix H (2007). "Expression ratio evaluation in two-colour microarray experiments is significantly improved by correcting image misalignment". Bioinformatics. 23 (20): 2686–2691. doi:10.1093/bioinformatics/btm399. PMID 17698492.
- ^ Shafee, Thomas; Lowe, Rohan (2017). "Eukaryotic and prokaryotic gene structure". WikiJournal of Medicine. 4 (1). doi:10.15347/wjm/2017.002. ISSN 2002-4436.
- ^ Churchill, GA (2002). "Fundamentals of experimental design for cDNA microarrays" (PDF). Nature Genetics. supplement. 32: 490–5. doi:10.1038/ng1031. PMID 12454643. S2CID 15412245. Archived from the original (PDF) on 8 May 2005. Retrieved 12 December 2013.
- ^ NCTR 독성정보학 센터 - MAQC 프로젝트
- ^ "Prosigna Prosigna algorithm". prosigna.com. Retrieved 22 June 2017.
- ^ Little, M.A.; Jones, N.S. (2011). "Generalized Methods and Solvers for Piecewise Constant Signals: Part I" (PDF). Proceedings of the Royal Society A. 467 (2135): 3088–3114. doi:10.1098/rspa.2010.0671. PMC 3191861. PMID 22003312.
- ^ a b c Peterson, Leif E. (2013). Classification Analysis of DNA Microarrays. John Wiley and Sons. ISBN 978-0-470-17081-6.
- ^ De Southo M et al.(2008) 클러스터화 암 유전자 발현 데이터: 비교 연구, BMC 생물 정보학, 9(497).
- ^ Jaskowiak, Pablo A; Campello, Ricardo JGB; Costa, Ivan G (2014). "On the selection of appropriate distances for gene expression data clustering". BMC Bioinformatics. 15 (Suppl 2): S2. doi:10.1186/1471-2105-15-S2-S2. PMC 4072854. PMID 24564555.
- ^ Bolshakova N, Azuaje F(2003) 게놈 발현 데이터에 대한 클러스터 검증 기법, 신호 처리, Vol. 83, 페이지 825–833.
- ^ Ben Gal, I.; Shani, A.; Gohr, A.; Grau, J.; Arviv, S.; Shmilovici, A.; Posch, S.; Grosse, I. (2005). "Identification of transcription factor binding sites with variable-order Bayesian networks". Bioinformatics. 21 (11): 2657–2666. doi:10.1093/bioinformatics/bti410. ISSN 1367-4803. PMID 15797905.
- ^ Yuk Fai Leung과 Duccio Cavalieri, cDNA 마이크로 어레이 데이터 분석의 기초.Trends in Genetics Vol.19 2003년 11월 11일
- ^ Priness I.; Maimon O.; Ben-Gal I. (2007). "Evaluation of gene-expression clustering via mutual information distance measure". BMC Bioinformatics. 8 (1): 111. doi:10.1186/1471-2105-8-111. PMC 1858704. PMID 17397530.
- ^ Wei C; Li J; Bumgarner RE (2004). "Sample size for detecting differentially expressed genes in microarray experiments". BMC Genomics. 5: 87. doi:10.1186/1471-2164-5-87. PMC 533874. PMID 15533245.
- ^ Emmert-Streib, F. & Dehmer, M. (2008). Analysis of Microarray Data A Network-Based Approach. Wiley-VCH. ISBN 978-3-527-31822-3.
- ^ Wouters L; Gõhlmann HW; Bijnens L; Kass SU; Molenberghs G; Lewi PJ (2003). "Graphical exploration of gene expression data: a comparative study of three multivariate methods". Biometrics. 59 (4): 1131–1139. CiteSeerX 10.1.1.730.3670. doi:10.1111/j.0006-341X.2003.00130.x. PMID 14969494. S2CID 16248921.
- ^ Jain N; Thatte J; Braciale T; Ley K; O'Connell M; Lee JK (2003). "Local-pooled-error test for identifying differentially expressed genes with a small number of replicated microarrays". Bioinformatics. 19 (15): 1945–1951. doi:10.1093/bioinformatics/btg264. PMID 14555628.
- ^ Barbosa-Morais, N. L.; Dunning, M. J.; Samarajiwa, S. A.; Darot, J. F. J.; Ritchie, M. E.; Lynch, A. G.; Tavare, S. (18 November 2009). "A re-annotation pipeline for Illumina BeadArrays: improving the interpretation of gene expression data". Nucleic Acids Research. 38 (3): e17. doi:10.1093/nar/gkp942. PMC 2817484. PMID 19923232.
- ^ Mortazavi, Ali; Brian A Williams; Kenneth McCue; Lorian Schaeffer; Barbara Wold (July 2008). "Mapping and quantifying mammalian transcriptomes by RNA-Seq". Nat Methods. 5 (7): 621–628. doi:10.1038/nmeth.1226. ISSN 1548-7091. PMID 18516045. S2CID 205418589.
- ^ a b Wang, Zhong; Mark Gerstein; Michael Snyder (January 2009). "RNA-Seq: a revolutionary tool for transcriptomics". Nat Rev Genet. 10 (1): 57–63. doi:10.1038/nrg2484. ISSN 1471-0056. PMC 2949280. PMID 19015660.
외부 링크
| 라이브러리 리소스 정보 DNA마이크로어레이 |
- Curlie에서의 유전자 발현
- Curlie 생화학 및 분자생물학 마이크로스케일 제품 및 서비스
- Curlie 유전자 발현 제품 및 서비스
- Curlie 유전자 발현 분석을 위한 온라인 서비스
- 마이크로어레이 애니메이션 1Lec.com
- PLoS 생물 입문서:마이크로 어레이 분석
- 마이크로 어레이 테크놀로지 개요
- ArrayMining.net – 온라인 마이크로 어레이 분석용 무료 웹 서버
- 마이크로 어레이 - 어떻게 작동합니까?
- PNAS 코멘트:DNA 마이크로어레이 데이터의 수학적 모델링을 통한 자연의 원리 발견
- DNA 마이크로어레이 가상실험

 비교할 필요가 있다고
비교할 필요가 있다고 





