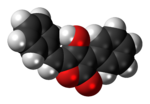
풀비노네
Pulvinone | |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 (E/Z)-5-페닐메틸렌-4-하이드록시-3-페닐푸란-2(5H)-1 | |||
| 식별자 | |||
| |||
3D 모델(JSmol) |
| ||
| 켐스파이더 |
| ||
펍켐 CID | |||
| 유니 | |||
| |||
| |||
| 특성. | |||
| C17H12O3 | |||
| 어금질량 | 264.1987 g·190−1 | ||
| 외관 | 누런 바늘 | ||
| 녹는점 | 243 ~ 247°C(469 ~ 477°F, 516 ~ 520K)[1] | ||
| 불용성 | |||
| 관련 화합물 | |||
관련 화합물 | 풀빈산, 벌피닌산 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
에스테르, 락톤, 알코올, 부테놀리드 등급에 속하는 유기 화합물인 풀비논은 황색 결정체 고체다.풀비논은 천연제품은 아니지만 자연발생 히드록시화 파생상품이 여럿 알려져 있다.이 수산화 펄비논은 유럽 공동의 라르크 보테(Boletus elegleans, 일명 Suillus grevili)와 같은 곰팡이 종이나 아스페르길루스 테레우스와 같은 곰팡이에 의해 생산된다.
역사
곰팡이(볼레티 등), 곰팡이 및 이끼는 하나의 (모노머) 단위 또는 여러 개의 (올리거머) 단위 펄빈산으로 구성된 광범위한 색소를 생산한다.1831년, 이끼의 성분(케트라리아 벌피나)에 대한 연구 과정에서 프랑스의 화학자 겸 약사 앙투안 베베르가 펄빈산의 자연발생 메틸 에스테르로 알려진 벌피닌산이라는 화합물을 발견했다.이 색소의 구조에 대한 자세한 내용은 1860년 독일의 화학자 프란츠 뮐러와 아돌프 스트렐러에 의해 밝혀졌다.[2]독일의 화학자 아돌프 슈피겔은[3][4][5][6] 불피니산의 구조를 해명하려다가 1880년에 불피니산이 디아시드로 사포니화 될 수 있다는 것을 발견했다.그는 그 결과로 생긴 diacid pulvinic acid를 명명했다.독일의 화학자 제이콥 볼하르드는[7] 해당 디야노콤 파운드의 기본적인 가수분해를 통해 이를 합성함으로써 펄빈산의 체질을 해명하였다.이 과정에서 소량의 부제품도 입수했다.1년 후 루드비히 클라이센과 토마스[8] 이완은 이 사이드 제품의 합성을 이루어 5-벤질리덴-4-하이드록시-3-페닐푸란-2-5-one으로 특징지어졌다.
Claisen과 Ewan은 그것을 Das der Pulvinsaure zu Grunde liegende Lucton(펄빈산의 구조 밑바탕에 있는 락톤): 그것이 풀비논이라는 이름의 유래라고 설명했다.
자연발생
풀비논이라는 단어가 집단 용어로 바뀐 것은 최초의 풀비논이 합성된 지 한 세기 만이다.1973년 에드워즈와 질은 자연적으로 발생한 최초의 히드록시화 풀비논 파생물을 분리했다.[9]이 삼하이드록실화 풀비논은 유럽 버섯 라르크 보우테(Suillus Grevili라고도 한다)의 줄기와 모자의 노란색을 담당하는 주요 색소 중 하나로 발견되었다.1973년 바로 같은 해, 세토와 동료들은 아스페르길루스 테레우스 곰팡이의 문화에서 수산화 펄빈을 발견하기도 했다.[10][11][12]그들의 유래를 주장하기 위해 - 그래서 수이러스 그레빌리에서 발견된 히드록실화 풀비논과 구별하기 위해 - 세토와 동료들은 이 화합물들을 아스풀비논이라고 이름 지었다.[13][14][15][16]또한 아스풀비논 용어에는 이러한 화합물의 크로마토그래픽 용출 순서를 나타내는 문자가 포함되어 있다(헨체, 최소 극성 아스풀비논 A, 다음 아스풀비논 B 등).
곰팡이와 이끼에 들어있는 다른 많은 노란 색소들처럼, 풀비논은 풀빈산 통로에서 거슬러 올라갈 수 있다.풀비논 구조 단위는 많은 천연물에서 발견된다.풀빈산의 모든 모노메릭(펄빈산 자체, 벌피닌산, 컴피드산, 아스풀비논, 코다이스타틴[17] 등) 또는 올리고메릭(바디온, [18]노르바디온,[19][20] 오란트리히오론[21] 등) 유도체는 풀비논 구조 요소를 포함한다.지금까지 자연적으로 발생하는 모든 풀비논 파생상품은 Z-구성이라는 것이 밝혀졌다.
약리학적 특성
- 레스 외 연구진은 쥐에서 일부 맥박의 응고 방지 활성을 보여주었다.[22][23][24][25]
- 80년대 초 ICI와 스미스 클라인앤프랑스 회사는 항염증, 항염증, 진통제 특성 때문에 벌피닉산의 파생상품을 대거 특허화했다.그러나 많은 파생상품들뿐만 아니라 벌피닌산은 세포독성 화합물이다.펄비논은 벌피닉산과 그 파생상품에 비해 세포독성이 낮기 때문에 오가론은 100개 이상의 풀비논의 의약품 잠재력을 조사했다.[26]현재까지 이들 연구 결과는 완전히 공개되지 않았다.
- 2005년 와이엣스사는 비페닐 대체펄비논을[27][28] 특허로 내성균을 포함한 그람 양성균에 대한 전도유망한 활동으로 특허를 얻었다.하지만, 풀비논에 기반한 항생제는 지금까지 동물용으로만 특허를 받았다.
화학적 특성
풀비논은 락톤으로, 보다 정확히 말하면 trans-1,4-diphenyl-2,3-dihydroxy-1,3-butadien-1-carboxylic acid)의 분자 내 에스테르로서, 이 에스테르에서 다음과 같은 한 가지 동등한 물을 제거하여 준비할 수 있다.[citation needed]
펄비논의 중앙 5-엠베드 링 코어는 4-히드록시-부테놀리드 구조를 보여준다.그것들은 본질적으로 에놀 형태에서 발견되는데, 에놀 형태는 히드록시 양성자의 상대적 실연성으로 인한 산성 성질을 나타낸다.따라서 풀비논과 같은 4-제복시 부테놀리드는 테트로닉산이라고 불리며, 더 큰 범주의 빈니로고우산에 속한다.
생합성
진균 생합성은 페닐알라닌과 티로신 같은 방향족 아미노산으로부터 시작되는데, 해당 아릴피루빅산에 옥시 디아민을 제거한 후, 일련의 조광화, 산화 링-클레이브, 데카르복실화에 의해 풀비논 골격이 형성된다.[29][page range too broad]

총합성
Jacob Volhard는 벌피닌산, 풀빈산, 풀비논을 합성했다.[7]현재까지 총 11개의 펄스 합성이 보고되었다.
- 1895년 클라이센과 이완이 작곡한 [8]곡은
- 1975년, 1979년 나이트와 패튼이 작곡한 [30][31]곡은
- 1979년 제리스, 보브쿨리히, 아모스 B.스미스 [32]3세
- 1984년 라마게 외,[1]
- 1985년 캠벨 외,[26]
- 1990년 길 외,[33]
- 1991년 패튼덴, 투르빌, 초렐톤에 [34]의해
- 2005년 Caufield 외,[27]
- 2006년 Antane 외,[28]
- 2007년 카지부라와 브뤼크너에 [35]의해
- 버니어, 모저, 브뤼크너가 2007년에 작곡했다.[36][37]
참고 항목
원천
- ^ a b Ramage, Robert; Griffiths, Gareth J.; Shutt, Fiona E.; Sweeney, John N. A. (1984). "Dioxolanones as synthetic intermediates. Part 2. Synthesis of tetronic acids and pulvinones". Journal of the Chemical Society, Perkin Transactions 1: 1539. doi:10.1039/P19840001539.
- ^ 칸스타트의 자흐레스베리히트 뷔베르가 알렌 랑던, 하버드 대학교 자흐르강 10 (1861년)에 있는 더 파르칸디에서 포르츠크리트(Farmictie und Verwandte Wissenschaften)를 죽인다.
- ^ A. 슈피겔, 베르. Dtsch, Chemich. Ges. 1880, 13, 2, 1629-1635 doi:10.1002/cber.18800130293
- ^ A. 슈피겔, 베르. Dtsch, Chemich. Ges. 1880, 13, 2, 2219-2221 doi:10.1002/cber.188001302237.
- ^ A. 슈피겔, 베르. Dtsch, Chemich. Ges. 1881, 14, 1, 873-874 doi:10.1002/cber.188101401183.
- ^ a b A. 슈피겔, 베르. Dtsch, Chemich. Ges. 1881, 14, 2, 1686-1696 doi:10.1002/cber.18810140230.
- ^ a b c J. 볼하르트, 애널. Chem. 1894, 282, 1-21 doi:10.1002/jlac.18942820102.
- ^ a b L. Claisen, Th. Ewan, Annal. Chem, 1895, 284, 245-299 doi:10.1002/jlac.18952840302.
- ^ R. L. Edwards, M. Gill, J. Chem. Soc, Perkin Trans. 1 1973, 1921-1929. doi:10.1039/P19730001921.
- ^ N. 오지마, S.타케나카, S. 세토, 피토케미스트리(Elsevier) 1973, 12, 2527-2529.
- ^ N. 오지마, K. 오구라, S. 세토, J. 켐. Soc, Chem. 1975년, 717-718.
- ^ N. 오지마, S.타케나카, S. 세토, 피토케미스트리(Elsevier) 1975, 14, 573-576.
- ^ N. 오지마, 나.다카하시, K. 오구라, S. 세토, 테트라헤드론 레트. 1976, 17, 1013-1014.
- ^ I. 다카하시, N. 오지마, K. 오구라, S. 세토, 생화학 1978, 17, 2696-2702.
- ^ M. 코바야시, N. 오지마, K. 오구라, S. 세토, 화학. 1979년, 579-582번지
- ^ H. 스기야마, N. 오지마, M. 고바야시, Y. 센다, J. 이시야마, S. 세토, 아그리치. 1979, 43, 403-4
- ^ L. Vértesy, H.-J. Burger, J. Kenja, M. Knauf, H. Kogler, E. F. Paulus, N. V. S. Ramakrishna, K. H. S. Swamy, E. K. S. Vijayakumar, P. Hammann, J. Antibiot.2000, 53, 677-686.
- ^ B. Steffan, W. Steglich, Angew. 화학. 인트. Ed. 1984, 23, 6, 445-447. doi:10.1002/anie.198404451.
- ^ M. 길, D. A. 롤리, 파이토케미칼 1985, 24, 1351-1354. 도이:10.1016/S0031-9422(00)81131-0.
- ^ T. 르 갈, C.Mioskowski, B.아메크라즈 외안젤라, 화학. 2003년 Ed. 2003, 42, 11, 1289-1293. doi:10.1002/anie.198404451.
- ^ D. Clostermeyer, L. Knops, T. 신들링거, K. 폴본, W. Steglich Eur. J. Org. Chem. 2000, 4, 603-609. doi:10.1002/anie. 200390332.
- ^ K. 레세, J. 와겐크네히트, N. 리에트브록, 아치. 제약회사 (Weinheim, Ger.) 1978, 311, 986-991.
- ^ K. 레세, U. 에미쉬, 아치. 제약회사 (Weinheim, Ger.) 1982, 315, 1020-1025.
- ^ K. 레스, J. 쉬크, G. 보허트, 아치. 제약회사 (Weinheim, Ger.) 1979, 312, 390-394.
- ^ K. 레스, J. 렘케, 아치. 제약회사 (Weinheim, Ger.) 1985, 318, 11-14.
- ^ a b A. C. 캠벨, M. S. 메이드먼트, J. H. 픽, D. F. M. 스티븐슨, J. Chem. Soc, Perkin Trans. 1985, 1567-1576. doi:10.1039/P19850001567.
- ^ a b C. E. Caufield, S. A. Antane, K. M. M. Morris, S. M. Naughton, D.A. 콰글리아토, P. M. 안드레이, A.에노스, J. F.Chiarelo, J. (Wyeth, and Brother Ltd, 미국, Brother Ltd.) WO 20050196, US 2005054721, 2005.
- ^ a b S. A. Antane, C. E. Caufield, W. Hu, D. Keeney, P. Labthavikul, K. M. Morris, S. M. Naughton, P. J. Petersen, B. A. Rasmussen, G. Singh, Y. Yang, Bioorg. 의학. 화학. 2006년, 176-180. doi:10.1016/j.bmcl. 2005.09.021
- ^ a b Gill, M. & Steglich, W. (1987). "Pigments of Fungi (Macromycetes)". Fortschr. Chem. Org. Naturst. [Prog. Chem. Org. Nat. Prod.] Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products. 51: 1–297. doi:10.1007/978-3-7091-6971-1_1. ISBN 978-3-7091-7456-2. PMID 3315906.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크)[페이지 범위가 너무 넓다] - ^ D. W. Knight, G. Pattenden, J. Chem. Soc, Chem. 1975년, 876-877 도이:10.1039/C39750000876
- ^ D. W. Knight, G. Pattenden, J. Chem. Soc, Perkin Trans. 1 1979, 70-76 doi:10.1039/P19790000070.
- ^ P. J. J. 예리스, P. M. Wovkulich, A. B. Smith III, Tetrahedron Lett. 1979, 20, 4517-20 doi:10.1016/S0040-4039(01)86637-5.
- ^ M. Gill, M. J. Kiefel, D. A. Lally, A.10개, 호주. J. Chem. 1990, 43, 1497-518.
- ^ G. Pattenden, M. W. Turvill, A. P. Chorlton, J. Chem. Soc, Perkin Trans. 1 1991, 10, 2357-2361. doi:10.1039/P19910002357.
- ^ N. 카지부라, R. 브뤼크너 합성 2007, 118-130. doi:10.1055/s-2006-950378.
- ^ D. 버니어, F.Moser, R. Bruckner 합성 2007, 15, 2240-2248. doi:10.1055/s-2007-983800.
- ^ D. 버니어, R. 브뤼크너 합성 2007, 15, 2249-2272. 도이:10.1055/s-2007-983803.