힐 방정식 (생화학)
Hill equation (biochemistry)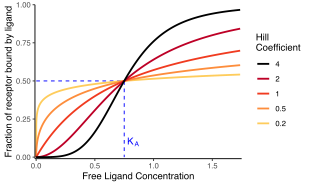
생화학과 약리학에서 힐 방정식(Hill equation)은 리간드 농도의 함수로서 리간드와 고분자의 결합을 반영하는 두 개의 밀접한 관련이 있는 방정식을 말합니다.리간드(ligand)는 "생물학적 목적을 달성하기 위해 생체 분자와 복합체를 형성하는 물질"(ligand 정의)이며, 고분자는 단백질과 같이 매우 큰 분자로 복잡한 구성요소 구조를 가지고 있습니다(대분자 정의).단백질-리간드 결합은 일반적으로 표적 단백질의 구조를 변화시키고, 그에 따라 세포에서 그 기능을 변화시킵니다.
두 힐 방정식의 구별은 점유율을 측정하느냐 반응을 측정하느냐에 있습니다.힐 방정식은 리간드에 의해 포화되거나 결합된 분율인 거대 분자의 점유를 반영합니다.[1][2][nb 1]이 방정식은 공식적으로 랭뮤어 등온선과 동치입니다.[3]반대로, 힐 방정식은 리간드에 대한 세포 또는 조직의 반응을 적절히 반영합니다: 근육 수축과 같은 시스템의 생리적 출력.
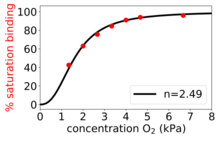
힐 방정식은 원래 1910년 아치볼드 힐이 헤모글로빈의 S자형 O 결합2 곡선을 설명하기 위해 만들었습니다.[4]
리간드와 매크로 분자의 결합은 동일한 매크로 분자에 이미 다른 리간드가 존재하는 경우(이를 협동 결합이라고 함) 종종 강화됩니다.힐 방정식은 효소 또는 수용체에 결합하는 리간드(들)의 협조성 정도를 결정하는 데 유용합니다.힐 계수는 리간드 결합 부위 간의 상호작용 정도를 정량화하는 방법을 제공합니다.[5]
힐 방정식(반응의 경우)은 선량-반응 곡선을 구성하는 데 중요합니다.
리간드 결합 수용체 비율
힐 방정식은 일반적으로 다음과 같은 방식으로 표현됩니다.[2][7][8]
여기서:
- displaystyle\theta}는 리간드에 의해 결합된 수용체 단백질 농도의 부분입니다.
- 은(는) 총 리간드 농도입니다.
- 는 질량 작용 법칙에서 도출된 겉보기 해리 상수이며,
- 는 리간드 농도가 절반의 점유를 생성하는 것이고,
- 은(는) 힐 계수입니다.
= displaystyle n = 1}인 특수한 경우는 모노드 방정식입니다.
상수
약리학에서θ {\displaystyletheta}는 종종 {\ce{AR로 A ce {A}}는 에 해당하는 리간드이고R {R}}는 수용체입니다.\theta}는 수용체의 총량과 리간드 결합 수용체 농도로 표현할 수 있습 θ = [LR ] [ R total ] {\displaystyle \thta = {\ce {[LR]}}{\ce {[R_{\rm {total}}}}{\ce {[R_{\rm {total}}}}. 는eptor 복합체의 해리율과 그 결합율의 비율과 같습니( = {\textstyle K_{d}}={k_{\rm {d \over k_{\rm {a}}).Kd는 해리에 대한 평형 상수입니다. 는 =K = a textstyle (K_{A}){} = K_{\rm{d} = {k_{\rm {d} \over k_{\rm {a}}, 이는 미시 해리 상수라고도 하며 결합 부위의 절반을 차지하는 리간드 농도입니다.최근 문헌에서는 이 상수를 라고 부르기도 합니다[8]
가둠 방정식
가덤 방정식은 힐 방정식을 더욱 일반화한 것으로, 가역적인 경쟁적 대항제의 존재를 통합한 것입니다.[1]가둠 방정식은 힐 방정식과 유사하게 유도되지만 수용체와 리간드, 수용체와 길항제의 두 가지 평형으로 유도됩니다.따라서 가둠 방정식은 리간드의 평형 상수와 길항제의 평형 상수 2개를 갖습니다.
언덕도

힐 그림은 힐 방정식을 직선으로 재배열하는 것입니다.
힐 방정식의 양변의 역수를 취하면 θ 1 - θ = [ L ]nK =[ ] n ( K A ) n {\theta \over 1-\theta } = {[{\ce {L}}]^{n} \over K_{d} = {[{\ce {L}}}^{n} \over (K_{A}) ^{n}}방정식의 양변의 로그를 취하면 힐-랑무어 방정식의 대체 공식이 됩니다.
이 힐 방정식의 마지막 형식은 θ1 - θ) {\textstyle \log \left({\theta \over 1-\theta}\right)} 대 로그 [L] {\displaystyle \log {[{\ce {L}}}}의 플롯이 선형 플롯을 산출하기 때문에 유리합니다.힐 플롯의 기울기는 생화학적 상호작용에 대한 힐 계수와 같기 때문에 기울기는 로 표시됩니다 따라서 기울기가 1보다 크면 수용체와 리간드 사이의 양의 협력 결합을 나타내고, 기울기가 1보다 작으면 음의 협력 결합을 나타냅니다.
이와 같이 방정식을 선형 형태로 변환하는 것은 연구자들이 데이터에 선을 맞추어 매개변수를 결정할 수 있게 해 주었기 때문에 컴퓨터가 널리 사용되기 전에 매우 유용했습니다.그러나 이러한 변환은 오류 전파에 영향을 미치며, 이로 인해 0 또는 1 근처의 데이터 점에서 과도한 가중치가 발생할 수 있습니다.[nb 2]이는 데이터에 적합된 선형 회귀선의 모수에 영향을 미칩니다.또한 컴퓨터를 사용하면 비선형 회귀를 포함한 보다 강력한 분석이 가능합니다.
조직반응

수용체에 결합하는 약물의 정량화와 반응을 생성하는 약물 간의 구분이 이루어져야 합니다.두 값 사이에 반드시 선형 관계가 있는 것은 아닙니다.본 기사의 힐 방정식에 대한 이전 정의와 달리, IUPHAR는 조직 반응 의 관점에서 힐 방정식을 다음과[1] 같이 정의합니다
이 형식의 방정식은 약물에 대한 조직/세포/집단 반응을 반영할 수 있으며 선량 반응 곡선을 생성하는 데 사용할 수 있습니다. 와 EC50 사이의 관계는 매우 복잡할 수 있습니다. 생물학적 반응은 무수히 많은 요인의 총합이기 때문입니다. 약물은 친화도와 관계없이 더 많은 수용체가 존재하면 다른 생물학적 효과를 가질 것입니다.
델 카스티요 카츠 모델은 리간드 결합 수용체의 활성화된 형태에 리간드 결합 수용체의 두 번째 평형을 포함함으로써 힐 방정식을 수용체 활성화와 관련시키는 데 사용됩니다.
자극의 함수로서 반응의 통계적 분석은 프로빗 모델 또는 로짓 모델과 같은 회귀 방법 또는 스피어맨-케르버 방법과 같은 다른 방법에 의해 수행될 수 있습니다.[9]비선형 회귀에 기초한 경험적 모델은 대개 선량-반응 관계를 선형화하는 데이터의 일부 변환을 사용하는 것보다 선호됩니다.[10]
힐계수
힐 계수는 초감도(즉, 반응 곡선이 얼마나 가파른지)를 측정하는 척도입니다.
힐 계수, 또는 H 는 협동성(또는 힐 방정식이 사용되는 상황에 따라 다른 생화학적 특성)을 나타낼 수 있습니다.적절한 경우, [clarification needed]힐 계수 값은 다음과 같은 방법으로 리간드 결합의 협동성을 나타냅니다.
- 양의 협력 바인딩:일단 한 리간드 분자가 효소에 결합하면, 다른 리간드 분자에 대한 친화도가 증가합니다.예를 들어, 헤모글로빈에 결합하는 산소의 힐 계수(양의 협동성의 예)는 1.7–3.2의 범위에 속합니다.[5]
- < 음의 협력 바인딩:일단 한 리간드 분자가 효소에 결합하면, 다른 리간드 분자에 대한 친화력은 감소합니다.
- = displaystye n=1}. 비협조적(완전히 독립적) 바인딩:리간드 분자에 대한 효소의 친화도는 다른 리간드 분자가 이미 결합되어 있는지 여부에 의존하지 않습니다.n=1일 때, 우리는 = = KM {\textstyle K_{D} = K_인 미카엘리스-멘텐키네틱스에 의해 모델링될 수 있는 모델을 얻습니다.}미카엘리스-멘텐 상수.
힐 계수는 다음과 같이 Taketa와 Pogell의[12] 협력 지수로 대략 계산할 수 있습니다.[13]
- = 10 (81 ) log10 (EC 90 / EC 10 ) {\displaystye n={\frac {\log _{10}(81)}{\log _{10}}{\log _{10}({\ce {EC90}}/{\ce {EC10}}}}.
여기서 및 은 각각 최대 응답의 10% 및 90%를 생성하는 데 필요한 입력 값입니다.
리버서블 폼
힐 방정식의 가장 일반적인 형태는 그것의 비가역적 형태입니다.그러나 계산 모델을 구축할 때 제품 억제를 모델링하기 위해서는 종종 가역적인 형태가 필요합니다.이러한 이유로 호프마이어와 코니쉬 보우덴은 가역 힐 방정식을 고안했습니다.[14]
탄성계수와의 관계
힐 계수는 탄성 계수와도 밀접하게 연결되어 있으며, 여기서 힐 계수는 다음과 같습니다.
여기서θ \theta}는 부분, / {\ ES/E_{}},ε v _{s}^{v} 탄력 계수입니다.
이는 힐 방정식의 기울기를 취함으로써 도출됩니다.
계수 규칙을 사용하여 기울기를 확장합니다.결과는 위의 방정식을 다음과 같이 재배열할 수 있으므로 탄성이 을(를) 절대 초과할 수 없음을 보여줍니다.
적용들
힐 방정식은 약물의[citation needed] 기능적 매개변수를 정량화하기 위해 약리학에서 광범위하게 사용되며 생화학의 다른 분야에서도 사용됩니다.
힐 방정식은 예를 들어 이온 채널 개방 확률(P-open) 대 리간드 농도와 같은 선량-반응 관계를 설명하는 데 사용할 수 있습니다.[15]
유전자 전사 규정
힐 방정식은 모 유전자가 전사 인자(예: 활성제 및/또는 억제제)에 의해 조절될 때 유전자 생성물이 생성되는 속도를 모델링할 때 적용될 수 있습니다.[11]이렇게 하는 것은 유전자가 전사 인자에 대한 다수의 결합 부위에 의해 조절될 때 적절하며, 이 경우 전사 인자는 DNA를 협력적인 방식으로 결합할 수 있습니다.[16]
유전자 X로부터 단백질의 생성이 전사 인자 Y에 의해 상향 조절(활성화)되면, 단백질 X의 생성 속도는 활성화된 Y 단백질의 농도의 관점에서 미분 방정식으로 모델링될 수 있습니다.
- ,
여기서 k는 유전자 X의 최대 전사율입니다.
마찬가지로, 유전자 Y로부터 단백질의 생성이 전사 인자 Z에 의해 하향 조절(억제)되면, 단백질 Y의 생성 속도는 활성화된 Z 단백질의 농도 측면에서 미분 방정식으로 모델링될 수 있습니다.
- ,
여기서 k는 유전자 Y의 최대 전사율입니다.
한계
리간드 분자가 수용체에 동시에 결합한다는 가정 때문에 힐 방정식은 물리적으로 비현실적인 모델이라는 비판을 받아왔습니다.[5]또한, 힐 계수는 첫 번째 리간드와 후속 리간드의 결합이 극단적인 양의 협력성을 초래하는 경우를 제외하고는 수용체[5][17] 상의 협력 리간드 결합 부위 수의 신뢰성 있는 근사치로 간주되어서는 안 됩니다.[5]
더 복잡한 모델과 달리 비교적 간단한 힐 방정식은 단백질 리간드 상호 작용의 근본적인 생리학적 메커니즘에 대한 통찰력을 거의 제공하지 않습니다.그러나 이 단순성은 힐 방정식을 유용한 경험적 모델로 만드는 이유인데, 이는 그것의 사용이 연구 중인 단백질 또는 리간드의 특성에 대한 사전 지식을 거의 필요로 하지 않기 때문입니다.[2]그럼에도 불구하고, 다른 더 복잡한 협력 결합 모델이 제안되었습니다.[7]이러한 모델에 대한 자세한 내용과 예제는 Cooperative binding을 참조하십시오.
힐 계수와 같은 전역 민감도 측정은 s 모양 곡선의 국소적인 거동을 특성화하지 않습니다.대신 이러한 특징은 반응 계수 측도를 통해 잘 포착됩니다.[18]
힐 계수와 반응 계수 사이에는 다음과 같은 관계가 있습니다.Altszyler et al. (2017)은 이러한 초음파 민감도 측정이 연관될 수 있음을 보여주었습니다.[13]
참고 항목
메모들
참고문헌
- ^ a b c Neubig, Richard R. (2003). "International Union of Pharmacology Committee on Receptor Nomenclature and Drug Classification. XXXVIII. Update on Terms and Symbols in Quantitative Pharmacology" (PDF). Pharmacological Reviews. 55 (4): 597–606. doi:10.1124/pr.55.4.4. PMID 14657418. S2CID 1729572.
- ^ a b c Gesztelyi, Rudolf; Zsuga, Judit; Kemeny-Beke, Adam; Varga, Balazs; Juhasz, Bela; Tosaki, Arpad (31 March 2012). "The Hill equation and the origin of quantitative pharmacology". Archive for History of Exact Sciences. 66 (4): 427–438. doi:10.1007/s00407-012-0098-5. ISSN 0003-9519. S2CID 122929930.
- ^ Langmuir, Irving (1918). "The adsorption of gases on plane surfaces of glass, mica and platinum". Journal of the American Chemical Society. 40 (9): 1361–1403. doi:10.1021/ja02242a004.
- ^ Hill, A. V. (1910-01-22). "The possible effects of the aggregation of the molecules of haemoglobin on its dissociation curves". J. Physiol. 40 (Suppl): iv–vii. doi:10.1113/jphysiol.1910.sp001386. S2CID 222195613.
- ^ a b c d e Weiss, J. N. (1 September 1997). "The Hill equation revisited: uses and misuses". The FASEB Journal. 11 (11): 835–841. doi:10.1096/fasebj.11.11.9285481. ISSN 0892-6638. PMID 9285481. S2CID 827335.
- ^ "Proceedings of the Physiological Society: January 22, 1910". The Journal of Physiology. 40 (suppl): i–vii. 1910. doi:10.1113/jphysiol.1910.sp001386. ISSN 1469-7793. S2CID 222195613.
- ^ a b c Stefan, Melanie I.; Novère, Nicolas Le (27 June 2013). "Cooperative Binding". PLOS Computational Biology. 9 (6): e1003106. Bibcode:2013PLSCB...9E3106S. doi:10.1371/journal.pcbi.1003106. ISSN 1553-7358. PMC 3699289. PMID 23843752.
- ^ a b c d Nelson, David L.; Cox, Michael M. (2013). Lehninger principles of biochemistry (6th ed.). New York: W.H. Freeman. pp. 158–162. ISBN 978-1429234146.
- ^ Hamilton, MA; Russo, RC; Thurston, RV (1977). "Trimmed Spearman–Karber method for estimating median lethal concentrations in toxicity bioassays". Environmental Science & Technology. 11 (7): 714–9. Bibcode:1977EnST...11..714H. doi:10.1021/es60130a004.
- ^ Bates, Douglas M.; Watts, Donald G. (1988). Nonlinear Regression Analysis and its Applications. Wiley. p. 365. ISBN 9780471816430.
- ^ a b Alon, Uri (2007). An Introduction to Systems Biology: Design Principles of Biological Circuits ([Nachdr.] ed.). Boca Raton, FL: Chapman & Hall. ISBN 978-1-58488-642-6.
- ^ Taketa, K.; Pogell, B. M. (1965). "Allosteric inhibition of rat-liver fructose 1,6-diphosphatase by adenosine 5'-monophosphate". J. Biol. Chem. 240 (2): 651–662.
- ^ a b Altszyler, E; Ventura, A. C.; Colman-Lerner, A.; Chernomoretz, A. (2017). "Ultrasensitivity in signaling cascades revisited: Linking local and global ultrasensitivity estimations". PLOS ONE. 12 (6): e0180083. arXiv:1608.08007. Bibcode:2017PLoSO..1280083A. doi:10.1371/journal.pone.0180083. PMC 5491127. PMID 28662096.
- ^ Hofmeyr, Jan-Hendrik S.; Cornish-Bowden, Athel (1997). "The reversible Hill equation: how to incorporate cooperative enzymes into metabolic models". Bioinformatics. 13 (4): 377–385. doi:10.1093/bioinformatics/13.4.377.
- ^ Ding, S; Sachs, F (1999). "Single Channel Properties of P2X2 Purinoceptors". J. Gen. Physiol. The Rockefeller University Press. 113 (5): 695–720. doi:10.1085/jgp.113.5.695. PMC 2222910. PMID 10228183.
- ^ Chu, Dominique; Zabet, Nicolae Radu; Mitavskiy, Boris (2009-04-07). "Models of transcription factor binding: Sensitivity of activation functions to model assumptions" (PDF). Journal of Theoretical Biology. 257 (3): 419–429. Bibcode:2009JThBi.257..419C. doi:10.1016/j.jtbi.2008.11.026. PMID 19121637.
- ^ Monod, Jacques; Wyman, Jeffries; Changeux, Jean-Pierre (1 May 1965). "On the nature of allosteric transitions: A plausible model". Journal of Molecular Biology. 12 (1): 88–118. doi:10.1016/S0022-2836(65)80285-6. PMID 14343300.
- ^ Kholodenko, Boris N.; et al. (1997). "Quantification of information transfer via cellular signal transduction pathways". FEBS Letters. 414 (2): 430–434. doi:10.1016/S0014-5793(97)01018-1. PMID 9315734. S2CID 19466336.
추가열람
- 도를랜드의 삽화가 있는 의학사전
- Coval, ML (December 1970). "Analysis of Hill interaction coefficients and the invalidity of the Kwon and Brown equation". J. Biol. Chem. 245 (23): 6335–6. doi:10.1016/S0021-9258(18)62614-6. PMID 5484812.
- d'A Heck, Henry (1971). "Statistical theory of cooperative binding to proteins. Hill equation and the binding potential". J. Am. Chem. Soc. 93 (1): 23–29. doi:10.1021/ja00730a004. PMID 5538860.
- Atkins, Gordon L. (1973). "A simple digital-computer program for estimating the parameter of the Hill Equation". Eur. J. Biochem. 33 (1): 175–180. doi:10.1111/j.1432-1033.1973.tb02667.x. PMID 4691349.
- Endrenyi, Laszlo; Kwong, F. H. F.; Fajszi, Csaba (1975). "Evaluation of Hill slopes and Hill coefficients when the saturation binding or velocity is not known". Eur. J. Biochem. 51 (2): 317–328. doi:10.1111/j.1432-1033.1975.tb03931.x. PMID 1149734.
- Voet, Donald; Voet, Judith G. (2004). Biochemistry.
- Weiss, J. N. (1997). "The Hill equation revisited: uses and misuses". FASEB Journal. 11 (11): 835–841. doi:10.1096/fasebj.11.11.9285481. PMID 9285481. S2CID 827335.
- Kurganov, B. I.; Lobanov, A. V. (2001). "Criterion for Hill equation validity for description of biosensor calibration curves". Anal. Chim. Acta. 427 (1): 11–19. doi:10.1016/S0003-2670(00)01167-3.
- Goutelle, Sylvain; Maurin, Michel; Rougier, Florent; Barbaut, Xavier; Bourguignon, Laurent; Ducher, Michel; Maire, Pascal (2008). "The Hill equation: a review of its capabilities in pharmacological modelling". Fundamental & Clinical Pharmacology. 22 (6): 633–648. doi:10.1111/j.1472-8206.2008.00633.x. PMID 19049668. S2CID 4979109.
- Gesztelyi R; Zsuga J; Kemeny-Beke A; Varga B; Juhasz B; Tosaki A (2012). "The Hill equation and the origin of quantitative pharmacology". Archive for History of Exact Sciences. 66 (4): 427–38. doi:10.1007/s00407-012-0098-5. S2CID 122929930.
- Colquhoun D (2006). "The quantitative analysis of drug-receptor interactions: a short history". Trends Pharmacol Sci. 27 (3): 149–57. doi:10.1016/j.tips.2006.01.008. PMID 16483674.
- Rang HP (2006). "The receptor concept: pharmacology's big idea". Br J Pharmacol. 147 (Suppl 1): S9–16. doi:10.1038/sj.bjp.0706457. PMC 1760743. PMID 16402126.
![{\displaystyle {\begin{aligned}\theta &={[{\ce {L}}]^{n} \over K_{d}+[{\ce {L}}]^{n}}\\&={[{\ce {L}}]^{n} \over (K_{A})^{n}+[{\ce {L}}]^{n}}\\&={1 \over 1+\left({K_{A} \over [{\ce {L}}]}\right)^{n}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/386ff885fdf558b83ca54868e1c90d7a27431451)
![{\displaystyle {\ce {[L]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b3d168a8fcf5a74047be127a23620e6c9a5534c1) (는) 총
(는) 총 
 리간드 농도가 절반의 점유를 생성하는 것이고,
리간드 농도가 절반의 점유를 생성하는 것이고, (는) 힐 계수입니다.
(는) 힐 계수입니다.
![{\displaystyle {\begin{aligned}\log \left({\theta \over 1-\theta }\right)&=n\log {[{\ce {L}}]}-\log {K_{d}}\\&=n\log {[{\ce {L}}]}-n\log {K_{A}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85e17bac0e7828741f0ce8943abbf129033f3fba)


![{\displaystyle {\begin{aligned}{\frac {E}{E_{\mathrm {max} }}}&={\frac {[A]^{n}}{{\text{EC}}_{50}^{n}+[A]^{n}}}\\&={\frac {1}{1+\left({\frac {{\text{EC}}_{50}}{[A]}}\right)^{n}}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e59f5002b0fc98cc03c0931e09ee8c937da865a2)
![{\displaystyle {\ce {[A]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/881146b6653b24508d87e34a81c84832f1d5ffea) 약물 농도,
약물 농도,  최대 50%의 반응을 나타내는 약물 농도입니다.(이전 섹션의) 해리 상수는 리간드 결합과 관련이 있는 반면,
최대 50%의 반응을 나타내는 약물 농도입니다.(이전 섹션의) 해리 상수는 리간드 결합과 관련이 있는 반면, 





![{\displaystyle {\mathrm {d} \over \mathrm {d} t}[{\rm {X_{produced}}}]=k\ \cdot {{[{\rm {Y_{active}}}]^{\mathit {n}}} \over {(K_{A})^{n}\ +\ {[{\rm {Y_{active}}}]^{\mathit {n}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce8f1d4a7e5379a47f17d14efde6a9c497496bac)
![{\displaystyle {\mathrm {d} \over \mathrm {d} t}[{\rm {Y_{produced}}}]=k\ \cdot {{(K_{A})^{\mathit {n}}} \over {(K_{A})^{n}\ +\ {[{\rm {Z_{active}}}]^{\mathit {n}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c4fca0f3452f5c99014402ed5ed8f04e7286e4be)



