엽록체
Chloroplast엽록체 /ˈklɔrrplplplæst, -plɑːst/[1][2]는 주로 식물과 조류 세포에서 광합성을 하는 플라스티드로 알려진 막 결합형 오르간젤의 일종이다.광합성 색소 엽록소는 태양빛으로부터 에너지를 포착하여 변환시켜 에너지 저장 분자 ATP와 NADPH에 저장하면서 세포 내 수분으로부터 산소를 자유롭게 한다.그리고 나서 ATP와 NADPH는 칼빈 사이클이라고 알려진 과정에서 이산화탄소로부터 유기 분자를 만드는 데 사용된다.엽록체들은 지방산 합성, 많은 아미노산 합성, 그리고 식물의 면역 반응을 포함한 많은 다른 기능들을 수행한다.세포당 엽록체 수는 단세포 조류에서 1개에서 아라비도시스나 밀과 같은 식물에서 100개까지 다양하다.
엽록체는 두 개의 막과 엽록소의 농도가 높은 것이 특징이다.다른 플라스티드 타입인 류코플라스틱이나 크로모플라스틱은 엽록소를 거의 함유하지 않고 광합성을 하지 않는다.
엽록체들은 매우 역동적이다. 그들은 순환하고 식물 세포 안에서 이동하며, 때때로 번식하기 위해 둘로 꼬집는다.그들의 행동은 밝은 색과 강렬함 같은 환경적 요인에 의해 강한 영향을 받는다.엽록체들은 미토콘드리아와 마찬가지로 그들 자신의 DNA를 포함하고 있는데, 이것은 그들의 조상으로부터 물려받은 것으로 생각되는 광합성 시아노박테리움 즉, 초기 진핵세포에 의해 삼켜진 광합성 시아노박테리움이다.[3]엽록체는 식물세포에서 만들 수 없으며 세포분할 중 각 딸세포에서 물려받아야 한다.
한가지 예외(아메보이드 파울리넬라 크로마토포라)를 제외하면, 모든 엽록체들은 아마도 시아노박테리움이 진카리오테에 휩싸였을 때 단일 내분비생물학적 사건으로 추적될 수 있을 것이다.그럼에도 불구하고 엽록체들은 극도로 광범위한 유기체에서 발견될 수 있는데, 어떤 유기체들은 서로 직접적으로 연관되지도 않는다. 이는 많은 2차적이고 3차적인 내분비생물학적 사건의 결과물이다.
엽록체라는 단어는 초록색을 뜻하는 그리스어 클로로스(χλωως)와 '형성하는 자'[4]를 뜻하는 플라스티즈(Plastes)에서 유래했다.
디스커버리
엽록체(Cloroprast, "Clorophilkörnen, "엽록소의 회색")에 대한 최초의 결정적인 설명은 1837년 휴고 폰 모울에 의해 녹색 식물 세포 내의 이산체로서 주어졌다.[5]1883년 안드레아스 프란츠 빌헬름 쉬머는 이 시체들을 "염소플라스티드"(Cloroplastiden)[6]라고 명명했다.1884년 에두아르트 스트라스버거는 '염소플라스틱'(Cloroplasten)이라는 용어를 채택하였다.[7][8][9]
선과 진화
엽록체들은 식물 세포에 있는 많은 종류의 유기체들 중 하나이다.그것들은 내생성 시아노박테리아에서 진화한 것으로 여겨진다.미토콘드리아는 에어로빅 프로카리오테가 삼켜버린 비슷한 내시경적 사건에서 나온 것으로 생각된다.[10]이러한 엽록체의 기원은 1883년 안드레아스 프란츠 빌헬름 Schimper가 엽록체들이 시아노박테리아와 매우 흡사하다고 관찰한 이후 1905년[11] 러시아 생물학자 콘스탄틴 메레스코프스키에 의해 처음 제안되었다.[6]엽록체는 식물, 해조류,[12] 아메바 3종인 파울리넬라 크로마토포라, P. 마이크로포라, 해양 P. 롱리크로마토포라에서만 발견된다.[13]
상위그룹 : 시아노박테리아
엽록체는 내생성 시아노박테리아로 여겨진다.[14]시아노박테리아는 원핵생물임에도 청록색조류라고 부르기도 한다.그들은 광합성을 수행할 수 있는 그램 음성 박테리아의 다양한 망상이다.시아노박테리아에도 펩티도글리칸 세포벽이 들어 있는데, 이는 다른 그램 음성 박테리아보다 두껍고, 두 세포막 사이에 위치한다.[15]엽록체처럼, 그들은 그 안에[16] 태즈메니아 늑대를 가지고 있다. 태즈메니아 늑막에는 엽록소 a를 포함한 광합성 색소가 있다.[17]피코빌린은 또한 흔한 시아노박테리아 색소로, 보통 태일라코이드막 외부에 부착된 반구형 피코빌리솜으로 조직된다(그러나 피코빌린은 모든 엽록체와 공유되지는 않는다).[17][18]
일차내시경
10억년에서 20억년 전 사이 어딘가에서,[20][21][22] 자유생존하는 시아노박테리움이 먹이로든 내생 기생충으로든 초기 진핵세포에 들어갔지만,[10] 그 안에 들어 있던 포자낭성 바쿠올에서 가까스로 빠져나왔다.[17]모든 엽록체를 둘러싸고 있는 가장 안쪽의 두 지질-빌라이어 막은[23] 조상 시아노박테리움의 그램 음세포 벽의 외측과 내측 막에 해당하며,[19][24][25] 아마도 잃어버린 숙주의 포고소마막은 아니다.[19]새로운 세포 거주자는 진핵 숙주에게 음식을 제공함으로써 그 안에서 살 수 있게 했다.[10]시간이 흐르면서 시아노박테리움은 동화되었고, 그 유전자의 많은 부분이 숙주의 핵으로 손실되거나 전이되었다.[26]아마도 원래 3000개 이상의 유전자를 포함하고 있었던 게놈으로부터 약 130개의 유전자만이 현대 식물의 엽록체에 남아있다.[21]그 후 그것의 단백질 중 일부는 숙주세포의 세포질에서 합성되어 다시 엽록체(이전의 시아노박테리움)로 수입되었다.[26][27]이와는 별개로 약 9천만~1억 4천만년 전 어디선가 다시 이런 일이 일어나 아메보이드인 파울리넬라 크로마토포라로 이어졌다.[22]
이 사건을 내시경증이라고 부르거나, "두 가지 모두에 대해 상호 이익을 가지고 다른 세포 안에 사는 세포"라고 부른다.외부 셀은 일반적으로 호스트라고 하는 반면 내부 셀은 내시경이라고 한다.[10]
엽록체들은 모든 진핵생물들이 미토콘드리아를 포함하고 있지만 모든 것이 엽록체를 가지고 있는 것은 아니기 때문에 미토콘드리아 이후에 발생한 것으로 생각된다.[10][28]이것을 직렬 내분비증이라고 한다. 즉, 미토콘드리아 조상을 뒤덮은 초기 진핵생물들이 엽록체 조상을 뒤덮고 그 후 후손들이 엽록체와 미토콘드리아를 모두 가진 세포를 만들어낸다.[10]
1차 엽록체들이 단일 내분비생물학적 사건에서 왔는지, 아니면 여러 가지 진핵생물학적 선에 걸쳐서 많은 독립된 포획물에서 나왔는지 여부는 오랫동안 논의되어 왔다.현재 일차 엽록체 생물이 6억-2000만 년 전에 시아노박테리움을 섭취한 단일 조상을 공유하는 것이 일반적이다.[20][22]이것은 이 박테리아의 가장 가까운 살아있는 친척인 Gloeomargarita 리토포라라고 제안되었다.[29][30][31]예외는 아메보이드 파울리넬라 크로마토포라인데, 이것은 9~5억년 전에 프로클로로코쿠스 시아노박테리움을 섭취한 조상으로부터 내려온다.[32][31][22]
시아노박테리아 조상으로 바로 거슬러 올라갈 수 있는 이 엽록체들은 일차 플라스티드로[33] 알려져 있다("이 맥락에서 플라스티드"는 엽록체와[10] 거의 같은 것을 의미한다.모든 1차 엽록체들은 4개의 엽록체 라인 중 하나에 속한다. 즉, 글라우코프산 엽록체 혈통, 아메보이드인 폴리넬라 크로마토포라 혈통, 로도프산(적조) 엽록체 혈통, 또는 엽록소산(녹조) 엽록체 혈통이다.[34]엽록소와 엽록체 라인은 가장 크며,[19] 엽록체(녹색)가 육지 식물을 함유하고 있다.[19]
글라우코피타
보통 내시성 증후군은 고대유래에서 일어난 것으로 간주되는데, 그 안에서 글라우코피타는 가장 일찍 혈통을 분리할 수 있는 가능성이 있는 것이다.[27][14]이 글라우코스모플라스틱 그룹은 3개의 1차 엽록체 라인 중 가장 작은 것으로 13종에서만 발견되며,[19] 가장 일찍 발견된 것으로 생각된다.[19][20][35]글라우코피아는 그들의 시아노박테리아 부모처럼 이중막 사이에 펩티도글리칸 벽을 유지하는 엽록체를 가지고 있다.[33][15]이 때문에 글라우코필테 엽록체들은 '무로플라스'('[33]cyanoprasts' 또는 'cyanelles'를 제외한)로도 알려져 있다.글라우코필테 엽록체 또한 카복시솜을 둘러싸고 있는 동심원 분쇄 태라코이드를 함유하고 있는데, 이는 글라우코필테 엽록체와 시아노박테리아가 탄소 고정 효소 루비스(Rubis)를 유지하는 이코사이드 구조다.CO in. 그들이 합성하는 전분은 엽록체 바깥에 모인다.[17]시아노박테리아처럼 글라우코필레스와 로도필리스타일라코이드에는 피코빌리솜이라는 광 채집 구조물이 박혀 있다.[17][33]이러한 이유로 글라우코필테 엽록체들은 시아노박테리아와 홍조류와 식물에서 더욱 진화된 엽록체 사이의 원시적인 중간체로 간주된다.[33]
홍조류(붉은 해조류
엽록체 또는 적조류 엽록체 그룹은 또 다른 크고 다양한 엽록체 혈통이다.[19]로도피테 엽록체들은 또한 로도플라스라 [33]불리는데, 문자 그대로 "붉은 엽록체"이다.[37]
로도플라스틱은 태일라코이드 막에 피코빌리솜으로 조직된 피코빌리솜으로 구성된 2중 막과 피코빌린 색소를 가지고 있어 태즈메니아 늑대가 쌓이는 것을 방지한다.[17]어떤 것들은 피레노이드들을 포함하고 있다.[33]로도플라스틱은 광합성 색소를 위한 엽록소 a와 피코빌린을[35] 가지고 있다; 피코빌린 피코베리린은 많은 홍조류들에게 독특한 붉은 색을 주는 역할을 한다.[36]그러나 청록색 엽록소 a와 다른 색소들도 포함하고 있기 때문에, 많은 색소들은 그 조합에서 붉은색에서 자주색까지 있다.[33][dubious ]붉은 피커리테린 색소는 홍조류가 깊은 물에서[33] 더 많은 햇빛을 잡도록 돕기 위한 적응증이다. 예를 들어,[36] 얕은 물에 사는 일부 홍조류는 그들의 로도플라스틱에 더 적은 피커리쓰린을 가지고 있고, 더 푸르게 보일 수 있다.로도플라스틱은 붉은 알가의 세포질에서 로도플라스틱 바깥의 과립으로 모여드는 플로리데안 전분이라고 불리는 전분의 형태를 합성한다.[33][17]
엽록체(녹조류 및 식물)
엽록체 엽록체 또는 녹색 엽록체들은 또 다른 크고 매우 다양한 1차 엽록체 혈통이다.그들의 숙주 유기체는 보통 녹조와 육지식물로 알려져 있다.[38]이들은 식물성 엽록소를 잃었다는 점에서 글라우코필리테, 적조 엽록체와는 다르며, 대신 엽록소 b를 함유하고 있다.[17]대부분의 녹색 엽록체들은 녹색이지만, 일부는 엽록소의 초록색보다 우선하는 부속 색소 때문에 Hmatmatocococcus pluufulitis의 일부 형태처럼 녹색이다.엽록체 엽록체들은 이중막 사이에 있는 펩티도글리칸 벽이 없어져 그 사이에 공간이 생겼다.[17]일부 식물들은 엽록체 분할에 사용하기 위해 용도 변경되었지만, 펩티도글리칸 층의 합성을 위한 유전자를 유지한 것으로 보인다.[39]
이 글에서 묘사된 엽록체 대부분은 녹색 엽록체다.
녹조와 식물은 엽록체 내부에 녹말을 보관하고,[17][35][38] 식물과 일부 해조류에서는 엽록체 태라코이드가 그라나 스택에 배열되어 있다.일부 녹조 엽록체에는 피레노이드라는 구조물이 들어 있는데,[17] 루비스가 있는 곳이라는 점에서 기능적으로 글라우코프 카복시솜과 유사하다.CO와 CO는2 엽록체에 집중되어 있다.[40]
헬리코스포리듐(Helicosoporidium)은 비포토합성 기생 녹조의 속성으로, 잔존성 엽록체를 함유하고 있는 것으로 생각된다.[35]엽록체의 존재를 나타내는 엽록체와[41] 핵 유전자의 유전자는 아무도 엽록체 자체를 보지 못하더라도 헬리코스포리디움에서[35] 발견되었다.[35]
파울리넬라 크로마토포라
대부분의 엽록체들은 그 첫 번째 일련의 내분비생물학적 사건에서 유래된 반면, Pauinella Chromatophora는 광합성 시아노박테리아 내분비온을 최근에 획득한 예외다.그 공생물이 다른 진핵생물의 조상 엽록체와 밀접한 관련이 있는지는 확실하지 않다.[19]내시경 검사 초기인 Pauinella Chromatophora는 엽록체들이 어떻게 진화했는지에 대한 통찰력을 제공할 수 있다.[26][42]파울리넬라 세포는 시아노박테리움 시네초코쿠스로부터 내려온 한 두 개의 소시지 모양의 청록색 광합성 구조를 포함하고 있다.[26][42]색소포체는 숙주 밖에서 생존할 수 없다.[26]크로마토포레 DNA는 약 100만 염기쌍으로 약 850개의 단백질 인코딩 유전자를 포함하고 있다. 이는 300만 염기쌍인 시네코쿠스 게놈보다는 훨씬 작지만,[26] 더 동화된 엽록체 약 15만 염기쌍의 게놈보다 훨씬 크다.[43][44][45]색소포체는 DNA의 훨씬 적은 양을 숙주의 핵으로 옮겼다.파울리넬라 내 핵 DNA의 약 0.3~0.8%는 색소포레에서 추출한 것이며, 이에 비해 식물 내 엽록체에서 추출한 것은 11~14%이다.[42]
2차 및 3차 내시경
다른 많은 유기체들은 1차 엽록체 라인에서 2차 내분비증을 통해 엽록체를 얻어냈는데, 이는 엽록체를 함유한 적색 또는 녹색 알가(alga)를 함몰시킨다.이 엽록체들은 2차 플라스티드로 알려져 있다.[33]
1차 엽록체는 시아노박테리아 조상으로부터 이중막을 가지고 있는 반면, 2차 엽록체에는 원래 두 가지 이외의 추가 막이 있는데, 2차 내분비생균 이벤트의 결과, 비포토사이신성 진핵산이 엽록체 함유 알가를 삼켰지만 소화에 실패했을 때, 그 막은 현재의 시아노박테륨과 같다.이 이야기의 [19]줄거리삼켜진 알가는 분해되어 엽록체만 남았고, 때로는 세포막과 핵으로, 두 개의 시아노박테리아막, 때로는 먹은 알가의 세포막, 그리고 숙주의 세포막에서 나오는 파고솜탈 바쿠올 등 서너 개의 막으로[46] 엽록체를 형성하기도 했다.[19]

포고포스코스 진핵 세포핵에 있는 유전자들은 종종 2차 숙주의 핵으로 옮겨진다.[19]크립토모나드와 엽록소 양생물은 엽록체의 제2막과 제3막 사이에 위치한 핵형이라고 불리는 피구정성 진핵의 핵을 보유하고 있다.[19][17][27]
모든 2차 엽록체들은 녹조류와 홍조류에서 나온다. 그 어떤 2차 엽록체도 관찰되지 않았는데, 아마도 글라우코피아는 자연에서 상대적으로 드물기 때문에 다른 진핵생물에 의해 섭취되었을 가능성이 적기 때문일 것이다.[19]
녹조 유도 엽록체
녹조는 우글렌이드, 엽록소, 디노플라겔라테스의 혈통,[35] 그리고 아마도 CASC 계통의 조상(크립토모나드, 알베올레이트, 스트라모플라네일, 햅트로피테스)[47]에 의해 3, 4개의 별개의 포획에 의해 차지되어 왔다.[48]많은 녹조에서 파생된 엽록체에는 피레노이드 성분이 들어 있지만, 녹색의 조상에 있는 엽록체와 달리 저장제품은 엽록체 외부의 과립에서 수집된다.[17]
우글레노피스
우글레노피아는 녹색 알가에서 유래한 엽록체를 함유하고 있는 일반적인 편평성 원생들의 집단이다.[19]우글레노피테 엽록체에는 3개의 막이 있다. 1차 내시경검사의 막이 없어져 시아노박테리아 막이, 2차 숙주의 포고소마막 등이 남아 있는 것으로 생각된다.[19]우글레노피테 엽록체에는 피레노이드와 태라코이드가 3인 1조로 쌓여 있다.광합성 제품은 파라메론 형태로 저장되는데, 우생물의 세포질 내 막 결합 과립에 들어 있다.[17][35]
클로로라치니오피스류
엽록소 양생동물 /ˌklɔrərrrrrrknioʊfaɪts/는 우생식물보다 이야기가 복잡하지만 녹조에서 유래한 엽록체도 함유하고 있는 희귀한 유기체군이다.[19]엽록소의 조상은 적색 녹조가 유도된 엽록체를 가진 진핵생물이었던 것으로 생각된다.이후 첫 번째 적조 엽록체를 잃었고, 이후 녹색 알가를 삼켜 두 번째, 녹색 알조 유도 엽록체를 부여한 것으로 생각된다.[35]
엽록소는 엽록체 막이 이중 막으로 융합되는 세포막 근처를 제외한 4개의 막으로 경계를 이루고 있다.[17]그들의 태즈메니아 늑대는 3개의 느슨한 층으로 배열되어 있다.[17]클로로파르키니오피아는 시토플라즘에 저장되는 크리솔라미나린이라는 다당류의 일종으로,[35] 종종 엽록체 피레노이드 주위에 수집되어 시토플라즘으로 불룩하게 된다.[17]
엽록소 엽록체들은 그들이 파생된 녹색 알가가 완전히 분해되지 않았기 때문에 눈에 띈다. 그 핵은 녹색 알가의 세포질에 해당하는 두 번째와 세 번째 엽록체 막 사이에[17] 있는 핵으로[19] 여전히 남아 있다.[35]
프라시노피제 유래 다이노피제 엽록체
레피도디늄 버라이드와 그 가까운 친척들은 원래 페리딘 엽록체를 잃어버리고 녹조에서 파생된 엽록체(더 구체적으로는 프라시노피테스)로 대체한 다이노피플라이스(아래 참조)[17][49]이다.레피도디늄은 엽록체를 가지고 있는 유일한 다이노피늄으로, 이 엽록체 혈통에서 나온 것이 아니다.엽록체는 두 개의 막으로 둘러싸여 있고 핵형도 없다. 모든 핵형 유전자는 다이노피드 핵으로 옮겨졌다.[49]이 엽록체를 일으킨 내분비생물학적 사건은 3차 내분비증이라기보다는 직렬 2차 내분비증이었다. 내분비전은 1차 엽록소를 함유한 녹색 알가였다(이차 엽록체를 만든다).[35]
적도 도 엽록체
크립토모나드 또는 크립토모나드(cryptomonad)는 적색 알갈에서 파생된 엽록체를 포함하는 조류군이다.암호화된 엽록체에는 엽록소와 겉으로 닮은 핵종이 들어 있다.[19]암호화된 엽록체에는 4개의 막이 있으며, 그 중 가장 바깥쪽은 거친 내엽성 망막과 연속된다.그들은 적색 알가의 세포질에 해당하는 장소에서 원래의 이중 막 바깥쪽의 과립 공간에서 발견되는 과립에 저장되는 보통의 전분을 합성한다.암호화된 엽록체 안에는 피레노이드와 태라코이드 두 개가 쌓여 있다.[17]
그들의 엽록체는 피코빌리솜을 가지고 있지 않지만,[17] 그들은 태라코이드 막의 바깥쪽에 정박하기 보다는 태라코이드 공간에 보관하는 피코빌린 색소를 가지고 있다.[17][19]
암호생물은 적색 녹조 기반 엽록체 확산에 핵심적인 역할을 했을 것이다.[50][51]
햅트로피스트
햅토피아는 유사하며 암호화된 동물이나 이단상피종과 밀접하게 관련되어 있다.[35]그들의 엽록체에는 뉴클레오모르프가 부족하고,[17][19] 그들의 틸라코이드는 3개 층이 쌓여 있으며, 그들은 엽록체 바깥에서 완전히 저장한 크리솔라미나린 설탕을 합체하여 햅트로피트의 세포질에 넣는다.[17]
헤테로콘톱하이테스(스트라메노플라일)

스트라메노필로 알려진 이단상피종은 진핵생물의 매우 크고 다양한 집단이다.광자생성 혈통인 오크로파타(Ochrophata)에는 규조류와 갈색조류, 황금조류,[36] 황록조류 등도 적색조류에서 파생된 엽록체들이 들어 있다.[35]
헤테로콘트 엽록체들은 피레노이드, 트리플트 틸라코이드를 함유하고 있는 햅트로피테 엽록체와 매우 유사하며, 일부 예외는 [17]소포체 망막에 연결된 가장 바깥쪽 경막인 4층 플라스티드 봉투를 가지고 있다.헤테로콘토피테스는 햅트로피테스처럼 세포질의 크리솔라미나린 과립에 설탕을 저장한다.[17]헤테로콘토피테 엽록체에는 엽록소 a와 몇 가지 예외가[17] 있는 엽록소 c가 들어있지만,[19] 또한 카로티노이드도 있어 다양한 색상을 준다.[36]
아피콤플렉산, 크로메리드, 다이노피즘
알베올레이트는 자생성 및 이생성 부재의 단세포 진핵생물의 주요 층이다.가장 눈에 띄는 공유특성은 피질(외부영역) 알베올리(sac)의 존재다.이것들은 납작해진 방광(sac)들이 막 바로 아래 연속적인 층으로 채워져 그것을 지탱하고 있으며, 전형적으로 유연한 펠리클(마른 피부)을 형성하고 있다.디노플라겔라테스에서 그들은 종종 갑옷 접시를 형성한다.많은 회원들이 적갈색에서 파생된 플라스티드를 함유하고 있다.이 다양한 집단의 한 가지 주목할 만한 특징은 광합성의 빈번한 손실이다.그러나 이러한 이질세포의 대다수는 비광합성 플라스티드를 계속 처리한다.[52]
- 아피콤플란스
아피콤플렉산(apicomplexans)은 알베올레이트의 집단이다.헬리코스포드로이드증처럼 기생하며 비포토사이신성 엽록체를 가지고 있다.[35]이들은 한때 헬리코프로이드증(Helicosproidia)과 관련이 있는 것으로 생각되었으나, 지금은 헬리코프로이드가 CASH 혈통의 일부라기보다는 녹조류인 것으로 알려져 있다.[35]아피콤플렉산에는 말라리아 기생충인 플라스모디움이 포함된다.많은 아피콤플렉시언들은 그들의 조상으로부터 물려받은 아피코플라스틱이라고 불리는 잔존적인 적색조류에서 유래된 엽록체를[53][35] 가지고 있다.크립토스포리듐과 같은 다른 아피콤플렉스는 엽록체를 완전히 잃었다.[53]아피콤플렉산들은 세포질 내에 있는 아밀로펙틴 과립에 에너지를 저장하는데, 이들은 비록 비포토사이신성이지만 말이다.[17]
아피코플라스틱은 모든 광합성 기능을 상실했으며 광합성 색소나 진정한 태즈메니아 늑대를 포함하지 않는다.그것들은 4개의 막으로 경계를 이루지만, 막은 소포체 망막과 연결되지 않는다.[17]아피콤플렉스인들이 여전히 비광합성 엽록체를 주변에 보관하고 있다는 사실은 엽록체들이 광합성 이외의 중요한 기능을 어떻게 수행하는지 보여준다.식물 엽록체는 식물 세포에 설탕 외에도 많은 중요한 것들을 제공하며, 아피코플라스틱은 다를 바 없다. 그들은 지방산, 이소펜테닐 피로인산염, 철-황산 성단을 합성하고 헤메 경로의 일부를 수행한다.[53]이것은 아피코플레스가 아피콤플렉산 관련 질병을 치료하는 약의 매력적인 표적이 되게 한다.[33]가장 중요한 아피코플라스틱 함수는 이소펜테닐 피로인산염 합성이다—사실 아피콤플렉산스는 이 아피코플라스틱 함수를 방해할 때 죽고, 아피콤플렉산스가 이소펜테닐 피로인산염이 풍부한 매질에서 자라면 오르가넬을 버린다.[53]
- 크로메리드
크로메리다는 호주 산호에서 새로 발견된 조류로, 아피콤플렉산들의 가까운 광합성 친척들로 구성되어 있다.첫 번째 멤버인 크로메라 벨리아는 2001년에 발견되어 처음으로 고립되었다.아피콤플렉산스와 유사한 구조를 가진 크로메라 벨리아의 발견은 아피콤플렉산 및 다이노피스의 진화 역사에 중요한 연계를 제공한다.그들의 플라스티드는 4개의 막으로 이루어져 있고 엽록소 c가 부족하며 Ⅱ유형의 루비스를 사용한다.수평 전달 이벤트에서 얻은 CO.[54]
- 다이노피스
디노플라겔라테스는 또 하나의 매우 크고 다양한 양성자 집단이며, 그 중 절반 정도는 광합성(적어도 부분적으로는 광합성 물질이다.[36][49]
대부분의 다이노피테 엽록체들은 2차 적색조에서 파생된 엽록체들이다.다른 많은 공룡들은 엽록체를 잃거나 3차 내분비증[55](적색조류에서 파생된 엽록체를 포함한 또 다른 진핵성 해조류의 포만감)으로 대체했다.다른 사람들은 그들의 원래 엽록체를 녹색 조류에서 파생된 것으로 대체했다.[19][35][49]
대부분의 다이노피테 엽록체에는 제2형 루비스CO, 적어도 광합성 색소인 엽록소 a, 엽록소2 c, 베타 카로틴, 그리고 적어도 하나의 다이노피테-유니크 크산토필(페리딘, 디녹산틴 또는 디아디녹산틴)을 함유하고 있어 많은 황금빛 갈색을 준다.[52][49]모든 다이노피스트들은 전분을 세포질에 저장하며, 대부분은 태즈메니아 늑대가 3개씩 쌓여 있는 엽록체들을 가지고 있다.[17]
가장 흔한 다이노이드성 엽록체는 페리딘형 엽록체로서 엽록체 a, 엽록소 c와2 함께 카로티노이드 색소 페리딘이 엽록체 안에 들어 있는 것이 특징이다.[19][49]페리디닌은 다른 어떤 엽록체 그룹에서도 발견되지 않는다.[49]페리딘 엽록체에는 3개의 막이 경계를 이루고 있으며([17]마찰적으로 2개) 적색 알조내막의 원래 세포막을 잃었다.[19][35]가장 바깥쪽 막은 소포체 망막에 연결되지 않는다.[17][49]그들은 피레노이드와 세 겹으로 쌓인 태즈메니아 늑대를 가지고 있다.녹말은 엽록체 밖에서 발견된다.[17]이러한 엽록체들의 중요한 특징은 그들의 엽록체 DNA가 많은 작은 원들로 크게 감소하고 조각난다는 것이다.게놈의 대부분은 핵으로 옮겨갔으며, 엽록체에는 중요한 광합성 관련 유전자만 남아 있다.[49]
페리딘 엽록체는 다이노피아의 "원래" 엽록체라고 생각되는데,[49] 이 엽록체들은 분실, 감소, 교체 또는 몇몇 다른 다이노피아의 계열에 회사를 두고 있다.[35]
푸코산틴 함유(합초제 유래) 다이노피테 엽록체
푸코산틴 다이노피테 라인(칼로디늄과 카레니아 포함)[35]은 원래의 적색 녹조에서 파생된 엽록체를 잃어버렸고, 이를 합초체 내합성체에서 파생된 새로운 엽록체로 대체했다.카를로디니움과 카레니아는 아마도 서로 다른 이단상피아를 차지했을 것이다.[35]햅트로피테 엽록체는 4개의 막을 가지고 있기 때문에, 3차 내분비증은 햅트로피테의 세포막과 다이노피테의 페이고솜 바쿠올을 첨가하여 6개의 막으로 이루어진 엽록체를 만들 것으로 예상된다.[57]그러나 합초는 크게 줄어들어 몇 개의 막과 핵이 벗겨져 엽록체(원래의 이중막과 함께)만 남았고, 아마도 주위에 한두 개의 추가 막이 남아 있을 것이다.[35][57]
푸코산틴 함유 엽록체 성분은 색소 후코산틴(실제로 19′-헥사노일록시-후코산틴 및/또는 19′-부타노일록시-후코산틴)이 있고 페리딘이 없는 것이 특징이다.푸코산틴은 또한 햅트로피테 엽록체에서도 발견되는데, 이는 조상의 증거를 제공한다.[49]
디아톰에서 유래한 다이노피테 엽록체
크립토페리디늄과 두린스키아와[35] 같은 일부 다이노피아는 엽록체에서 파생된 이원자(heterokontophyte)를 가지고 있다.[19]이 엽록체들은 최대 5개의 막으로 경계를 이룬다.[19] (전체를 엽록체로 계산하느냐, 아니면 단지 그 안에서 붉은 해조에서 파생된 엽록체만 계산하느냐에 따라 달라진다.)diomatom endosymbiont는 상대적으로 거의 감소하지 않았다. - 여전히 원래의 미토콘드리아를 보존하고 있고,[35] 내포성 망막, 리보솜, 핵 그리고 물론, 적색 조류에서 파생된 엽록체 - 실제로 완전한 세포 - 숙주의 내포성 망막 내부를 가지고 있다.[58][35]그러나 diatom 내분비온은 자신의 음식을 저장할 수 없다. 그것의 저장 다당류는 대신 다이노피테 숙주의 세포질에서 과립에서 발견된다.[17][58]diatom intersymbiont의 핵은 존재하지만, 그것은 아마도 게놈 감소의 징후를 보이지 않고, 확장되었을 수도 있기 때문에 핵형이라고 불릴 수는 없을 것이다.[35]디아톰은 적어도 세 번은 디노플라겔라테스에 휩싸였다.[35]
규조내막은 하나의 막으로 경계를 이루며,[49] 그 안에는 4개의 막이 있는 엽록체들이 있다.diatom endosymbiont의 diatom 조상처럼, 엽록체들은 세 쌍의 태일라코이드와 피레노이드들을 가지고 있다.[58]
이 생식기들 중 일부에서는, 이원자 내엽성의 엽록체만이 다이노피아의 유일한 엽록체들이 아니다.원래 3mbraned peridin chloropratis는 여전히 주위에 있고, 눈구멍으로 변환된다.[19][35]
클렙토플라스티
일부 디노플라겔라테이트(Dinoflagellate, 예를 들어 디노플라겔라테스)와 같은 혼혈성 원생들의 일부 집단에서는 엽록체들이 포획된 알가로부터 분리되어 일시적으로 사용된다.이 클렙토 엽록체들은 단 며칠의 수명을 가지고 있다가 대체될 수도 있다.[59][60]
크립토피테 유래 다이노피테 엽록체
디노펜시온의 구성원들은 암호화된 식물에서 추출한 식물성[57] 엽록체를 가지고 있다.[19]그러나 그 암호화된 엽록체는 내시경검사가 아니다. 엽록체만 복용한 것 같고, 엽록체는 핵모형과 가장 바깥쪽 두 개의 막이 벗겨져 2엠브란으로 된 엽록체만 남게 되었다.암호화된 엽록체들은 자신을 유지하기 위해 핵동형을 필요로 하고, 세포 배양에서만 자라는 다이노피석소 종은 살아남을 수 없기 때문에, 다이노피석소 엽록체가 도벽체일 가능성은 있다(그러나 확인되지는 않음). 만약 그렇다면, 다이노피석소 엽록체는 닳아 없어지고 디노피석소 종은 새로운 클로로포석을 얻기 위해 지속적으로 암호동물을 삼켜야 한다.낡은 것을 교체하기 위한 [49]도배
엽록체 DNA
엽록체들은 다른 종류의 플라스티드와 마찬가지로 세포핵에서 분리된 게놈을 포함하고 있다.엽록체 DNA(cpDNA)의 존재는 1959년 생화학적으로 확인되었고,[61] 1962년 전자 현미경으로 확인되었다.[62]엽록체가 리보솜을[63] 함유하고 단백질 합성을[64] 한다는 발견은 엽록체가 유전적으로 반자율적이라는 것을 밝혀냈다.엽록체 DNA는 1986년에 처음으로 염기서열화되었다.[65]이후 다양한 종의 엽록체 DNA 수백 개가 염기서열화되었지만, 그것들은 대부분 육지 식물과 녹조류, 즉 유채류, 홍조류, 그리고 그 밖의 녹조류들의 DNA가 극히 과소표현되어 있어, 잠재적으로 '일반적인' 엽록체 DNA 구조와 내용물의 관점에 어느 정도 편향성을 도입하고 있다.[66]
분자구조

거의 예외 없이, 대부분의 엽록체들은 그들의 전체 엽록체 게놈을 하나의 큰 원형 DNA 분자로 결합하고 있는데,[66] 보통 12만~17만 염기쌍의 길이가 된다.[43][44][45][21]그들은 약 30-60마이크로미터의 등고선 길이를 가질 수 있고, 질량은 약 8천만–1억 3천만 달톤이다.[67]
보통 원형 분자로 생각되지만, 엽록체 DNA 분자가 더 자주 선형적인 형태를 취한다는 증거가 있다.[66][68]
반전 반복측정
많은 엽록체 DNA에는 두 개의 역반복 반복측정기가 들어 있는데, 이는 짧은 단일복사구간(SSC)에서 긴 단일복사구간(LSC)을 분리한다.[45]주어진 역반복 한 쌍이 완전히 동일한 경우는 드물지만, 그들은 항상 서로 매우 유사하며, 명백히 일치된 진화에서 기인한다.[66]
반전된 반복은 길이가 엄청나게 다양하며, 각각 길이가 4,000개에서 25,000개에 이르는 염기쌍과 4개 또는 150개 이상의 유전자를 포함하고 있다.[66]식물의 역반복은 이 범위의 위쪽 끝에 있는 경향이 있으며, 각각은 20,000–25,000개의 염기쌍이 된다.[45][69]
역반복 지역은 육지식물 중 보존도가 높고 변이도 거의 없다.[45][69]시아노박테리아와 다른 두 개의 엽록체 라인(글라우카스와 로도포체)의 게놈에도 유사한 역반복형이 존재하는데, 그 이후 일부 엽록체 DNA가 역반복(직접반복)을 잃거나[69][70] 뒤집었지만([66]직접반복)이 엽록체보다 앞서 있음을 시사한다.[66]역반복은 엽록체 유전체의 안정화에 도움을 줄 수 있는데, 역반복 부분 중 일부를 분실한 엽록체 DNA가 더 재배열되는 경향이 있기 때문이다.[70]
뉴클레오이드
새로운 엽록체들은 그들의 DNA를 100개까지 포함할 수 있지만 [43]엽록체 DNA의 수는 엽록체들이 나이가 들면서 약 15-20개로 감소한다.[71]그것들은 보통 뉴클레오이드로 포장되는데, 이것은 몇 개의 동일한 엽록체 DNA 고리를 포함할 수 있다.많은 뉴클레오이드들이 각각의 엽록체에서 발견될 수 있다.[67]원시적 홍조류에서는 엽록체 DNA 뉴클레오이드들이 엽록체 중앙에 군집하고, 녹색 식물과 녹조류에서는 뉴클레오이드들이 스트로마 전체에 분산된다.[72]
엽록체 DNA는 실제 히스톤과 관련이 없지만,[10] 홍조류에서 각각의 엽록체 DNA 고리를 핵으로 단단하게 포장하는 유사한 단백질이 발견되었다.[72]
DNA 수리
이끼 물리화합물의 엽록체에서 DNA 불일치 보수 단백질 Msh1이 재조합 보수 단백질 RecA 및 RecG와 상호작용하여 엽록체 게놈 안정성을 유지한다.[73]아라비도피스탈리아나 식물의 엽록체에서 레카 단백질은 DNA 손상의 재조합 수리를 수반할 가능성이 있는 과정을 통해 엽록체 DNA의 무결성을 유지한다.[74]
DNA 복제

엽록체 DNA(cpDNA) 복제 메커니즘은 결정적으로 결정되지 않았지만, 두 가지 주요 모델이 제안되었다.과학자들은 1970년대부터 전자현미경을 통해 엽록체 복제를 관찰하려고 시도해왔다.[75][76]현미경 실험의 결과는 엽록체 DNA가 이중 변위 루프(D-루프)를 사용하여 복제된다는 생각으로 이어졌다.D-루프가 원형 DNA를 통과하면서 케언스 복제 중간이라고도 하는 세타 중간 형태를 채택하고, 롤링 서클 메커니즘으로 복제를 완료한다.[75][68]전사는 특정 기원에서 시작한다.복제 포크가 여러 개 열려 복제 기계가 DNA를 변환할 수 있음복제가 계속되면 포크는 점점 커지고 결국 수렴하게 된다.새로운 cpDNA 구조는 분리되어 딸 cpDNA 염색체를 만든다.
초기 현미경 실험 외에도, 이 모델은 cpDNA에서 볼 수 있는 디아밍의 양에 의해서도 지지를 받고 있다.[75]탈염은 아미노군이 상실되었을 때 발생하며 염기변화를 초래하는 돌연변이다.아데닌이 탈염되면 히산산틴이 된다.저산산틴은 시토신(cytosine)에 결합할 수 있으며, XC 염기쌍을 복제하면 GC(thus, A → G 염기변경)가 된다.[77]
cpDNA에서는 몇 가지 A → G 디마미네이션 그라데이션이 있다.DNA는 단 한 번 좌초되었을 때 탈모에 걸리기 쉽다.복제 포크가 형성되면 복사되지 않는 가닥이 한 번 좌초되어 A → G 디아미네이션의 위험이 있다.따라서, 감광의 그라데이션은 복제 포크가 존재할 가능성이 가장 높고 처음 열었던 방향(가장 높은 그라데이션은 가장 긴 시간 동안 단일 좌초되었기 때문에 시작 부지에서 가장 가까울 가능성이 가장 높다)을 나타낸다.[75]이 메커니즘은 오늘날에도 여전히 선도적인 이론이다. 그러나 두 번째 이론은 대부분의 cpDNA가 실제로 선형이고 동음이의 재조합을 통해 복제된다는 것을 시사한다.그것은 또한 유전 물질의 소수만이 원형 염색체에 보관되고 나머지는 분기, 선형 또는 다른 복잡한 구조물에 보관된다고 주장한다.[75][68]
CPDNA 복제에 대한 경쟁 모델 중 하나는 대부분의 CPDNA가 선형이며 박테리오파지 T4의 선형 및 원형 DNA 구조와 유사한 동질 재조합 및 복제 구조에 참여한다고 주장한다.[68][78]일부 식물은 옥수수와 같은 선형 cpDNA를 가지고 있고, 더 많은 종들이 아직 과학자가 이해하지 못하는 복잡한 구조를 포함하고 있다는 것이 확립되었다.[68]CPDNA에 대한 최초의 실험이 수행되었을 때, 과학자들은 선형 구조에 주목했다. 그러나 그들은 이러한 선형 형태를 부러진 원들에 기인했다.[68]만약 cpDNA 실험에서 볼 수 있는 갈라지고 복잡한 구조가 실제이고 결합된 원형 DNA나 깨진 원의 유물이 아니라면, 복제의 D-루프 메커니즘은 그러한 구조들이 어떻게 복제되는지 설명하기에 불충분하다.[68]동시에 동음이의 재조합은 플라스텀에서 볼 수 있는 다중 A -> G 그라데이션은 확장되지 않는다.[75]원형 cpDNA를 가지고 있는 것으로 보여진 수많은 식물 종뿐만 아니라 탈염화 경사를 설명하지 못하기 때문에, 지배적인 이론은 대부분의 cpDNA가 원형이며 D 루프 메커니즘을 통해 반복실험될 가능성이 가장 높다는 것을 계속 고수하고 있다.
유전자 함량 및 단백질 합성
엽록체 게놈은 대부분 단백질 파이프라인과 광합성 작용과 관련된 다양한 것을 암호화하는 약 100개의 유전자를[27][44] 가장 일반적으로 포함한다.원핵생물에서와 같이 엽록체 DNA의 유전자는 오퍼레이터로 조직된다.[27]원핵 DNA 분자와 달리 엽록체 DNA 분자는 인트론(식물 미토콘드리아 DNA도 마찬가지지만 인간 mtDNA는 아니다)을 함유하고 있다.[79]
육지 식물 중에서 엽록체 게놈의 내용물은 상당히 비슷하다.[45]
엽록체 게놈감소 및 유전자전달
시간이 지남에 따라 엽록체 게놈의 많은 부분이 숙주의 핵 게놈으로 전이되었는데,[43][44][80] 이 과정은 내생생물 유전자 전이라고 한다.그 결과 엽록체 게놈은 자유생존 시아노박테리아에 비해 크게 감소한다.엽록체는 60–100개의 유전자를 포함할 수 있는 반면 시아노박테리아는 종종 그들의 게놈에 1500개 이상의 유전자를 가지고 있다.[81]최근, 유전자가 없는 플라스티드가 발견되었는데, 엽록체들이 유전자 전달 과정에서 내생균제를 투여하는 동안 그들의 게놈을 잃을 수 있다는 것을 보여준다.[82]
내분비생물 유전자 전이란 우리가 많은 CASH 라인에서 잃어버린 엽록체들에 대해 아는 방법이다.설사 엽록체가 결국 소실된다 하더라도 그것이 전 숙주의 핵에 기증한 유전자가 지속되어 잃어버린 엽록체 존재에 대한 증거를 제공한다.예를 들어, 현재 디아톰(이형성체)은 적색 녹조에서 파생된 엽록체를 가지고 있지만, 이아톰 핵에 많은 녹색 녹조 유전자의 존재는 이아톰 조상이 어느 시점에 녹색 녹조에서 파생된 엽록체를 가지고 있었다는 증거를 제공하며, 이는 이후 적색 엽록체로 대체되었다.[47]
육지식물의 경우, 핵에 있는 DNA의 약 11~14%는 엽록체,[42] 약 4,500개의 단백질 부호화 유전자에 해당하는 아라비도프시스에서는 최대 18%까지 추적할 수 있다.[83]최근에 육지 발전소에서 엽록체 DNA에서 핵 게놈으로 유전자가 옮겨진 일이 몇 번 있었다.[44]
엽록체에서 발견된 약 3000개의 단백질 중 95%는 핵 유전자에 의해 암호화된다.많은 엽록체 단백질 복합체는 엽록체 게놈과 숙주의 핵 게놈에서 나온 아유닛으로 이루어져 있다.결과적으로 단백질 합성은 엽록체와 핵 사이에서 조정되어야 한다.엽록체는 핵에서 유전자 발현을 조절하는 신호를 줄 수 있지만, 엽록체들은 대부분 핵 통제 하에 있다. 역행 신호라고 불린다.[84]
단백질 합성
엽록체 내의 단백질 합성은 두 개의 RNA 중합체에 의존한다.하나는 엽록체 DNA에 의해 암호화된 것이고, 다른 하나는 핵에서 유래한 것이다.두 개의 RNA 중합체는 엽록체 게놈 내의 다른 종류의 촉진제를 인식하고 결합할 수 있다.[85]엽록체 속의 리보솜은 박테리아 리보솜과 비슷하다.[86]
이 섹션은 다음과 같이 확장될 필요가 있다: 조류와 육지 식물 사이의 게놈 크기 차이, 핵에 의해 암호화된 엽록체 물질.추가하면 도움이 된다. (2013년 1월) |
단백질 타겟팅 및 수입
그렇게 많은 엽록체 유전자들이 핵으로 옮겨졌기 때문에, 원래 엽록체에서 번역되었을 많은 단백질들이 이제 식물 세포의 세포질에서 합성된다.이 단백질들은 반드시 엽록소로 돌아가 적어도 두 개의 엽록체 막을 통해 수입되어야 한다.[87]
신기하게도, 유전자의 단백질 생산물의 약 절반은 엽록체 표적조차 되지 않는다.많은 사람들이 세포분열, 단백질 이동, 그리고 심지어 질병저항과 같은 새로운 기능을 맡으면서 퇴장하게 되었다.몇몇 엽록체 유전자들은 미토콘드리아 게놈에서 새로운 가정을 발견했는데, 대부분은 비기능성 유사 유전자가 되었다. 비록 몇몇 tRNA 유전자는 여전히 미토콘드리아에서 작용하고 있지만 말이다.[81]비록 많은 중등 plastids 바깥쪽 세포막이 호스트의 세포막에서 파생된 한정된다 어떤 전송 엽록체 DNA단백질 제품이 분비 pathway,[81]에 갔지만, 시토졸의 엽록체에 이 때문에 접속 형태적으로 세포 밖에서 연출하면, 세포막,를 상징하는 것을 뛰어넘어야 한다. 멤머는세포외 공간으로 돌진하다이 경우 엽록체 표적 단백질은 처음에 분비물 경로를 따라 이동한다.[35]
엽록체를 획득하는 세포에는 이미 미토콘드리아(및 과산화소, 분비를 위한 세포막)가 있었기 때문에, 새로운 엽록체 숙주는 엽록체 단백질이 잘못된 오르간젤로 보내지는 것을 피하기 위해 독특한 단백질 표적 시스템을 개발해야 했다.[87]
![The two ends of a polypeptide are called the N-terminus, or amino end, and the C-terminus, or carboxyl end.[88] This polypeptide has four amino acids linked together. At the left is the N-terminus, with its amino (H2N) group in green. The blue C-terminus, with its carboxyl group (CO2H) is at the right.](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c0/Tetrapeptide_structural_formulae.svg/370px-Tetrapeptide_structural_formulae.svg.png)
모든 경우는 아니지만, 대부분의 경우에서, 핵으로 인코딩된 엽록체 단백질은 단백질 전구체의 N단자에 첨가된 갈라진 트랜짓 펩타이드로 번역된다.때때로 전달 순서는 단백질의 C-단자 또는 단백질의 기능적 부분 내에서 발견된다.[89][87]
단백질과 막 반투명체 운반
엽록체 폴리펩티드가 시토솔의 리보솜에 합성된 후 엽록체 단백질[90] 인산염에 특유한 효소 또는 그 전달 순서에서 많은 (전부는 아니지만) 인산염 그룹을 첨가한다.[87]인산화 작용은 많은 단백질들이 폴리펩타이드의 결합을 도와서 그것이 일찍 접히는 것을 막는다.[87]이것은 엽록체 단백질이 그들의 활동적인 형태를 가정하고 그들의 엽록체 기능을 잘못된 장소인 시토솔에서 수행하는 것을 막기 때문에 중요하다.[91][92]동시에 그들은 엽록체에게 인식될 수 있도록 충분한 모양을 유지해야 한다.[91]이 단백질들은 또한 폴리펩타이드들이 엽록체로 수입되는 것을 돕는다.[87]
여기서 스트로마에 묶인 엽록체 단백질은 반드시 TOC 복합체나 외부 엽록체 막의 반투명체, 내부 엽록체 막의 TIC 반투명체 또는 반투명체 두 가지 복합체를 통과해야 한다.[87]엽록체 폴리펩타이드 체인은 아마도 두 콤플렉스를 동시에 여행하는 경우가 많지만, TIC 콤플렉스는 또한 인터엠브레인 공간에서 잃어버린 전단백질을 회수할 수 있다.[87]
구조
육상 식물에서 엽록체는 일반적으로 렌즈모양이며 지름이 3~10μm, 두께가 1~3μm이다.[93][21]옥수수 씨를 뿌리는 엽록체는 부피 20 µm이다3.[21]엽록체 모양의 더 큰 다양성은 해조류 사이에 존재하는데, 해조류에는 그물 모양의 단일 엽록체[17]([94]예: 오이도고늄), 컵(예: 클라미도모나스),[95] 세포 가장자리 주변의 리본 모양의 나선형(예: 스피로기라),[96] 세포 가장자리(예: 시로고늄) 또는 세포 가장자리의 약간 뒤틀린 띠(예: 시로고늄)를 포함하고 있는 경우가 많다.[97]어떤 해조류는 각 세포에 두 개의 엽록체를 가지고 있다; 그것들은 지네마에서 별 모양을 하고 있거나,[98] 데스미디알레스 순서로 세포의 절반의 모양을 따를 수도 있다.[99]어떤 해조류에서는 엽록체가 세포의 대부분을 차지하는데, 핵이나 다른 장기들을 위한 주머니를 가지고 있다.[17] 예를 들어, 클로렐라의 어떤 종은 세포의 대부분을 차지하는 컵 모양의 엽록체를 가지고 있다.[100]
모든 엽록체에는 외부 엽록체 막, 내부 엽록체 막, 그리고 태일라코이드 막 등 적어도 세 개의 막 시스템이 있다.2차 내시경검사의 산물인 엽록체에는 이 세 가지를 둘러싸고 있는 추가 막이 있을 수 있다.[46]바깥쪽과 안쪽의 엽록체 막 안에는 엽록체의 부피를 상당 부분 구성하는 반겔 형태의 액체인[33] 엽록체 스트로마가 있고, 그 안에 태일라코이드 시스템이 떠 있다.
바깥쪽과 안쪽 엽록체 막에 대한 몇 가지 일반적인 오해들이 있다.엽록체들이 이중막으로 둘러싸여 있다는 사실은 종종 그들이 내분비생물 시아노박테리아의 후손이라는 증거로 인용된다.이것은 종종 외부 엽록체 막이 숙주의 세포막의 산물이라는 뜻으로 해석된다. 이것은 사실이 아니다. 두 엽록체 막은 모두 시아노박테리움의 원래 이중막과 동질적이다.[19]
엽록체 이중막은 미토콘드리아 이중막과도 종종 비교된다.이것은 유효한 비교가 아니다. 내부 미토콘드리아 막은 양성자 펌프를 가동하고 ATP 에너지를 생성하기 위해 산화 인산화를 수행하는 데 사용된다.그것과 유사한 것으로 간주할 수 있는 유일한 엽록체 구조는 내부 태일라코이드 시스템이다.그렇더라도 '인아웃(in-out)'이라는+ 관점에서 보면, 엽록체 H 이온 흐름의 방향은 미토콘드리아에서 산화 인산화에 비해 반대 방향이다.[33][101]또 기능 면에서도 대사물 통로를 조절하고 일부 물질을 합성하는 내엽 엽록체 막은 미토콘드리온에 상대가 없다.[33]
엽록부부부막막막
외부 엽록체막은 작은 분자와 이온이 쉽게 퍼져나갈 수 있는 반구체막이다.[102]그러나 더 큰 단백질에는 침투할 수 없기 때문에 세포 세포질에서 합성되고 있는 엽록체 폴리펩타이드들은 TOC 콤플렉스에 의해 바깥쪽 엽록체 막을 가로질러, 또는 바깥쪽 엽록체 막 위에 있는 반코콘으로 운반되어야 한다.[87]
엽록체 막은 때때로 세포질 속으로 튀어나와 스트로모플, 즉 스트로마 함유 관을 형성한다.스트로몬은 엽록체에서 매우 희귀하며, 각각 꽃잎과 뿌리의 크로모플라스틱과 아밀로플라스틱과 같은 다른 플라스티드에 훨씬 더 흔하다.[103][104]그것들은 종종 갈라지고 내포체와 엉켜있기 때문에 교차 기억 수송을 위해 엽록체의 표면적을 증가시키기 위해 존재할 수 있다.[105]1962년 처음 관찰되었을 때, 일부 식물 생물학자들은 스트로몬이 수축된 부위가 있거나 엽록체를 분열시키는 이상한 모양의 엽록체일 뿐이라고 주장하며 이 구조물들을 인공적인 것으로 치부했다.[106]그러나, 스트로뮬이 단순한 유물이 아니라, 식물 세포 플라스티드의 기능적이고 본질적인 특징이라는 증거들이 증가하고 있다.[107]
멤브레인 공간과 펩티도글리칸 벽체
보통 10~20나노미터 두께의 얇은 중간 공간이 외부와 내부 엽록체 막 사이에 존재한다.[108]
글라우코필테 알갈 엽록체에는 엽록체 막 사이에 펩티도글리칸 층이 있다.그것은 그들의 두 세포막 사이에 위치한 시아노박테리아 조상들의 펩티도글리칸 세포벽에 해당한다.이 엽록체들은 무로플라스틱이라고 불린다.다른 엽록체들은 시아노박테리아 벽을 잃었고, 두 엽록체 봉투막 사이에 간격이 생겼다.[33]
엽록부부부막막막
내부 엽록체 막은 스트로마와 경계를 이루며 엽록체 내부와 외부로 물질의 통로를 조절한다.외부 엽록체 막의 TOC 콤플렉스를 통과한 후 폴리펩타이드제는 내부 엽록체 막에 위치한 TIC 콤플렉스(내측 엽록체 막의 트랜스클로콘)를 통과해야 한다.[87]
내부의 엽록체 막은 물질의 통로를 조절하는 것 외에도 지방산, 지질, 카로티노이드 등이 합성되는 곳이다.[33]
일부 엽록체에는 엽록체 말초 망막이라는 구조가 들어 있다.[108]C식물의4 엽록체에서도 종종 발견되지만, 일부 C형3 혈관종,[33] 심지어 일부 체조종에서도 발견된다.[109]엽록체 말초 레티쿨룸은 엽록체의 내부 스트롬액으로 확장되는 내부 엽록체 막과 연속되는 막관 및 음낭의 미로들로 구성되어 있다.그것의 목적은 그것의 스트로마와 세포질 사이의 교차 기억 전달을 위해 엽록체의 표면적을 증가시키는 것이라고 생각된다.때때로 관찰된 작은 방광은 태즈메니아 늑대와 중간 공간 사이의 물질을 왕복하는 수송용 방광 역할을 할 수 있다.[110]
스트로마
단백질이 풍부하고 [33]알칼리성이 있는 [101]수액을 내부 엽록체 막과 태일라코이드 공간 바깥에 있는 것을 스트로마라고 하는데,[33] 이는 원래 시아노박테리움의 세포솔에 해당한다.엽록체 DNA의 뉴클레오이드, 엽록체 리보솜, 플라스토글로불리를 가진 틸라코이드 시스템, 녹말과립, 그리고 많은 단백질들이 그 안에서 떠다니는 것을 발견할 수 있다.G3P에 CO를2 고정하는 캘빈 사이클은 스트로마에서 일어난다.
엽록체들은 그들 자신의 리보솜을 가지고 있는데, 그들은 그들의 단백질의 작은 부분을 합성하는데 사용한다.엽록체 리보솜은 세포질 리보솜의 약 3분의 2 크기(약 17nm vs 25nm)[108]그들은 엽록체 DNA에서 옮겨온 mRNA를 단백질로 변환한다.박테리아 리보솜과 유사하지만,[10] 엽록체 번역은 박테리아보다 더 복잡하기 때문에 엽록체 리보솜에는 엽록체-독특한 특징이 일부 포함되어 있다.[111][112]
몇몇 엽록소와 우글레니드 엽록체에서 작은 단위 리보솜 RNA는 대부분의 엽록체와 원핵생물에서 번역 개시에 필수적인 샤인-달가노 염기서열 인식 모티브가 결여되어 있다.[113][114][115]이러한 손실은 다른 플라스티드와 원핵생물에서도 거의 관찰되지 않는다.[113][116]3'꼬리 23S'에 대한 호몰로학을 가진 4.5S rRNA가 더 높은 식물에서 발견된다.[112]
플라스토글로불리
플라스티오글로불리(Singular Plastoglobulus,[117] 때때로 철자로 된 플라스티오글로불루스)는 지질과[33] 단백질의 구형 거품이다.그들은 지질 단층 동물에 둘러싸여 있다.[117]플라스토글로불리는 모든 엽록체에서 발견되지만 엽록체가 산화 스트레스를 받거나 나이가 들어 제론토플라스틱으로 전환될 때 더 흔해진다.[108][117][33]플라스토글로불리는 또한 이러한 조건에서 더 큰 크기 변동을 보인다.[117]그들은 또한 식이성형에서 흔하지만 식이성형이 엽록체로 성숙함에 따라 수가 감소한다.[117]
플라스토글루불리는 지질 합성과 신진대사에 관여하는 구조 단백질과 효소를 모두 함유하고 있다.그것들은 플라토키논, 비타민 E, 카로티노이드, 엽록소를 포함한 많은 종류의 지질을 함유하고 있다.[117]
플라스토글로불리는 한때 스트로마에서 자유롭게 떠다니는 것으로 생각되었으나, 현재는 플라토글로불루스가 태라코이드 네트워크와 내용물을 교환할 수 있는 구성인 태라코이드나 태라코이드에 부착된 또 다른 플라스토글로불루스에 영구적으로 붙어 있는 것으로 생각된다.[117]정상적인 녹색 엽록체에서, 대부분의 플라스티오글로불리는 특이하게 발생하며, 그들의 부모인 틸라코이드에 직접 부착된다.오래되거나 스트레스를 받는 엽록체에서 플라스티오글로불리는 연결된 집단이나 사슬에서 발생하는 경향이 있으며, 여전히 태즈메니아 늑대에 고정되어 있다.[117]
플라스토글로불리는 비록 그것들이 결코 분리되어 스트로마 속으로 떠내려가지 않지만, 태즈메니아 막의 지질 빌레이어 층 사이에 거품이 나타날 때 형성된다.[117]사실상 모든 플라스티오글로불리는 태즈메니아 늑판 또는 시트의 고도로 구부러진 가장자리 위 또는 근처에서 형성된다.그들은 또한 곡물보다 스트로몰 태라코이드에서 더 흔하다.[117]
녹말과립
녹말 과립은 엽록체에서 매우 흔하며, 전형적으로 오르가넬 부피의 15%를 차지하지만,[118] 아밀로플라스틱과 같은 다른 플라스티드에서는 오르가넬의 모양을 왜곡할 정도로 클 수 있다.[108]녹말 과립은 스트로마 속에 녹말이 축적된 것일 뿐, 막에 의해 경계가 되지 않는다.[108]
녹말 과립은 하루 종일 나타나고 자라는데, 엽록체가 당분을 합성하여 밤에 섭취하여 호흡을 연료화하고 당분 수출을 계속하는데,[119] 성숙한 엽록체에서는 녹말 과립이 완전히 소비되거나 새로운 과립이 축적되는 경우는 드물다.[118]
녹말 과립은 엽록체 선마다 성분과 위치가 다르다.홍조류에서는 녹말과립이 엽록체보다는 세포질에서 발견된다.[120]C식물의4 경우 당분을 합성하지 않는 중생필 엽록체에는 녹말과립이 부족하다.[33]
루비스코
엽록체 스트로마는 많은 단백질을 함유하고 있지만, 가장 흔하고 중요한 것은 지구상에서 가장 풍부한 단백질인 RuBisCO일 것이다.[101]루비스코는 당분자에 CO를2 고정하는 효소다.C공장에서는3 루비스CO는 모든 엽록체에서 풍부하지만, C공장에서는4 다발 피복 엽록체에만 국한되며, C공장에서는4 캘빈 사이클이 이루어진다.[121]
피레노이드
일부 뿔풍뎅이와[122] 해조류의 엽록체에는 피레노이드라고 불리는 구조물이 들어 있다.그것들은 더 높은 식물에서는 발견되지 않는다.[123]피레노이드(pyrenoids)는 대략 구형의 굴절성이 강한 몸체로, 그것들을 포함하는 식물에서 전분이 축적되는 곳이다.그것들은 두 개의 반구형 전분판으로 둘러싸인 전자에서 불투명한 행렬로 이루어져 있다.피레노이드의 성숙에 따라 녹말이 축적된다.[124]탄소집중 메커니즘이 있는 조류에서 루비스 효소이산화탄소는 피레노이드에서 발견된다.또한2 CO가 부족할 때 전분은 피레노이드 주위에 축적될 수 있다.[123]피레노이드들은 분열되어 새로운 피레노이드들을 형성하거나 "de novo"[124][125]로 만들어질 수 있다.
틸라코이드 시스템
틸라코이드(Thylakoids, tylako reactionsds)[127]는 광합성의 빛 반응이 일어나는 막을 포함하는 작은 상호 연결된 자루다.태일라코이드라는 단어는 그리스어 태일라코스에서 유래되었는데, 이것은 "짝짝짝"을 의미한다.[128]
엽록체 스트로마 안에 매달려 있는 것은 태라코이드 계통으로, 엽록소가 발견되고 광합성의 빛 반응이 일어나는 태라코이드라고 불리는 막자루의 매우 역동적인 집합체다.[16]대부분의 혈관 식물 엽록체에서, 태즈메니아 늑대는 그라나라고 불리는 스택으로 배열되어 있지만,[129] 특정4 C 식물 엽록체와[121] 일부 녹조 엽록체에서는 태즈메니아 늑대가 자유롭게 떠다니고 있다.[17]
틸라코이드 구조

가벼운 현미경을 사용하면, 그라나라고 이름 붙여진 작은 녹색 과립을 거의 볼 수 없다.[108]전자현미경으로 태라코이드 시스템을 보다 자세히 볼 수 있게 되어, 그라나를 구성하는 납작한 태라코이드와 서로 다른 그라나를 연결한 긴 상호연결 스트로몰 태라코이드로 구성되어 있음을 알 수 있다.[108]전송전자현미경에서 태일라코이드막은 두께 8.5나노미터의 빛과 어둠의 띠가 교대로 나타난다.[108]
오랫동안, 태즈메니아 늑막 시스템의 3차원 구조는 알려지지 않았거나 논란이 되어왔다.많은 모델들이 제안되었는데, 가장 보편적인 것은 나선형 모델로서, 그란룸 스택의 틸라코이드가 나선형 스트로몰 태라코이드에 의해 포장된다.[130]식물 태라코이드 막의 첫 전자 단층촬영 연구에 기초하여 '바이퍼레이션 모델'로 알려진 또 다른 모델은 그라눔-스트로마 조립체를 이루는 여러 개의 평행 디스크로 분리되는 그라나 기둥에 수직인 넓은 성층판으로 스트롬막을 묘사하고 있다.[131]헬리컬 모델은 여러 추가 작업에 의해 지원되었지만,[129][132] 최종적으로 2019년에 새롭게 발견된 왼손 헬리컬 멤브레인 접합부에 의해 헬리컬 모델과 분기 모델 모두의 특징이 통합된다는 것이 결정되었다.[126]쉽게 설명될 수 있는, 태즈메니아 늑대는 여전히 오래된 "허브와 스포크" 모델에 의해 묘사되는데, 그라나는 스트로말 태즈메니아 늑대의 관에 의해 서로 연결되어 있다.[133]
그라나는 팬케이크를 닮은 납작한 원형 그라날 태라코이드 더미로 이루어져 있다.각 그래눔은 2개에서 100개까지의 태즈메니아 늑대를 포함할 수 있지만,[108] 10~20개의 태즈메니아 늑대를 가진 그래나가 가장 흔하다.[129]그라나 주위에는 여러 개의 평행한 오른손 나선형 나선형 태라코이드가 있는데, 이는 조바심 또는 라멜라 태라코이드라고도 알려져 있다.나선은 교량형 슬릿 분기점에서 각 그라날 태일라코이드와 연결되면서 약 20° 각도로 상승한다.[129][132][126]
스트로마 라멜레는 그라나 기둥에 수직인 큰 시트로 확장된다.이 시트들은 직접 또는 왼손 헬리컬 막 표면을 형성하는 분리를 통해 오른손 헬리컬에 연결된다.[126]왼손 헬리컬 표면은 오른손 헬리컬(~20°)과 경사각이 유사하지만 피치는 pitch이다.그란룸당 약 4개의 왼손 헬리컬 접합부가 존재하며, 최소 표면과 벤딩 에너지로 네트워크를 통합하는 서로 다른 반지름과 피치의 오른손 및 왼손 헬리컬 막 표면의 피치 균형이 잡힌다.[126]태즈메니아 늑대의 다른 부분들이 다른 막 단백질을 포함하고 있는 반면, 태즈메니아 늑막은 연속적이고 그들이 에워싸고 있는 태즈메니아 늑대는 하나의 연속적인 미로를 형성한다.[129]
틸라코이드 구성
태즈메니아 늑막에는 광합성의 빛 반응을 수행하는 중요한 단백질 복합체가 포함되어 있다.포토시스템Ⅱ와 포토시스템Ⅰ에는 빛에너지를 흡수해 전자에너지를 공급하는 엽록소와 카로티노이드 등이 포함된 빛 수확 복합체가 들어 있다.태일라코이드 막의 분자는 전자가 통전된 전자를 사용하여 수소 이온을 태일라코이드 공간으로 펌핑하여 pH를 감소시키고 산성화시킨다.ATP 싱타아제는 태라코이드 공간에 있는 수소 이온의 농도 구배를 활용하여 수소 이온이 댐 터빈처럼 다시 스트로마로 흐를 때 ATP 에너지를 생성하는 대규모 단백질 복합체다.[101]
실로모이드에는 그라나로 배열된 그라날 탈라코이드와 스트로마와 접촉하는 스트로몰 탈라코이드의 두 종류가 있다.그라날 태라코이드(Granal Thylakoids)는 직경 300~600나노미터의 팬케이크 모양의 원형 원반이다.Stromal thylakoids는 그라나 주위를 나선형으로 도는 헬리코이드 시트다.[129]그라날 태라코이드의 평평한 윗부분과 아랫부분에는 비교적 평평한 광섬제 II 단백질 복합체만 들어 있다.이를 통해 촘촘히 쌓을 수 있어 그라날막이라 불리는 촘촘하게 부착된 막이 여러 겹으로 형성돼 빛 포획을 위한 안정성과 표면적을 높일 수 있다.[129]
이와는 대조적으로 포토시스템 I과 ATP 싱타아제는 스트로마 속으로 분출되는 큰 단백질 복합체다.그것들은 부착된 그라날 막에 들어갈 수 없고, 그래서 그라날 태라코이드 막, 즉 그라날 태라코이드 디스크의 가장자리와 스트롬 태라코이드에서 발견된다.이러한 큰 단백질 복합체는 스트롬탈 틸라코이드 판 사이의 스페이서 역할을 할 수 있다.[129]
엽록체의 태즈메니아 늑대의 수와 총 태즈메니아 늑대는 빛 노출의 영향을 받는다.그늘진 엽록체에는 밝은 빛에 노출된 엽록체보다 더 크고 더 많은 태라코이드 막이 들어 있는데, 이 색소는 점점 더 작으며 태라코이드 면적이 적다.태일라코이드 범위는 광선 노출 또는 제거 후 몇 분 이내에 변할 수 있다.[110]
색소 및 엽록체 색상
엽록체 태일라코이드 막에 내장된 포토시스템 안에는 광 에너지를 흡수하고 전달하는 다양한 광합성 색소가 있다.발견된 색소의 종류는 엽록체의 여러 그룹에서 다르며, 광범위한 엽록체 색소를 담당한다.
엽록소
엽록소 a는 그들의 시아노박테리아 조상뿐만 아니라 모든 엽록체에서 발견된다.엽록소 a는 대부분의 시아노박테리아와 엽록체 색소를 부분적으로 담당하는 청녹색 색소다[134].엽록소의 다른 형태는 부속 색소 엽록소 b, 엽록소 c, [17]엽록소 d, 엽록소 f와 같이 존재한다.
엽록소 b는 식물의 엽록체, 녹조, 녹색알가의 2차 내분비증을 통해 얻은 2차 엽록체, 그리고 몇 개의 시아노박테리아에서만 발견되는 올리브 녹색 색소다.[17]대부분의 식물과 녹색 녹조 엽록체를 녹색으로 만드는 것은 엽록소 a와 b이다.[134]
엽록소 c는 홍조류의 엽록체 자체에서는 발견되지 않지만 적색 알가에서 유래한 2차 내합성 엽록체에서 주로 발견된다.엽록소 c는 일부 녹조와 시아노박테리아에서도 발견된다.[17]
엽록소 d와 f는 일부 시아노박테리아에서만 발견되는 색소다.[17][135]
카로티노이드
엽록소 외에도 카로티노이드라고 불리는 또 다른 황색-오렌지[134] 색소 그룹이 광학 시스템에서도 발견된다.광합성 카로티노이드에는 약 30개가 있다.[136]그것들은 과도한 에너지를 전달하고 발산하는데 도움을 주고,[17] 그들의 밝은 색은 때때로 몇몇 육지 식물의 잎들이 색이 변하는 가을 동안처럼 엽록소 초록색보다 우선한다.[137]β-카로틴은 엽록소 a와 같은 거의 모든 엽록체에서 발견되는 밝은 적색-오렌지 카로티노이드다.[17] 크산토필, 특히 주황색 적색 제악산틴도 흔하다.[136]많은 다른 형태의 카로티노이드들은 엽록체들의 특정 그룹에서만 발견된다.[17]
피코빌린
피코빌린은 시아노박테리아에서 발견된 세 번째 색소군이며, 글라우코필레, 홍조류, 암호화된 엽록체군이다.[17][138]피코빌린은 모든 색이 있지만, 피코베리테린은 많은 홍조류를 붉게 만드는 것은 피코빌린이다.[139]피코빌린은 흔히 피코빌리솜이라고 불리는 약 40나노미터의 비교적 큰 단백질 복합체로 구성된다.[17]포토시스템 I과 ATP 싱타아제처럼 피코빌리솜이 스트로마 속으로 스며들어 적색 녹조 엽록체에 태라코이드 적층 방지 효과가 있다.[17]암호화된 엽록체와 일부 시아노박테리아에는 피코빌리솜으로 구성된 피코빌린 색소가 없으며, 대신 태일라코이드 공간에 보관한다.[17]
| 광합성 색소 표 엽록체 그룹에 걸친 다양한 색소의 존재 표.색소 세포는 색소 유무를 나타낸다.[17][136][138] | |||||||||
| 엽록소 a | 엽록소 b | 엽록소 c | 엽록소 d와 f | 크산토필스 | α-carotene | β-carotene | 피코빌린 | ||
| 육지식물 | |||||||||
| 녹조 | |||||||||
| 우글레노피스트와 클로로라치니오피스류 | |||||||||
| 다세포적조류 | |||||||||
| 단세포적 홍조류 | |||||||||
| 학식동물과 다이노피스 | |||||||||
| 암호학 | |||||||||
| 글라우코피테스 | |||||||||
| 시아노박테리아 | |||||||||
C공장의4 특화된 엽록체
광합성 과정에서 당분자에 이산화탄소를 고정시키기 위해 엽록체들은 루비스CO라는 효소를 사용한다.RuBisCO는 이산화탄소와 산소를 구별하는데 어려움을 겪기 때문에 높은 산소 농도에서 RuBis를 구별할 수 있다.이산화탄소는 실수로 설탕 전구체에 산소를 첨가하기 시작한다.이것은 ATP 에너지가 낭비되고 CO가2 방출되는 결과를 가지고 있는데, 모두 설탕이 생산되지 않는다.이것은2 큰 문제인데, O는 광합성의 초기 빛 반응에 의해 생성되어 루비스를 사용하는 캘빈 사이클에서 선을 따라 문제를 일으키기 때문이다.CO.[140]
C식물은4 빛의 반응과 캘빈 사이클을 공간적으로 분리함으로써 이것을 해결하기 위한 방법을 발전시켰다.빛에너지를 ATP와 NADPH에 저장하는 빛 반응은 C잎의4 중생세포에서 이루어진다.저장된 에너지를 사용하여 루비스CO를 이용하여 설탕을 만드는 칼빈 사이클은 잎의 정맥을 둘러싸고 있는 세포층인 번들 피복 세포에서 이루어진다.[140]
그 결과 C4 메소필 세포와 번들 피복 세포의 엽록체들은 광합성의 각 단계에 특화되어 있다.중엽소세포에서 엽록체는 빛 반응에 특화돼 있어 루비스CO가 부족하고, ATP와 NADPH를 만드는 [121]데 사용하는 정상적인 그라나·틸라코이드와 산소를 가지고 있다.그들은 CO를2 4탄소 화합물에 저장하는데, 이것이 그 과정을 C4 광합성이라고 부르는 이유다.그런 다음 4-탄소 화합물은 다발 피복 엽록체로 운반되고, 거기서 CO를2 떨어뜨려 메소필로 돌아온다.번들 피복 엽록체들은 빛 반응을 수행하지 않아 그 안에 산소가 쌓이는 것을 막고 루비스를 교란시킨다.CO 활동.[140]이 때문에, 그들은 그라나 스택으로 조직된 틸라코이드가 부족하다. 하지만 다발성 피복 엽록체들은 여전히 순환 전자 흐름을 수행하는 스트로마에 자유 유동 틸라코이드를 가지고 있는데, 이것은 산소를 발생시키지 않고 캘빈 사이클에 동력을 공급하기 위해 ATP를 합성하는 광구동 방식이다.그것들은 포토시스템 II가 없고, 오직 포토시스템 I만을 가지고 있는데, 이것은 순환 전자 흐름에 필요한 유일한 단백질 복합체다.[121][140]다발성 피복 엽록체는 칼빈 사이클을 수행하고 설탕을 만드는 일이기 때문에 큰 녹말 알갱이를 함유하는 경우가 많다.[121]
두 종류의 엽록체에는 다량의 엽록체 말초 레티쿨룸이 함유되어 있는데,[121] 이 레티쿨룸은 물질을 안팎으로 운반할 수 있는 표면적을 더 많이 얻기 위해 사용한다.[109][110]메소필 엽록체들은 다발성 피복 엽록체보다 좀 더 말초적인 망막을 가지고 있다.[141]
위치
플랜트 내 분포
다세포 식물의 모든 세포가 엽록체를 포함하는 것은 아니다.식물의 모든 녹색 부분에는 엽록소가 들어 있다. 엽록체, 더 구체적으로 말하면 그 안에 있는 엽록소가 식물의 광합성 부분을 녹색으로 만드는 것이다.[16]엽록체를 포함하는 식물 세포는 대개 실질 세포지만 엽록체는 또한 담금질 조직에서도 발견될 수 있다.[142]엽록체를 포함하는 식물 세포는 클로렌치마 세포로 알려져 있다.육지 식물의 전형적인 클로렌치마 세포는 약 10에서 100개의 엽록체를 포함하고 있다.

선인장과 같은 일부 식물에서는 줄기에서 엽록체가 발견되지만 대부분의 식물에서는 엽록체가 잎에 집중되어 있다.[143]1제곱밀리미터의 잎조직은 50만개의 엽록체를 포함할 수 있다.[16]잎 안에서 엽록체들은 주로 잎의 중간층, 기공의 경계 세포에서 발견된다.팰리세이드 중엽소 세포는 세포당 30–70개의 엽록체를 포함할 수 있으며, 기공 감시 세포는 세포당 8–15 정도의 엽록소만을 포함할 뿐 아니라 훨씬 적은 엽록소를 함유하고 있다.엽록체는 잎의 묶음 피복세포에서도 발견될 수 있으며, 특히 C식물은4 묶음 피복세포에서 캘빈 사이클을 수행한다.그들은 종종 나뭇잎의 표피에 결석한다.[144]
셀룰러 위치
엽록체 운동
식물과 해조세포의 엽록체는 이용 가능한 빛에 가장 잘 맞도록 방향을 잡을 수 있다.조도가 낮은 상태에서는 표면적을 최대화하여 빛을 흡수하는 시트로 퍼진다.강렬한 빛 아래에서, 그들은 식물 세포벽을 따라 수직 기둥에 정렬하거나 빛이 그들을 엣지온에 닿도록 옆으로 돌면서 피난처를 찾을 것이다.이것은 노출을 줄이고 광산화물 손상으로부터 그들을 보호한다.[145]이렇게 엽록체를 유통시켜 서로 뒤에 숨거나 퍼져나갈 수 있게 하는 능력은 육지식물이 몇 개의 큰 엽록체 대신 작은 엽록체를 많이 갖도록 진화한 이유일 것이다.[146]엽록체 운동은 식물에서 발견될 수 있는 가장 밀접하게 규제되는 자극-반응 시스템 중 하나로 여겨진다.[147]미토콘드리아는 또한 그들이 움직일 때 엽록체를 따르는 것이 관찰되었다.[148]
상급 식물에서 엽록체 운동은 포토트로핀에 의해 실행되는데, 푸른 빛 광수용체 또한 식물 광로피즘을 담당한다.일부 조류, 이끼, 양치류, 꽃식물에서 엽록체 운동은 청색광 외에 적색광의 영향을 받지만 매우 긴 적색 파장은 속도를 올리기보다는 움직임을 억제한다.[145]푸른 빛은 일반적으로 엽록체들이 피난처를 찾도록 하는 반면, 붉은 빛은 그것들을 끌어내어 빛의 흡수를 극대화시킨다.[148]
수생화식물인 Vallisneria gigantea에 대한 연구는 엽록체들이 처음에는 순방향성을 보여주지 않지만 빛에 노출된 지 5분 이내에 움직일 수 있다는 것을 보여주었다.그들은 마이크로필라멘트 트랙을 따라 움직일 수 있고, 마이크로필라멘트 메쉬가 이동한 후에 엽록체를 둘러싼 벌집 구조를 형성하기 위해 모양을 바꾼다는 사실은 마이크로필라멘트가 엽록체를 제자리에 고정시키는 데 도움을 줄 수 있다는 것을 시사한다.[147][148]
기능 및 화학
가드 세포 엽록체
대부분의 표피세포와 달리 식물 기공의 보호세포는 비교적 잘 발달된 엽록체를 포함하고 있다.[144]하지만, 정확히 그들이 하는 일은 논란의 여지가 있다.[149]
식물성내성
식물은 전문화된 면역 세포가 부족하다. 모든 식물 세포는 식물의 면역 반응에 참여한다.엽록체들은 핵, 세포막, 내포체성 망막과 함께 병원체 방어의 핵심 플레이어다.[150]식물 세포의 면역 반응에서 그것의 역할 때문에 병원균은 종종 엽록체를 목표로 한다.[150]
식물은 두 가지 주요 면역 반응을 가지고 있다. 즉, 감염된 세포가 스스로를 봉쇄하고 프로그램된 세포사멸을 겪는 과민반응과 감염된 세포가 병원체의 존재에 대한 나머지 식물의 경고 신호를 방출하는 전신 후천 저항이다.엽록체들은 그들의 광합성계를 의도적으로 손상시켜 반응성 산소종을 만들어냄으로써 두 반응을 자극한다.높은 수준의 활성산소 종은 과민반응을 일으킬 것이다.활성산소 종은 세포 내의 어떤 병원균도 직접 죽인다.반응성 산소 종의 낮은 레벨은 시스템적으로 획득된 저항을 시작하며, 이는 공장의 나머지 부분에서 방어 분자 생성을 촉발한다.[150]
일부 식물에서 엽록체는 감염이 진행되는 동안 감염 부위 및 핵에 더 가까이 이동하는 것으로 알려져 있다.[150]
엽록체는 세포 센서 역할을 할 수 있다.병원체 때문일 수도 있는 세포에서 스트레스를 감지한 후 엽록체들은 살리실산, 자스몬산, 질소산화물, 그리고 방어 신호의 역할을 할 수 있는 반응성 산소종과 같은 분자를 생산하기 시작한다.세포 신호로서 반응하는 산소 종은 불안정한 분자여서 아마도 엽록체에서 떠나지 않고 대신 그들의 신호를 알 수 없는 두 번째 메신저 분자에게 전달한다.이 모든 분자들은 역행 신호, 즉 핵에서 유전자 발현을 조절하는 엽록체로부터의 신호를 시작한다.[150]
방어 신호 외에도 엽록체들은 과록시솜의 도움을 받아 중요한 방어 분자인 재스몬테를 합성하는데 도움을 준다.[151]엽록체는 식물 세포의[150][152] 모든 지방산을 합성한다. 지방산인 리놀산은 재스몬테이트의 전구체다.[150]
광합성
엽록체의 주요 기능 중 하나는 빛이 화학 에너지로 변환되는 과정인 광합성에 있어서 그것의 역할이며, 그 후에 설탕의 형태로 음식을 생산한다.광합성에는 물(HO2)과 이산화탄소(CO2)가 사용되고, 광 에너지를 이용해 설탕과 산소(O2)가 만들어진다.광합성은 두 단계로 나뉘는데, 물이 갈라져 산소가 생기는 빛 반응과 어두운 반응, 또는 이산화탄소에서 당분자를 만드는 칼빈 사이클이다.이 두 단계는 에너지 운반체 아데노신 3인산염(ATP)과 니코틴아미드 아데닌 디뉴클레오티드 인산염(NADP)에 의해 연결된다.+[153][154]
가벼운 반응
빛 반응은 태즈메니아 늑막에서 일어난다.그들은 빛에너지를 취하여 NADP의+ 한 형태인 NADPH와 ATP에 저장하여 어두운 반응을 부채질한다.
에너지 운반체
ATP는 아데노신 디포인산염(ADP)의 인산화 버전으로, 에너지를 세포에 저장하고 대부분의 세포 활동에 전력을 공급한다.ATP는 전원이 공급된 형태고, ADP는 (부분적으로) 고갈된 형태다.NADP는+ 높은 에너지 전자를 운반하는 전자 운반선이다.빛 반응에서, 그것은 감소한다. 즉, 그것은 전자를 집어서 NADPH가 된다.
광인산화
미토콘드리아처럼 엽록체들은 ATP 에너지를 생성하기 위해 H+, 즉 수소 이온 경사로에 저장된 전위 에너지를 사용한다.두 개의 광섬유는 빛 에너지를 포착하여 물에서 채취한 전자에 에너지를 공급하고 전자 전송 체인을 아래로 방출한다.광계 사이의 분자는 전자의 에너지를 이용하여 수소 이온을 태라코이드 공간으로 펌핑하여 농도 구배를 생성하는데, 스트로마보다 태라코이드 시스템 내부에 더 많은 수소 이온(최대 천 배)[101]이 있다.태일라코이드 공간에 있는 수소 이온은 다시 그들의 농도 구배를 따라 확산되어 ATP 싱타아제를 통해 스트로마로 다시 흘러나온다.ATP 싱타아제는 흐르는 수소 이온에서 아데노신 디포스포산염까지의 에너지를 아데노신 삼인산 또는 ATP로 사용한다.[101][155]엽록체 ATP synthase가 스트로마에 투영되기 때문에 ATP는 어두운 반응에 사용될 수 있는 위치에 합성된다.[156]
NADP+ 감소
전자는 종종 전자 전송 사슬에서 제거되어 NADP를+ 전자로 충전하여 NADPH로 감소시킨다.ATP 싱타아제처럼 NADP를+ 감소시키는 효소인 페레독신-NADP 환원효소는 NADPH가 만드는 NADPH를 어두운 반응에 필요한 스트로마로 방출한다.[156]
NADP+ 감소가 전자 전송 체인에서 전자를 제거하기 때문에, 그것들은 대체되어야 한다. 즉, 수소 원자로부터 전자를 얻기 위해 물 분자(HO2)를 분열시키는 광시스템 II의 작업이다.[101][153]
순환광인산화
포토시스템 II는 물을 광학화하여 새로운 전자를 얻고 활력을 불어넣는 반면, 포토시스템 I는 단순히 전자전달 체인의 끝에서 고갈된 전자에 전원을 공급한다.일반적으로, 재활성화된 전자는 NADP에+ 의해 취하지만, 때로는 더 많은 수소 이온을 더 많은 ATP를 생성하기 위해 더 많은 H-펌핑+ 전자 전송 체인을 아래로 흘러 내려갈 수 있다.이것은 전자가 재활용되기 때문에 순환 광인산화라고 불린다.주기적인 광인산화 작용은 NADPH보다 더 많은 ATP가 필요한4 C 발전소에서 흔히 발생한다.[140]
다크 리액션
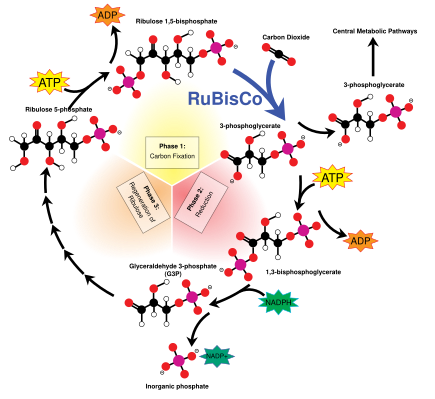
다크 리액션으로도 알려진 캘빈 사이클은 G3P 설탕 분자에 CO를2 고정시키고 빛 리액션에서 만들어진 ATP와 NADPH의 에너지와 전자를 사용하는 일련의 생화학 반응이다.칼뱅 주기는 엽록체의 스트로마에서 일어난다.[140]
"어두운 반응"이라고 이름 붙이기는 하지만, 대부분의 식물에서는, 어두운 반응이 빛의 반응의 생산물에 의존하기 때문에, 그것들은 빛 속에서 일어난다.[16]
탄소 고정 및 G3P 합성
캘빈 사이클은 루비스 효소를 사용하는 것으로 시작한다.CO를2 5-탄소 리불로오스 비스포스포산(RubbP) 분자에 고정한다.그 결과는 불안정한 6-탄소 분자로 즉시 3-인스포글리세르산 또는 3-PGA라고 불리는 3-탄소 분자로 분해된다.빛 반응에서 만들어진 ATP와 NADPH는 3-PGA를 글리세랄알데히드-3-인산염 또는 G3P 설탕 분자로 변환하는데 사용된다.대부분의 G3P 분자는 더 많은 ATP로부터 나오는 에너지를 사용하여 RuBP로 다시 재활용되지만, 생산된 6개 중 1개는 사이클을 떠난다. 즉 암흑 반응의 최종 산물이다.[140]
설탕과 녹말
글리세랄데히드-3-인산염은 포도당과 과당과 같은 더 큰 설탕 분자를 형성하기 위해 두 배로 증가할 수 있다.이 분자들은 처리되고, 그 분자들로부터, 비록 이 과정이 엽록체 밖에서 세포질 안에서 이루어지지만, 여전히 더 큰 자당인 이당류가 만들어진다.[157]
또는 엽록체 속의 포도당 단층기를 연결하여 녹말을 만들 수 있는데, 녹말은 엽록체에서 발견된 녹말 알갱이에 축적된다.[157]대기 중 CO2 농도와 같은 조건에서는 이러한 녹말 알갱이가 매우 크게 자라 그라나와 태라코이드를 왜곡할 수 있다.녹말 과립은 태즈메니아 늑대를 대체하지만, 그것들을 그대로 둔다.[158]또한 물에 잠긴 뿌리는 엽록체에서 녹말 증식을 유발할 수 있는데, 이는 엽록체(또는 더 정확히 말하면, 식물 세포)에서 내보내는 자당류가 적기 때문일 수 있다.이것은 식물의 자유로운 인산염 공급을 감소시켜 엽록체 전분 합성을 간접적으로 자극한다.[158]낮은 광합성률과 연결되어 있는 반면, 녹말 알갱이 자체는 반드시 광합성의 효율성에 큰 지장을 주지 않을 수 있으며,[159] 단순히 또 다른 광합성 억제 요인의 부작용일 수도 있다.[158]
포토레스피레이션
광자극은 산소 농도가 너무 높을 때 발생할 수 있다.RuBisCO는 산소와 이산화탄소를 잘 구별하지 못하기 때문에 실수로 LuBP에 CO2 대신2 O를 첨가할 수 있다.이 과정은 광합성의 효율성을 감소시킨다. 그것은 ATP와 산소를 소비하고, 이산화탄소를2 배출하며, 설탕을 배출하지 않는다.그것은 캘빈 사이클에 의해 고정된 탄소의 절반까지 낭비할 수 있다.[153]엽록체 내 산소에 대한 이산화탄소 농도를 높이는 여러 가지 메커니즘이 서로 다른 라인에서 진화해 광합성의 효율성을 높였다.이러한 메커니즘을 이산화탄소 집중 메커니즘 또는 CCM이라고 부른다.여기에는 크라술라산 대사, C탄소4 고정,[153] 피레노이드 등이 포함된다.C식물의4 엽록체들은 뚜렷한 엽록체 이형성을 보이기 때문에 눈에 띈다.
pH
태일라코이드 막을 가로지르는 H+ 그라데이션 때문에 태일라코이드의 내부는 산성으로 pH가 4 정도인 반면 [160]스트로마는 약간 기본이 되어 pH가 8 정도 된다.[161]캘빈 사이클의 최적 스트로마 pH는 8.1이며, pH가 7.3 이하로 떨어지면 반응이 거의 정지한다.[162]
물에 함유된 CO는2 탄산을 형성할 수 있는데, 이는 광합성에 CO를2 사용함에도 불구하고 광합성을 방해하여 고립된 엽록체의 pH를 교란시킬 수 있다.그러나 살아있는 식물 세포의 엽록체들은 이것만큼 영향을 받지 않는다.[161]
엽록체들은 잘 이해되지 않는 광구동 운송 시스템을 이용하여+ K와+ H 이온을 주입할 수 있다.[161]
빛이 있으면 태즈메니아 루멘의 pH는 최대 1.5 pH까지 떨어질 수 있고 스트로마의 pH는 거의 1 pH 단위로 상승할 수 있다.[162]
아미노산합성
엽록체만 해도 시스테인과 메티오닌과 같은 유황을 함유한 아미노산을 제외한 거의 모든 식물 세포의 아미노산을 스트로마에서[163] 만든다.[164][165]시스테인은 엽록체(프로플라스틱도)에서 만들어지지만, 시토솔과 미토콘드리아에서도 합성되는데, 아마도 필요한 곳에 도달하기 위해 막을 건너는 데 어려움을 겪기 때문일 것이다.[165]엽록체는 메티오닌에 전구체를 만드는 것으로 알려져 있지만 오르가넬이 경로의 마지막 다리를 수행하는지, 시토솔에서 발생하는지는 불분명하다.[166]
기타 질소 화합물
엽록체들은 세포의 모든 청색과 피리미딘을 만든다. 즉,[163] DNA와 RNA에서 발견되는 질소 베이스.그들은 또한 아미노산과 뉴클레오티드를 만들기 위해 식물에 질소를 공급하는 암모니아(NH2−3)로 변환한다.[163]
기타 화학제품
플라스티드는 식물의 다양하고 복잡한 지질 합성의 현장이다.[167][168]지질의 대다수를 형성하는 데 사용되는 탄소는 피루베이트의 데카복시화 제품인 아세틸-CoA에서 나온다.[167]피루베이트는 글리콜리시스 생산 후 막을 통해 수동적으로 확산되어 시토솔에서 플라스티드로 들어갈 수 있다.[169]피루바이트는 또한 피루바이트나 PGA에서 시토솔로 만들어진 대사물인 인광에노폴피루바이트의 플라스티드에서 만들어진다.[167]시토솔의 아세테이트는 플라스티드에서 지질 생합성 작용을 할 수 없다.[170]플라스티드에서 생산되는 지방산의 대표적인 길이는 16개 또는 18개의 탄소로 0-3 cis 이중 결합이다.[171]
아세틸-CoA에서 나오는 지방산의 생합성은 주로 두 개의 효소를 필요로 한다.아세틸-CoA 카르복실라아제는 합성의 첫 단계와 확장 단계 모두에서 사용되는 악성코닐-CoA를 생성한다.지방산 신타아제(FAS)는 아킬 체인을 합성하면서 고정시키는 아킬 운반체 단백질(ACP)을 포함한 효소와 공효소의 큰 복합체다.합성의 시작은 아세틸-CoA와 함께 말론-ACP의 응축으로 시작하여 NADPH의 사용을 포함하는 케토부틸-ACP 2 감소와 한 번의 탈수증이 부틸-ACP를 생성한다.지방산의 확장은 말란닐-ACP 응결, 감소, 탈수 등의 반복적인 순환에서 온다.[167]
다른 지질들은 메틸-에리스리톨 인산염(MEP) 경로에서 파생되며, 지브렐린, 스테롤, 아비스시산, 피톨, 무수한 2차 대사물로 구성되어 있다.[167]
차별화, 복제 및 상속

엽록체는 플라스티드라고 불리는 식물 세포 오르간젤의 특별한 유형이지만, 두 용어는 서로 교환하여 사용된다.그 밖에 여러 가지 종류의 플라스티드가 있어 다양한 기능을 수행한다.식물의 모든 엽록체들은 지고테에서 발견된 미분화 프로플라스틱, [163]즉 수정란의 후손이다.프로플라스틱은 성인 식물의 무생물에서 흔히 발견된다.엽록체들은 보통 뿌리 끝 메리스템의[172] 프롤라스테이드로부터 발달하지 않는다. 대신, 전분 응고 아밀로플라스틱의 형성이 더 흔하다.[163]
새싹에서, 발포한 아피질 메리스템에서 나오는 프로플라스틱은 필요한 빛에 노출될 경우 잎이 성숙함에 따라 광합성 잎 조직에서 점차 엽록체로 발전할 수 있다.[12]이 과정은 내부 플라스티드 막의 침입을 수반하며, 내부 스트로마에 투영되는 막의 시트를 형성한다.그리고 나서 이 막 시트는 접혀서 틸라코이드와 그라나를 형성한다.[173]
혈관조영술 촬영이 엽록체 형성에 필요한 빛에 노출되지 않을 경우, 프로플라스틱은 엽록체가 되기 전에 식각성 단계로 발전할 수 있다.에티오플라스틱은 엽록소가 결핍된 플라스티드로, 프롤라멜라체라고 불리는 그들의 스트로마에 관의 격자를 형성하는 내막 자극이 있다.엽록소는 부족하지만 엽록소는 노란 엽록소 전구체가 비축되어 있다.[12]빛에 노출된 지 몇 분 안에 프롤라멜라 몸체는 태라코이드 더미로 재편성되기 시작하고 엽록소가 생성되기 시작한다.이 과정에서 식이세포가 엽록체가 되는 데 몇 시간이 걸린다.[173]체육관은 엽록체를 형성하는데 빛을 필요로 하지 않는다.[173]
그러나 빛은 프로플라스티드가 엽록체로 발전한다는 것을 보장하지 않는다.proplastid가 엽록체로 발전하는지는 어떤 다른 종류의 플라스티드가 대부분 핵에[12] 의해 제어되고 그것이 살고 있는 세포의 종류에 의해 크게 영향을 받는다.[163]
플라스티드 인터컨버전스
플라스티드 분화는 영구적이지 않다. 사실 많은 상호작용이 가능하다.엽록체들은 꽃과 잘 익은 과일에서 보이는 밝은 색상을 담당하는 색소충성 플라스티드로 전환될 수 있다.전분을 저장하는 아밀로플라스틱도 크롬플라스틱으로 변환할 수 있으며, 프로플라스틱이 곧바로 크롬플라스틱으로 발전할 수 있다.크로모플라스틱과 아밀로플라스틱은 또한 당근이나 감자가 켜질 때 생기는 것과 같은 엽록체가 될 수 있다.만약 식물이 다쳤거나, 다른 무언가가 식물 세포가 영구적인 상태로 되돌아간다면, 엽록체와 다른 플라스티드는 다시 재생될 수 있다.엽록체, 아밀로플라스틱, 크로모플라스틱, 프로플라스트 등은 절대 상태가 아니다. 중간 형태는 일반적이다.[163]
나누기
이 섹션은 기능, Z-링 동적 조립체, 거대 엽록체 1과 같은 규제 장치로 확장되어야 한다.추가하면 도움이 된다. (2013년 2월) |
광합성 세포에 있는 대부분의 엽록체들은 프로플라스트나 에티오플라스틱으로부터 직접 발달하지 않는다.사실, 일반적인 촬영용 메리테마틱 식물 세포는 7-20개의 프로플라스틱만 포함하고 있다.이 프롤라스트리드들은 성숙한 광합성 식물 세포에서 발견되는 30–70의 엽록체를 만들기 위해 분열하는 엽록체들로 분화한다.세포가 분열하면 엽록체 분할은 두 딸 세포 사이를 갈라놓을 수 있는 추가 엽록체를 제공한다.[174]
단세포 조류에서는 엽록체 분할만이 새로운 엽록체를 형성하는 유일한 방법이다.프로플라스틱 분화는 없다. 녹조 세포가 분열하면 엽록체도 함께 분열되고, 각 딸 세포는 성숙한 엽록체를 받는다.[173]
세포 내 거의 모든 엽록체들이 빠르게 분열하는 작은 집단이 아니라 분열한다.[175]엽록체에는 명확한 S 단계가 없다. 그들의 DNA 복제는 숙주 세포의 그것과 동기화되거나 제한되지 않는다.[176]우리가 엽록체 분할에 대해 알고 있는 많은 것들은 아라비도시스나 적색 알가 시안리디오시존 메롤레 같은 유기체들을 연구하는 데서 온다.[146]
분열 과정은 FtsZ1과 FtsZ2 단백질이 필라멘트로 조립될 때 시작되고, ARC6 단백질의 도움으로 엽록체 스트로마 내에서 Z-링이라는 구조를 형성한다.[146][177]Min 시스템은 Z-링의 배치를 관리하여 엽록체가 다소 균일하게 분해되도록 한다.MinD라는 단백질은 FtsZ가 필라멘트를 형성하는 것을 방지한다.또 다른 단백질 ARC3도 관여할 수 있지만 잘 이해되지는 않는다.이 단백질들은 엽록체의 극지방에서 활동하여 그곳에서 Z-링 형성을 막지만, 엽록체 중심 부근에서는 MinE가 억제하여 Z-링 형성을 가능하게 한다.[146]
다음으로 두 개의 플라스티드 분할 링, 즉 PD 링이 형성된다.내측 플라스티드 디바이드 링은 엽록체 내막의 내측에 위치하며, 먼저 형성된다.[146]바깥쪽 플라스티드 분리 링은 바깥쪽 엽록체 막을 감싸고 있다.가로 약 5나노미터의 필라멘트로 구성되어 있으며,[146] 6.4나노미터 간격으로 줄지어 배열되어 있으며, 수축하여 엽록체를 압착한다.이때 엽록체 수축이 시작된다.[177]
시아니디오시존메롤레와 같은 몇몇 종에서 엽록체는 엽록체의 중간 공간에 세 번째 플라스티드 분리 링을 가지고 있다.[146][177]
수축 단계 후반에 다이나민 단백질은 외부 플라스티드 분리 링 주위에 모여 엽록체를 짜는 힘을 제공한다.[177][146]그 사이 Z링과 내부 플라스티드 디바이드 링이 고장난다.[177]이 단계 동안, 스트로마에 떠다니는 많은 엽록체 DNA 플라스미드가 분할되어 두 개의 형성되는 딸 엽록체에게 분배된다.[178]
이후 다이너민은 바깥쪽 플라스티드 분할 링 아래로 이동하며 엽록체 외부 막과 직접 접촉하여 두 딸 엽록체에서 엽록체를 분리한다.[177][146]
바깥쪽 플라스티드 분할 링의 잔해가 두 딸 엽록체 사이에 떠 있고, 다이너마인 링 잔해가 딸 엽록체 중 한 마리에 붙어 있다.[177]
엽록체 분할에 관여하는 5, 6개의 고리 중 전체 수축과 분할 단계에는 바깥쪽 플라스티드 분할 링만 존재한다. Z 링이 먼저 형성되는 동안, 바깥쪽 플라스티드 분할 링이 형성될 때까지 수축이 시작되지 않는다.[177]
규정
엽록체 1개가 포함된 조류 종의 경우, 엽록체 분리의 규제는 각 딸 세포가 엽록체-염색체를 처음부터 만들 수 없다는 것을 확실히 하기 위해 매우 중요하다.[79][146]세포가 여러 개의 엽록체를 포함하고 있는 식물과 같은 유기체에서, 조정은 더 느슨하고 덜 중요하다.엽록체와 세포분열이 어느 정도 일치할 가능성이 있지만, 그 메커니즘은 대부분 알려져 있지 않다.[146]
빛은 엽록체 분할의 필수 요건인 것으로 나타났다.엽록체들은 나쁜 품질의 녹색 불빛 아래서 수축 단계를 거치면서 자라고 진행될 수 있지만 분열을 완료하는 데는 더디다. 분열을 완료하려면 밝은 백색 빛에 노출되어야 한다.녹색 불빛 아래에서 자란 시금치 잎에는 많은 큰 아령 모양의 엽록체들이 들어 있는 것으로 관찰되었다.백색광에 노출되면 이러한 엽록체들을 자극하여 아령 모양의 엽록체 개체수를 분열시키고 감소시킬 수 있다.[175][178]
엽록체 상속
미토콘드리아처럼 엽록체도 보통 한 부모에게서 물려받는다.두 개의 모식물에서 모두 플라스티드 유전자가 유전되는 바이파렌탈 엽록체 유전자는 일부 꽃식물에서 매우 낮은 수준으로 나타난다.[179]
많은 메커니즘은 생식계나 지고테 내에서 엽록체나 그 유전자의 선택적 파괴를 포함하여 두피렌탈 엽록체 DNA 유산을 방지하고, 한 부모로부터 온 엽록체들이 배아에서 제외되는 것을 포함한다.부모의 엽록체들은 각 자손에게 한 가지 유형만 존재하도록 분류될 수 있다.[180]
소나무와 같은 체르노스페럼은 주로 엽록체를 교대로 전승하는 반면,[181] 꽃이 피는 식물은 종종 엽록체를 교대로 물려받은 엽록체는 주로 엽록체를 교대로 물려받는다.[182][183]한때 꽃이 피는 식물은 엽록체만 유전한다고 여겨졌다.그러나, 현재 혈관신경이 엽록체들을 혈통적으로 계승하는 많은 기록적인 사례들이 있다.[179]
엽록체를 모태로 전승하는 혈관신종은 부계 유산을 막는 여러 가지 방법이 있다.대부분 플라스티드가 전혀 들어 있지 않은 정자세포를 생산한다.배아 내의 엽록체 복제율이 다른 것과 같이 이러한 꽃식물에서 부계 유산을 막는 많은 다른 문서화된 메커니즘이 있다.[179]
혈관조영제 중 부성 엽록체 유산은 같은 종 부모에게서 물려받은 자손보다 하이브리드에서 더 자주 관찰된다.이것은 양립할 수 없는 잡종 유전자가 아버지의 유산을 막는 메커니즘을 방해할 수 있음을 시사한다.[179]
이식성 식물
최근 엽록체들이 유전자 조작 농작물 개발자들에게 주목을 받고 있다.대부분의 꽃식물에서 엽록체들은 수컷 부모로부터 물려받지 않기 때문에, 이러한 플라스티드의 유전자들은 꽃가루에 의해 전파될 수 없다.이것은 플라스티드 변환을 생물학적으로 함유된 유전자 변형 식물의 생성과 재배에 귀중한 도구로 만들어, 환경 위험을 현저히 낮춘다.따라서 이러한 생물학적 봉쇄 전략은 재래식 농업과 유기농 농업의 공존을 확립하는 데 적합하다.이 메커니즘의 신뢰성은 모든 관련 작물 종에 대해 아직 연구되지 않았지만, 담배 공장에서의 최근 결과는 유망하며, 이앙성 식물의 억제율이 100,000분의 3으로 실패했음을 보여준다.[183]
참조
- ^ Jones D (2003) [1917]. Roach P, Hartmann J, Setter J (eds.). English Pronouncing Dictionary. Cambridge: Cambridge University Press. ISBN 3-12-539683-2.
- ^ "Chloroplast". Merriam-Webster Dictionary.
- ^ Basic Biology (18 March 2016). "Bacteria".
- ^ "chloroplast". Online Etymology Dictionary.
- ^ 본 몰, H. (1835/1837).우에버는 테일룽에서 베르메룽 데르 프란젠 젤렌으로 죽는다.논문.1835년.플로라 1837, .
- ^ a b Schimper, AF (1883). "Über die Entwicklung der Chlorophyllkörner und Farbkörper" [About the development of the chlorophyll grains and stains]. Bot. Zeitung (in German). 41: 105–14, 121–31, 137–46, 153–62. Archived from the original on 19 October 2013.
- ^ Strasburger E (1884). Das botanische Praktikum (1st ed.). Jena: Gustav Fischer.
- ^ Gunning B, Koenig F, Govindjee P (2006). "A dedication to pioneers of research on chloroplast structure". In Wise RR, Hoober JK (eds.). The structure and function of plastids. Netherlands: Springer. pp. xxiii–xxxi. ISBN 9781402065705.
- ^ Hoober JK (1984). Chloroplasts. New York: Plenum. ISBN 9781461327677.
- ^ a b c d e f g h i j Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biology (8th ed.). Benjamin Cummings (Pearson). p. 516. ISBN 978-0-8053-6844-4.
- ^ Mereschkowsky C (1905). "Über Natur und Ursprung der Chromatophoren im Pflanzenreiche" [About the nature and origin of chromatophores in the vegetable kingdom]. Biol Centralbl (in German). 25: 593–604.
- ^ a b c d Alberts B (2002). Molecular biology of the cell (4. ed.). New York [u.a.]: Garland. ISBN 0-8153-4072-9.
- ^ Gabr A, Grossman AR, Bhattacharya D (August 2020). "Paulinella, a model for understanding plastid primary endosymbiosis". J Phycol. 56 (4): 837–843. doi:10.1111/jpy.13003. PMC 7734844. PMID 32289879.
- ^ a b Moore KR, Magnabosco C, Momper L, Gold DA, Bosak T, Fournier GP (2019). "An Expanded Ribosomal Phylogeny of Cyanobacteria Supports a Deep Placement of Plastids". Frontiers in Microbiology. 10: 1612. doi:10.3389/fmicb.2019.01612. PMC 6640209. PMID 31354692.
- ^ a b Kumar K, Mella-Herrera RA, Golden JW (April 2010). "Cyanobacterial heterocysts". Cold Spring Harbor Perspectives in Biology. 2 (4): a000315. doi:10.1101/cshperspect.a000315. PMC 2845205. PMID 20452939.
- ^ a b c d e Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biology (8th ed.). Benjamin Cummings (Pearson). pp. 186–187. ISBN 978-0-8053-6844-4.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw Kim E, Archibald JM (2009). "Diversity and Evolution of Plastids and Their Genomes". In Sandelius AS, Aronsson H (eds.). The Chloroplast. Plant Cell Monographs. Vol. 13. pp. 1–39. doi:10.1007/978-3-540-68696-5_1. ISBN 978-3-540-68692-7.
- ^ Bryant DA, Guglielmi G, de Marsac NT, Castets AM, Cohen-Bazire G (1979). "The structure of cyanobacterial phycobilisomes: A model". Archives of Microbiology. 123 (2): 311–34. doi:10.1007/BF00446810. S2CID 1589428.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af Keeling PJ (October 2004). "Diversity and evolutionary history of plastids and their hosts". American Journal of Botany. 91 (10): 1481–93. doi:10.3732/ajb.91.10.1481. PMID 21652304. S2CID 17522125.
- ^ a b c d McFadden GI, van Dooren GG (July 2004). "Evolution: red algal genome affirms a common origin of all plastids". Current Biology. 14 (13): R514-6. doi:10.1016/j.cub.2004.06.041. PMID 15242632. S2CID 18131616.
- ^ a b c d e Milo R, Phillips R. "Cell Biology by the Numbers: How large are chloroplasts?". book.bionumbers.org. Retrieved 7 February 2017.
- ^ a b c d Sánchez-Baracaldo P, Raven JA, Pisani D, Knoll AH (September 2017). "Early photosynthetic eukaryotes inhabited low-salinity habitats". Proceedings of the National Academy of Sciences of the United States of America. 114 (37): E7737–E7745. doi:10.1073/pnas.1620089114. PMC 5603991. PMID 28808007.
- ^ Fuks B, Homblé F (October 1996). "Mechanism of proton permeation through chloroplast lipid membranes". Plant Physiology. 112 (2): 759–66. doi:10.1104/pp.112.2.759. PMC 158000. PMID 8883387.
- ^ Joyard J, Block MA, Douce R (August 1991). "Molecular aspects of plastid envelope biochemistry". European Journal of Biochemistry. 199 (3): 489–509. doi:10.1111/j.1432-1033.1991.tb16148.x. PMID 1868841.
- ^ "Chloroplast". Encyclopedia of Science. Retrieved 27 December 2012.
- ^ a b c d e f Nakayama T, Archibald JM (April 2012). "Evolving a photosynthetic organelle". BMC Biology. 10 (1): 35. doi:10.1186/1741-7007-10-35. PMC 3337241. PMID 22531210.
- ^ a b c d e McFadden GI (January 2001). "Chloroplast origin and integration". Plant Physiology. 125 (1): 50–3. doi:10.1104/pp.125.1.50. PMC 1539323. PMID 11154294.
- ^ Archibald JM (January 2009). "The puzzle of plastid evolution". Current Biology. 19 (2): R81-8. doi:10.1016/j.cub.2008.11.067. PMID 19174147. S2CID 51989.
- ^ Ponce-Toledo RI, Deschamps P, López-García P, Zivanovic Y, Benzerara K, Moreira D (February 2017). "An Early-Branching Freshwater Cyanobacterium at the Origin of Plastids". Current Biology. 27 (3): 386–391. doi:10.1016/j.cub.2016.11.056. PMC 5650054. PMID 28132810.
- ^ de Vries J, Archibald JM (February 2017). "Endosymbiosis: Did Plastids Evolve from a Freshwater Cyanobacterium?". Current Biology. 27 (3): R103–R105. doi:10.1016/j.cub.2016.12.006. PMID 28171752.
- ^ a b López-García P, Eme L, Moreira D (December 2017). "Symbiosis in eukaryotic evolution". Journal of Theoretical Biology. 434: 20–33. Bibcode:2017JThBi.434...20L. doi:10.1016/j.jtbi.2017.02.031. PMC 5638015. PMID 28254477.
- ^ Delaye L, Valadez-Cano C, Pérez-Zamorano B (March 2016). "How Really Ancient Is Paulinella Chromatophora?". PLOS Currents. 8. doi:10.1371/currents.tol.e68a099364bb1a1e129a17b4e06b0c6b. PMC 4866557. PMID 28515968. Archived from the original on 27 March 2019. Retrieved 3 December 2016.
- ^ a b c d e f g h i j k l m n o p q r s t u v w Wise RR, Hoober JK (2006). The structure and function of plastids. Dordrecht: Springer. pp. 3–21. ISBN 978-1-4020-4061-0.
- ^ Ball S, Colleoni C, Cenci U, Raj JN, Tirtiaux C (March 2011). "The evolution of glycogen and starch metabolism in eukaryotes gives molecular clues to understand the establishment of plastid endosymbiosis". Journal of Experimental Botany. 62 (6): 1775–801. doi:10.1093/jxb/erq411. PMID 21220783.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af Keeling PJ (March 2010). "The endosymbiotic origin, diversification and fate of plastids". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 365 (1541): 729–48. doi:10.1098/rstb.2009.0103. PMC 2817223. PMID 20124341.
- ^ a b c d e f g Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biology (8th ed.). Benjamin Cummings (Pearson). pp. 582–92. ISBN 978-0-8053-6844-4.
- ^ "rhodo-". The Free Dictionary. Farlex. Retrieved 7 June 2013.
- ^ a b Lewis LA, McCourt RM (October 2004). "Green algae and the origin of land plants". American Journal of Botany. 91 (10): 1535–56. doi:10.3732/ajb.91.10.1535. PMID 21652308.
- ^ Machida M, Takechi K, Sato H, Chung SJ, Kuroiwa H, Takio S, et al. (April 2006). "Genes for the peptidoglycan synthesis pathway are essential for chloroplast division in moss". Proceedings of the National Academy of Sciences of the United States of America. 103 (17): 6753–8. Bibcode:2006PNAS..103.6753M. doi:10.1073/pnas.0510693103. PMC 1458953. PMID 16618924.
- ^ Moroney JV, Somanchi A (January 1999). "How Do algae concentrate CO2 to increase the efficiency of photosynthetic carbon fixation?". Plant Physiology. 119 (1): 9–16. doi:10.1104/pp.119.1.9. PMC 1539202. PMID 9880340.
- ^ Tartar A, Boucias DG (April 2004). "The non-photosynthetic, pathogenic green alga Helicosporidium sp. has retained a modified, functional plastid genome". FEMS Microbiology Letters. 233 (1): 153–7. doi:10.1016/j.femsle.2004.02.006. PMID 15043882.
- ^ a b c d Nowack EC, Vogel H, Groth M, Grossman AR, Melkonian M, Glöckner G (January 2011). "Endosymbiotic gene transfer and transcriptional regulation of transferred genes in Paulinella chromatophora". Molecular Biology and Evolution. 28 (1): 407–22. doi:10.1093/molbev/msq209. PMID 20702568.
- ^ a b c d Dann L (2002). Bioscience—Explained (PDF). Green DNA: BIOSCIENCE EXPLAINED.
- ^ a b c d e Clegg MT, Gaut BS, Learn GH, Morton BR (July 1994). "Rates and patterns of chloroplast DNA evolution". Proceedings of the National Academy of Sciences of the United States of America. 91 (15): 6795–801. Bibcode:1994PNAS...91.6795C. doi:10.1073/pnas.91.15.6795. PMC 44285. PMID 8041699.
- ^ a b c d e f Shaw J, Lickey EB, Schilling EE, Small RL (March 2007). "Comparison of whole chloroplast genome sequences to choose noncoding regions for phylogenetic studies in angiosperms: the tortoise and the hare III". American Journal of Botany. 94 (3): 275–88. doi:10.3732/ajb.94.3.275. PMID 21636401. S2CID 30501148.
- ^ a b Chaal BK, Green BR (February 2005). "Protein import pathways in 'complex' chloroplasts derived from secondary endosymbiosis involving a red algal ancestor". Plant Molecular Biology. 57 (3): 333–42. doi:10.1007/s11103-004-7848-y. PMID 15830125. S2CID 22619029.
- ^ a b Moustafa A, Beszteri B, Maier UG, Bowler C, Valentin K, Bhattacharya D (June 2009). "Genomic footprints of a cryptic plastid endosymbiosis in diatoms" (PDF). Science. 324 (5935): 1724–6. Bibcode:2009Sci...324.1724M. doi:10.1126/science.1172983. PMID 19556510. S2CID 11408339.
- ^ Rogers MB, Gilson PR, Su V, McFadden GI, Keeling PJ (January 2007). "The complete chloroplast genome of the chlorarachniophyte Bigelowiella natans: evidence for independent origins of chlorarachniophyte and euglenid secondary endosymbionts". Molecular Biology and Evolution. 24 (1): 54–62. doi:10.1093/molbev/msl129. PMID 16990439.
- ^ a b c d e f g h i j k l m n Hackett JD, Anderson DM, Erdner DL, Bhattacharya D (October 2004). "Dinoflagellates: a remarkable evolutionary experiment". American Journal of Botany. 91 (10): 1523–34. doi:10.3732/ajb.91.10.1523. PMID 21652307.
- ^ Toledo RI (5 March 2018). Origins and early evolution of photosynthetic eukaryotes (Thesis). Université Paris-Saclay.
- ^ Bodył A (February 2018). "Did some red alga-derived plastids evolve via kleptoplastidy? A hypothesis". Biological Reviews of the Cambridge Philosophical Society. 93 (1): 201–222. doi:10.1111/brv.12340. PMID 28544184. S2CID 24613863.
- ^ a b Janouškovec J, Gavelis GS, Burki F, Dinh D, Bachvaroff TR, Gornik SG, et al. (January 2017). "Major transitions in dinoflagellate evolution unveiled by phylotranscriptomics". Proceedings of the National Academy of Sciences of the United States of America. 114 (2): E171–E180. doi:10.1073/pnas.1614842114. PMC 5240707. PMID 28028238.
- ^ a b c d Nair SC, Striepen B (August 2011). "What do human parasites do with a chloroplast anyway?". PLOS Biology. 9 (8): e1001137. doi:10.1371/journal.pbio.1001137. PMC 3166169. PMID 21912515.
- ^ Quigg A, Kotabová E, Jarešová J, Kaňa R, Setlík J, Sedivá B, et al. (10 October 2012). "Photosynthesis in Chromera velia represents a simple system with high efficiency". PLOS ONE. 7 (10): e47036. Bibcode:2012PLoSO...747036Q. doi:10.1371/journal.pone.0047036. PMC 3468483. PMID 23071705.
- ^ Dorrell RG, Smith AG (July 2011). "Do red and green make brown?: perspectives on plastid acquisitions within chromalveolates". Eukaryotic Cell. 10 (7): 856–68. doi:10.1128/EC.00326-10. PMC 3147421. PMID 21622904.
- ^ Meeson BW, Chang SS, Sweeney BM (1982). "Characterization of Peridinin-Chlorophyll α-Proteins from the Marine Dinoflagellate Ceratium furca". Botanica Marina. 25 (8): 347–50. doi:10.1515/botm.1982.25.8.347. S2CID 83867103.
- ^ a b c Tengs T, Dahlberg OJ, Shalchian-Tabrizi K, Klaveness D, Rudi K, Delwiche CF, Jakobsen KS (May 2000). "Phylogenetic analyses indicate that the 19'Hexanoyloxy-fucoxanthin-containing dinoflagellates have tertiary plastids of haptophyte origin". Molecular Biology and Evolution. 17 (5): 718–29. doi:10.1093/oxfordjournals.molbev.a026350. PMID 10779532.
- ^ a b c Schnepf E, Elbrächter M (1999). "Dinophyte chloroplasts and phylogeny – A review". Grana. 38 (2–3): 81–97. doi:10.1080/00173139908559217.
- ^ Skovgaard A (1998). "Role of chloroplast retention in a marine dinoflagellate". Aquatic Microbial Ecology. 15: 293–301. doi:10.3354/ame015293.
- ^ Dorrell RG, Howe CJ (August 2015). "Integration of plastids with their hosts: Lessons learned from dinoflagellates". Proceedings of the National Academy of Sciences of the United States of America. 112 (33): 10247–54. Bibcode:2015PNAS..11210247D. doi:10.1073/pnas.1421380112. PMC 4547248. PMID 25995366.
- ^ Stocking, C. R. & Gifford, E. M. (1959). "Incorporation of thymidine into chloroplasts of Spirogyra". Biochemical and Biophysical Research Communications. 1 (3): 159–164. doi:10.1016/0006-291X(59)90010-5.
- ^ Ris, H. & Plaut, W. (1962). "Ultrastructure of DNA-containing areas in the chloroplast of Chlamydomonas". J. Cell Biol. 13 (3): 383–91. doi:10.1083/jcb.13.3.383. PMC 2106071. PMID 14492436.
- ^ Lyttleton, J. W. (1962). "Isolation of ribosomes from spinach chloroplasts". Exp. Cell Res. 26 (1): 312–317. doi:10.1016/0014-4827(62)90183-0. PMID 14467684.
- ^ Heber, U. (1962). "Protein synthesis in chloroplasts during photosynthesis". Nature. 195 (1): 91–92. Bibcode:1962Natur.195...91H. doi:10.1038/195091a0. PMID 13905812. S2CID 4265095.
- ^ "Chloroplasts and Other Plastids". University of Hamburg. Archived from the original on 25 September 2012. Retrieved 27 December 2012.
- ^ a b c d e f g Sandelius AS (2009). The Chloroplast: Interactions with the Environment. Springer. p. 18. ISBN 978-3-540-68696-5.
- ^ a b Burgess J (1989). An introduction to plant cell development. Cambridge: Cambridge university press. p. 62. ISBN 0-521-31611-1.
- ^ a b c d e f g Bendich AJ (July 2004). "Circular chloroplast chromosomes: the grand illusion". The Plant Cell. 16 (7): 1661–6. doi:10.1105/tpc.160771. PMC 514151. PMID 15235123.
- ^ a b c Kolodner R, Tewari KK (January 1979). "Inverted repeats in chloroplast DNA from higher plants". Proceedings of the National Academy of Sciences of the United States of America. 76 (1): 41–5. Bibcode:1979PNAS...76...41K. doi:10.1073/pnas.76.1.41. PMC 382872. PMID 16592612.
- ^ a b Palmer JD, Thompson WF (June 1982). "Chloroplast DNA rearrangements are more frequent when a large inverted repeat sequence is lost". Cell. 29 (2): 537–50. doi:10.1016/0092-8674(82)90170-2. PMID 6288261. S2CID 11571695.
- ^ Plant Biochemistry (3rd ed.). Academic Press. 2005. p. 517. ISBN 978-0-12-088391-2.
number of copies of ctDNA per chloroplast.
- ^ a b Kobayashi T, Takahara M, Miyagishima SY, Kuroiwa H, Sasaki N, Ohta N, et al. (July 2002). "Detection and localization of a chloroplast-encoded HU-like protein that organizes chloroplast nucleoids". The Plant Cell. 14 (7): 1579–89. doi:10.1105/tpc.002717. PMC 150708. PMID 12119376.
- ^ Odahara M, Kishita Y, Sekine Y (August 2017). "MSH1 maintains organelle genome stability and genetically interacts with RECA and RECG in the moss Physcomitrella patens". The Plant Journal. 91 (3): 455–465. doi:10.1111/tpj.13573. PMID 28407383.
- ^ Rowan BA, Oldenburg DJ, Bendich AJ (June 2010). "RecA maintains the integrity of chloroplast DNA molecules in Arabidopsis". Journal of Experimental Botany. 61 (10): 2575–88. doi:10.1093/jxb/erq088. PMC 2882256. PMID 20406785.
- ^ a b c d e f Krishnan NM, Rao BJ (May 2009). "A comparative approach to elucidate chloroplast genome replication". BMC Genomics. 10 (237): 237. doi:10.1186/1471-2164-10-237. PMC 2695485. PMID 19457260.
- ^ Heinhorst S, Cannon GC (1993). "DNA replication in chloroplasts". Journal of Cell Science. 104: 1–9. doi:10.1242/jcs.104.1.1.
- ^ "Effect of chemical mutagens on nucleotide sequence". Biocyclopedia. Retrieved 24 October 2015.
- ^ Bernstein H, Bernstein C (July 1973). "Circular and branched circular concatenates as possible intermediates in bacteriophage T4 DNA replication". Journal of Molecular Biology. 77 (3): 355–61. doi:10.1016/0022-2836(73)90443-9. PMID 4580243.
- ^ a b Alberts B (2002). Molecular biology of the cell (4. ed.). New York [u.a.]: Garland. ISBN 0-8153-4072-9.
- ^ Huang CY, Ayliffe MA, Timmis JN (March 2003). "Direct measurement of the transfer rate of chloroplast DNA into the nucleus". Nature. 422 (6927): 72–6. Bibcode:2003Natur.422...72H. doi:10.1038/nature01435. PMID 12594458. S2CID 4319507.
- ^ a b c Martin W, Rujan T, Richly E, Hansen A, Cornelsen S, Lins T, et al. (September 2002). "Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus". Proceedings of the National Academy of Sciences of the United States of America. 99 (19): 12246–51. Bibcode:2002PNAS...9912246M. doi:10.1073/pnas.182432999. PMC 129430. PMID 12218172.
- ^ Smith DR, Lee RW (April 2014). "A plastid without a genome: evidence from the nonphotosynthetic green algal genus Polytomella". Plant Physiology. 164 (4): 1812–9. doi:10.1104/pp.113.233718. PMC 3982744. PMID 24563281.
- ^ Archibald JM (December 2006). "Algal genomics: exploring the imprint of endosymbiosis". Current Biology. 16 (24): R1033-5. doi:10.1016/j.cub.2006.11.008. PMID 17174910.
- ^ Koussevitzky S, Nott A, Mockler TC, Hong F, Sachetto-Martins G, Surpin M, et al. (May 2007). "Signals from chloroplasts converge to regulate nuclear gene expression". Science. 316 (5825): 715–9. Bibcode:2007Sci...316..715K. doi:10.1126/science.1140516. PMID 17395793. S2CID 245901639.
- Bob Grant (1 April 2009). "Communicating with chloroplasts". The Scientist.
- ^ Hedtke B, Börner T, Weihe A (August 1997). "Mitochondrial and chloroplast phage-type RNA polymerases in Arabidopsis". Science. 277 (5327): 809–11. doi:10.1126/science.277.5327.809. PMID 9242608.
- ^ Harris EH, Boynton JE, Gillham NW (December 1994). "Chloroplast ribosomes and protein synthesis". Microbiological Reviews. 58 (4): 700–54. doi:10.1128/MMBR.58.4.700-754.1994. PMC 372988. PMID 7854253.
- ^ a b c d e f g h i j Soll J, Schleiff E (March 2004). "Protein import into chloroplasts". Nature Reviews Molecular Cell Biology. 5 (3): 198–208. doi:10.1038/nrm1333. PMID 14991000. S2CID 32453554.
- ^ Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biology (8th ed.). Benjamin Cummings (Pearson). p. 340. ISBN 978-0-8053-6844-4.
- ^ Lung SC, Chuong SD (April 2012). "A transit peptide-like sorting signal at the C terminus directs the Bienertia sinuspersici preprotein receptor Toc159 to the chloroplast outer membrane". The Plant Cell. 24 (4): 1560–78. doi:10.1105/tpc.112.096248. PMC 3398564. PMID 22517318.
- ^ Waegemann K, Soll J (March 1996). "Phosphorylation of the transit sequence of chloroplast precursor proteins". The Journal of Biological Chemistry. 271 (11): 6545–54. doi:10.1074/jbc.271.11.6545. PMID 8626459.
- ^ a b May T, Soll J (January 2000). "14-3-3 proteins form a guidance complex with chloroplast precursor proteins in plants". The Plant Cell. 12 (1): 53–64. doi:10.1105/tpc.12.1.53. PMC 140214. PMID 10634907.
- ^ Jarvis P, Soll J (December 2001). "Toc, Tic, and chloroplast protein import". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1541 (1–2): 64–79. doi:10.1016/S0167-4889(01)00147-1. PMID 11750663.
- ^ Wise RR, Hoober JK (2007). The Structure and Function of Plastids. Springer. pp. 32–33. ISBN 978-1-4020-6570-5.
- ^ "Oedogonium Link ex Hirn, 1900: 17". algaeBASE. Retrieved 19 May 2013.
- ^ "Chlamydomonas Ehrenberg, 1833: 288". algaeBASE. Retrieved 19 May 2013.
- ^ "Spirogyra Link, 1820: 5". algaeBASE. Retrieved 19 May 2013.
- ^ "Sirogonium Kützing, 1843: 278". algaeBASE. Retrieved 19 May 2013.
- ^ "Zygnema C.Agardh, 1817: xxxii, 98". algaeBASE. Retrieved 19 May 2013.
- ^ "Micrasterias C.Agardh ex Ralfs, 1848: 68". algaeBASE. Retrieved 19 May 2013.
- ^ John DM, Brook AJ, Whitton BA (2002). The freshwater algal flora of the British Isles: an identification guide to freshwater and terrestrial algae. Cambridge: Cambridge University Press. p. 335. ISBN 978-0-521-77051-4.
- ^ a b c d e f g Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biology (8th ed.). Benjamin Cummings (Pearson). pp. 196–197. ISBN 978-0-8053-6844-4.
- ^ Koike H, Yoshio M, Kashino Y, Satoh K (May 1998). "Polypeptide composition of envelopes of spinach chloroplasts: two major proteins occupy 90% of outer envelope membranes". Plant & Cell Physiology. 39 (5): 526–32. doi:10.1093/oxfordjournals.pcp.a029400. PMID 9664716.
- ^ Köhler RH, Hanson MR (January 2000). "Plastid tubules of higher plants are tissue-specific and developmentally regulated". Journal of Cell Science. 113 (Pt 1): 81–9. doi:10.1242/jcs.113.1.81. PMID 10591627. Archived from the original on 20 September 2016.
- ^ Gray JC, Sullivan JA, Hibberd JM, Hansen MR (2001). "Stromules: mobile protrusions and interconnections between plastids". Plant Biology. 3 (3): 223–33. doi:10.1055/s-2001-15204.
- ^ Schattat M, Barton K, Baudisch B, Klösgen RB, Mathur J (April 2011). "Plastid stromule branching coincides with contiguous endoplasmic reticulum dynamics". Plant Physiology. 155 (4): 1667–77. doi:10.1104/pp.110.170480. PMC 3091094. PMID 21273446.
- ^ Schattat MH, Griffiths S, Mathur N, Barton K, Wozny MR, Dunn N, et al. (April 2012). "Differential coloring reveals that plastids do not form networks for exchanging macromolecules". The Plant Cell. 24 (4): 1465–77. doi:10.1105/tpc.111.095398. PMC 3398557. PMID 22474180.
- ^ Brunkard JO, Runkel AM, Zambryski PC (August 2015). "Chloroplasts extend stromules independently and in response to internal redox signals". Proceedings of the National Academy of Sciences of the United States of America. 112 (32): 10044–9. Bibcode:2015PNAS..11210044B. doi:10.1073/pnas.1511570112. PMC 4538653. PMID 26150490.
- ^ a b c d e f g h i j Burgess J (1989). An introduction to plant cell development (Pbk. ed.). Cambridge: Cambridge university press. p. 46. ISBN 0-521-31611-1.
- ^ a b Whatley JM (5 July 1994). "The occurrence of a peripheral reticulum in plastids of the gymnosperm Welwitschia mirabilis". New Phytologist. 74 (2): 215–220. doi:10.1111/j.1469-8137.1975.tb02608.x.
- ^ a b c Wise RR (2007). The Structure and Function of Plastids. Springer. pp. 17–18. ISBN 978-1-4020-6570-5.
- ^ Manuell AL, Quispe J, Mayfield SP (August 2007). "Structure of the chloroplast ribosome: novel domains for translation regulation". PLOS Biology. 5 (8): e209. doi:10.1371/journal.pbio.0050209. PMC 1939882. PMID 17683199.
- ^ a b Bieri, P; Leibundgut, M; Saurer, M; Boehringer, D; Ban, N (15 February 2017). "The complete structure of the chloroplast 70S ribosome in complex with translation factor pY". The EMBO Journal. 36 (4): 475–486. doi:10.15252/embj.201695959. PMC 5694952. PMID 28007896.
- ^ a b Lim K, Kobayashi I, Nakai K (July 2014). "Alterations in rRNA-mRNA interaction during plastid evolution". Molecular Biology and Evolution. 31 (7): 1728–40. doi:10.1093/molbev/msu120. PMID 24710516.
- ^ Hirose T, Sugiura M (January 2004). "Functional Shine-Dalgarno-like sequences for translational initiation of chloroplast mRNAs". Plant & Cell Physiology. 45 (1): 114–7. doi:10.1093/pcp/pch002. PMID 14749493. S2CID 10774032.
- ^ Ma J, Campbell A, Karlin S (October 2002). "Correlations between Shine-Dalgarno sequences and gene features such as predicted expression levels and operon structures". Journal of Bacteriology. 184 (20): 5733–45. doi:10.1128/JB.184.20.5733-5745.2002. PMC 139613. PMID 12270832.
- ^ Lim K, Furuta Y, Kobayashi I (October 2012). "Large variations in bacterial ribosomal RNA genes". Molecular Biology and Evolution. 29 (10): 2937–48. doi:10.1093/molbev/mss101. PMC 3457768. PMID 22446745.
- ^ a b c d e f g h i j Austin JR, Frost E, Vidi PA, Kessler F, Staehelin LA (July 2006). "Plastoglobules are lipoprotein subcompartments of the chloroplast that are permanently coupled to thylakoid membranes and contain biosynthetic enzymes". The Plant Cell. 18 (7): 1693–703. doi:10.1105/tpc.105.039859. PMC 1488921. PMID 16731586.
- ^ a b Crumpton-Taylor M, Grandison S, Png KM, Bushby AJ, Smith AM (February 2012). "Control of starch granule numbers in Arabidopsis chloroplasts". Plant Physiology. 158 (2): 905–16. doi:10.1104/pp.111.186957. PMC 3271777. PMID 22135430.
- ^ Zeeman SC, Delatte T, Messerli G, Umhang M, Stettler M, Mettler T, Streb S, Reinhold H, Kötting O (2007). "Starch breakdown: Recent discoveries suggest distinct pathways and novel mechanisms". Functional Plant Biology. 34 (6): 465–73. doi:10.1071/FP06313. PMID 32689375. S2CID 15995416.
- ^ Rochaix JD (1998). The molecular biology of chloroplasts and mitochondria in Chlamydomonas. Dordrecht [u.a.]: Kluwer Acad. Publ. pp. 550–565. ISBN 978-0-7923-5174-0.
- ^ a b c d e f Gunning BE, Steer MW (1996). Plant cell biology: structure and function. Boston, Mass.: Jones and Bartlett Publishers. p. 24. ISBN 0-86720-504-0.
- ^ Hanson D, Andrews TJ, Badger MR (2002). "Variability of the pyrenoid-based CO2 concentrating mechanism in hornworts (Anthocerotophyta)". Functional Plant Biology. 29 (3): 407–16. doi:10.1071/PP01210. PMID 32689485.
- ^ a b Ma Y, Pollock SV, Xiao Y, Cunnusamy K, Moroney JV (June 2011). "Identification of a novel gene, CIA6, required for normal pyrenoid formation in Chlamydomonas reinhardtii". Plant Physiology. 156 (2): 884–96. doi:10.1104/pp.111.173922. PMC 3177283. PMID 21527423.
- ^ a b Retallack B, Butler RD (January 1970). "The development and structure of pyrenoids in Bulbochaete hiloensis". Journal of Cell Science. 6 (1): 229–41. doi:10.1242/jcs.6.1.229. PMID 5417694.
- ^ Brown MR, Arnott HJ (1970). "Structure and Function of the Algal Pyrenoid" (PDF). Journal of Phycology. 6: 14–22. doi:10.1111/j.1529-8817.1970.tb02350.x. S2CID 85604422. Archived from the original (PDF) on 31 May 2013. Retrieved 31 December 2012.
- ^ a b c d e f g Bussi Y; Shimoni E; Weiner A; Kapon R; Charuvi D; Nevo R; Efrati E; Reich Z (2019). "Fundamental helical geometry consolidates the plant photosynthetic membrane". Proc Natl Acad Sci USA. 116 (44): 22366–22375. doi:10.1073/pnas.1905994116. PMC 6825288. PMID 31611387.
- ^ Infanger S, Bischof S, Hiltbrunner A, Agne B, Baginsky S, Kessler F (March 2011). "The chloroplast import receptor Toc90 partially restores the accumulation of Toc159 client proteins in the Arabidopsis thaliana ppi2 mutant" (PDF). Molecular Plant. 4 (2): 252–63. doi:10.1093/mp/ssq071. PMID 21220583.
- ^ "thylakoid". Merriam-Webster Dictionary. Merriam-Webster. Retrieved 19 May 2013.
- ^ a b c d e f g h Mustárdy L, Buttle K, Steinbach G, Garab G (October 2008). "The three-dimensional network of the thylakoid membranes in plants: quasihelical model of the granum-stroma assembly". The Plant Cell. 20 (10): 2552–7. doi:10.1105/tpc.108.059147. PMC 2590735. PMID 18952780.
- ^ Paolillo Jr, DJ (1970). "The three-dimensional arrangement of intergranal lamellae in chloroplasts". J Cell Sci. 6 (1): 243–55. doi:10.1242/jcs.6.1.243. PMID 5417695.
- ^ Shimoni E; Rav-Hon O; Ohad I; Brumfeld V; Reich Z (2005). "Three-dimensional organization of higher-plant chloroplast thylakoid membranes revealed by electron tomography". Plant Cell. 17 (9): 2580–6. doi:10.1105/tpc.105.035030. PMC 1197436. PMID 16055630.
- ^ a b Austin JR, Staehelin LA (April 2011). "Three-dimensional architecture of grana and stroma thylakoids of higher plants as determined by electron tomography". Plant Physiology. 155 (4): 1601–11. doi:10.1104/pp.110.170647. PMC 3091084. PMID 21224341.
- ^ "Chloroplast in a plant cell". TUMEGGY / SCIENCE PHOTO LIBRARY. Retrieved 19 August 2020.
- ^ a b c Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biology (8th ed.). Benjamin Cummings (Pearson). pp. 190–193. ISBN 978-0-8053-6844-4.
- ^ "Australian scientists discover first new chlorophyll in 60 years". University of Sydney. 20 August 2010.
- ^ a b c Takaichi S (15 June 2011). "Carotenoids in algae: distributions, biosyntheses and functions". Marine Drugs. 9 (6): 1101–18. doi:10.3390/md9061101. PMC 3131562. PMID 21747749.
- ^ Shapley D (15 October 2012). "Why Do Leaves Change Color in Fall?". News Articles. Retrieved 21 May 2013.
- ^ a b Howe CJ, Barbrook AC, Nisbet RE, Lockhart PJ, Larkum AW (August 2008). "The origin of plastids". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 363 (1504): 2675–85. doi:10.1098/rstb.2008.0050. PMC 2606771. PMID 18468982.
- ^ "Introduction to the Rhodophyta". University of California Museum of Paleontology. Retrieved 20 May 2013.
- ^ a b c d e f g Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biology (8th ed.). Benjamin Cummings (Pearson). pp. 200–201. ISBN 978-0-8053-6844-4.
- ^ Lawton JR (March 1988). "Ultrastructure of Chloroplast Membranes in Leaves of Maize and Ryegrass as Revealed by Selective Staining Methods". New Phytologist. 108 (3): 277–283. doi:10.1111/j.1469-8137.1988.tb04163.x. JSTOR 2433294. PMID 33873933.
- ^ Roberts K (2007). Handbook of plant science. Chichester, West Sussex, England: Wiley. p. 16. ISBN 978-0-470-05723-0.
- ^ Campbell NA, Reece JB, Urry LA, Cain ML, Wasserman, Minorsky PV, Jackson RB (2009). Biology (8th ed.). Benjamin Cummings (Pearson). p. 742. ISBN 978-0-8053-6844-4.
- ^ a b 로슨 T.와 J. I. L. 모리슨.에세이 10.1 보호 세포 광합성식물 생리 및 개발, 제6판 [1]
- ^ a b Wells, C.; Balish, E. (1979). "The mitogenic activity of lipopolysaccharide for spleen cells from germfree, conventional, and gnotobiotic rats". Canadian Journal of Microbiology. 25 (9): 1087–93. doi:10.1139/m79-166. PMID 540263.
- ^ a b c d e f g h i j k l Glynn JM, Miyagishima SY, Yoder DW, Osteryoung KW, Vitha S (May 2007). "Chloroplast division". Traffic. 8 (5): 451–61. doi:10.1111/j.1600-0854.2007.00545.x. PMID 17451550. S2CID 2808844.
- ^ a b Dong XJ, Nagai R, Takagi S (1998). "Microfilaments Anchor Chloroplasts along the Outer Periclinal Wall in Vallisneria Epidermal Cells through Cooperation of PFR and Photosynthesis". Plant and Cell Physiology. 39 (12): 1299–306. doi:10.1093/oxfordjournals.pcp.a029334.
- ^ a b c Takagi S (June 2003). "Actin-based photo-orientation movement of chloroplasts in plant cells". The Journal of Experimental Biology. 206 (Pt 12): 1963–9. doi:10.1242/jeb.00215. PMID 12756277.
- ^ Zeiger E, Talbott LD, Frechilla S, Srivastava A, Zhu J (2002). "The guard cell chloroplast: A perspective for the twenty-first century". New Phytologist. 153 (3): 415–424. doi:10.1046/j.0028-646X.2001.NPH328.doc.x. PMID 33863211.
- ^ a b c d e f g Padmanabhan MS, Dinesh-Kumar SP (November 2010). "All hands on deck—the role of chloroplasts, endoplasmic reticulum, and the nucleus in driving plant innate immunity". Molecular Plant-Microbe Interactions. 23 (11): 1368–80. doi:10.1094/MPMI-05-10-0113. PMID 20923348.
- ^ Katsir L, Chung HS, Koo AJ, Howe GA (August 2008). "Jasmonate signaling: a conserved mechanism of hormone sensing". Current Opinion in Plant Biology. 11 (4): 428–35. doi:10.1016/j.pbi.2008.05.004. PMC 2560989. PMID 18583180.
- ^ Schnurr JA, Shockey JM, de Boer GJ, Browse JA (August 2002). "Fatty acid export from the chloroplast. Molecular characterization of a major plastidial acyl-coenzyme A synthetase from Arabidopsis". Plant Physiology. 129 (4): 1700–9. doi:10.1104/pp.003251. PMC 166758. PMID 12177483.
- ^ a b c d Biology—Concepts and Connections. Pearson. 2009. pp. 108–118.
- ^ Campbell NA, Williamson B, Heyden RJ (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7.[페이지 필요]
- ^ Jagendorf AT, Uribe E (January 1966). "ATP formation caused by acid-base transition of spinach chloroplasts". Proceedings of the National Academy of Sciences of the United States of America. 55 (1): 170–7. Bibcode:1966PNAS...55..170J. doi:10.1073/pnas.55.1.170. PMC 285771. PMID 5220864.
- ^ a b Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5. ed., 4. print. ed.). New York, NY [u.a.]: W. H. Freeman. pp. Section 19.4. ISBN 0-7167-3051-0.
- ^ a b Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5. ed., 4. print. ed.). New York, NY [u.a.]: W. H. Freeman. pp. Section 20.1. ISBN 0-7167-3051-0.
- ^ a b c Wample RL, Davis RW (September 1983). "Effect of Flooding on Starch Accumulation in Chloroplasts of Sunflower (Helianthus annuus L.)". Plant Physiology. 73 (1): 195–8. doi:10.1104/pp.73.1.195. PMC 1066435. PMID 16663176.
- ^ Carmi A, Shomer I (1979). "Starch Accumulation and Photosynthetic Activity in Primary Leaves of Bean (Phaseolus vulgaris L.)". Annals of Botany. 44 (4): 479–484. doi:10.1093/oxfordjournals.aob.a085756.
- ^ Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5th ed.). W H Freeman. pp. Section 19.4. Retrieved 30 October 2012.
- ^ a b c Hauser M, Eichelmann H, Oja V, Heber U, Laisk A (July 1995). "Stimulation by Light of Rapid pH Regulation in the Chloroplast Stroma in Vivo as Indicated by CO2 Solubilization in Leaves". Plant Physiology. 108 (3): 1059–1066. doi:10.1104/pp.108.3.1059. PMC 157457. PMID 12228527.
- ^ a b Werdan K, Heldt HW, Milovancev M (August 1975). "The role of pH in the regulation of carbon fixation in the chloroplast stroma. Studies on CO2 fixation in the light and dark". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 396 (2): 276–92. doi:10.1016/0005-2728(75)90041-9. PMID 239746.
- ^ a b c d e f g Burgess J (1989). An introduction to plant cell development. Cambridge: Cambridge university press. p. 56. ISBN 0-521-31611-1.
- ^ Ferro M, Salvi D, Riviere-Rolland H, Vermat T, Seigneurin-Berny D, Grunwald D, et al. (August 2002). "Integral membrane proteins of the chloroplast envelope: identification and subcellular localization of new transporters". Proceedings of the National Academy of Sciences of the United States of America. 99 (17): 11487–92. Bibcode:2002PNAS...9911487F. doi:10.1073/pnas.172390399. PMC 123283. PMID 12177442.
- ^ a b Rolland N, Droux M, Douce R (March 1992). "Subcellular Distribution of O-Acetylserine(thiol)lyase in Cauliflower (Brassica oleracea L.) Inflorescence". Plant Physiology. 98 (3): 927–35. doi:10.1104/pp.98.3.927. PMC 1080289. PMID 16668766.
- ^ Ravanel S, Gakière B, Job D, Douce R (June 1998). "The specific features of methionine biosynthesis and metabolism in plants". Proceedings of the National Academy of Sciences of the United States of America. 95 (13): 7805–12. Bibcode:1998PNAS...95.7805R. doi:10.1073/pnas.95.13.7805. PMC 22764. PMID 9636232.
- ^ a b c d e Buchanan BB, Gruissem W, Jones RL (Eds.) 2015.식물의 생화학 및 분자생물학.와일리 블랙웰이야
- ^ Joyard J, Ferro M, Masselon C, Seigneurin-Berny D, Salvi D, Garin J, Rolland N (April 2010). "Chloroplast proteomics highlights the subcellular compartmentation of lipid metabolism". Progress in Lipid Research. 49 (2): 128–58. doi:10.1016/j.plipres.2009.10.003. PMID 19879895.
- ^ Proudlove MO, Thurman DA (1981). "The uptake of 2‐oxoglutarate and pyruvate by isolated pea chloroplasts". New Phytologist. 88 (2): 255–264. doi:10.1111/j.1469-8137.1981.tb01722.x.
- ^ Bao X, Focke M, Polard M, Ohlrogge J. 2000.잎 조직에서 지방산 합성을 위한 생체내 탄소 전구 공급 이해.플랜트 저널 22, 39-50.
- ^ Ohlrogge J, Browse J (1995). "Lipid Biosynthesis". The Plant Cell. 7 (7): 957–970. doi:10.1105/tpc.7.7.957. PMC 160893. PMID 7640528.
- ^ Gunning BE, Steer MW (1996). Plant cell biology: structure and function. Boston, Mass.: Jones and Bartlett Publishers. p. 20. ISBN 0-86720-504-0.
- ^ a b c d e Burgess J (1989). An introduction to plant cell development (Pbk. ed.). Cambridge: Cambridge university press. pp. 54–55. ISBN 0-521-31611-1.
- ^ Burgess J (1989). An introduction to plant cell development (Pbk. ed.). Cambridge: Cambridge university press. p. 57. ISBN 0-521-31611-1.
- ^ a b Possingham JV, Rose RJ (1976). "Chloroplast Replication and Chloroplast DNA Synthesis in Spinach Leaves". Proceedings of the Royal Society B: Biological Sciences. 193 (1112): 295–305. Bibcode:1976RSPSB.193..295P. doi:10.1098/rspb.1976.0047. S2CID 2691108.
- ^ Cannon GC, Heinhorst S (1 January 1993). "DNA replication in chloroplasts". Journal of Cell Science. 104 (1): 1–9. CiteSeerX 10.1.1.1026.3732. doi:10.1242/jcs.104.1.1.
- ^ a b c d e f g h i Miyagishima SY, Nishida K, Mori T, Matsuzaki M, Higashiyama T, Kuroiwa H, Kuroiwa T (March 2003). "A plant-specific dynamin-related protein forms a ring at the chloroplast division site". The Plant Cell. 15 (3): 655–65. doi:10.1105/tpc.009373. PMC 150020. PMID 12615939.
- ^ a b Hashimoto H, Possingham JV (April 1989). "Effect of light on the chloroplast division cycle and DNA synthesis in cultured leaf discs of spinach". Plant Physiology. 89 (4): 1178–83. doi:10.1104/pp.89.4.1178. PMC 1055993. PMID 16666681.
- ^ a b c d Hansen AK, Escobar LK, Gilbert LE, Jansen RK (January 2007). "Paternal, maternal, and biparental inheritance of the chloroplast genome in Passiflora (Passifloraceae): implications for phylogenetic studies" (PDF). American Journal of Botany. 94 (1): 42–6. doi:10.3732/ajb.94.1.42. PMID 21642206.
- ^ Birky CW (December 1995). "Uniparental inheritance of mitochondrial and chloroplast genes: mechanisms and evolution". Proceedings of the National Academy of Sciences of the United States of America. 92 (25): 11331–8. Bibcode:1995PNAS...9211331B. doi:10.1073/pnas.92.25.11331. PMC 40394. PMID 8524780.
- ^ Powell W, Morgante M, McDevitt R, Vendramin GG, Rafalski JA (August 1995). "Polymorphic simple sequence repeat regions in chloroplast genomes: applications to the population genetics of pines". Proceedings of the National Academy of Sciences of the United States of America. 92 (17): 7759–63. Bibcode:1995PNAS...92.7759P. doi:10.1073/pnas.92.17.7759. PMC 41225. PMID 7644491.
In the pines, the chloroplast genome is transmitted through pollen
- ^ Stegemann S, Hartmann S, Ruf S, Bock R (July 2003). "High-frequency gene transfer from the chloroplast genome to the nucleus". Proceedings of the National Academy of Sciences of the United States of America. 100 (15): 8828–33. Bibcode:2003PNAS..100.8828S. doi:10.1073/pnas.1430924100. PMC 166398. PMID 12817081.
- ^ a b Ruf S, Karcher D, Bock R (April 2007). "Determining the transgene containment level provided by chloroplast transformation". Proceedings of the National Academy of Sciences of the United States of America. 104 (17): 6998–7002. Bibcode:2007PNAS..104.6998R. doi:10.1073/pnas.0700008104. PMC 1849964. PMID 17420459.
외부 링크
| 위키미디어 커먼즈에는 엽록체와 관련된 미디어가 있다. |
- 엽록체 – 셀 중심 데이터베이스
- Clegg MT, Gaut BS, Learn GH, Morton BR (July 1994). "Rates and patterns of chloroplast DNA evolution". Proceedings of the National Academy of Sciences of the United States of America. 91 (15): 6795–801. Bibcode:1994PNAS...91.6795C. doi:10.1073/pnas.91.15.6795. PMC 44285. PMID 8041699.
- 엽록체 변환에 대한 공동 엑스트라 연구
- NCBI 완전 엽록체 게놈


![Primary endosymbiosis A eukaryote with mitochondria engulfed a cyanobacterium in an event of serial primary endosymbiosis, creating a lineage of cells with both organelles.[10] It is important to note that the cyanobacterial endosymbiont already had a double membrane—the phagosomal vacuole-derived membrane was lost.[19]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b8/Chloroplast_endosymbiosis_simple.svg/440px-Chloroplast_endosymbiosis_simple.svg.png)









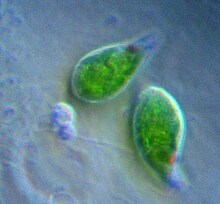






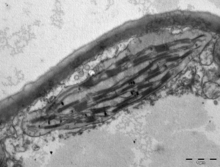





![Delesseria sanguinea, a red alga, has chloroplasts that contain red pigments like phycoerytherin that mask their blue-green chlorophyll a.[36]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/19/Delesseria_sanguinea_Helgoland.JPG/250px-Delesseria_sanguinea_Helgoland.JPG)
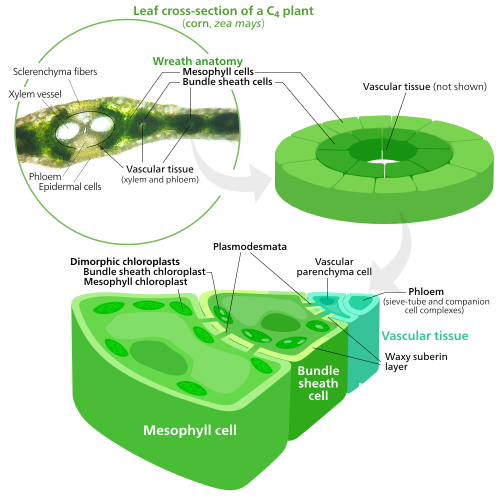
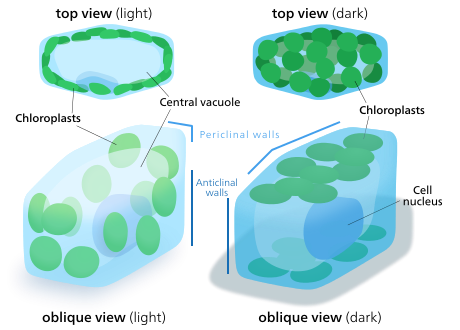



![Most chloroplasts in plant cells, and all chloroplasts in algae arise from chloroplast division.[173] Picture references,[146][177]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Chloroplast_division.svg/800px-Chloroplast_division.svg.png)




