스타부딘
Stavudine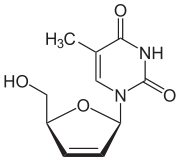 | |
 | |
| 임상자료 | |
|---|---|
| 상명 | 제릿 |
| 기타 이름 | 2′,3′-다이데하이드로-2′,3′-다이데옥시미딘 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a694033 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | 입으로 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | >80% |
| 단백질 결합 | 무시할 수 있는 |
| 신진대사 | 신장제거(~40%) |
| 제거 반감기 | 0.8–1.5시간(성인) |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 켐벨 | |
| NIAID 화학DB | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.169.180 |
| 화학 및 물리적 데이터 | |
| 공식 | C10H12N2O4 |
| 어금질량 | 224.216 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
| (iii) | |
스테부딘(d4T)은 제릿이라는 상표명으로 판매되는 항레트로바이러스제로 에이즈 예방과 치료에 쓰인다.[3] 일반적으로 다른 항레트로비럴과 함께 사용할 것을 권장한다.[3] 이것은 바늘에 찔리는 부상이나 기타 잠재적 노출 후 예방에 사용될 수 있다.[3] 그러나 일차적인 치료는 아니다.[3] 그것은 입으로 주는 것이다.[3]
일반적인 부작용으로는 두통, 설사, 구토, 발진, 말초신경장애 등이 있다.[3] 심한 부작용으로는 고혈압, 췌장염, 간 확대 등이 있다.[3] 임신 중에는 일반적으로 권장하지 않는다.[3] 스타부딘은 뉴클레오사이드 아날로그 역투명효소 억제제(NRTI) 등급의 약물이다.[3]
Stavudine은 1966년에 처음 설명되었고 1994년 미국에서 사용 승인을 받았다.[4] 그것은 일반적인 약으로 이용할 수 있다.[3]
의학적 용법
Stavudine은 HIV-1 감염 치료에 사용되지만 치료법은 아니다. 일반적으로 초기 치료로는 권장되지 않는다.[5] 스타부딘은 또한 직장에서나 감염된 혈액이나 다른 체액에 노출되어 바이러스와 접촉한 후 HIV-1 감염의 위험을 줄일 수 있다.[6] 그것은 감염의 더 나은 통제와 HIV 합병증의 감소를 위해 항상 다른 HIV 약물과 함께 사용된다.[7]
세계보건기구(WHO)는 스타부딘의 독성 수치가 높기 때문에 단계적으로 폐기할 것을 권고하고 있다. 반드시 약을 사용해야 하는 경우 부작용 발생을 줄이기 위해 저용량을 사용하는 것이 좋지만, 2015년 코크란 리뷰에서는 고용량 및 저용량 방법 사이에 뚜렷한 이점이 발견되지 않았다.[8]
임신과 모유수유
스타부딘은 동물 연구에서 태아에게 영향을 미치는 것으로 증명되었지만 인간 연구에서 얻을 수 있는 데이터는 없다.[1] 따라서 임신부에게는 잠재적인 이익이 태아에 대한 잠재적 위해보다 클 경우에만 스타부딘을 투여해야 한다. 또한, 다른 항바이러스제와 스타부딘과 디다노신 혼합치료를 받는 임산부의 치명적인 젖산염에 대한 사례 보고가 있었다.[1]
질병관리본부는 모유를 통한 HIV 전염의 위험을 피하기 위해 HIV에 감염된 산모들에게 모유를 먹이지 말 것을 권고하고 있다.[9] 인간의 모유에 대한 데이터는 없지만 스타부딘이 동물의 모유에 들어간다는 증거도 있다.[1]
아이들.
스타부딘은 태어날 때부터 청소년기까지 HIV에 감염된 어린이들에게 사용하기에 안전하다. 부작용과 안전 프로파일은 성인과 동일하다.[1]
노인
65세 이상의 HIV 감염 성인에게 스타부딘을 사용할 수 있는 데이터는 없다. 그러나 65세 이상 1만2000명 중 30%가 말초신경장애에 걸렸다.[1] 게다가, 노인들은 신기능이 저하될 가능성이 높기 때문에 독성 부작용을 일으킬 가능성이 더 높다.[10]
부작용
일반 부작용[1]
심각한 부작용[1]
개인은 이러한 심각한 부작용의 발생을 감시한다. 말초신경증의 발달은 용량과 관련이 있는 것으로 보이며, 그 약이 단종되면 해결될 수도 있다. HIV-1 질환이 발달한 개인이나 말초신경증의 역사, 신경증과 연관성이 있는 다른 약물에 중독된 개인들은 이런 부작용을 더 자주 발생시킨다.[1]
스타부딘은 실험실 테스트에서 유전독성이 있는 것으로 나타났지만 임상 용량으로는 발암 효과가 존재하지 않는다. 고농도, 골밀도(BMD) 손실, 사지지방 감소, 중성지방 증가 등이 다량으로 투여했을 때 발견되었다. 또한 지피 위축증을 일으킬 가능성이 가장 높은 항바이러스제 중 하나이며, 이러한 이유로 선진국에서는 더 이상 대부분의 환자에게는 적절한 치료제로 여겨지지 않는다.
태국의 한 연구에 따르면 HLA-B*4001은 스타부딘의 지속시간을 피하거나 단축하기 위해 어떤 환자가 스타부딘과 연관된 지질성 위축증에 걸릴지 예측하는 유전자 표지로 사용될 수 있다.[11]
인도와 같은 자원 불량 환경에서는 여전히 1선 치료의 첫 번째 선택으로 사용되고 있다. 말초신경증이나 임신이 발달한 경우에만 다음 선택인 지도부딘으로 바뀐다. 치료 순진한 환자에게는 복용량 적정화의 안전성과 효과가 보고되지 않았다. 그것은 지속적인 바이러스 억제를 받은 환자들에게만 보고되었다. 이러한 발견은 바이러스 부하가 높은 ART 순진한 환자에게 사용되는 스타부딘에 일반화되지 않는다.
2009년 11월 30일 월요일, 세계보건기구는 "[WHO]는 장기적이고 돌이킬 수 없는 부작용 때문에 각국에 Stavudine, 즉 d4T 사용을 단계적으로 중단할 것을 권고한다"고 밝혔다. Stavudine은 저렴한 비용과 광범위한 가용성 때문에 개발도상국에서는 여전히 1차 치료에서 널리 사용되고 있다. 지도부딘(AZT)이나 테노포비르(Tenofovir)는 독성이 적고 똑같이 효과적인 대안으로 추천된다."[12]
작용기전
스타부딘은 티미딘의 뉴클레오사이드 아날로그다. 그것은 세포 키나아제에 의해 인산염으로 활성 3인산염으로 만들어진다. 스타부딘 삼인산염은 자연 기질인 티미딘 삼인산염과 경쟁함으로써 HIV의 역성격화효소를 억제한다. 역분해효소는 바이러스가 숙주의 DNA에 유전 물질을 삽입하기 위해 RNA의 DNA 복사를 위해 사용하는 효소다. Stavudine triphosphate는 DNA Strand에 통합되면 DNA 복제가 종료된다.
약동학
흡수: 스타부딘은 흡수가 빠르고 경구 생체이용률이 좋다(F = 0.86).[7]
분포: 스타부딘은 혈액 속의 단백질과 결합하지 않는다.[7]
신진대사: 스타부딘의 간격은 간 신진대사에 의해 최소로 영향을 받는다. 산화 및 글루쿠로니드는 경미한 대사물을 생성한다.[7]
제거: 스타부딘은 대부분 소변에서 제거되고 대부분 변하지 않는 형태로 나타난다.[7]
약물 상호작용
지도부딘은 스타부딘의 세포내 인산화를 억제할 수 있으므로 동시에 사용하는 것이 권장되지 않는다. 다른 항-HIV 약품들은 이 속성을 가지고 있지 않다.
스타부딘은 단백질에 구속되지도 않고 주요 사이토크롬 P450 이소폼을 억제하지도 않는다. 따라서 이러한 경로를 통해 대사되는 약물이나 단백질에 구속되어 있는 약물과의 유의미한 약물 상호작용은 가능성이 낮다.[7]
역사
스타부딘은 1960년대에 제롬 호르비츠에 의해 처음 만들어졌으며 원래 D4T라는 이름이 붙여졌다.[13] 1980년대에 에이즈 전염병이 발생했을 때 윌리엄 프루소프와 타이쉰 린 박사는 스타부딘의 항-HIV 특성을 발견했다.[14] 제약회사 브리스톨마이어스 스퀴브는 제릿이라는 상표명으로 이 약을 제조한다.[14]
또한 1992년 미국 식품의약국(FDA)에 의해 최초로 병렬 추적 지위를 부여받은 약으로, 승인되기 전에 스타부딘을 환자에게 사용할 수 있도록 허용했다. Stavudine은 FDA의 가속화된 승인 절차에 따라 제출되었다. 이 과정을 통해 스타부딘의 효과는 임상 종말점이 아닌 대리마커인 CD4에 미치는 효과로 측정되었다. FDA는 CD4 세포수의 증가는 이 약이 에이즈와 HIV 감염에 얼마나 효과적인지를 보여주는 지표라고 결론지었다. Stavudine은 1994년 6월 27일 FDA로부터 에이즈와 HIV 감염의 치료 승인을 받은 네 번째 약이었다. 승인 후에도 약물의 임상적 편익을 평가하기 위한 연구가 계속되었다. 임상적 효익의 징후가 없는 경우 가속 승인이 철회될 수 있다.[15]
밀란제약은 2018년 스타부딘 20mg, 30mg, 40mg 캡슐 제조를 중단했다.[16]
참조
- ^ a b c d e f g h i "Stavudine capsule". DailyMed. 21 September 2019. Retrieved 13 October 2020.
- ^ "Zerit EPAR". European Medicines Agency (EMA). Retrieved 13 October 2020.
- ^ a b c d e f g h i j "Stavudine Monograph for Professionals - Drugs.com". www.drugs.com. Archived from the original on 2016-11-10. Retrieved 2016-11-09.
- ^ Fischer, Janos; Ganellin, C. Robin (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 505. ISBN 9783527607495. Archived from the original on 2017-09-08.
- ^ "Updated Guidelines for Antiretroviral Postexposure Prophylaxis After Sexual, Injection Drug Use, or Other Nonoccupational Exposure to HIV—United States, 2016" (PDF). Center for Disease Control and Prevention. Annals of Emergency Medicine. Archived (PDF) from the original on 20 November 2016. Retrieved 11 August 2016.
- ^ "Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents" (PDF). Panel on Antiretroviral Guidelines for Adults and Adolescents, US Department of Health and Human Services (HHS). Archived (PDF) from the original on 1 November 2016. Retrieved 11 August 2016.
- ^ a b c d e f Bristol-Myers Squibb (December 2012). "Zerit (stavudine) capsules and powder for oral solution prescribing information" (PDF). Princeton, NJ. Archived (PDF) from the original on 2017-01-31.
- ^ Magula, N; Dedicoat, M (28 January 2015). "Low dose versus high dose stavudine for treating people with HIV infection". The Cochrane Database of Systematic Reviews. 1: CD007497. doi:10.1002/14651858.CD007497.pub2. PMID 25627012.
- ^ "Pregnant Women, Infants, and Children Gender HIV by Group HIV/AIDS CDC". www.CDC.gov. Archived from the original on 15 November 2016. Retrieved 15 November 2016.
- ^ "FDA Guideline for Industry: Geriatric Population" (PDF). FDA.gov. Archived (PDF) from the original on 14 September 2016.
- ^ Wangsomboonsiri W, Mahasirimongkol S, Chantarangsu S, et al. (February 15, 2010). "Association between HLA-B*4001 and lipodystrophy among HIV-infected patients from Thailand who received a stavudine-containing antiretroviral regimen". Clinical Infectious Diseases. 50 (4): 597–604. doi:10.1086/650003. PMID 20073992.
- ^ "New HIV recommendations to improve health, reduce infections and save lives". World Health Organization. November 30, 2009. Archived from the original on January 18, 2010.
- ^ "Jerome Horwitz". Telegraph.co.uk. Archived from the original on 2016-11-07. Retrieved 2016-11-06.
- ^ a b Prusoff, William (2001-03-19). "The Scientist's Story". The New York Times. ISSN 0362-4331. Archived from the original on 2016-11-07. Retrieved 2016-11-06.
- ^ "FDA Approval of Stavudine (d4T) News AIDSinfo". AIDSinfo. Archived from the original on 2016-11-07. Retrieved 2016-11-06.
- ^ 미국 식품의약국 10903 뉴햄프셔 애비뉴 실버 스프링, MD 20993 1-888-INFO-FDA(1-888-46332). (2018년 4월 30일). FDA 약품 부족. 2018년 5월 1일, https://www.accessdata.fda.gov/scripts/drugshortages/dsp_ActiveIngredientDetails.cfm의 약물 부족&에서 검색됨AI=스타부딘 캡슐&st=d&tab=tabs-4&panels=0&elqTrackId=ea74e0ed22944b0e044b80c0e85a7812de68&elq=eba2efb1494bdddba432bc417&elqaid=3343&elqat=1&elqCampaignId=2529#
외부 링크
- "Stavudine". Drug Information Portal. U.S. National Library of Medicine.