나라프레비르
Narlaprevir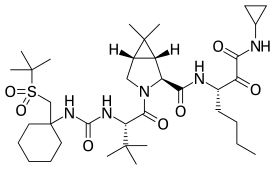 | |
| 임상자료 | |
|---|---|
| 상명 | 알란사 |
| 기타 이름 | SCH 900518 |
| 경로: 행정 | 입으로 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 |
|
| 약동학 데이터 | |
| 단백질 결합 | 86.5–91.4% |
| 신진대사 | 산화, 환원 및 N-데알킬화(CYP3A4)를 통한 광범위한 간질 |
| 배설 | 대변(81.1%), 소변(3.14%) |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| 화학 및 물리적 데이터 | |
| 공식 | C36H61N5O7S |
| 어금질량 | 707.97 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
Narlaprevir(무역명 알란사,[1] 코드명 SCH 900518)[2]는 NS3/4A 세린 프로테아제의 억제제로, 다른 항바이러스제와 결합하여 유전자형 1 바이러스로 인한 만성 C형 간염의 치료를 목적으로 한다.[3][4][5]
나라프레비르(Narlaprevir)는 만성 C형 간염 치료를 위한 러시아 최초의 처방약이다.[4][6]
작용기전
Narlaprevir는 C형 간염 바이러스의 경구 NS3 세린 프로테아제 억제제다.그것은 감염된 숙주 세포의 바이러스 복제를 억제한다.[2]억제 메커니즘은 케토아미드 기능 그룹을 통해 NS3 프로테아제 활성 부위와 나르랩레비르의 가역적 공밸런트 결합을 포함한다.[2]
Narlaprevir는 카테핀 B(69% 억제)를 제외하고 인간 보호에 구속되지 않는다.카테핀 B의 과도한 압박은 악성종양의 발달과 관련이 있다.[7]
사용법
- 적응증
만성 C형 간염 바이러스(HCV) 감염 유전자형 1은 18세 이상 간질환 중 치료-나아브레이드 인터페론 알파와 리바비린의 이중 결합에 실패한 환자에서 리토나비르, 페길티드 인터페론 알파, 리바비린과 결합한 유전자형 1이다.Narlaprevir는 단일 에이전트로 사용할 수 없다.[1][2][6][8][9]
- 콘트라인커뮤니케이션
Narlaprevir는 약간의 금기를 가지고 있다.특히:[1][8]
효능 연구
H. 리싱크 외(2009) 단일 에이전트로서 그리고 페기럴 인터페론 알파-2b와 이중 조합으로 나르프라비르 안전 및 항바이러스 활동을 입증했다.[10]
X. Tong 외 연구진(2010)은 Boceprevir와 텔라프레비르에 대한 저항을 유발하는 HCV 돌연변이에 대한 내라프레비르 활동을 시연했다.[2]
2016년에는 대규모 단계 III 다단계 FORNER 연구가 완료되었다.지속적 바이러스 반응(SVR)은 치료-나트륨혈관이 89%, 치료 경험자가 70%로 나르프레비르군에서 치료 종료 24주 후인 반면 대조군에서 SVR은 치료-나트륨혈관이 59.6%, 치료 경험자가 24.5%에 불과했다.페글레이트 인터페론 알파와 리바비린을 사용한 이중 치료법에 나래퍼비어를 추가하는 것은 나래퍼비르 안전 프로파일에 영향을 미치지 않았다.보상성 간경변 환자에서 리토나비르와 결합한 나래프레비르 약동학에 대한 1단계 연구도 완료되었다(리버 미팅 AASLD, 2015년 2월 13-17일, 미국 캘리포니아주 샌프란시스코).[9][11]
모스크바 임상연구센터 간학부장이자 모스크바 정부 보건부 최고위내과 전문의인 I.G. 바쿨린 교수에 따르면 나르플라프레비르의 규제 승인은 러시아 C형 간염과의 싸움에서 달성된 주요 이정표가 됐다.[9]
역사
2012년, 제약 그룹 R-Pham은 Merck & Co. (MSD)로부터 나르프레비르 제조 면허를 취득했다.[12]이 약품의 추가 개발은 R-Pham이 텍사스 간연구소(미국)와 협력하여 연방 표적 프로그램 '러시아 연방의 2020년까지의 기간 및 그 이상의 제약 및 의료 산업 개발'[9]의 지원을 받아 수행되었다.약 7억 루블이 임상시험과 약품 개발에 투자되었고,[4][13] 이 중 1억 2천만 루블은 러시아 정부로부터 나왔다.[14]
이 약물에 대한 사전 임상 및 임상 연구는 유럽, 미국, 러시아의 여러 임상 센터에서 수행되었다.[9][13][14]
이 약은 러시아 야로슬라블 시에 있는 제약 공장에서 제조된다.[4]
참조
- ^ a b c "Russian State Registry of Medicines. Arlansa (narlaprevir) film-coated tablets: Registration sertificate" (in Russian). Retrieved 11 January 2017.
- ^ a b c d e Tong X, Arasappan A, Bennett F, Chase R, Feld B, Guo Z, et al. (June 2010). "Preclinical characterization of the antiviral activity of SCH 900518 (narlaprevir), a novel mechanism-based inhibitor of hepatitis C virus NS3 protease". Antimicrobial Agents and Chemotherapy. 54 (6): 2365–70. doi:10.1128/AAC.00135-10. PMC 2876368. PMID 20308381.
- ^ Chen KX, Njoroge FG (2012). "12. Discovery of Boceprevir and Narlaprevir: The First and Second Generation of HCV NS3 Protease Inhibitors". In Huang X, Aslanian RG (eds.). Case Studies in Modern Drug Discovery and Development. Oxford: John Wiley & Sons, Inc. pp. 296–335. doi:10.1002/9781118219683.ch12. ISBN 9781118219683.
- ^ a b c d "Российский препарат от гепатита С готовится к выпуску" (in Russian). Собеседник.RU. 30 June 2016.
- ^ Wang H, Geng L, Chen BZ, Ji M (October 2014). "Computational study on the molecular mechanisms of drug resistance of Narlaprevir due to V36M, R155K, V36M+R155K, T54A, and A156T mutations of HCV NS3/4A protease". Biochemistry and Cell Biology. 92 (5): 357–69. doi:10.1139/bcb-2014-0039. PMID 25178998.
- ^ a b Rudakova AV, Gusev DA, Uskov AN, Konovalova LN, Lobzin YV (2016). "Cost-Effectiveness of the Second Wave of Protease Inhibitors in the Treatment of Chronic Hepatitis C (Genotype 1) in Patients Not Previously Treated with Antiviral Drugs, and for Relapsed Disease". Journal of Infectology (in Russian). 8 (1): 79–82. doi:10.22625/2072-6732-2016-8-1-79-82 (inactive 28 February 2022).
{{cite journal}}: CS1 maint : 2022년 2월 현재 DOI 비활성화(링크) - ^ Arasappan A, Bennett F, Bogen SL, Venkatraman S, Blackman M, Chen KX, et al. (May 2010). "Discovery of Narlaprevir (SCH 900518): A Potent, Second Generation HCV NS3 Serine Protease Inhibitor". ACS Medicinal Chemistry Letters. 1 (2): 64–9. doi:10.1021/ml9000276. PMC 4007962. PMID 24900178.
- ^ a b Bakulin I. "The "Second Wave" PI Narlaprevir in Russian Patients with Genotype 1 Chronic Hepatitis C" (PDF).
- ^ a b c d e ""R-Pharm" Launches Narlaprevir — a New Oral Medication for Hepatitis C" (in Russian). R-Pharm.com. 6 June 2016. Archived from the original on 28 August 2016. Retrieved 23 December 2016.
- ^ Reesink H, Bergmann J, de Bruijne J, Weegink C, Van Lier J, Van Vliet A, et al. (2009). "Safety and Antiviral Activity of SCH 900518 Administered as Monotherapy and in Combination with Peginterferon Alfa-2B to Naive and Treatment-Experienced HCV-1 Infected Patients". Journal of Hepatology. 50 (Supp. 1): S35–S36. doi:10.1016/S0168-8278(09)60088-X.
- ^ Bakulin IG, Abdurakhmanov DT, Bogomolov PO, Burnevich EZ, Voloshina NB, Geivandova NI, et al. "Preliminary Results of a Phase III Study of New Protease Inhibitor Narlaprevir in Treatment-Naïve and Treatment-Experienced Patients with Chronic Hepatitis C Genotype 1 (PIONEER Study)" (PDF) (in Russian). p. 20.
{{cite web}}:체크하다.url=가치(도움말) - ^ Dranishnikova M, Fomchenko D (21 June 2012). "Together Against Hepatitis" (in Russian). Vedomosti.
- ^ a b Lapin M (30 June 2016). "Manufacturing of Hepatitis C Drug Will Begin in Russia" (in Russian).
- ^ a b Nevinnaya I. "Minpromtorg Supports the Development of New Drugs" (in Russian). No. Federal Issue №5823 (150). Rossiyskaya Gazeta.
추가 읽기
- Burnevish EZ, Tikhonova NY, Schanitsyna SE (2014). "Narlaprevir, Boosted with Ritonavir, in Combination with Pegylated Interferon Alpha-2A and Ribavirin in the Treatment of Chronic Hepatitis C". Clinical Pharmacology and Therapy. 5: 34–9.


