엠트리시타빈
Emtricitabine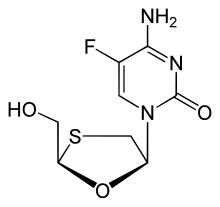 | |
| 임상자료 | |
|---|---|
| 발음 | /ˌɛmtrəˈsaɪtəbiːn/ EM-trit-SY-tit-been |
| 상명 | 엠트리바 |
| 기타 이름 | 공정위 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a604004 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | 입으로 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | 93% |
| 단백질 결합 | 매우 낮음(4% 미만) |
| 신진대사 | 간산화 및 글루쿠로니화 CYP 시스템이 관련되지 않음 |
| 제거 반감기 | 10시간 |
| 배설 | 레날(86%)과 대변(14%) |
| 식별자 | |
| CAS 번호 | |
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| NIAID 화학DB | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.120.945 |
| 화학 및 물리적 데이터 | |
| 공식 | C8H10FN3O3S |
| 어금질량 | 247.24 g·2010−1 |
| 3D 모델(JSmol) | |
| (iii) | |
통상명 Emtricitabine(일반적으로 FTC, 체계명 2',3'-dideoxy-5-fluoro-3'-thiacytidine[1])은 성인과 어린이의 HIV 감염 예방 및 치료를 위한 뉴클레오사이드 역투명효소 억제제(NRTI)이다.
엠트리치타빈도 트루바다라는 상표명으로 테노포비르 이소프로필(비레아드)과 데스코비라는 상표명으로 테노포비르 알라페나미드(벨리디)가 고정된 양분 조합으로 시판되고 있다.
엠트리시타빈, 테노포비르, 에파비렌즈(Sustainiva, Bristol-Myers Squibb가 시판)의 고정 3중 결합은 2006년 7월 12일 미국 식품의약국(FDA)으로부터 아트리플라라는 상표명으로 승인되었다.
엠트리시타빈은 쿼드 알약의 4분의 1을 차지한다. 스트리빌드와 겐보야).
테노포비르 또는 에파비렌즈 및 테노포비르와 고정 복용량 조합에서는 세계보건기구의 필수 의약품 목록에 등재되어 있다.[2] 2017년에는 미국에서 가장 흔하게 처방된 224번째로 200만 개 이상의 처방전이 있었다.[3][4]
의학적 용법
HIV 감염
Emtricitabine은 HIV-1 감염의 예방과 치료를 위해 다른 항레트로바이러스제와 함께 표시된다.[5][6]
HBV 감염
엠트리시타빈은 B형 간염 바이러스(HBV)에 대한 임상 활동을 보이나 미국 식품의약국(FDA)의 HBV 감염 치료 승인을 받지 않았다.[5] 만성 HBV 감염을 가진 개인들 중에서, 엠트리시타빈 치료는 상당한 역사학, 비뇨기학, 생화학적 개선을 가져온다. 치료 중 엠트리치타빈의 안전 프로필은 위약과 유사하다. 다른 모든 FDA 승인 약물과 마찬가지로 Emtricitabine은 HIV나 HBV 감염을 치료하지 않는다. HBV 감염자를 대상으로 한 연구에서, 치료에서 제외된 엠트리시타빈 치료자의 23%에서 감염 증상이 돌아왔다.[7] 만성 HIV 감염자를 포함한 연구에서, 바이러스 복제는 연구 대상이 치료에서 제외될 때 재개된다.[8] HIV 감염을 치료하기 위해 사용되는 약과 마찬가지로 HBV 감염을 치료하기 위해 사용되는 약도 약물 내성 균주의 진화를 막기 위해 함께 사용해야 할 수 있다. 다른 항HBV 약물과 조합한 엠트리시타빈의 효능은 확립되지 않았다.
부작용
임상실무에서는 엠트리시타빈과의 독성이 특이하다. 가장 흔한 치료 관련 부작용은 설사, 두통, 메스꺼움, 발진이다. 이러한 증상은 일반적으로 심각도가 경미할 정도로 경미하지만 임상시험 환자의 1%가 치료를 포기하게 만들었다. 일반적으로 과피질로 보고되며 대개 손바닥이나 발바닥 중 하나에 영향을 미치는 피부 변색은 개인 2% 미만으로 보고되며 아프리카 출신 환자에게는 거의 배타적이다.
환자들이 경험할 수 있는 더 심각한 부작용으로는 간독성이나 젖산증이 있다.
작용기전
엠트리치타빈은 시티딘의 아날로그물이다. 이 약은 HIV RNA를 새로운 바이러스 DNA로 복제하는 효소인 역분해효소를 억제함으로써 효과가 있다. emtricitabine은 HIV의 복제의 중심인 이 과정을 방해함으로써 환자의 몸에서 HIV, 즉 "바이러스 부하"의 양을 낮추는 데 도움을 줄 수 있고 면역 체계 세포(이름: T세포/CD4+ T세포)의 수를 간접적으로 증가시킬 수 있다. 이 두 가지 변화 모두 건강한 면역 체계와 심각한 질병의 발생 가능성 감소와 관련이 있다.
역사
Emtricitabine은 Dennis C 박사에 의해 발견되었다. 리오타, 레이먼드 F 박사님 시나지, 그리고 에모리 대학의 최우백 박사 그리고 1996년에 에모리사가 Triangle Pharmethics에 면허했다.[9] 트라이앵글제약은 길리어드사이언스가 2003년 인수해 개발을 완료하고 현재 엠트리바라는 브랜드명으로 제품을 시판하고 있다.
2003년 7월 2일 FDA의 승인을 받았다.[10] 라미부딘(3TC)과 매우 유사하며, 둘 사이의 교차 저항은 거의 보편적이다.[medical citation needed]
참조
- ^ 1998년 9월 29일 발행된 미국 5814639, 리오타 DC, 시나지 RF, 최 WB, "2'-deoxy-5-fluoro-3'-thiacytidine 및 관련 화합물의 합성, 구성 및 사용에 대한 방법"을 에모리 대학에 배정했다.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ "The Top 300 of 2020". ClinCalc. Retrieved 11 April 2020.
- ^ "Emtricitabine - Drug Usage Statistics". ClinCalc. Retrieved 11 April 2020.
- ^ Jump up to: a b "Emtriva- emtricitabine capsule Emtriva- emtricitabine solution". DailyMed. 14 December 2018. Retrieved 24 July 2020.
- ^ "Emtriva EPAR". European Medicines Agency. 17 September 2018. Retrieved 24 July 2020.
- ^ Lim SG, Ng TM, Kung N, Krastev Z, Volfova M, Husa P, et al. (January 2006). "A double-blind placebo-controlled study of emtricitabine in chronic hepatitis B". Archives of Internal Medicine. 166 (1): 49–56. doi:10.1001/archinte.166.1.49. PMID 16401810.
- ^ Oxenius A, Price DA, Günthard HF, Dawson SJ, Fagard C, Perrin L, et al. (October 2002). "Stimulation of HIV-specific cellular immunity by structured treatment interruption fails to enhance viral control in chronic HIV infection". Proceedings of the National Academy of Sciences of the United States of America. 99 (21): 13747–52. Bibcode:2002PNAS...9913747O. doi:10.1073/pnas.202372199. PMC 129766. PMID 12370434.
- ^ Leaf C (September 19, 2005). "The Law of Unintended Consequences". CNN.
- ^ 스탠더드 앤드 푸어스 500 가이드. 스탠더드 앤 푸어스, 맥그로 힐(2004년), 페이지 83.
외부 링크
- "Emtricitabine". Drug Information Portal. U.S. National Library of Medicine.


