비뉴클레오시드 역전사효소 억제제 발견 및 개발
Discovery and development of non-nucleoside reverse-transcriptase inhibitors비뉴클레오시드 역전사효소 억제제(NNRTI)는 인간면역결핍바이러스(HIV) 치료에 사용되는 항레트로바이러스제이다.NNRTI는 HIV 유전물질의 복제를 제어하는 효소인 역전사효소(RT)를 억제한다.RT는 항레트로바이러스제 [1]개발 분야에서 가장 인기 있는 표적 중 하나이다.
NNRTI의 발견과 개발은 1980년대[2] 후반에 시작되었으며 2009년 말에 규제 당국에 의해 4개의 NNRTI가 승인되었고 다른 몇 개는 임상 개발 중에 있다.NNRTI를 단일 요법으로 투여하면 약물 내성이 빠르게 발생하므로 NNRTI는 항상 높은 활성 항레트로바이러스 치료(HAART)[3]인 조합 요법의 일부로 투여된다.
역사
후천성면역결핍증후군은 [1]세계 주요 사망 원인이다.1981년에 질병으로 판명되었다.2년 후, 에이즈의 원인인 HIV가 [4]설명되었습니다.HIV는 레트로바이러스이며 HIV-1과 HIV-2의 두 가지 주요 혈청형을 가지고 있다.유행병은 대부분 HIV-1과 관련이 있는 반면 HIV-2는 낮은 발병률을 보이며 주로 [5]서아프리카로 제한된다.
2009년에는 전 세계에서 4000만 명 이상이 HIV에 감염되어 그 수는 [6]계속 증가하고 있습니다.감염자의 대부분은 개발도상국에 [7]살고 있다.
HIV 약물은 HIV 감염을 치료하지는 않지만, 그 치료법은 환자의 삶의 질을 향상시키고 사망률을 낮추는 것을 목표로 한다.[8]
HIV 감염 치료를 위해 2009년에 25개의 항레트로바이러스제가 제공되었다.그 약들은 서로 다른 표적에 작용하는 6개의 다른 등급에 속합니다.항레트로바이러스제 개발 분야에서 가장 인기 있는 대상은 HIV-1 역전사효소(RT)[1]다.HIV-1 RT 효소를 대상으로 하는 약물에는 뉴클레오시드/뉴클레오티드 역전사효소 억제제(NRTIs/NtRTIs)와 비뉴클레오시드 역전사효소 억제제(NNRTIs)의 두 종류가 있다.이러한 클래스의 약물은 HAART로 [3]더 잘 알려진, 매우 활동적인 항레트로바이러스 치료라고 불리는 HIV 조합 치료법의 중요한 구성요소이다.
1987년, HIV 감염 치료를 위한 첫 번째 약이 미국 식품의약국에 의해 승인되었다.이것은 디도부딘이라는 NRTI입니다.1980년대 후반, NRTI의 추가 개발 중에 NNRTI의 검출 분야가 시작되었습니다.NNRTIs의 개발은 1990년대에 빠르게 개선되었고 그들은 곧 단백질 분해효소 [7][8]억제제에 이은 세 번째 항레트로바이러스제가 되었다.
NNRTI는 HIV-1에 특유하며 HIV-2 및 다른 레트로바이러스에 대한 활동은 없습니다.최초의 NNRTI인 네비라핀은 베링거 잉겔하임 연구진에 의해 발견되었고 1996년 FDA에 의해 승인되었다.이후 2년 동안 두 개의 다른 NNRTI가 FDA에 의해 승인되었고, 1997년에는 델라비딘, [4]1998년에는 에파비렌즈가 승인되었다.이 세 가지 약물은 소위 1세대 NNRTI라고 불립니다.보다 나은 저항 프로파일을 가진 NNRTI의 필요성은 차세대 NNRTI의 개발로 이어졌습니다.얀센스 재단과 티보텍의 연구원들은 2008년 FDA에 의해 승인된 이 클래스의 첫 번째 약인 에트라비린을 발견했다.이 클래스의 두 번째 약물인 릴피비린도 티보텍에 의해 발견되었고 2011년에 FDA에 의해 승인되었다.이 4가지 NNRTI 외에도 여러 가지 NNRTI가 임상 [7]개발 중입니다.
HIV-1 역전사 효소
기능.
역전사효소(RT)는 HIV와 다른 레트로바이러스의 [1]유전자 물질 복제를 제어하는 효소입니다.그 효소는 두 가지 효소 기능을 가지고 있다.첫째, 그것은 단가닥 RNA 게놈을 단가닥 DNA로 전사하고 그 후에 상보적인 DNA 가닥을 형성하는 중합효소 역할을 한다.이것은 숙주 세포의 [7]염색체에 통합될 수 있는 DNA 이중나선을 제공한다.둘째, 바이러스 DNA [9]합성 중에 형성되는 RNA-DNA 중간체의 RNA 가닥을 분해하기 때문에 리보핵산가수분해효소 H(Rnase H) 활성을 갖는다.
구조.
HIV-1 RT는 p66(560 아미노산)과 p51 서브유닛(440 아미노산)[1]으로 구성된 비대칭 1000-아미노산 헤테로다이머입니다.p66 서브유닛은 중합효소 및 리보핵산가수분해효소 H의 두 개의 도메인을 가지고 있다.중합효소 도메인은 "손가락", "팜", "엄지", "접속"이라고 불리는 4개의 서브도메인을 포함하고 있으며 종종 오른손과 비교된다([7]그림 1).p66 서브유닛의 역할은 효소의 활성 부위를 포함하는 반면 RT의 활성을 수행하는 것이다.p51은 주로 구조적인 [9]역할을 하는 것으로 여겨진다.
결합 및 약초
NNRTI의 화학적 다양성에도 불구하고 이들은 모두 RT의 동일한 부위에서 결합한다.결합은 [1][7]효소의 p66 서브유닛 부위의 팜 도메인에서 촉매 부위에서 약 10Ω 떨어진 소수성 포켓에서 알로스테릭하게 발생한다.NNRTI 결합 포켓(NNIBP)에는 5개의 방향족(Tyr-181, Tyr-188, Pe-227 및 Trp-229), 6개의 소수성(Pro-59, Leu-100, Val-106, Val-179, Leu-234 및 Pro-236)이 들어 있습니다.p51 [7]서브유닛각 NNRTI는 NNIBP의 [10]다른 아미노산 잔기와 상호작용한다.
네비라핀과 같은 제1세대 NNRTI의 결합에서 중요한 요소는 나비 모양이다.그들의 화학적 다양성에도 불구하고 그들은 매우 비슷한 나비 같은 [10]모양을 하고 있다.NNRTI의 두 방향족 고리는 효소 내에서 나비의 날개를 닮도록 일치합니다(그림 2).나비 구조에는 '몸통'으로서의 친수성 중심과 [11]날개를 나타내는 두 개의 소수성 부분이 있습니다.윙 I은 보통 이방향환이고 윙 II는 페닐 또는 알릴 치환기입니다.윙 I은 아미노산 Lys-101 및 Lys-103의 주쇄와의 수소결합을 수용 및/또는 기증할 수 있는 관능기를 고리 한쪽에 가진다.윙 II는 대부분 방향족 아미노산의 곁사슬에 의해 형성되는 소수성 포켓과 γ-γ 상호작용을 통해 상호작용합니다.버터플라이 본체에는 Lys-103, Val-106, Val-179의 [12]측쇄를 주체로 하는 소주머니가 소수성 부분에 충전되어 있다.단, 다른 많은 NNRTI는 다양한 모드에서 RT에 바인드되어 있습니다.다이어릴피리미딘(DAPY)과 같은 2세대 NNRTI는 2개의 측방 소수성 날개와 중앙 [13]극부인 피리미딘 고리를 가진 편자 모양이다.
NNIBP는 탄성이 있으며, 배치는 NNRTI의 크기, 특정 화학 성분 및 결합 모드에 따라 달라집니다.RT의 전체 구조에는 바인딩된 NNRTI의 특성에 따라 세그먼트 유연성이 있습니다.억제제가 돌연변이 표적의 변형된 주머니에서 결합할 수 있는 유연성을 갖는 것이 중요하다.억제제 유연성은 억제제-표적 [10]상호작용에 영향을 미치지 않을 수 있다.
작용 메커니즘
NNRTI는 RT 효소에 비경쟁적으로 결합함으로써 작용한다(그림 3).결합은 효소의 3차원 구조에 구조 변화를 일으키고 NNIBP를 [6][7]생성한다.NNRTI와 HIV-1RT의 결합은 아미노산 잔류물 Tyr-181 및 Tyr-188의 [14]로타머 배좌 변화를 유도하기 때문에 p66 엄지 도메인을 하이퍼 확장시킨다.이는 효소의 촉매 활성에 영향을 미치고 RT의 p66 서브유닛의 [15]중합효소 활성 부위를 억제하여 HIV-1 복제를 차단합니다.전지구적 구조 변화는 추가적으로 핵산 템플릿의 효소를 불안정하게 하고 뉴클레오티드와 [16]결합하는 능력을 감소시킨다.바이러스 RNA의 전사가 억제되어 바이러스의 복제율이 [6]저하됩니다.정확한 분자 메커니즘은 여전히 가설이지만,[citation needed] 여러 연구에서 이것이 작용의 주요 메커니즘이라는 것이 입증되었습니다.
이 제안된 1차 작용 메커니즘 외에 NNRTI는 다른 작용 메커니즘을 가지고 역전사효소 [7]반응의 다양한 단계를 간섭하는 것으로 나타났다.NNRTI에 의한 역전사의 억제는 RT Rnase H 활성 및/또는 템플릿/프라이머 결합에 대한 영향 때문일 수 있다고 제안되었다[by whom?].일부 NNRTI는 HIV-1의 복제를 [citation needed]억제함으로써 HIV-1 Gag-Pol 폴리단백질 처리를 방해한다.
차세대 NNRTI를 개발하고 약물 [15]내성의 메커니즘을 이해하기 위해서는 NNRTI의 다양한 작용 메커니즘을 깊이 이해하는 것이 중요하다.
의약품의 발견과 설계
효과적인 항HIV 약물의 개발은 뉴클레오티드와 아미노산 배열의 큰 차이 때문에 어렵다.완벽한 항HIV 약물 화학 물질은 약물 내성 돌연변이에 효과적이어야 한다.표적 RT 효소와 그 구조, 약물 작용 메커니즘 및 약물 내성 돌연변이의 결과를 이해하는 것은 보다 효과적인 NNRTI 설계에 도움이 될 수 있는 유용한 정보를 제공한다.NNRTI 결합을 방해할 [10]수 있는 돌연변이로 인해 RT 효소가 변화할 수 있습니다.
검출
NNRTI로 확인된 첫 번째 두 가지 화합물은 1-(2-2-히드록시에톡시메틸)-6-(페닐티오)티민(HEPT)과 테트라히드로이미다조[4,5,1-jkj][1,4]벤조디아제핀-2(1H-티브)였다.TIBO 컴파운드의 검출에 의해 1980년대[2] 후반 NNRTI 클래스가 정의되어 RT를 억제하는 것이 예기치 않게 판명되었습니다.이 발견은 이러한 화합물의 작용 메커니즘에 대한 연구를 시작했다.헵트 화합물은 TIBO 화합물보다 먼저 설명되었으며 원래 NRTI로 생각되었다.나중에 그들이 TIBO [4][7]화합물과 공통 작용 메커니즘을 공유한다는 것이 밝혀졌다.HEPT와 TIBO 화합물 모두 다른 [4]RT에 대해 활성화되지 않고 매우 특이적이고 강력한 HIV-1 RT 억제제로 처음 확인되었다.이러한 화합물은 세포나 미토콘드리아 DNA 합성을 방해하지 않는다.HIV-1에 대한 NNRTI의 특이성은 NNRTI 약물 [7]클래스의 특징으로 간주됩니다.
발전
제1세대 NNRTI
HEPT와 TIBO의 발견 후, 화합물 스크리닝 방법을 사용하여 일반적으로 네비라핀으로 알려진 최초의 NNRTI인 BI-RG-587을 개발하였다.HEPT 및 TIBO와 마찬가지로, 네비라핀은 비경쟁적 억제(dNTP 결합과 관련하여)에 의해 바이러스 RT 활성을 차단하였다.이것은 새로운 종류의 항HIV 억제제가 활성 부위가 아닌 RT의 활성을 억제하고 있다는 생각을 강화했다.여러 분자의 선별과 진화에 따라 여러 개의 NNRTI 분자 패밀리가 나타났다.[8]
1세대 NNRTI 화합물 3개가 HIV-1 감염 치료에 대해 FDA에 의해 승인되었다.Nevirapine은 1996년에, delavirdine은 1997년에, efavirenz는 1998년에 승인되었습니다(표 1).이들 약물 중 두 가지인 네비라핀과 에파비렌즈는 현재 거의 사용되지 않는 반면,[7][8] HAART의 초석이다.이 세 가지 약물의 구조는 HIV-1 RT에 대한 활성을 허용하는 광범위한 고리, 치환기 및 결합을 보여준다.이러한 다양성은 왜 그렇게 많은 비-뉴클레오시드가 합성되었는지 보여주지만 왜 3가지 약품만 시장에 나왔는지 설명해주지는 않는다.주된 문제는 이 화합물들이 [8]내성을 발달시키는 능력이었다.
 |  |  |
|---|---|---|
| 네비라핀 | 들라비딘 | 에파비렌즈 |
α-APA에서 ITU로의 개발
결정 구조 분석 결과, 1세대 NNRTI(예: TIBO, 네비라핀 및 α-APA)는 HIV-1 RT를 "나비 같은" 형태로 결합하는 것으로 나타났다.이러한 1세대 NNRTI는 Tyr-181C 및 Tyr-188L/H와 같은 일반적인 약물 내성 돌연변이에 취약했다.이로 인해 새롭고 보다 효과적인 NNRTI를 찾을 필요성이 대두되었습니다.α-APA 아날로그에서 유망한 일련의 NNRTI인 ITU(이미도일티오요소)가 나타났다(그림 4).ITU 화합물은 α-APA의 아릴 측기와 결합하는 링커를 확장하여 얻었다.강력한 ITU 화합물 R100943은 구조-활성 관계(SAR)에 기초한 측면군의 화학적 조성을 배열하여 얻었다.HIV-1/R100943 복합체의 결정구조는 ITU 화합물이 α-APA 화합물보다 유연성이 높다는 것을 증명했다.ITU 화합물은 "horseshoe" 또는 "U" 모드로 결합되는 독특한 결합 모드를 보였습니다.화학적으로 α-APA의 날개 II, 6-디브로모페닐 부분에 해당하는 R100943의 2,6-디클로로페닐 부분은 NNIB의 날개 I 부분을 차지했고, R100943의 4-시아노아닐리노 부분은 [10][17]NNIB의 날개 II 위치를 차지했다.
R100943은 HIV-1을 억제했으며, 로비라이드(α-APA)와 네비라핀에 대한 높은 수준의 내성을 야기한 G190A 돌연변이와 같은 다수의 핵심 NNRTI 내성 돌연변이에 대해 상당히 효과적이었다.G190A 돌연변이는 나비 모양의 NNRTI의 링커 부분에 의해 채워지는 바인딩 포켓의 일부를 점유함으로써 저항을 일으키는 것으로 생각되었습니다.R100943은 말굽형 바인딩 모드로 G190에서 약 6.0Ω 거리에 있습니다.나비 모양으로 결합하는 네비라핀 및 로비라이드와 비교하여 ITU 유도체는 Tyr-181C 및 Tyr-188L 돌연변이에 대해 개선된 활성을 보였습니다.구조 연구에 따르면 강력한 TIBO 화합물은 돌연변이 RT의 NNIBP(non-nucleoside inhibitator binding pocket) 내에서 이동함으로써 Tyr-181C 돌연변이의 영향을 부분적으로 보완할 수 있다.이 맥락에서 R100943은 NNRTI의 컨포메이션 교체를 가능하게 하는 비틀림 자유도를 갖추고 있습니다.이 비틀림 자유도는 ITU 유도체에 의해 변이된 NNIBP에 결합되어 저항 돌연변이의 영향을 보상하기 위해 사용될 수 있습니다.그럼에도 불구하고, HIV-1 내성 돌연변이에 대한 R100943의 효력은 효과적인 약물 후보로 고려하기에 충분하지 않았다.또한 ITU 유도체의 이미도일티오 요소 부분의 화학적 안정성은 경구 [10][18][19]약물에 적합하지 않았다.
ITU에서 DATA로의 개발
이미도일티오 요소 복합체의 변화는 새로운 종류의 화합물인 diaryltriazine(DATA)의 합성으로 이어졌다.이들 화합물에서는 ITU 화합물의 티오요소 부분이 트리아진 고리로 대체되었다.DATA 화합물은 일반적인 NNRTI 내성 돌연변이 변종에 대해 ITU 화합물보다 더 강력했다.프로토타입 DATA 화합물인 R106168은 합성하기가 비교적 쉬웠습니다.3개의 링 모두와 링을 접속하는 링커 상의 다른 위치에서 여러 개의 치환이 이루어졌습니다.주머니에서, 대부분의 DATA 파생 모델은 말굽 형태를 따릅니다.R106168의 두 날개(2,6-디클로로벤질 및 4-시아노아닐리노)는 ITU 유도체의 두 날개와 유사한 포켓 내 위치를 차지했습니다.트리아진 고리가 ITU 유도체의 티오요소군을 대체한 DATA 화합물의 중심부는 L100과 V179의 측쇄 사이에 위치한다.이를 통해 중앙 부분의 비틀림 자유도가 상당 부분 제거되고 트리아진 링과 [10][20]날개 사이의 유연성이 유지됩니다.
DATA 화합물의 3방향 고리 골격에서 화학적 치환 또는 변형이 활성에 상당한 영향을 미쳤다.DATA 아날로그인 R120393은 중합효소 프라이머 그립 루프의 보존된 W229 사이드 체인과의 상호작용을 확장하기 위해 날개 I에 클로로인돌 파트를 포함하도록 설계되었다.R120393은 대부분의 NNRTI 내성 돌연변이에 대해 R106168과 같은 효과를 보였습니다.클로로인돌 부분은 포켓의 소수성 코어와 상호작용하여 R120393의 바인딩 모드에 영향을 미쳤기 때문에 다른 DATA 아날로그의 날개 I 위치에 비해 포켓 안으로 깊숙이 들어가 있습니다.결정 구조는 DATA 화합물이 NNIBP를 다른 형태로 결합할 수 있다는 것을 보여주었다.여러 모드에서 결합할 수 있는 능력은 NNRTI를 약물 내성 돌연변이에 대해 더 강하게 만들었다.억제제 간의 변동성은 화학 성분, 날개 I의 크기 및 고리를 연결하는 두 링커 그룹이 변경되었을 때 확인할 수 있었다.트리아진 질소 원자가 [10]탄소로 대체되었을 때 NNRTIs의 효력은 변화했다.
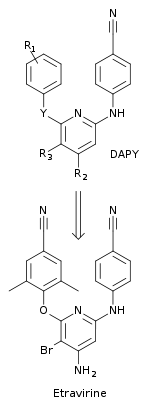
차세대 NNRTI
연구자들은 더 나은 내성 프로필과 [10]내성의 발달에 대한 유전적 장벽을 증가시킨 NNRTI를 설계하기 위해 다학문적 접근법을 사용했다.DATA 화합물로부터 중앙 트리아진 고리를 피리미딘으로 대체하면서 새로운 등급의 화합물인 다이어릴피리미드(DARPY)가 발견되었다.이 새로운 클래스는 대응하는 DATA 아날로그보다 약물에 내성이 있는 HIV-1 변종에 대해 더 효과적이었다.이를 통해 중앙 방향족 링의 5개 위치에서 CH-group으로 치환할 수 있었습니다.최초의 DATY 화합물 중 하나인 다피비린(R1=2,4,6-트리메틸아닐리노, R2=R3=H, Y=NH)은 약물 내성 HIV-1 변종에 효과적인 것으로 밝혀졌다.새로운 DATY 유도체를 찾기 위해 R, R2, R3 및 Y 위치에서1 체계적인 화학적 대체가 이루어졌다.이를 통해 피리미딘 고리의 5개 위치(R3)에 브롬 치환을 가진 에트라비린이 발견되었다(R1 = 2,6-디메틸-4-시아노아닐리노, R2 = NH2, Y = O). (그림 5)[10]에트라비린은 얀센연구재단과 티보텍 연구진에 의해 발견됐으며 2008년 FDA의 승인을 받았다.다른 항레트로바이러스제와 [21]함께 다제내성을 가진 HIV 감염을 가진 치료 기간 만료 성인 환자에게 사용된다.
저항
세균이든 바이러스든 감염을 치료할 때 감염제에 내성이 생길 위험이 항상 있습니다.HIV 감염 치료는 특히 약물 내성에 취약하며, 이는 감염의 화학 치료 치료에서 심각한 임상적 우려 사항이다.항레트로바이러스제의 [10]존재 하에서 바이러스가 복제될 수 있다면, 약물에 내성이 있는 HIV 균열이 나타난다.
NNRTI 내성 HIV스트레인은 주로 NNIBP 내 및 그 주변에서 발생하는 돌연변이를 포켓의 다른 영역의 크기, 모양 및 극성을 변경하거나 [10]포켓에 대한 접근에 간접적으로 영향을 줌으로써 NNRTI 결합에 직접 영향을 준다.이러한 돌연변이는 주로 p66 서브유닛의 아미노산 98-108, 178-190 또는 225-238에 걸쳐 있는 도메인에서 나타난다.화학요법을 포함한 NNRTI에 실패한 환자로부터 분리된 바이러스에서 가장 빈번하게 관찰되는 돌연변이는 Lys-103N과 Tyr-181C이다.NNRTI 내성은 시험관내 [7]및 생체내 40개 이상의 아미노산 치환과 연관되어 있다.
항레트로바이러스제는 내성이 빠르게 발달하기 때문에 단발성 치료에는 사용되지 않는다.고활성 항레트로바이러스 치료법(HAART)은 [6]1996년에 도입되었다.치료법은 적어도 두 종류의 항레트로바이러스제로부터 [7]세 가지 약물을 조합한다.
다른 NNRTI에 비해 에트라비린의 발전은 약물 내성의 발달에 다중 돌연변이가 필요하다는 것이다.이 약물은 또한 일반적인 NNRTI 저항성 돌연변이와 교차 저항성 [21]돌연변이를 가진 바이러스에 대한 활성을 보였다.
현황
NNRTI 등급의 5가지 약물이 규제 당국에 의해 승인되었다.이들은 1세대 NNRTIs nevirapine, delavirdine 및 efavirenz와 차세대 NNRTIs etravirine 및 릴피비린이다.몇몇 다른 NNRTI는 임상 개발을 거쳤지만, 불리한 약물역학, 유효성 및/또는 안전성 요인으로 인해 중단되었다.현재 임상 개발 중인 NNRTI는 IDX899, RDEA-428 및 Lersivirine(표 2) 등 4가지가 있다.
릴피비린
릴피비린은 에트라비린과 같은 DATY 화합물이며 NNRTI 계열 내에서 추가 최적화가 수행되었을 때 발견되었다.내성 프로파일과 내성 발달에 대한 유전적 장벽은 체외 에트라비린과 유사하다.에트라비린에 비해 릴피비린의 장점은 에트라비린보다 생물학적 가용성이 뛰어나고 조제하기가 더 쉽다는 것이다.에트라비린은 낮은 용해성과 생물학적 [7]가용성으로 인해 광범위한 화학 제제 작업이 필요했다.릴피비린은 2011년 5월 에듀란트라는 [22]브랜드명으로 FDA에 의해 HIV 치료를 승인받았다.에듀란트는 치료 시작 [23]시 바이러스 부하가 10만 카피/mL 이하인 치료 순진한 환자에게 승인됩니다.권장 복용량은 [24]다른 항레트로바이러스제와 조합하여 매일 한 번 식사와 함께 경구 복용량 25mg이다.위 pH가 증가하여 릴피비린 혈장 농도가 감소하여 바이러스 반응 손실 및 [24]내성이 발생할 수 있으므로 양성자 펌프 억제제와 함께 사용이 금지된다.리피비린과 엠트리시타빈 및 테노포비르 디소프록실(TDF)을 결합한 고정 용량 약은 2011년 8월 미국 식품의약국에 의해 Complera라는 [25]브랜드명으로 승인되었습니다.또한 릴피비린과 엠트리시타빈 및 테노포비르 알라페나미드(TAF)를 결합한 새로운 고정 용량 약이 2016년 3월 [citation needed]Odefsey라는 브랜드로 승인되었습니다.
RDEA806
2007년 제약회사 Ardea Biosciences의 연구자들에 의해 트리아졸 NNRTIs의 새로운 제품군이 발표되었습니다.실행된 선별에서 선택된 후보는 트리아졸 계열에 속하는 RDEA806이었다.선택된 NNRTI 내성 HIV-1 변종에 대해 다른 차세대 [7]NNRTI와 유사한 내성 프로파일을 가지고 있습니다.후보자는 2009년 [26]말에 IIb 임상시험에 들어갔지만 더 이상의 시험은 시작되지 않았다.Ardea는 2012년에 [27]AstraZeneca에 매각되었습니다.
Fosdevirine(IDX899)
Fosdevirine(IDX899 및 GSK-2248761이라고도 함)은 Idenix Pharmacuticals와 ViiV Healthcare가 개발한 또 다른 차세대 NNRTI입니다.그것은 3-포스포인돌과에 속합니다.체외 연구는 다른 차세대 NNRTI와 [7]유사한 내성 프로파일을 보여주었다.2009년 11월에 후보자는 임상 2단계에 들어갔지만, Fosdevirine을 투여받은 35명의 피험자 중 5명이 지연 [28]발작을 경험하면서 시험과 모든 추가 개발이 중단되었다.
Lersivirine (UK-453061)
Lersivirine은 피라졸 계열에 속하며 제약회사 ViiV Healthcare가 개발한 또 다른 차세대 NNRTI입니다.저항 프로파일은 다른 차세대 NNRTI와 비슷합니다.2009년 말에 Lersivirine은 IIb [7]단계에 있었다.2013년 2월 ViiV Healthcare는 Lersivirine을 [29]조사하는 개발 프로그램의 중단을 발표했다.
| 약물 후보 | RDEA806 | Fosdevirine(IDX899) | Lersivirine (UK-453061) |
|---|---|---|---|
| 화학 구조 | 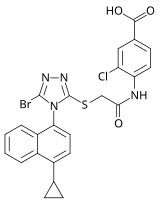 |  | 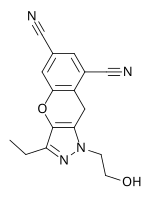 |
| 개발 단계 | IIb | II | IIb |
「 」를 참조해 주세요.
- 항레트로바이러스제
- 역전사효소억제제
- 단백질분해효소억제제
- 진입억제제
- HIV단백질억제제 발견
- CCR5 수용체 길항제 발견 및 개발
- 뉴클레오시드 및 뉴클레오티드 역전사효소 억제제 발견 및 개발
레퍼런스
- ^ a b c d e f Ivetac A, McCammon JA (May 2009). "Elucidating the inhibition mechanism of HIV-1 non-nucleoside reverse transcriptase inhibitors through multicopy molecular dynamics simulations". Journal of Molecular Biology. 388 (3): 644–58. doi:10.1016/j.jmb.2009.03.037. PMC 2744402. PMID 19324058.
- ^ a b De Clercq E (August 2005). "Antiviral drug discovery and development: where chemistry meets with biomedicine". Antiviral Research. 67 (2): 56–75. doi:10.1016/j.antiviral.2005.05.001. PMID 16046240.
- ^ a b Jochmans D (June 2008). "Novel HIV-1 reverse transcriptase inhibitors". Virus Research. 134 (1–2): 171–85. doi:10.1016/j.virusres.2008.01.003. PMID 18308412.
- ^ a b c d De Clercq E (April 2009). "Anti-HIV drugs: 25 compounds approved within 25 years after the discovery of HIV". International Journal of Antimicrobial Agents. 33 (4): 307–20. doi:10.1016/j.ijantimicag.2008.10.010. PMID 19108994.
- ^ Ren J, Bird LE, Chamberlain PP, Stewart-Jones GB, Stuart DI, Stammers DK (October 2002). "Structure of HIV-2 reverse transcriptase at 2.35-A resolution and the mechanism of resistance to non-nucleoside inhibitors". Proceedings of the National Academy of Sciences of the United States of America. 99 (22): 14410–5. Bibcode:2002PNAS...9914410R. doi:10.1073/pnas.222366699. PMC 137897. PMID 12386343.
- ^ a b c d Sosnik A, Chiappetta DA, Carcaboso AM (August 2009). "Drug delivery systems in HIV pharmacotherapy: what has been done and the challenges standing ahead". Journal of Controlled Release. 138 (1): 2–15. doi:10.1016/j.jconrel.2009.05.007. PMID 19445981.
- ^ a b c d e f g h i j k l m n o p q r de Béthune MP (January 2010). "Non-nucleoside reverse transcriptase inhibitors (NNRTIs), their discovery, development, and use in the treatment of HIV-1 infection: a review of the last 20 years (1989-2009)". Antiviral Research. 85 (1): 75–90. doi:10.1016/j.antiviral.2009.09.008. PMID 19781578.
- ^ a b c d e Basavapathruni A, Anderson KS (December 2007). "Reverse transcription of the HIV-1 pandemic". FASEB Journal. 21 (14): 3795–808. doi:10.1096/fj.07-8697rev. PMID 17639073. S2CID 24960391.
- ^ a b Prajapati DG, Ramajayam R, Yadav MR, Giridhar R (August 2009). "The search for potent, small molecule NNRTIs: A review". Bioorganic & Medicinal Chemistry. 17 (16): 5744–62. doi:10.1016/j.bmc.2009.06.060. PMID 19632850.
- ^ a b c d e f g h i j k l Das K, Lewi PJ, Hughes SH, Arnold E (June 2005). "Crystallography and the design of anti-AIDS drugs: conformational flexibility and positional adaptability are important in the design of non-nucleoside HIV-1 reverse transcriptase inhibitors". Progress in Biophysics and Molecular Biology. 88 (2): 209–31. doi:10.1016/j.pbiomolbio.2004.07.001. PMID 15572156.
- ^ Bal TR, Anand B, Yogeeswari P, Sriram D (October 2005). "Synthesis and evaluation of anti-HIV activity of isatin beta-thiosemicarbazone derivatives". Bioorganic & Medicinal Chemistry Letters. 15 (20): 4451–5. doi:10.1016/j.bmcl.2005.07.046. PMID 16115762.
- ^ Samuele A, Kataropoulou A, Viola M, Zanoli S, La Regina G, Piscitelli F, Silvestri R, Maga G (January 2009). "Non-nucleoside HIV-1 reverse transcriptase inhibitors di-halo-indolyl aryl sulfones achieve tight binding to drug-resistant mutants by targeting the enzyme-substrate complex". Antiviral Research. 81 (1): 47–55. doi:10.1016/j.antiviral.2008.09.008. PMID 18984007.
- ^ Van Gyseghem E, Pendela M, Baert L, Rosier J, Van 't Klooster G, De Man H, Bouche MP, Schueller L, Van Remoortere P, Wigerinck P, Adams E, Hoogmartens J, Van den Mooter G (November 2008). "Powder for reconstitution of the anti-HIV-1 drug TMC278 - Formulation development, stability and animal studies". European Journal of Pharmaceutics and Biopharmaceutics. 70 (3): 853–60. doi:10.1016/j.ejpb.2008.06.030. PMID 18657611.
- ^ D'Cruz OJ, Uckun FM (March 2006). "Dawn of non-nucleoside inhibitor-based anti-HIV microbicides". The Journal of Antimicrobial Chemotherapy. 57 (3): 411–23. doi:10.1093/jac/dki464. PMID 16431862.
- ^ a b Sluis-Cremer N, Tachedjian G (June 2008). "Mechanisms of inhibition of HIV replication by non-nucleoside reverse transcriptase inhibitors". Virus Research. 134 (1–2): 147–56. doi:10.1016/j.virusres.2008.01.002. PMC 2745993. PMID 18372072.
- ^ Schauer GD, Huber KD, Leuba SH, Sluis-Cremer N (October 2014). "Mechanism of allosteric inhibition of HIV-1 reverse transcriptase revealed by single-molecule and ensemble fluorescence". Nucleic Acids Research. 42 (18): 11687–96. doi:10.1093/nar/gku819. PMC 4191400. PMID 25232099.
- ^ Ludovici DW, Kukla MJ, Grous PG, Krishnan S, Andries K, de Béthune MP, Azijn H, Pauwels R, De Clercq E, Arnold E, Janssen PA (September 2001). "Evolution of anti-HIV drug candidates. Part 1: From alpha-anilinophenylacetamide (alpha-APA) to imidoyl thiourea (ITU)". Bioorganic & Medicinal Chemistry Letters. 11 (17): 2225–8. doi:10.1016/S0960-894X(01)00410-3. PMID 11527703.
- ^ Hsiou Y, Das K, Ding J, Clark AD, Kleim JP, Rösner M, Winkler I, Riess G, Hughes SH, Arnold E (November 1998). "Structures of Tyr188Leu mutant and wild-type HIV-1 reverse transcriptase complexed with the non-nucleoside inhibitor HBY 097: inhibitor flexibility is a useful design feature for reducing drug resistance". Journal of Molecular Biology. 284 (2): 313–23. doi:10.1006/jmbi.1998.2171. PMID 9813120.
- ^ Das K, Ding J, Hsiou Y, Clark AD, Moereels H, Koymans L, Andries K, Pauwels R, Janssen PA, Boyer PL, Clark P, Smith RH, Kroeger Smith MB, Michejda CJ, Hughes SH, Arnold E (December 1996). "Crystal structures of 8-Cl and 9-Cl TIBO complexed with wild-type HIV-1 RT and 8-Cl TIBO complexed with the Tyr181Cys HIV-1 RT drug-resistant mutant". Journal of Molecular Biology. 264 (5): 1085–100. doi:10.1006/jmbi.1996.0698. PMID 9000632.
- ^ Ludovici DW, Kavash RW, Kukla MJ, Ho CY, Ye H, De Corte BL, Andries K, de Béthune MP, Azijn H, Pauwels R, Moereels HE, Heeres J, Koymans LM, de Jonge MR, Van Aken KJ, Daeyaert FF, Lewi PJ, Das K, Arnold E, Janssen PA (September 2001). "Evolution of anti-HIV drug candidates. Part 2: Diaryltriazine (DATA) analogues". Bioorganic & Medicinal Chemistry Letters. 11 (17): 2229–34. doi:10.1016/S0960-894X(01)00411-5. PMID 11527704.
- ^ a b Schiller DS, Youssef-Bessler M (April 2009). "Etravirine: a second-generation nonnucleoside reverse transcriptase inhibitor (NNRTI) active against NNRTI-resistant strains of HIV". Clinical Therapeutics. 31 (4): 692–704. doi:10.1016/j.clinthera.2009.04.020. PMID 19446143.
- ^ "Approval of Edurant (rilpivirine), a new NNRTI, for the Treatment of HIV in Treatment Naive Patients" (Press release). Food and Drug Administration. May 20, 2011. Retrieved October 19, 2017.
- ^ Domingo P, Ribera E (June 2013). "[Data on rilpivirine in treatment-naïve patients. Lessons from ECHO, THRIVE and STaR]" [Data on rilpivirine in treatment-naïve patients. Lessons from ECHO, THRIVE and STaR]. Enfermedades Infecciosas y Microbiologia Clinica (in Spanish). 31 Suppl 2: 20–9. doi:10.1016/S0213-005X(13)70139-3. PMID 24252530.
- ^ a b "EDURANT (rilpivirine)" (PDF). FDA. 2011. Retrieved 9 October 2017.
- ^ "Approval of Complera: emtricitabine/rilpivirine/tenofovir DF fixed dose combination" (Press release). Food and Drug Administration. August 10, 2011. Retrieved October 19, 2017.
- ^ "Development Pipeline - HIV". Ardea Biosciences. Archived from the original on 29 April 2010. Retrieved 6 November 2009.
- ^ "AstraZeneca to acquire Ardea Biosciences for $1 billion (Net of existing cash) including lead product lesinurad in Phase III development for gout". AstraZeneca. 23 April 2012. Retrieved 28 February 2018.
- ^ Margolis DA, Eron JJ, DeJesus E, White S, Wannamaker P, Stancil B, Johnson M (2014). "Unexpected finding of delayed-onset seizures in HIV-positive, treatment-experienced subjects in the Phase IIb evaluation of fosdevirine (GSK2248761)". Antiviral Therapy. 19 (1): 69–78. doi:10.3851/IMP2689. PMID 24158593. S2CID 6147197.
- ^ Highleyman, Liz (6 February 2013). "ViiV Announces Halt to Lersivirine Development". HIVandHepatitis. Retrieved 28 March 2013.