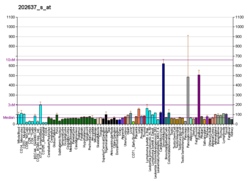
ICAM-1
ICAM-1CD54로도 알려진 ICAM-1(세포간 접착 분자 1)은 ICAM1 [5][6]유전자에 의해 인간에게 암호화되는 단백질이다.이 유전자는 전형적으로 내피세포와 면역체계의 세포에서 발현되는 세포 표면 당단백질을 암호화한다.CD11a/CD18형 인테그린 또는 CD11b/CD18형 인테그린에 결합하고 호흡상피 [7]진입 수용체로서 라이노바이러스에 의해 이용된다.
구조.
ICAM-1은 항체와 T세포 수용체를 포함한 단백질의 슈퍼 패밀리인 면역글로불린 슈퍼 패밀리의 구성원이다.ICAM-1은 아미노 말단 세포외 도메인, 단일 막간 도메인 및 카르복시 말단 세포질 도메인을 가진 막간 단백질이다.ICAM-1의 구조는 무거운 글리코실화를 특징으로 하며, 단백질의 세포외 도메인은 단백질 내의 이황화물 브릿지에 의해 생성된 다중 루프로 구성되어 있다.단백질의 지배적인 2차 구조는 베타 시트이며, 연구자들이 [8]ICAM-1 내에 이합체화 도메인의 존재를 가설을 세우도록 이끈다.
기능.
이 유전자에 의해 코드된 단백질은 백혈구와 내피세포의 막에 저농도로 지속적으로 존재하는 세포간 접착 분자의 일종이다.사이토카인을 자극하면 농도가 크게 높아진다.ICAM-1은 인터류킨-1(IL-1) 및 종양괴사인자(TNF)에 의해 유도될 수 있으며 혈관내피, 대식세포 및 림프구에 의해 발현된다.ICAM-1은 백혈구에서 [9]발견되는 수용체인 LFA-1(integrin)의 리간드이다.백혈구는 활성화되면 ICAM-1/LFA-1을 통해 내피세포에 결합하고 [10]조직으로 전환된다.LFA-1은 또한 [12]ICAM-1을 결합하고 차단하는 것으로 보이는 수용성 [11]형태로 발견되었다.
셀 시그널링에서의 역할
ICAM-1은 세포-세포 상호작용을 안정화하고 백혈구 내피 전환을 촉진하는 데 중요한 것으로 오랫동안 알려진 내피 및 백혈구 관련 트랜스멤브란 단백질이다.최근 ICAM-1은 인간 라이노 [13]바이러스의 세포 진입 부위로 특징지어지고 있다.면역 반응과의 이러한 연관성 때문에 ICAM-1이 신호 전달에서 기능할 수 있다는 가설을 세워왔다.ICAM-1 결합은 키나아제 p56lyn을 포함한 다수의 키나아제를 포함한 캐스케이드를 통해 신호를 전달함으로써 염증성 백혈구 획득과 같은 염증 예방 효과를 일으킨다.
기타 기능
ICAM-1과 가용성 ICAM-1은 혈액 고환 장벽을 형성하는 밀착 접합부에 길항제 효과가 있어 정자 [14]형성에 중요한 역할을 한다.
ICAM-1의 무거운 글리코실화와 다른 구조적 특성은 수많은 리간드에 단백질 결합 부위를 제공한다.ICAM-1은 다수의 면역관련 리간드에 대한 결합부위를 가진다.특히 ICAM-1은 대식세포 접착 리간드-1(Mac-1; ITGB2/ITGAM), 백혈구 기능 관련 항원-1(LFA-1) 및 피브리노겐에 결합한다.이들 3가지 단백질은 일반적으로 내피세포와 백혈구에서 발현되며 혈관 내피에서 백혈구의 전이를 촉진하기 위해 ICAM-1에 결합한다.이들 결합특성의 결과 ICAM-1은 고전적으로 세포간 접착기능을 부여받았다.
연구진은 ICAM-1이 인간 라이노바이러스(HRV)의 주요 그룹이 다양한 세포 [8]유형으로 진입하는 결합 부위의 역할을 한다는 것을 발견하고 ICAM-1의 단순한 접착 분자로서의 역할에 의문을 제기하기 시작했다.ICAM-1은 또한 플라스모듐 팔시파룸 감염 적혈구(PFIE)에 대한 친화력으로 알려져 감염 질환에서 ICAM-1에 더 많은 역할을 제공했다.
세포 접착, 외부 침투 및 감염에 대한 ICAM-1의 역할이 더욱 완전히 이해됨에 따라 신호 전달에서 ICAM-1의 잠재적 역할이 가정되었다.최근 ICAM-1과 관련된 대부분의 연구는 관련 질문뿐만 아니라 이 중심 질문에 초점을 맞추고 있다.연구자들은 ICAM-1 신호 변환이 발생하는 것으로 판명되면 해당 신호의 메커니즘, 신호가 발생하는 조건과 환경, 관련된 신호 캐스케이드의 생물학적 종말점을 식별할 필요가 있다고 판단했다.ICAM-1은 유착 및 바이러스 유입 분자로서 고전적으로 기술된 기능을 넘어 신호 전달에서 역할을 하는 것으로 확실히 특징지어졌습니다.또한 ICAM-1의 신호전달 기능은 주로 염증 경로와 관련된 것으로 보인다.특히 ICAM-1 시그널링은 대식세포나 과립구 [15]등의 염증성 면역세포의 신병을 생성하는 것으로 보인다.
ICAM-1은 또한 양성 피드백 루프에 참여하여 백혈구 내피 전이를 촉진하는 염증 환경을 유지하기 위해 ICAM-2와 경쟁할 수 있다.발현 mRNA와 단백질 수준 모두에서 ICAM-1 결찰은 양피드백 루프에서 ICAM-1 자신의 발현을 상향 조절하는 것으로 확인되었다.또한 RANTES mRNA와 단백질의 발현도 ICAM-1 결찰에 의해 상향 조절되는 것으로 확인되었다.RANTES 또는 Regulated on Activation Normal T-cell Expressed and Secredented는 과립구 및 [16]대식세포와 같은 다양한 염증성 면역 세포에 대한 염증 매개 화학 물질인 사이토카인이다.그러나 ICAM-1의 시그널링을 완전히 특징짓기 위해서는 아직 많은 연구가 필요하다. ICAM-1과 ICAM-2 시그널링 환경의 관계는 단순한 상관관계를 넘어 확립되지 않았다. ICAM 시그널링을 생체 내 염증 환경의 실제 변조에 연결하는 연구는 아직 수행되지 않았다.시그널링 캐스케이드의 망상성 때문에 p56lyn, Raf-1 및 MAPK를 포함한 다양한 키나제를 통한 ICAM-1 매개 시그널링의 다운스트림 이펙터가 거의 알려져 있지 않을 필요가 있습니다.이들 시그널링 분자 간의 크로스톡에 대한 보다 철저한 연구는 ICAM-1 결찰과 신호 전달에 의해 생성된 생물학적 종말점을 더욱 밝힐 수 있다.
임상적 의의
ICAM-1은 지주막하출혈(SAH)에 관여하고 있다.ICAM-1의 수치는 많은 [17][18]연구에서 대조군 피험자에 비해 SAH 환자에서 유의하게 높은 것으로 나타났다.ICAM-1은 SAH 환자의 70%에 영향을 미치는 2차 증상인 뇌혈관 경련과 직접적인 상관관계가 있는 것으로 보여지지 않았지만, 항ICAM-1을 통한 치료는 혈관 경련의 심각성을 감소시켰다.
호흡기 상피세포에 의해 발현되는 ICAM-1은 또한 가장 흔한 감기의 원인 물질인 라이노바이러스의 결합 부위이다.
ICAM-1은 I형 과민반응을 촉진하는 항염증성 림프구 및 비만세포를 모집하는 눈 알레르기에 중요한 역할을 한다.
ICAM-1은 용혈성 바이러스인 Coxsackievirus A21의 1차 진입 수용체이다(브랜드명 Cavatak, Viralytics가 [19]개발).
칸나비노이드 CB2 수용체 작용제는 다양한 염증 [20]매개체에 피폭된 인간의 뇌 조직 및 일차 뇌내피세포(BMVEC)에서 ICAM-1 및 VCAM-1 표면 발현 유도를 감소시키는 것으로 밝혀졌다.
상호 작용
ICAM-1은 CD11a,[21][22][23] EZR[24] 및 [21][25][26]CD18과 상호작용하는 것으로 나타났습니다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG000090339 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000037405 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Carlson M, Nakamura Y, Payson R, O'Connell P, Leppert M, Lathrop GM, Lalouel JM, White R (May 1988). "Isolation and mapping of a polymorphic DNA sequence (pMCT108.2) on chromosome 18 [D18S24]". Nucleic Acids Research. 16 (9): 4188. doi:10.1093/nar/16.9.4188. PMC 336612. PMID 2453850.
- ^ Katz FE, Parkar M, Stanley K, Murray LJ, Clark EA, Greaves MF (Jan 1985). "Chromosome mapping of cell membrane antigens expressed on activated B cells". European Journal of Immunology. 15 (1): 103–06. doi:10.1002/eji.1830150121. PMID 3871395. S2CID 6571761.
- ^ "Entrez Gene: intercellular adhesion molecule 1".
- ^ a b Bella J, Kolatkar PR, Marlor CW, Greve JM, Rossmann MG (Apr 1998). "The structure of the two amino-terminal domains of human ICAM-1 suggests how it functions as a rhinovirus receptor and as an LFA-1 integrin ligand". Proceedings of the National Academy of Sciences. 95 (8): 4140–45. Bibcode:1998PNAS...95.4140B. doi:10.1073/pnas.95.8.4140. PMC 22455. PMID 9539703.
- ^ Rothlein R, Dustin ML, Marlin SD, Springer TA (August 1986). "A human intercellular adhesion molecule (ICAM-1) distinct from LFA-1". Journal of Immunology. 137 (4): 1270–4. PMID 3525675.
- ^ Yang L, Froio RM, Sciuto TE, Dvorak AM, Alon R, Luscinskas FW (July 2005). "ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alpha-activated vascular endothelium under flow". Blood. 106 (2): 584–92. doi:10.1182/blood-2004-12-4942. PMC 1635241. PMID 15811956.
- ^ Gjelstrup LC, Boesen T, Kragstrup TW, Jørgensen A, Klein NJ, Thiel S, Deleuran BW, Vorup-Jensen T (October 2010). "Shedding of large functionally active CD11/CD18 Integrin complexes from leukocyte membranes during synovial inflammation distinguishes three types of arthritis through differential epitope exposure". Journal of Immunology. 185 (7): 4154–68. doi:10.4049/jimmunol.1000952. PMID 20826754.
- ^ Kragstrup TW, Jalilian B, Hvid M, Kjærgaard A, Østgård R, Schiøttz-Christensen B, Jurik AG, Robinson WH, Vorup-Jensen T, Deleuran B (February 2014). "Decreased plasma levels of soluble CD18 link leukocyte infiltration with disease activity in spondyloarthritis". Arthritis Research & Therapy. 16 (1): R42. doi:10.1186/ar4471. PMC 3978678. PMID 24490631.
- ^ Abraham G, Colonno RJ (Aug 1984). "Many rhinovirus serotypes share the same cellular receptor". Journal of Virology. 51 (2): 340–45. doi:10.1128/JVI.51.2.340-345.1984. PMC 254443. PMID 6086949.
- ^ Xiao X, Mruk DD, Cheng CY (2013). "Intercellular adhesion molecules (ICAMs) and spermatogenesis". Human Reproduction Update. 19 (2): 167–86. doi:10.1093/humupd/dms049. PMC 3576004. PMID 23287428.
- ^ Etienne-Manneville S, Chaverot N, Strosberg AD, Couraud PO (Jul 1999). "ICAM-1-coupled signaling pathways in astrocytes converge to cyclic AMP response element-binding protein phosphorylation and TNF-alpha secretion". Journal of Immunology. 163 (2): 668–74. PMID 10395656.
- ^ Blaber R, Stylianou E, Clayton A, Steadman R (Jan 2003). "Selective regulation of ICAM-1 and RANTES gene expression after ICAM-1 ligation on human renal fibroblasts". Journal of the American Society of Nephrology. 14 (1): 116–27. doi:10.1097/01.ASN.0000040595.35207.62. PMID 12506144.
- ^ Polin RS, Bavbek M, Shaffrey ME, Billups K, Bogaev CA, Kassell NF, Lee KS (Oct 1998). "Detection of soluble E-selectin, ICAM-1, VCAM-1, and L-selectin in the cerebrospinal fluid of patients after subarachnoid hemorrhage". Journal of Neurosurgery. 89 (4): 559–67. doi:10.3171/jns.1998.89.4.0559. PMID 9761049.
- ^ Frijns CJ, Kappelle LJ (Aug 2002). "Inflammatory cell adhesion molecules in ischemic cerebrovascular disease". Stroke: A Journal of Cerebral Circulation. 33 (8): 2115–22. doi:10.1161/01.STR.0000021902.33129.69. PMID 12154274.
- ^ Annels NE, Mansfield D, Arif M, Ballesteros-Merino C, Simpson GR, Denyer M, et al. (July 2019). "Viral targeting of non-muscle invasive bladder cancer and priming of anti-tumour immunity following intravesical Coxsackievirus A21" (PDF). Clinical Cancer Research. 25 (19): 5818–5831. doi:10.1158/1078-0432.CCR-18-4022. PMID 31273010. S2CID 208598278.
- ^ Ramirez SH, Haskó J, Skuba A, Fan S, Dykstra H, McCormick R, Reichenbach N, Krizbai I, Mahadevan A, Zhang M, Tuma R, Son YJ, Persidsky Y (March 2012). "Activation of cannabinoid receptor 2 attenuates leukocyte-endothelial cell interactions and blood-brain barrier dysfunction under inflammatory conditions". The Journal of Neuroscience. 32 (12): 4004–16. doi:10.1523/JNEUROSCI.4628-11.2012. PMC 3325902. PMID 22442067.
- ^ a b Lu C, Takagi J, Springer TA (May 2001). "Association of the membrane proximal regions of the alpha and beta subunit cytoplasmic domains constrains an integrin in the inactive state". The Journal of Biological Chemistry. 276 (18): 14642–48. doi:10.1074/jbc.M100600200. PMID 11279101.
- ^ Shimaoka M, Xiao T, Liu JH, Yang Y, Dong Y, Jun CD, McCormack A, Zhang R, Joachimiak A, Takagi J, Wang JH, Springer TA (Jan 2003). "Structures of the alpha L I domain and its complex with ICAM-1 reveal a shape-shifting pathway for integrin regulation". Cell. 112 (1): 99–111. doi:10.1016/S0092-8674(02)01257-6. PMC 4372089. PMID 12526797.
- ^ Yusuf-Makagiansar H, Makagiansar IT, Hu Y, Siahaan TJ (Dec 2001). "Synergistic inhibitory activity of alpha- and beta-LFA-1 peptides on LFA-1/ICAM-1 interaction". Peptides. 22 (12): 1955–62. doi:10.1016/S0196-9781(01)00546-0. PMID 11786177. S2CID 54343441.
- ^ Heiska L, Alfthan K, Grönholm M, Vilja P, Vaheri A, Carpén O (Aug 1998). "Association of ezrin with intercellular adhesion molecule-1 and -2 (ICAM-1 and ICAM-2). Regulation by phosphatidylinositol 4, 5-bisphosphate". The Journal of Biological Chemistry. 273 (34): 21893–900. doi:10.1074/jbc.273.34.21893. PMID 9705328.
- ^ Kotovuori A, Pessa-Morikawa T, Kotovuori P, Nortamo P, Gahmberg CG (Jun 1999). "ICAM-2 and a peptide from its binding domain are efficient activators of leukocyte adhesion and integrin affinity". Journal of Immunology. 162 (11): 6613–20. PMID 10352278.
- ^ Huang C, Springer TA (Aug 1995). "A binding interface on the I domain of lymphocyte function-associated antigen-1 (LFA-1) required for specific interaction with intercellular adhesion molecule 1 (ICAM-1)". The Journal of Biological Chemistry. 270 (32): 19008–16. doi:10.1074/jbc.270.32.19008. PMID 7642561.
추가 정보
- Wahl SM, et al. (Sep 2000). "Permissive factors for HIV-1 infection of macrophages". Journal of Leukocyte Biology. 68 (3): 303–10. PMID 10985244.
- Yonekawa K, Harlan JM (Feb 2005). "Targeting leukocyte integrins in human diseases". Journal of Leukocyte Biology. 77 (2): 129–40. doi:10.1189/jlb.0804460. PMID 15548573. S2CID 44606865.
- Chakravorty SJ, Craig A (Jan 2005). "The role of ICAM-1 in Plasmodium falciparum cytoadherence". European Journal of Cell Biology. 84 (1): 15–27. doi:10.1016/j.ejcb.2004.09.002. PMID 15724813.
- Lebedeva T, Dustin ML, Sykulev Y (Jun 2005). "ICAM-1 co-stimulates target cells to facilitate antigen presentation". Current Opinion in Immunology. 17 (3): 251–58. doi:10.1016/j.coi.2005.04.008. PMID 15886114.
- Yang L, Froio RM, Sciuto TE, Dvorak AM, Alon R, Luscinskas FW (Jul 2005). "ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alpha-activated vascular endothelium under flow". Blood. 106 (2): 584–92. doi:10.1182/blood-2004-12-4942. PMC 1635241. PMID 15811956.