딜스-알더 반응
Diels–Alder reaction
| 딜스-알더 반응 | |
|---|---|
| 반응형 | 사이클로딩 |
| 식별자 | |
| 유기화학 포털 | 딜알더 reaction |
| RSC 온톨로지 ID | RXNO:0000006 |
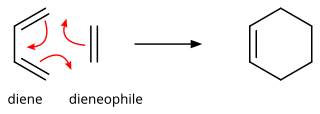
유기화학에서 디엘스-알더 반응(Diels-Alder reaction)은 치환된 시클로헥센 유도체를 형성하기 위해 결합된 디엔과 치환된 알켄 사이의 화학 반응입니다. 그것은 일치된 메커니즘을 가진 주변 고리 반응의 전형적인 예입니다. 보다 구체적으로 우드워드-호프만 기호[π4s+2s]를 갖는 열적으로 허용되는 [4+2] 사이클로드 에디션으로 분류됩니다. 1928년 오토 딜스(Otto Diels)와 쿠르트 올더(Kurt Alder)에 의해 처음 기술되었습니다. 이 반응의 발견으로 그들은 1950년에 노벨 화학상을 수상했습니다. 두 개의 새로운 탄소-탄소 결합을 동시에 구성함으로써 Diels-Alder 반응은 영역 및 입체화학적 결과를 잘 제어하여 6원 고리를 형성할 수 있는 신뢰할 수 있는 방법을 제공합니다.[1][2] 결과적으로 천연물과 신소재 합성에 화학적 복잡성을 도입하기 위한 강력하고 광범위하게 적용되는 도구 역할을 했습니다.[3][4] 기본 개념은 해당 헤테로 고리를 제공하는 카보닐 및 이민과 같은 헤테로 원자를 포함하는 π 시스템에도 적용되었으며, 이 변형은 헤테로-딜스-알더 반응으로 알려져 있습니다. 이 반응은 다른 링 크기에도 일반화되었지만 이러한 일반화 중 어느 것도 범위나 범용성 측면에서 6원 링의 형성과 일치하지 않았습니다. 일반적인 Diels-Alder 반응에 대해 δH° 및 δS°의 음의 값 때문에, Diels-Alder 반응의 미세한 역방향은 고온에서 유리해지지만, 이것은 제한된 범위의 Diels-Alder 부가물에 대해서만 합성적으로 중요합니다. 일반적으로 몇 가지 특별한 구조적 특징을 가지고 있으며, 이 역반응을 레트로-딜스-알더 반응이라고 합니다.[5]
메카니즘
그 반응은 일치된 주변 고리 반응의 한 예입니다.[6] 이는 반응 과정에서 생성되는 중간체가 [7]없는 단일 순환 전이 상태를 통해 발생하는 것으로 여겨집니다. 이와 같이, 디엘스-알더 반응은 궤도 대칭성 고려 사항에 의해 지배되며, 이는 [4 + 2] 사이클로딩으로 분류되며, 이는 4 π 전자 시스템(디엔 구조)과 2 π 전자 시스템(디엔 구조)의 표면/표면 상호 작용을 통해 진행됨을 나타냅니다. 추가적인 궤도 대칭에 의해 부과된 에너지 장벽 없이 전이 상태로 이어지고, 딜스-알더 반응이 상대적으로 쉽게 일어날 수 있도록 하는 상호작용.[8]
반응물의 프런티어 분자궤도(FMO)를 살펴보면 왜 그런지 알 수 있습니다. (궤도 상관도나 드워-짐머만 분석에서도 같은 결론을 얻을 수 있습니다.) 더 일반적인 "정상적인" 전자 수요 딜스-알더 반응의 경우, 두 가지 HOMO/LUMO 상호 작용 중 더 중요한 것은 전자가 풍부한 디엔의 ψ가 가장 높은 점유 분자 궤도(HOMO)로서 전자가 부족한 디엔오필의 π*가 가장 낮은 점유 분자 궤도(LUMO)로서 전자 사이에 있다는 것입니다. 그러나 HOMO-LUMO 에너지 갭은 두 구성 요소에 대한 치환기의 전자 효과를 전환함으로써 역할을 역전시킬 수 있을 정도로 충분히 가깝습니다. 역(역) 전자 수요 딜스-알더 반응에서, 디엔의 전자 withdraw 치환기는 빈 ψ 궤도의 에너지를 낮추고 디엔필의 전자 donating 치환기는 채워진 π 궤도의 에너지를 충분히 높여 이 두 궤도 사이의 상호 작용이 에너지적으로 중요한 안정화 궤도 상호 작용이 됩니다. 아래 그림에서 볼 수 있는 바와 같이 구성 요소의 HOMO와 LUMO는 상(phase)이며 결합 상호 작용이 발생합니다. 반응물이 바닥 상태에 있기 때문에 반응은 열적으로 시작되며 빛에 의한 활성화를 필요로 하지 않습니다.[8]

대부분의 Diels-Alder 반응은 일치된 메커니즘을 통해 진행된다는 것이 " 우세한 의견"[9][10][11][12]이지만, 이 문제는 철저히 논쟁되었습니다. 대부분의 Diels-Alder 반응은 입체특이적인 두 성분의 합성을 나타냄에도 불구하고, 방사형 중간체는 관찰된 입체특이성이 입체화학의 반전을 허용하기 위해 회전할 수 있는 것보다 더 빨리 생성물로 붕괴되는 중간체를 포함하는 2단계 추가를 배제하지 않는다는 근거로 가정[7](계산적 증거로 뒷받침)되었습니다.
특정 Diels-Alder 반응이 디메틸포름아미드 및 에틸렌 글리콜과 같은 극성 유기 용매에서 [13]수행되고 심지어 물에서도 수행될 때 현저한 속도 향상이 있습니다.[14] 예를 들어, 사이클로펜타디엔과 부테논의 반응은 용매인 2,2,4-트리메틸펜탄에 비해 물에서 700배 더 빠릅니다.[14] 소수성 패킹으로[15] 인한 유효 농도의 증가 또는 전이 상태의 수소 결합 안정화와 같은 이 효과에 대한 여러 가지 설명이 제안되었습니다.[16]
디엔 및 디엔노필 성분의 기하학적 구조는 각각 제품의 입체 화학적 세부 사항으로 전파됩니다. 특히 분자 간 반응의 경우, 서로 비교되는 두 성분의 치환기의 바람직한 위치 및 입체화학적 관계는 전자 효과에 의해 제어됩니다. 그러나 분자 내 Diels-Alder 사이클로딩 반응의 경우 전이 상태 구조의 형태적 안정성이 압도적인 영향을 미칠 수 있습니다.
지역 선택성
프론티어 분자 궤도 이론은 또한 치환된 시스템의 Diels-Alder 반응에서 관찰되는 영역 선택성 패턴을 설명하는 데 사용되었습니다. 아래와 같이, 구성요소들의 프론티어 궤도들의[17] 에너지 및 궤도 계수들의 계산은 대체물들의 공명 효과들에 대한 보다 단순한 분석과 잘 부합하는 그림을 제공합니다.

일반적으로 정상 및 역 전자 수요 Diels-Alder 반응 모두에서 발견되는 영역 선택성은 치환된 영역의 오르토 및 파라 위치와 유사한 위치에 시클로헥센 생성물이 치환되어 있기 때문에 오르토-파라 규칙을 따릅니다. 예를 들어, 정상 수요 시나리오에서, C1에 전자 공여 그룹(EDG)을 갖는 디엔은 C4에서 가장 큰 HOMO 계수를 갖는 반면, C1에 전자 인출 그룹(EWG)을 갖는 디엔호필은 C2에서 가장 큰 LUMO 계수를 갖습니다. 이 두 계수를 쌍으로 구성하면 아래 그림의 사례 1에서 볼 수 있는 "정형" 곱이 나옵니다. 아래의 사례 2와 같이 C2에서 치환된 디엔은 C1에서 HOMO 계수가 가장 크므로 "para" 생성물이 생성됩니다. 해당 역수요 시나리오에 대한 유사한 분석은 사례 3과 사례 4에서 볼 수 있듯이 유사한 제품을 생성합니다. 위의 표준 메조머 형태를 조사하면 이러한 결과가 전자 밀도와 편광에 대한 고려를 기반으로 한 기대와 일치하는지 쉽게 확인할 수 있습니다.

일반적으로, 에너지적으로 가장 잘 일치하는 HOMO-LUMO 쌍과 관련하여, 가장 큰 프론티어 궤도 계수를 갖는 중심 사이에 결합을 형성함으로써 상호 작용 에너지를 최대화하면 주어진 디엔-디에노필 조합에서 비롯될 주요 영역 이성질체를 예측할 수 있습니다.[8] 보다 정교한 치료법에서는 3가지 유형의 치환기(Z 인출: HOMO 및 LUMO 저하(CF3, NO2, CN, C(O)CH3)), X 기증: HOMO 및 LUMO 상승(Me, OMe, NMe2), C 접합: HOMO 상승 및 LUMO 하강(Ph, 비닐)이 고려되어 총 18가지 가능한 조합이 생성됩니다. 궤도 상호작용의 극대화는 실험 데이터를 사용할 수 있는 모든 경우에 제품을 정확하게 예측합니다. 예를 들어, 디엔과 디엔오필 모두에 X 그룹을 포함하는 흔치 않은 조합에서 1,3-치환 패턴이 선호될 수 있으며, 결과는 단순한 공명 구조 인수에 의해 설명되지 않습니다.[18] 그러나 공명 논법과 가장 큰 궤도 계수의 일치가 일치하지 않는 경우는 드물다.
입체특이성 및 입체선택성
Diels-Alder 반응은 일치된 순환 조건으로서 입체 특이적입니다. 각 구성 요소에 대한 합성으로 디엔 및 디엔호필의 입체 화학 정보가 제품에 유지됩니다. 예를 들어, 디에노필의 이중 결합에 대한 시스(trans, resp.) 관계에 있는 치환기는 사이클로헥센 고리에 대해 동일한 탄소에 대한 시스(trans, resp.)인 치환기를 생성합니다. 마찬가지로, 시스, 시스 및 트랜스, 트랜스-치환된 디엔은 생성물의 이러한 탄소에서 시스 치환기를 제공하는 반면, 시스, 트랜스-치환된 디엔은 트랜스 치환기를 제공합니다.[19][20]


새로 형성된 단일 결합의 두 끝에 인접한 입체 중심이 생성되는 딜스-알더 반응은 두 가지 가능한 입체 화학적 결과를 의미합니다. 이것은 분리된 두 구성 요소가 서로 반응할 때 상대적인 방향에 기반한 입체 선택적 상황입니다. Diels-Alder 반응의 맥락에서, 디엔오필 상의 가장 중요한 치환기(전자 인출 및/또는 결합기)가 디엔 π 시스템을 향하고 반응이 진행됨에 따라 그 아래로 미끄러지는 전이 상태는 엔도 전이 상태로 알려져 있습니다. 대안적인 exo 전이 상태에서는 그것으로부터 멀어집니다. (입체화학적 명명법에는 endo와 exo라는 용어가 더 일반적으로 사용됩니다.)
디에노필이 단일 전자 인출/결합 치환기 또는 2개의 전자 인출/결합 치환기가 서로 시스인 경우, 종종 결과를 예측할 수 있습니다. 이러한 "정상적인 수요" Diels-Alder 시나리오에서는 일반적으로 더 심각한 혼잡에도 불구하고 엔도 전환 상태가 선호됩니다. 이 선호도는 Alderendo 규칙으로 알려져 있습니다. Alder가 원래 밝힌 바와 같이, 선호되는 전이 상태는 "이중 결합의 최대 축적"을 갖는 상태입니다. 일반적으로 말레산 무수물 및 벤조퀴논과 같은 단단한 디에노필류의 경우 엔도 선택성이 더 높습니다. 아크릴레이트 및 크로토네이트와 같은 다른 것의 경우 선택성이 그다지 뚜렷하지 않습니다.[21]

이 효과의 기원에 대한 가장 널리 받아들여지는 설명은 디엔오필의 π 시스템과 디엔 사이의 유리한 상호 작용이며, 2차 궤도 효과로 설명되는 상호 작용이지만, 쌍극자와 반데르발스 인력도 역할을 할 수 있으며 용매는 때때로 선택성에 상당한 차이를 만들 수 있습니다. 2차 궤도 중첩 설명은 우드워드와 호프만이 처음 제안했습니다.[24] 이 설명에서 디엔노필 이중 결합과 결합된 그룹과 관련된 오비탈은 디엔의 내부 오비탈과 겹치는데, 이는 엔도 전이 상태에서만 가능한 상황입니다. 원래의 설명은 원자 α의 궤도를 디에노필 이중 결합에 적용했을 뿐이지만, Salem과 Houk는 분자 기하학이 허용할 때 α와 β 탄소의 궤도가 모두 참여한다고 나중에 제안했습니다.[25]

종종, 고도로 치환된 디엔, 매우 부피가 큰 디엔노필, 또는 가역적인 반응(푸란 아스디엔의 경우와 같이)과 마찬가지로 입체 효과는 엑소 이성질체에 유리하도록 정상적인 내인성 선택성을 무시할 수 있습니다.
디엔
Diels-Alder 반응의 디엔 성분은 개방 사슬 또는 고리형일 수 있으며 다양한 유형의 치환기를 수용할 수 있습니다.[6] 그러나 반응에 참여할 수 있는 유일한 컨포머이기 때문에 s-cis 형태로 존재할 수 있어야 합니다. 부타디엔은 일반적으로 s-trans 형태에서 더 안정적이지만 대부분의 경우 에너지 차이가 작습니다(~2–5 kcal/mol).[26]
부피가 큰 치환기가 C2 또는 C3 위치에 있으면 s-트랜스 구조를 불안정하게 하고 디엔을 반응성 s-시스 구조로 강제함으로써 반응 속도를 높일 수 있습니다. 예를 들어 2-tert-부틸-부타-1,3-디엔은 단순 부타디엔보다 반응성이 27배 높습니다.[6][27] 반대로, C2와 C3 모두에 부피가 큰 치환기를 갖는 디엔은 치환기 사이의 입체 상호작용이 s-cis 형태를 불안정하게 만들기 때문에 반응성이 적습니다.[27]
부피가 큰 말단 치환체(C1 및 C4)를 갖는 디엔은 아마도 디엔과 디엔호필의 접근을 방해함으로써 반응 속도를 감소시킵니다.[28]
특히 반응성이 있는 디엔은 1-메톡시-3-트리메틸실록시-부타-1,3-디엔이며, 그 외에는 다니셰프스키의 디엔으로 알려져 있습니다.[29] 에놀실릴 에테르의 탈보호 후 1-메톡시 치환기의 제거에 의해 α,β-불포화 사이클로헥세논 시스템을 제공하는 수단으로서 특별한 합성적 유용성을 갖습니다. 다니셰프스키 디엔의 다른 합성적으로 유용한 유도체로는 1,3-알콕시-1-트리메틸실록시-1,3-부타디엔(Brassard dien)[30]과 1-디알킬아미노-3-트리메틸실록시-1,3-부타디엔(Rawal dien)이 있습니다.[31] 이들 및 유사한 디엔의 반응성 증가는 C1 및 C3에서 공여체 그룹의 상승적 기여의 결과이며, HOMO를 유사한 단일 치환 디엔의 반응성보다 훨씬 더 높입니다.[3]

불안정한(따라서 반응성이 높은) 디엔은 합성적으로 유용할 수 있습니다. 예를 들어 o-퀴노디메탄은 제자리에서 생성될 수 있습니다. 대조적으로, 나프탈렌과 같은 안정한 디엔은 강제 조건 및/또는 N-페닐말레이미드와 같은 고반응성 디엔오필을 필요로 합니다. 안트라센은 중심 고리에서 덜 방향족(따라서 Diels-Alder 합성에 더 반응성이 있음)을 나타내며, 80°C에서는 말레산 무수물과, 250°C에서는 약한 디엔오필러인 아세틸렌과 함께 9,10개의 부가물을 형성할 수 있습니다.[32]
디엔오필러
일반적인 수요 Diels-Alder 반응에서 디에노필은 알켄과 결합하여 전자 인출기를 가지며, 역수요 시나리오에서 디에노필은 전자 공여기와 결합됩니다.[9] "마스크된 기능"을 포함하도록 다이노파일을 선택할 수 있습니다. 디에노필은 제품 분자에 그러한 기능성을 도입하는 디엔과 함께 Diels-Alder 반응을 거칩니다. 그런 다음 기능을 바람직한 그룹으로 변환하기 위해 일련의 반응이 뒤따릅니다. 동등한 디엔오필은 반응이 없거나 접근이 불가능하기 때문에 최종 제품은 한 번의 DA 단계로 만들 수 없습니다. 그러한 방법의 예로는 α-클로로아크릴로니트릴(CH=CClCN)을 사용하는 것이 있습니다. 디엔과 반응하면 이 디엔오필은 α-클로로니트릴 기능성을 생성물 분자에 도입합니다. 이것은 "가면을 쓴 기능성"으로 가수분해하여 케톤을 형성할 수 있습니다. α-Chloroacrylonitrile dienophile은 케텐 dienophile(CH=C=O)과 동등하며, 한 번의 DA 단계에서 동일한 제품을 생성합니다. 문제는 케텐 자체가 원하지 않는 방식으로 디엔과 반응하기 때문에 ([2+2] 사이클로딩에 의해) 디엔과 반응하기 때문에 디엔-알더 반응에 사용될 수 없으며, 따라서 "마스크된 기능성" 접근법을 사용해야 한다는 것입니다.[33] 다른 이러한 기능성은 포스포늄 치환기(Witig 반응 후 엑소사이클릭 이중 결합 생성), 다양한 설폭사이드 및 설포닐 기능성(둘 다 아세틸렌 당량) 및 니트로기(ketene 당량)입니다.[6]
고전적 딜스-알더 반응의 변형
헤테로-딜스-알더
적어도 하나의 헤테로 원자를 포함하는 딜스-알더 반응도 알려져 있으며, 이를 헤테로-딜스-알더 반응이라고 통칭합니다.[34] 예를 들어, 카르보닐기는 디엔과 성공적으로 반응하여 옥소-딜스-알더 반응으로 알려진 반응인 디히드로피란 고리를 생성할 수 있으며, 이민은 디엔 친유성체 또는 디엔의 다양한 위치에서 사용되어 아자-딜스-알더 반응을 통해 다양한 N-헤테로고리 화합물을 형성할 수 있습니다. 니트로소 화합물(R-N=O)은 디엔과 반응하여 옥사진을 형성할 수 있습니다. 클로로술포닐 이소시아네이트는 디에노필로 사용하여 빈스락탐을 제조할 수 있습니다.[6][35]
루이스 산 활성화
염화아연, 삼불화붕소, 사염화주석 또는 염화알루미늄과 같은 루이스산은 다이노필에 결합하여 Diels-Alder 반응을 촉진할 수 있습니다. 전통적으로, 향상된 Diels-Alder 반응성은 루이스 산이 활성화된 다이노필의 LUMO를 낮추는 능력에 기인하며, 이는 정상적인 전자 요구량 HOMO-LUMO 궤도 에너지 갭을 더 작게 만들어 궤도 상호 작용을 더 안정화시킵니다.[36][37][38]
그러나 최근 연구에 따르면 Lewis acid-catalytic Diels-Alder 반응 뒤에 있는 이러한 근거는 부정확한 것으로 나타났습니다.[39][40][41][42] 루이스 산은 상호 작용하는 디엔과 디엔노필 사이의 불안정한 입체 파울리 반발력을 감소시켜 디엔노필의 LUMO 에너지를 낮추고 결과적으로 정상적인 전자 요구 궤도 상호 작용을 향상시킴으로써 디엔-알더 반응을 가속화시키는 것으로 밝혀졌습니다. 루이스 산은 디에노필에 대한 공여체-수용체 상호작용을 통해 결합하고 메커니즘을 통해 디에노필의 반응성 C=C 이중 결합에서 루이스 산을 향해 점유된 궤도 밀도를 분극화합니다. 디에노필의 C=C 이중 결합에서 감소된 점유 궤도 밀도는 차례로 들어오는 디엔과 덜 반발적인 폐쇄-쉘-폐쇄-쉘 궤도 상호작용을 하여 불안정한 입체 파울리 반발력을 감소시켜 Diels-Alder 반응 장벽을 낮춥니다. 또한 Lewis 산 촉매는 Diels-Alder 반응의 비동기성을 증가시켜 Dienophile의 C=C 이중 결합에 위치한 점유된 π-orbital를 비대칭으로 만듭니다. 결과적으로, 이러한 향상된 비동기성은 불안정화 입체 파울리 반발력의 추가적인 감소를 초래할 뿐만 아니라 반응물이 변형되는 압력을 감소시키는, 즉 불안정화 활성화 변형(distortion energy라고도 함)을 감소시킵니다.[43] 이 작동하는 촉매 메커니즘은 다양한 유기 반응에서 작동하는 파울리-하강 촉매라고 합니다.[44][45][46][47]
루이스 산 촉매 Diels-Alder 반응의 원래 근거는 부정확합니다.[39][48][49][50] 왜냐하면 루이스 산은 디에노필의 LUMO 에너지를 낮추는 것 외에도 디에노필의 HOMO 에너지를 낮추어 역전자 요구 LUMO-HOMO 궤도 에너지 갭을 증가시키기 때문입니다. 따라서 실제로 루이스 산 촉매는 디에노필의 LUMO를 낮추어 정상적인 전자 수요 궤도 상호 작용을 강화하지만 동시에 디에노필의 HOMO 에너지를 낮추어 역전자 수요 궤도 상호 작용을 약화시킵니다. 이 두 가지 반작용 현상은 서로 효과적으로 상쇄되어 해당 비촉매 디엘-알더 반응과 비교할 때 거의 변하지 않는 궤도 상호작용을 초래하며 루이스 산촉매 디엘-알더 반응 뒤에 있는 활성 메커니즘이 아닙니다.
비대칭 딜스–알더
키랄 보조제의 사용, 키랄 루이스 산에 의한 촉매 작용 [51]및 작은 유기 분자 촉매와 같은 Diels-Alder 반응의 입체 선택성에 영향을 미치는 많은 방법이 개발되었습니다.[6] Evans's oxazolidinons,[52] oxazaborolidines,[53][54][55] bis-oxazoline-copper chelate,[56] imidazoline catalysis,[57] 그리고 많은 다른 방법론들이 디아스테레오- 및 enantioselective Diels-Alder 반응에 영향을 미치기 위해 존재합니다.
헥사데하이드로 디엘스-알더
헥사데하이드로 디엘스-알더 반응에서 알켄과 디엔 대신 알킨과 디엔이 사용되어 불안정한 벤진 중간체를 형성하고 이 중간체를 가두어 방향족 생성물을 형성합니다. 이 반응을 통해 한 번의 단계로 고도로 기능화된 방향족 고리를 형성할 수 있습니다.[58][59]
응용 및 자연발생

레트로-딜스-알더 반응은 사이클로펜타디엔의 산업적 생산에 사용됩니다. 사이클로펜타디엔은 일반적인 단량체인 다양한 노르보르넨의 전구체입니다. Diels-Alder 반응은 비타민 B6의 생성에도 사용됩니다.
역사

딜스와 앨더의 연구는 1928년부터 1937년까지 Justus Liebigs Annalender Chemie와 Berichte der deutschen Chemischen Gesellschaft에 게재된 28편의 논문 시리즈에 설명되어 있습니다. 처음 19편의 기사는 딜스와 올더에 의해 작성되었고, 이후의 기사는 딜스와 다른 여러 공동 저자들에 의해 작성되었습니다.[62][63]
종합합성 분야에서의 응용
Diels-Alder 반응은 스테로이드 코르티손과 콜레스테롤의 초기 준비의 한 단계였습니다.[64] 반응은 퀴논에 부타디엔을 첨가하는 것과 관련이 있습니다.
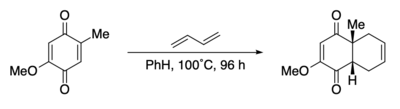
Diels-Alder 반응은 프로스타글란딘 F2α 및 E2의 원래 합성에 사용되었습니다.[65] Diels-Alder 반응은 프로스타글란딘 사이클로펜탄 코어에 있는 3개의 연속적인 입체 중심의 상대적 입체 화학을 확립합니다. Lewis 산성 큐프릭 테트라플루오로보레이트에 의한 활성화가 필요했습니다.

아미노산인 페닐알라닌과 티로신의 생합성 전구체인 [66]프리페네이트의 합성에는 Diels-Alder 반응이 사용되었습니다.
레세르핀의 합성은 D 고리와 E 고리의 시스-데칼린 골격을 설정하기 위해 Diels-Alder 반응을 사용합니다.[67]
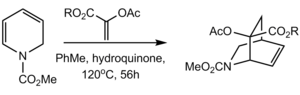
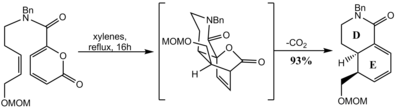
레세르핀의 또 다른 합성에서 시스 융합된 D와 E 고리는 Diels-Alder 반응에 의해 형성되었습니다. 레트로[4+2]를 통해 이산화탄소를 연속적으로 압출하는 아래의 피라논의 분자 내 Diels-Alder는 이환식 락탐을 제공했습니다. 덜 방해받는 α-면으로부터의 에폭시화, 덜 방해받는 C18에서의 에폭시드 개방은 이러한 위치에서 원하는 입체화학을 제공하는 반면, 시스 융합은 수소화로 달성되어 다시 주로 덜 방해받는 면에서 진행되었습니다.[68]
피라논은 택솔의 전체 합성에서 디에노필로 유사하게 사용되었습니다.[69] 아래에 표시된 하이드록시-파이론과 α,β-불포화 에스테르의 분자 간 반응은 수율과 부위 선택성이 좋지 않아 어려움을 겪었습니다. 그러나 페닐보론산에[70] 의해 지시된 경우 보론산을 네오펜틸 글리콜로 절단한 후 원하는 부가물을 61% 수율로 얻을 수 있습니다. 이 경우 Diels-Alder 반응의 입체특이성으로 인해 최종 생성물에 전달되는 4개의 입체중심을 정의할 수 있었습니다.

Diels-Alder 반응은 (-)-푸라퀴노신 C 합성의 핵심 단계입니다.[71]

타버닌은 알칼로이드 코어의 시스 상대 입체화학을 확립하기 위해 Diels-Alder 반응에 의해 제조되었습니다. 시스-알데히드가 위티골화에 의해 상응하는 알켄으로 전환되고 슈록 촉매를 사용한 후속 고리 종결 메타테시스가 알칼로이드 코어의 두 번째 고리를 제공했습니다. 여기서 디엔은 라왈디엔으로 알려진 1-아미노-3-실록시부타디엔의 예로서 주목할 만하다.[72]

(+)-스터퓨렌은 알렌의 분자 내 Diels-Alder 반응을 특징으로 하는 비대칭 D-A 반응에[73] 의해 제조될 수 있습니다. 아래와 같이 설폭사이드를 제공하기 위한 [2,3]-시그마트로픽 재배열은 프로파릴 알코올의 미리 정의된 입체화학으로 인해 항특이적으로 진행되었습니다. 이러한 방식으로 형성된 단일 알렌 이성질체는 생성된 '디엔'의 한 면에서만 디엘-알더 반응이 일어나도록 지시할 수 있습니다.

항생제(-)-테트라사이클린의 테트라사이클린 코어는 Diels-Alder 반응으로 제조되었습니다. 열적으로 시작된 벤조사이클로부텐의 회전 개방은 o-퀴노디메탄을 생성하고, 이는 분자간 반응하여 테트라사이클린 골격을 제공합니다. 디에노필의 유리 하이드록실 그룹은 하이드록실로 보호된 변이체가 여러 다른 반응 조건에서 반응하지 않았기 때문에 반응의 성공에 필수적입니다.[74]

Takemura 등은 1980년 고압을 이용하여 Diels-Alder 반응에 의해 칸타리딘을 합성하였습니다.[75]
Diels-Alder 반응의 합성 적용은 광범위하게 검토되었습니다.[76][77][78][79][80]
참고 항목
참고문헌
- ^ Kloetzel, M. C. (1948). "The Diels–Alder Reaction with Maleic Anhydride". Organic Reactions. Vol. 4. pp. 1–59. doi:10.1002/0471264180.or004.01. ISBN 978-0471264187.
- ^ Holmes, H. L. (1948). "The Diels-Alder Reaction Ethylenic and Acetylenic Dienophiles". Organic Reactions. Vol. 4. pp. 60–173. doi:10.1002/0471264180.or004.02. ISBN 978-0471264187.
- ^ a b Nicolaou, K. C.; Snyder, S. A.; Montagnon, T.; Vassilikogiannakis, G. (2002). "The Diels-Alder Reaction in Total Synthesis". Angewandte Chemie International Edition. 41 (10): 1668–1698. doi:10.1002/1521-3773(20020517)41:10<1668::AID-ANIE1668>3.0.CO;2-Z. PMID 19750686.
- ^ Atilla Tasdelen, Mehmet (2011). "Diels–Alder "click" reactions: recent applications in polymer and material science". Polymer Chemistry. 2 (10): 2133–2145. doi:10.1039/C1PY00041A.
- ^ Zweifel, G. S.; Nantz, M. H. (2007). Modern Organic Synthesis: An Introduction. W.H. Freeman and Co. ISBN 978-0-7167-7266-8.
- ^ a b c d e f g 캐리, 파트 B, 474-526페이지
- ^ a b Dewar, M. J.; Olivella, S.; Stewart, J. J. (1986). "Mechanism of the Diels-Alder reaction: Reactions of butadiene with ethylene and cyanoethylenes". Journal of the American Chemical Society. 108 (19): 5771–5779. doi:10.1021/ja00279a018. PMID 22175326.
- ^ a b c 캐리, 파트 A, 836-50페이지
- ^ a b Carey, Part A, p. 839
- ^ Gajewski, J. J.; Peterson, K. B.; Kagel, J. R. (1987). "Transition-state structure variation in the Diels–Alder reaction from secondary deuterium kinetic isotope effects: The reaction of a nearly symmetrical diene and dienophile is nearly synchronous". Journal of the American Chemical Society. 109 (18): 5545–5546. doi:10.1021/ja00252a052.
- ^ Houk, K. N.; Lin, Y. T.; Brown, F. K. (1986). "Evidence for the concerted mechanism of the Diels–Alder reaction of butadiene with ethylene". Journal of the American Chemical Society. 108 (3): 554–556. doi:10.1021/ja00263a059. PMID 22175504.
- ^ Goldstein, E.; Beno, B.; Houk, K. N. (1996). "Density Functional Theory Prediction of the Relative Energies and Isotope Effects for the Concerted and Stepwise Mechanisms of the Diels−Alder Reaction of Butadiene and Ethylene". Journal of the American Chemical Society. 118 (25): 6036–6043. doi:10.1021/ja9601494.
- ^ Breslow, R.; Guo, T. (1988). "Diels-Alder reactions in nonaqueous polar solvents. Kinetic effects of chaotropic and antichaotropic agents and of β-cyclodextrin". Journal of the American Chemical Society. 110 (17): 5613–5617. doi:10.1021/ja00225a003.
- ^ a b Rideout, D. C.; Breslow, R. (1980). "Hydrophobic acceleration of Diels-Alder reactions". Journal of the American Chemical Society. 102 (26): 7816–7817. doi:10.1021/ja00546a048.
- ^ Breslow, R.; Rizzo, C. J. (1991). "Chaotropic salt effects in a hydrophobically accelerated Diels–Alder reaction". Journal of the American Chemical Society. 113 (11): 4340–4341. doi:10.1021/ja00011a052.
- ^ Blokzijl, Wilfried; Engberts, Jan B. F. N. (1992). "Initial-State and Transition-State Effects on Diels–Alder Reactions in Water and Mixed Aqueous Solvents". Journal of the American Chemical Society. 114 (13): 5440–5442. doi:10.1021/ja00039a074.
- ^ Ashby, E. C.; Chao, L.-C.; Neumann, H. M. (1973). "Organometallic reaction mechanisms. XII. Mechanism of methylmagnesium bromide addition to benzonitrile". Journal of the American Chemical Society. 95 (15): 4896–4904. doi:10.1021/ja00796a022.
- ^ Fleming, I. (1990). Frontier Orbital and Organic Chemical Reactions. Chichester, UK: Wiley. ISBN 978-0471018193.
- ^ Kirmse, W.; Mönch, D. (1991). "Umlagerungen von 1,4,4- und 2,2,5-Trimethylbicyclo[3.2.1]oct-6-yl-Kationen". Chemische Berichte. 124 (1): 237–240. doi:10.1002/cber.19911240136.
- ^ Bérubé, G.; DesLongchamps, P. (1987). "Stéréosélection acyclique-1,5: Synthèse de la chaîne latérale optiquement active de la vitamine E". Bulletin de la Société Chimique de France. 1: 103–115.
- ^ Houk, K. N.; Luskus, L. J. (1971). "Influence of steric interactions on endo stereoselectivity". Journal of the American Chemical Society. 93 (18): 4606–4607. doi:10.1021/ja00747a052.
- ^ Kobuke, Y.; Sugimoto, T.; Furukawa, J.; Fueno, T. (1972). "Role of attractive interactions in endo–exo stereoselectivities of Diels–Alder reactions". Journal of the American Chemical Society. 94 (10): 3633–3635. doi:10.1021/ja00765a066.
- ^ Williamson, K. L.; Hsu, Y.-F. L. (1970). "Stereochemistry of the Diels–Alder reaction. II. Lewis acid catalysis of syn-anti isomerism". Journal of the American Chemical Society. 92 (25): 7385–7389. doi:10.1021/ja00728a022.
- ^ Woodward, R. B.; Hoffmann, R. (22 October 2013). The conservation of orbital symmetry. Weinheim. ISBN 9781483282046. OCLC 915343522.
{{cite book}}: CS1 maint: 위치 누락 게시자(링크) - ^ Wannere, Chaitanya S.; Paul, Ankan; Herges, Rainer; Houk, K. N.; Schaefer, Henry F.; Schleyer, Paul Von Ragué (2007). "The existence of secondary orbital interactions". Journal of Computational Chemistry. 28 (1): 344–361. doi:10.1002/jcc.20532. ISSN 1096-987X. PMID 17109435. S2CID 26096085.
- ^ 캐리, 파트 A, p. 149
- ^ a b Backer, H. J. (1939). "Le 2,3-Ditertiobutylbutadiène". Recueil des Travaux Chimiques des Pays-Bas. 58 (7): 643–661. doi:10.1002/recl.19390580712.
- ^ Craig, D.; Shipman, J. J.; Fowler, R. B. (1961). "The Rate of Reaction of Maleic Anhydride with 1,3-Dienes as Related to Diene Conformation". Journal of the American Chemical Society. 83 (13): 2885–2891. doi:10.1021/ja01474a023.
- ^ Danishefsky, S.; Kitahara, T. (1974). "Useful diene for the Diels–Alder reaction". Journal of the American Chemical Society. 96 (25): 7807–7808. doi:10.1021/ja00832a031.
- ^ Savard, J.; Brassard, P. (1979). "Regiospecific syntheses of quinones using vinylketene acetals derived from unsaturated esters". Tetrahedron Letters. 20 (51): 4911–4914. doi:10.1016/S0040-4039(01)86747-2.
- ^ Kozmin, S. A.; Rawal, V. H. (1997). "Preparation and Diels−Alder Reactivity of 1-Amino-3-siloxy-1,3-butadienes". Journal of Organic Chemistry. 62 (16): 5252–5253. doi:10.1021/jo970438q.
- ^ 마가레타 아브람 (1983). 치미 오르가니카 cp. 318-323. 에두라 아카데미에이 공화국 사회주의자 로마니아
- ^ Ranganathan, S.; Ranganathan, D.; Mehrotra, A. K. (1977). "Ketene Equivalents". Synthesis. 1977 (5): 289–296. doi:10.1055/s-1977-24362. S2CID 260335918.
- ^ Roush, W. R. (1991). "Intramolecular Diels–Alder Reactions". In Trost, B. M.; Flemming, I. (eds.). Comprehensive Organic Synthesis. Vol. 5. pp. 513–550. doi:10.1016/B978-0-08-052349-1.00131-1. ISBN 978-0-08-052349-1.
- ^ Grieco, P. A.; Larsen, S. D. (1990). "Iminium Ion-Based Diels–Alder Reactions: N-Benzyl-2-Azanorborene" (PDF). Organic Syntheses. 68: 206. doi:10.15227/orgsyn.068.0206.
- ^ Houk, Kendall N. (1 November 1975). "Frontier molecular orbital theory of cycloaddition reactions". Accounts of Chemical Research. 8 (11): 361–369. doi:10.1021/ar50095a001. ISSN 0001-4842.
- ^ Fleming, Ian (2009). Molecular orbitals and organic chemical reactions. Chichester, West Sussex, U.K.: Wiley. ISBN 9780470746592.
- ^ Clayden, Jonathan (2012). Organic chemistry (2nd ed.). Oxford: Oxford University Press. ISBN 9780199270293.
- ^ a b Vermeeren, Pascal; Hamlin, Trevor A.; Fernández, Israel; Bickelhaupt, F. Matthias (6 April 2020). "How Lewis Acids Catalyze Diels–Alder Reactions". Angewandte Chemie International Edition. 59 (15): 6201–6206. doi:10.1002/anie.201914582. PMC 7187354. PMID 31944503.
- ^ Vermeeren, Pascal; Hamlin, Trevor A.; Fernández, Israel; Bickelhaupt, F. Matthias (2020). "Origin of rate enhancement and asynchronicity in iminium catalyzed Diels–Alder reactions". Chemical Science. 11 (31): 8105–8112. doi:10.1039/D0SC02901G. PMC 8163289. PMID 34094173.
- ^ Vermeeren, Pascal; Hamlin, Trevor A.; Bickelhaupt, F. Matthias; Fernández, Israel (17 March 2021). "Bifunctional Hydrogen Bond Donor‐Catalyzed Diels–Alder Reactions: Origin of Stereoselectivity and Rate Enhancement". Chemistry: A European Journal. 27 (16): 5180–5190. doi:10.1002/chem.202004496. PMC 8049058. PMID 33169912.
- ^ Vermeeren, Pascal; Tiezza, Marco Dalla; Dongen, Michelle; Fernández, Israel; Bickelhaupt, F. Matthias; Hamlin, Trevor A. (21 July 2021). "Lewis Acid‐Catalyzed Diels‐Alder Reactions: Reactivity Trends across the Periodic Table". Chemistry: A European Journal. 27 (41): 10610–10620. doi:10.1002/chem.202100522. PMC 8360170. PMID 33780068.
- ^ Vermeeren, Pascal; Hamlin, Trevor A.; Bickelhaupt, F. Matthias (2021). "Origin of asynchronicity in Diels–Alder reactions". Physical Chemistry Chemical Physics. 23 (36): 20095–20106. Bibcode:2021PCCP...2320095V. doi:10.1039/D1CP02456F. PMC 8457343. PMID 34499069.
- ^ Hamlin, Trevor A.; Bickelhaupt, F. Matthias; Fernández, Israel (20 April 2021). "The Pauli Repulsion-Lowering Concept in Catalysis" (PDF). Accounts of Chemical Research. 54 (8): 1972–1981. doi:10.1021/acs.accounts.1c00016. hdl:1871.1/a0090b38-9ab8-4c32-9d9a-b3d5de4e5ed3. ISSN 0001-4842. PMID 33759502. S2CID 232337915.
- ^ Vermeeren, Pascal; Brinkhuis, Francine; Hamlin, Trevor A.; Bickelhaupt, F. Matthias (April 2020). "How Alkali Cations Catalyze Aromatic Diels‐Alder Reactions". Chemistry: An Asian Journal. 15 (7): 1167–1174. doi:10.1002/asia.202000009. PMC 7187256. PMID 32012430.
- ^ Hansen, Thomas; Vermeeren, Pascal; Yoshisada, Ryoji; Filippov, Dmitri V.; van der Marel, Gijsbert A.; Codée, Jeroen D. C.; Hamlin, Trevor A. (19 February 2021). "How Lewis Acids Catalyze Ring-Openings of Cyclohexene Oxide". The Journal of Organic Chemistry. 86 (4): 3565–3573. doi:10.1021/acs.joc.0c02955. PMC 7901664. PMID 33538169.
- ^ Tiekink, Eveline H.; Vermeeren, Pascal; Bickelhaupt, F. Matthias; Hamlin, Trevor A. (7 October 2021). "How Lewis Acids Catalyze Ene Reactions". European Journal of Organic Chemistry. 2021 (37): 5275–5283. doi:10.1002/ejoc.202101107. hdl:2066/241097. S2CID 239089361.
- ^ Vermeeren, Pascal; Hamlin, Trevor A.; Fernández, Israel; Bickelhaupt, F. Matthias (2020). "Origin of rate enhancement and asynchronicity in iminium catalyzed Diels–Alder reactions". Chemical Science. 11 (31): 8105–8112. doi:10.1039/D0SC02901G. PMC 8163289. PMID 34094173.
- ^ Vermeeren, Pascal; Hamlin, Trevor A.; Bickelhaupt, F. Matthias; Fernández, Israel (17 March 2021). "Bifunctional Hydrogen Bond Donor‐Catalyzed Diels–Alder Reactions: Origin of Stereoselectivity and Rate Enhancement". Chemistry: A European Journal. 27 (16): 5180–5190. doi:10.1002/chem.202004496. PMC 8049058. PMID 33169912.
- ^ Vermeeren, Pascal; Tiezza, Marco Dalla; Dongen, Michelle; Fernández, Israel; Bickelhaupt, F. Matthias; Hamlin, Trevor A. (21 July 2021). "Lewis Acid‐Catalyzed Diels‐Alder Reactions: Reactivity Trends across the Periodic Table". Chemistry: A European Journal. 27 (41): 10610–10620. doi:10.1002/chem.202100522. PMC 8360170. PMID 33780068.
- ^ White, James D.; Shaw, Subrata (2011). "cis-2,5-Diaminobicyclo[2.2.2]octane, a New Scaffold for Asymmetric Catalysis via Salen−Metal Complexes". Org. Lett. 13 (9): 2488–91. doi:10.1021/ol2007378. PMID 21462988.
- ^ Evans, D. A.; Chapman, K. T.; Bisaha, J. (1988). "Asymmetric Diels–Alder cycloaddition reactions with chiral α,β-unsaturated N-acyloxazolidinones". Journal of the American Chemical Society. 110 (4): 1238–1256. doi:10.1021/ja00212a037.
- ^ Corey, E. J.; Loh, T. P. (1991). "First application of attractive intramolecular interactions to the design of chiral catalysts for highly enantioselective Diels–Alder reactions". Journal of the American Chemical Society. 113 (23): 8966–8967. doi:10.1021/ja00023a066.
- ^ Corey, E. J.; Shibata, T.; Lee, T. W. (2002). "Asymmetric Diels-Alder reactions catalyzed by a triflic acid activated chiral oxazaborolidine". Journal of the American Chemical Society. 124 (15): 3808–3809. doi:10.1021/ja025848x. PMID 11942799.
- ^ Ryu, D. H.; Corey, E. J. (2003). "Triflimide activation of a chiral oxazaborolidine leads to a more general catalytic system for enantioselective Diels-Alder addition". Journal of the American Chemical Society. 125 (21): 6388–6390. doi:10.1021/ja035393r. PMID 12785777.
- ^ Johnson, J. S.; Evans, D. A. (2000). "Chiral bis(oxazoline) copper(II) complexes: Versatile catalysts for enantioselective cycloaddition, Aldol, Michael, and carbonyl Ene reactions". Accounts of Chemical Research. 33 (6): 325–335. doi:10.1021/ar960062n. PMID 10891050.
- ^ Ahrendt, K. A.; Borths, C. J.; MacMillan, D. W. C. (2000). "New Strategies for Organic Catalysis: The First Highly Enantioselective Organocatalytic Diels−Alder Reaction". Journal of the American Chemical Society. 122 (17): 4243–4244. doi:10.1021/ja000092s.
- ^ Hoye, T. R.; Baire, B.; Niu, D.; Willoughby, P. H.; Woods, B. P. (2012). "The hexadehydro-Diels–Alder reaction". Nature. 490: 208–212. doi:10.1038/nature11518.
- ^ Fluegel, Lucas L.; Hoye, Thomas R. (2021). "Hexadehydro-Diels–Alder Reaction: Benzyne Generation via Cycloisomerization of Tethered Triynes". Chem. Rev. 121 (4): 2413–2444. doi:10.1021/acs.chemrev.0c00825.
- ^ Minami, Atsushi; Oikawa, Hideaki (2016). "Recent advances of Diels–Alderases involved in natural product biosynthesis". The Journal of Antibiotics. 69 (7): 500–506. doi:10.1038/ja.2016.67. PMID 27301662. S2CID 30482282.
- ^ Behr, Arno (2000). "Organometallic Compounds and Homogeneous Catalysis". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a18_215. ISBN 978-3527306732.
- ^
- Diels, O.; Alder, K. (1928). "Synthesen in der hydroaromatischen Reihe, I. Mitteilung: Anlagerungen von "Di-en"-kohlenwasserstoffen". Justus Liebigs Annalen der Chemie. 460: 98–122. doi:10.1002/jlac.19284600106.
- Diels, O.; Alder, K. (1929). "Synthesen in der hydroaromatischen Reihe, II. Mitteilung: Über Cantharidin". Berichte der Deutschen Chemischen Gesellschaft. 62 (3): 554–562. doi:10.1002/cber.19290620318.
- Diels, O.; Alder, K. (1929). "Synthesen in der hydroaromatischen Reihe, III. Mitteilung: Synthese von Terpenen, Camphern, hydroaromatischen und heterocyclischen Systemen. Mitbearbeitet von den Herren Wolfgang Lübbert, Erich Naujoks, Franz Querberitz, Karl Röhl, Harro Segeberg". Justus Liebigs Annalen der Chemie. 470: 62–103. doi:10.1002/jlac.19294700106.
- Diels, O.; Alder, K. (1929). "Synthesen in der hydroaromatischen Reihe, IV. Mitteilung: Über die Anlagerung von Maleinsäure-anhydrid an arylierte Diene, Triene und Fulvene (Mitbearbeitet von Paul Pries)". Berichte der Deutschen Chemischen Gesellschaft. 62 (8): 2081–2087. doi:10.1002/cber.19290620829.
- Diels, O.; Alder, K. (1929). "Synthesen in der hydroaromatischen Reihe, V. Über Δ4-Tetrahydro-o-phthalsäure (Stellungnahme zu der Mitteilung von E. H. Farmer und F. L. Warren: Eigenschaften konjugierter Doppelbindungen (VII)". Berichte der Deutschen Chemischen Gesellschaft. 62 (8): 2087–2090. doi:10.1002/cber.19290620830.
- Diels, O.; Alder, K. (1929). "Synthesen in der hydroaromatischen Reihe, VI. Mitteilung, Kurt Alder und Gerhard Stein: Über partiell hydrierte Naphtho- und Anthrachinone mit Wasserstoff in γ- bzw. δ-Stellung. (Mitbearbeitet von Paul Pries und Hans Winckler)". Berichte der Deutschen Chemischen Gesellschaft. 62 (8): 2337–2372. doi:10.1002/cber.19290620872.
- Diels, O.; Alder, K. (1930). "Synthesen in der hydroaromatischen Reihe, VII. Mitteilung. (Mitbearbeitet von den Harren Ernst Petersen und Franz Querberitz.)". Justus Liebigs Annalen der Chemie. 478: 137–154. doi:10.1002/jlac.19304780109.
- Diels, O.; Alder, K. (1931). "Synthesen in der hydroaromatischen Reihe, VIII. Mitteilung: Dien-Synthesen des Anthracens. Anthracen-Forme". Justus Liebigs Annalen der Chemie. 486: 191–202. doi:10.1002/jlac.19314860110.
- Diels, O.; Alder, K. (1931). "Synthesen in der hydroaromatischen Reihe, IX. Mitteilung: Synthese des Camphenilons und des Santens". Justus Liebigs Annalen der Chemie. 486: 202–210. doi:10.1002/jlac.19314860111.
- Diels, O.; Alder, K. (1931). "Synthesen in der hydroaromatischen Reihe, X. Mitteilung: "Dien-Synthesen"︁ mit Pyrrol und seinen Homologen". Justus Liebigs Annalen der Chemie. 486: 211–225. doi:10.1002/jlac.19314860112.
- Diels, O.; Alder, K. (1931). "Synthesen in der hydroaromatischen Reihe, XI. Mitteilung. ("Dien-Synthesen"︁ des Cyclopentadiens, Cyclo-hexadiens und Butadiens mit Acetylen-dicarbonsäure und ihren Estern". Justus Liebigs Annalen der Chemie. 490: 236–242. doi:10.1002/jlac.19314900109.
- Diels, O.; Alder, K. (1931). "Synthesen in der hydroaromatischen Reihe, XII. Mitteilung. ("Dien-Synthesen"︁ sauerstoffhaltiger Heteroringe. 2. Dien-Synthesen des Furans.)". Justus Liebigs Annalen der Chemie. 490: 243–257. doi:10.1002/jlac.19314900110.
- Diels, O.; Alder, K. (1931). "Synthesen in der hydroaromatischen Reihe, XIII. Mitteilung. ("Dien-Synthesen"︁ sauerstoffhaltiger Heteroringe. 3. Dien-Synthesen der Cumaline.)". Justus Liebigs Annalen der Chemie. 490: 257–266. doi:10.1002/jlac.19314900111.
- Diels, O.; Alder, K. (1931). "Synthesen in der hydroaromatischen Reihe, XIV. Mitteilung. ("Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 2. Dien-Synthesen der Pyrrole mit Acetylen-dicarbonsäure und mit ihren Estern.)". Justus Liebigs Annalen der Chemie. 490: 267–276. doi:10.1002/jlac.19314900112.
- Diels, O.; Alder, K. (1931). "Synthesen in der hydroaromatischen Reihe, XV. Mitteilung. ("Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 3. Dien-Synthesen der Indole.)". Justus Liebigs Annalen der Chemie. 490: 277–294. doi:10.1002/jlac.19314900113.
- Diels, O.; Alder, K. (1932). "Synthesen in der hydroaromatischen Reihe, XVI. Mitteilung. ("Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 4. Dien-Synthesen der Pyrrole, Imidazole und Pyrazole.)". Justus Liebigs Annalen der Chemie. 498: 1–15. doi:10.1002/jlac.19324980102.
- Diels, O.; Alder, K. (1932). "Synthesen in der hydroaromatischen Reihe, XVII. Mitteilung. ("Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 5. Dien-Synthesen des Pyridins, Chinolins, Chinaldins und Isochinolins.)". Justus Liebigs Annalen der Chemie. 498: 16–49. doi:10.1002/jlac.19324980103.
- Diels, O.; Alder, K. (1933). "Synthesen in der hydroaromatischen Reihe, XVIII "Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 6. Dien-Synthesen des Pyridins. Zur Kenntnis des Chinolizins, Indolizins, Norlupinans und Pseudolupinins". Justus Liebigs Annalen der Chemie. 505: 103–150. doi:10.1002/jlac.19335050109.
- Diels, O.; Alder, K. (1934). "Synthesen in der hydroaromatischen Reihe, XIX. "Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 7. Zur Kenntnis der Primärprodukte bei den Dien-Synthesen des Pyridins, Chinolins und Chinaldins". Justus Liebigs Annalen der Chemie. 510: 87–128. doi:10.1002/jlac.19345100106.
- Diels, O.; Reese, J. (1934). "Synthesen in der hydroaromatischen Reihe, XX. Über die Anlagerung von Acetylen-dicarbonsäureester an Hydrazobenzol". Justus Liebigs Annalen der Chemie. 511: 168–182. doi:10.1002/jlac.19345110114.
- Diels, O.; Meyer, R. (1934). "Synthesen in der hydroaromatischen Reihe, XXI. "Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 8. Über den Verlauf der Dien-Synthese des Pyridins in methylalkoholischer Lösung". Justus Liebigs Annalen der Chemie. 513: 129–145. doi:10.1002/jlac.19345130108.
- Diels, O.; Friedrichsen, W. (1934). "Synthesen in der hydroaromatischen Reihe, XXII. Über die Anthracen–C4O3-Addukte, ihre Eignung zu Dien-Synthesen und ein neues Prinzip zur Synthese von Phtalsäuren und Dihydro-phtalsäuren". Justus Liebigs Annalen der Chemie. 513: 145–155. doi:10.1002/jlac.19345130109.
- Diels, O.; Möller, F. (1935). "Synthesen in der hydroaromatischen Reihe, XXIII. "Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 9. Stilbazol und Acetylen-dicarbonester". Justus Liebigs Annalen der Chemie. 516: 45–61. doi:10.1002/jlac.19355160104.
- Diels, O.; Kech, H. (1935). "Synthesen in der hydroaromatischen Reihe, XXIV "Dien-Synthesen"︁ stickstoffhaltiger Heteroringe". Justus Liebigs Annalen der Chemie. 519: 140–146. doi:10.1002/jlac.19355190112.
- Diels, O.; Reese, J. (1935). "Synthesen in der hydroaromatischen Reihe, XXV Über die Addukte aus Acetylen-dicarbonsäureester und Hydrazo-Verbindungen (2)". Justus Liebigs Annalen der Chemie. 519: 147–157. doi:10.1002/jlac.19355190113.
- Diels, O.; Harms, J. (1935). "Synthesen in der hydroaromatischen Reihe, XXVI. "Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 11. Über die aus Isochinolin und Acetylen-dicarbonsäureester entstehenden Addukte". Justus Liebigs Annalen der Chemie. 525: 73–94. doi:10.1002/jlac.19365250107.
- Diels, O.; Schrum, H. (1937). "Synthesen in der hydroaromatischen Reihe,XXVII. "Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 12. Über den Abbau der "gelben Substanz"︁ zu einem Isomeren des Norlupinans (1-Methyl-octahydro-indolizin)". Justus Liebigs Annalen der Chemie. 530: 68–86. doi:10.1002/jlac.19375300106.
- Diels, O.; Pistor, H. (1937). "Synthesen in der hydroaromatischen Reihe, XXVIII. "Dien-Synthesen"︁ stickstoffhaltiger Heteroringe. 13. α-Picolin und Acetylen-dicarbonsäureeste". Justus Liebigs Annalen der Chemie. 530: 87–98. doi:10.1002/jlac.19375300107.
- ^ "The Nobel Prize in Chemistry 1950". The Nobel Foundation. Retrieved 19 February 2016.
- ^ Woodward, R. B.; Sondheimer, F.; Taub, D.; Heusler, K.; McLamore, W. M. (1952). "The Total Synthesis of Steroids". Journal of the American Chemical Society. 74 (17): 4223–4251. doi:10.1021/ja01137a001.
- ^ Corey, E. J.; Weinshenker, N. M.; Schaaf, T. K.; Huber, W. (1969). "Stereo-controlled synthesis of prostaglandins F-2a and E-2 (dl)". Journal of the American Chemical Society. 91 (20): 5675–7. doi:10.1021/ja01048a062. PMID 5808505.
- ^ Danishefsky, S.; Hirama, M.; Fritsch, N.; Clardy, J. (1979). "Synthesis of disodium prephenate and disodium epiprephenate. Stereochemistry of prephenic acid and an observation on the base-catalyzed rearrangement of prephenic acid to p-hydroxyphenyllactic acid". Journal of the American Chemical Society. 101 (23): 7013–7018. doi:10.1021/ja00517a039.
- ^ Wender, P. A.; Schaus, J. M.; White, A. W. (1980). "General methodology for cis-hydroisoquinoline synthesis: Synthesis of reserpine". Journal of the American Chemical Society. 102 (19): 6157–6159. doi:10.1021/ja00539a038.
- ^ Martin, S. F.; Rueger, H.; Williamson, S. A.; Grzejszczak, S. (1987). "General strategies for the synthesis of indole alkaloids. Total synthesis of (±)-reserpine and (±)-α-yohimbine". Journal of the American Chemical Society. 109 (20): 6124–6134. doi:10.1021/ja00254a036.
- ^ Nicolaou, K. C.; Yang, Z.; Liu, J. J.; Ueno, H.; Nantermet, P. G.; Guy, R. K.; Claiborne, C. F.; Renaud, J.; Couladouros, E. A.; Paulvannan, K.; Sorensen, E. J. (1994). "Total synthesis of taxol". Nature. 367 (6464): 630–4. Bibcode:1994Natur.367..630N. doi:10.1038/367630a0. PMID 7906395. S2CID 4371975.
- ^ Narasaka, K.; Shimada, S.; Osoda, K.; Iwasawa, N. (1991). "Phenylboronic Acid as a Template in the Diels-Alder Reaction". Synthesis. 1991 (12): 1171–1172. doi:10.1055/s-1991-28413.
- ^ Smith, A. B.; Sestelo, J. P.; Dormer, P. G. (1995). "Total Synthesis of (−)-Furaquinocin C". Journal of the American Chemical Society. 117 (43): 10755–10756. doi:10.1021/ja00148a023.
- ^ Kozmin, S. A.; Rawal, V. H. (1998). "A General Strategy to Aspidosperma Alkaloids: Efficient, Stereocontrolled Synthesis of Tabersonine". Journal of the American Chemical Society. 120 (51): 13523–13524. doi:10.1021/ja983198k.
- ^ Gibbs, R. A.; Okamura, W. H. (1988). "A short enantioselective synthesis of (+)-sterpurene: Complete intramolecular transfer of central to axial to central chiral elements". Journal of the American Chemical Society. 110 (12): 4062–4063. doi:10.1021/ja00220a069.
- ^ Charest, M. G.; Siegel, D. R.; Myers, A. G. (2005). "Synthesis of (-)-tetracycline". Journal of the American Chemical Society. 127 (23): 8292–3. doi:10.1021/ja052151d. PMID 15941256.
- ^ Dauben, W. G.; Kessel, C. R.; Takemura, K. H. (1980). "Simple, efficient total synthesis of cantharidin via a high-pressure Diels–Alder reaction". Journal of the American Chemical Society. 102 (22): 6893–6894. doi:10.1021/ja00542a060.
- ^ Holmes, H. L. (1948). "The Diels–Alder Reaction Ethylenic and Acetylenic Dienophiles". Organic Reactions. Vol. 4. pp. 60–173. doi:10.1002/0471264180.or004.02. ISBN 978-0471264187.
- ^ Butz, L. W.; Rytina, A. W. (1949). "The Diels–Alder Reaction Quinones and Other Cyclenones". Organic Reactions. Vol. 5. pp. 136–192. doi:10.1002/0471264180.or005.03. ISBN 978-0471264187.
- ^ Kloetzel, M. C. (1948). "The Diels–Alder Reaction with Maleic Anhydride". Organic Reactions. Vol. 4. pp. 1–59. doi:10.1002/0471264180.or004.01. ISBN 978-0471264187.
- ^ Heintzelman, G. R.; Meigh, I. R.; Mahajan, Y. R.; Weinreb, S. W. (2005). "Diels-Alder Reactions of Imino Dienophiles". Organic Reactions. Vol. 65. pp. 141–599. doi:10.1002/0471264180.or065.02. ISBN 978-0471264187.
- ^ Ciganek, E. (1984). "The Intramolecular Diels-Alder Reaction". Organic Reactions. Vol. 32. pp. 1–374. doi:10.1002/0471264180.or032.01. ISBN 978-0471264187.
서지학
- Carey, Francis A.; Sundberg, Richard J. (2007). Advanced Organic Chemistry: Part B: Reactions and Synthesis (5th ed.). New York: Springer. ISBN 978-0387683546.
외부 링크
- [1]딜스와 올더의 1928년 노벨상을 수상한 독일의 중요한 논문 영어 번역. 영어 제목: '하이드로방향족 시리즈의 합성'; 독일어 제목: "Synthesen in der hydroaromatischen Reihe".


