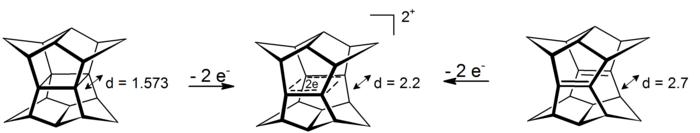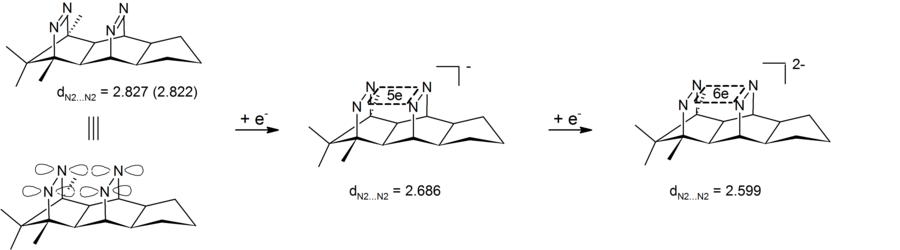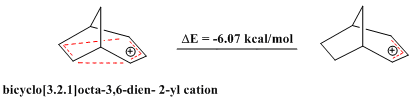호모자동성
Homoaromaticity유기화학에서 호모자동성은 단일 sp3 혼성 탄소 원자에 의해 결합이 중단되는 특별한 방향성을 말한다. 비록 이 sp3 center가 p-orbital의 연속적인 중첩을 방해하지만, 전통적으로 방향성의 요구조건으로 생각되는 p-orbitals의 상당한 열역학적 안정성과 방향성 화합물과 관련된 많은 분광, 자기 및 화학적 특성들은 여전히 그러한 화합물에 대해 관찰된다. 이 공식 불연속성은 p-오르비탈 중첩에 의해 분명히 연결되며, 이 보존된 화학적 안정성을 책임지는 π 전자의 연속적인 주기를 유지한다.[1]
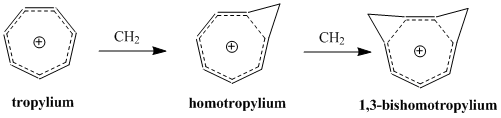
호모자성의 개념은 1959년 사울 윈슈타인에 의해 개척되었는데, 그의 "트리소시클로프로페닐" 계장에 대한 연구로 촉발되었다.[2] 윈슈타인의 논문이 발표된 이후, 이러한 분자들을 이해하고 분류하는 데 많은 연구가 바쳐졌는데, 이는 지속적으로 확대되는 방향성의 정의에 따라 포함된 방향족의 추가 부류를 나타낸다. 현재까지 호모자성 화합물은 양이온성 및 음이온성 종으로 알려져 있으며, 일부 연구에서는 중성자성 분자의 존재를 뒷받침하고 있다.[3] '호모트로필리움' 양이온(CH89+)은 아마도 호모토메틱 화합물의 가장 잘 연구된 예일 것이다.
개요
이름 지정
호모마토마이티(homoaromicity)라는 용어는 이전에 문헌에서 관찰되었던 유사 호모콘주알케인과 유사성 호모콘주알케인의 구조적 유사성에서 유래되었다.[2] IUPAC 골드북은 2, 3 등 sp가3 별도로 방향제의 결합을 방해하는 호모자성 화합물을 묘사하기 위해 Bis-, Tris- 등의 접두사를 사용하도록 요구한다.
역사
호마로마티즘의 개념은 1950년대에 일어난 비고전적 카보늄 이온에 대한 논쟁에서 비롯되었다. 비클래식 이온 모델의 유명한 지지자인 사울 윈스타인은 3-비시클로[3.1.0]헥실 양이온을 연구하면서 처음으로 호모자성을 설명했다. 
일련의 아세톨리시스 실험에서 윈슈타인 외 연구진은 토실 이탈군이 적도 위치에 있을 때 솔볼리시스 반응이 경험적으로 더 빨리 발생한다고 관찰했다. 그 단체는 이 반응률의 차이를 "cis" isomer에 의해 촉발된 고정관념적 지원에 돌렸다. 따라서 이 결과는 cation에 대한 비분류적 구조를 지지하였다.[4]
이후 윈스타인은 이 3-비시클로[3.1.0]헥실 양이온의 비클래식 모델이 이전에 잘 연구된 방향족 사이클로프로페닐 양이온과 유사하다고 관찰했다. 사이클로프로페닐 양이온과 마찬가지로 양전하도 2 π 전자가 들어 있는 등가탄소 3개에 걸쳐 소산된다. 따라서 이 전자적 구성은 방향성에 대한 허클의 규칙(4n+2 π 전자 필요)을 만족시킨다. 실제로, 윈스타인은 이 방향족 프로페닐 양이온과 그의 비전통 헥실 양이온 사이의 유일한 근본적인 차이점은 후자의 이온에서 3CH-
2 단위로 인해 결합이 중단된다는 사실이라는 것을 알아챘다. 따라서 이 그룹은 사이클로프로페닐 양이온에 대한 트리스호모(triis-homocyclopropenyl)라는 명칭을 제안했다.
호모자성을 위한 증거
호모자성 기준
방향성의 기준은 새로운 발전과 통찰력이 이 놀랍도록 안정된 유기 분자에 대한 우리의 이해에 계속 기여함에 따라 진화해 왔다.[5] 따라서 이러한 분자의 요구되는 특성은 일부 논란의 대상으로 남아 있다. 고전학적으로 방향성 화합물은 (4n+2) electrons 전자의 주기적 소산계를 갖는 평면 분자로 정의되어 허클의 법칙을 만족시켰다. 가장 중요한 것은 이러한 결합 링 시스템은 국부적인 공명 구조에 기초한 예측에 비해 엄청난 열화학 안정성을 보이는 것으로 알려져 있다. 간결하게 세 가지 중요한 특징이 방향족 화합물의 특성을 나타내는 듯 하다.[6]
그러나 이러한 관습적인 규칙에는 많은 예외가 존재한다. 뫼비우스 4n³ 전자종, 순환 순환 전환 상태, 탈초점화된 전자가 링 평면에서 또는 σ(π) 결합을 통해 순환하는 분자, 많은 전이금속 샌드위치 분자 등을 포함한 많은 분자들은 방향성에 대한 종래의 매개변수에서 어떻게든 벗어나지만 방향성으로 간주되어 왔다.[7]
결과적으로, 호모자적 소산성의 기준은 유사하게 모호하고 다소 논란의 여지가 있는 것으로 남아있다. 호모트로필리움 양이온(CH89+)은 지금까지 발견된 호모자성 화합물의 첫 번째 예는 아니지만, 호모자성으로 분류된 화합물 중 가장 많이 연구된 것으로 증명되어, 따라서 흔히 호모자성의 전형적인 예로 여겨진다. 1980년대 중반까지, 40개 이상의 호모트로필리움 계통의 대체 유도체들이 보고되었는데, 이는 동모세포 화합물에 대한 우리의 이해를 형성하는데 있어서 이온의 중요성을 반영한다.[6]
동성애에 대한 초기 증거
윈슈타인에 의해 트리스-호모시클로프로페닐 양이온에 대한 "호모마토믹" 구조의 초기 보고가 발표된 후, 많은 그룹들이 유사한 화합물에 대한 관찰 결과를 보고하기 시작했다. 이러한 분자에 대해 가장 잘 연구된 것 중 하나는 호모트로필리움 양이온인데, 그 모화합물은 1962년 페티트 외 연구원에 의해 안정된 소금으로 처음 격리되었는데, 그 때 그 그룹은 강한 산으로 사이클로크트라틴을 반응하였다.[8] 호모자성에 대한 초기 증거의 대부분은 이 분자와 관련된 특이한 NMR 성질의 관찰에서 비롯된다.
NMR 분광학 연구
HNMR 분광법에 의한 사이클로크타트리엔의 감응으로 인한 화합물의 특성을 나타내는 한편, 동일한 메틸렌 교량 탄소에 접합된 두 양성자에 해당하는 공명이 화학적 변화에서 놀라운 수준의 분리를 보인다는 것을 관찰했다.
이러한 관찰을 통해 페티트 외 연구진은 사이클로크타테닐 계통의 고전적 구조가 부정확해야 한다고 결론지었다. 그 대신, 이 단체는 8mb의 링 내부에 위치한 사이클로프로판 결합이 상당한 소산화의 영향을 받아야 한다는 이론으로, 관찰된 화학적 변화의 극적인 차이를 설명하면서, 자전거로[5.1.0]옥타디엔닐 화합물의 구조를 제안했다. 추가적인 고려에 따라, 페티트는 "내부 사이클로프로판" 결합이 전자 소산화로 완전히 대체되었음을 보여주는 "호모트로필리움 이온"으로 화합물을 나타내는 경향이 있었다. 이 구조는 탈초점화가 얼마나 순환적인지를 보여주며 6㎛의 전자를 포함하는데, 이는 허클의 방향성 규칙과 일치한다. 따라서 NMR의 자기장은 이온에 링 전류를 유도할 수 있으며, 이는 이 메틸렌 다리의 엑소 양성자와 엔도 양성자 사이의 공진 차이를 크게 담당한다. 따라서 페티트 외 연구진은 이 화합물과 방향족 이온 사이의 놀라운 유사성을 강조하면서 윈슈타인이 예측한 대로 이미 알려진 방향족에 새로운 "호모-카운터파트"를 묘사했다.
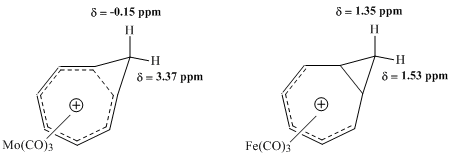
윈스타인 등이 수행한 후속 NMR 연구는 호모트로필리움 이온을 가진 금속 카보닐 복합체의 특성을 평가하려고 했다. 몰리브덴 콤플렉스와 철 콤플렉스의 비교는 특히 생산성이 높은 것으로 입증되었다. 몰리브데넘 트리카르보닐은 6㎛ 전자를 수용하여 호모트로필리움 cation과 조응하여 콤플렉스의 호모자적 특징을 보존할 것으로 기대되었다. 이와는 대조적으로 철 삼차르보닐은 호모트로필리움 이온에서 4 π의 전자만을 수용하여 양이온의 전자가 국부화되는 콤플렉스를 생성함으로써 양이온과 조응할 것으로 기대되었다. HNMR 분광법에 의한 이러한 복합체에 대한 연구는 모 콤플렉스의 메틸렌 양성자에 대한 화학적 이동 값에서 큰 차이를 보였으며, 이는 호모성 구조와 일치하지만, Fe 콤플렉스의 동일한 양성자에 대한 공진에서 사실상 비교할 만한 차이가 없다는 것을 발견했다.[9]
UV 분광학 연구
분자의 자기 특성에 의존하지 않는 호모트로필리움 양이온 구조를 지지하는 중요한 초기 증거의 한 조각은 분자의 UV 스펙트럼 획득과 관련이 있었다. 윈슈타인 외 연구진은 호모트로필리움 계통의 흡수 맥시마가 완전히 형성된 내부 사이클로프로판 결합(및 국부적 전자 구조)과 함께 고전적인 사이클로옥타이트릴 계통 또는 자전거로[5.1.0]옥타디엔릴 화합물보다 상당히 짧은 파장을 보인다는 결론을 내렸다. 대신에, UV 스펙트럼은 방향족 이온과 가장 흡사했다. 추가 계산을 통해 윈슈타인은 외곽 메틸렌 다리에 인접한 두 탄소 원자의 결합 순서가 대류 cation에서 해당 탄소 원자를 분리하는 π-본드의 결합 순서와 비교된다고 판단할 수 있었다.[10] 비록 이 실험이 매우 빛을 발하는 것으로 증명되었지만, UV 스펙트럼은 일반적으로 방향성이나 호모자성을 나타내는 좋지 않은 지표로 간주된다.[6]
호모에 대한 더 최근의 증거
더 최근에는, 다양한 다른 실험 기법과 이론적 계산을 채택하여, 소위 호모자성 호모트로필리움 이온의 구조를 조사하기 위한 작업이 행해지고 있다. 한 핵심 실험 연구는 X선 결정학에 의해 대체된 호모트로필리움 이온의 분석을 포함했다. 이러한 결정학적 연구는 사이클로프로페닐 구조의 기저에 있는 원자 사이의 핵융합 거리가 정상적인 사이클로프로판 분자에 대해 예상할 수 있는 것보다 실제로 더 긴 반면, 외부 결합은 델로카에 대한 내부 사이클로프로판 결합의 관여를 나타내는 것으로 보이는 것으로 보여진다.이온화화화화화하다[6]
분자 궤도 설명
호모자성의 안정성에 대한 분자 궤도 설명은 수많은 다양한 이론과 함께 광범위하게 논의되어 왔으며, 주로 호모트로페닐리움 양이온을 참고 자료로 삼았다. R.C. Haddon은 초기에 Sp 하이브리드3 메틸렌 브리지 탄소(2)의 외부 전자가 C1-C3 거리를 안정시키기 위해 인접한 탄소에 역기증하는 Mobius 모델을 제안했다.[11]
섭동 분자 궤도 이론
호모자동성은 로버트 C의 1975년 연구에서 설명한 바와 같이 섭동 분자 궤도 이론(PMO)을 사용하여 더 잘 설명될 수 있다. 하돈. 호모트로펜리움 양이온은 원래 양이온의 공명을 방해하는 호모콘쥬게이트 연계가 추가되어 열수이온의 변질된 형태로 간주할 수 있다.[12]
1차 효과
호모자적 특성에 영향을 미치는 가장 중요한 요소는 모향성 화합물에 단일 호모콘쥬게이트 연계를 추가하는 것이다. 호모콘쥬게이트 결합의 위치는 모든 동족들이 모든 탄소의 대칭성과 균일한 결합질서를 가진 방향족 화합물에서 파생될 수 있기 때문에 중요하지 않다. 호모콘주게이트 연결의 삽입은 ∆-electron 밀도 1 Δ3보다 커야 하며, 이 Δ3은 링 크기에 따라 0보다 커야 하며, 여기서 0은 동요하지 않고 1은 총 방향성 손실(개방 체인 형태와 동등한 확률)을 나타낸다.[12] 고리 크기가 증가함에 따라 호모콘쥬게이트 교량을 형성하는 스트레인에 의해 호모노메틱의 공명 안정화가 상쇄된다고 생각된다. 사실, 호모자성을 위한 최대 링 크기는 16mmb의 에베레스트린 링이 긴장된 브리지 호모에 대한 방향성 형성을 선호하기 때문에 상당히 낮다.[13]
2차 효과
두 번째 호모콘주게이트 연결
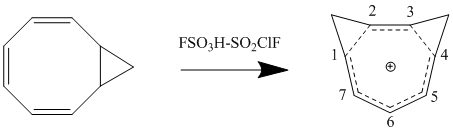
호모자성의 섭동 분자 궤도 모델에 대한 상당한 2차적 효과는 두 번째 호모콘쥬게이트 연계가 추가되고 안정성에 미치는 영향이다. 그 효과는 비록 두 링크의 근접성에 따라 달라지는 추가 용어가 있기는 하지만 단일 호모콘주게이트 연계가 추가됨으로써 초래된 불안정성의 두 배가 되는 경우가 많다. Δβ를 최소화하고 따라서 결합 기간을 최소로 유지하기 위해 공명에 의한 최대의 안정성과 최소의 장력 장애의 순응에 따라 비슈모마토메틱 화합물이 형성된다. cis-bycyclo[6.1.0]nona-2,4,6-triene을 양성하여 1,3-bichomotropenyum cation을 합성하는 것은 이론적 계산에 동의하고 제1탄소와 제3탄소에서 두 개의 메틸렌 다리를 형성하여 안정성을 최대화한다.[12]
대체품
호모자성 화합물에 대체물을 첨가하는 것은 화합물의 안정성에 큰 영향을 미친다. 대체물과 호모콘쥬게이트 연계의 상대적 위치에 따라 대체재는 안정화 또는 불안정화 효과를 가질 수 있다. 이러한 상호 작용은 대체된 대류 열량을 보는 것으로 가장 잘 입증된다. 제1탄소 또는 제3탄소 위치에서 cation에 유도 전자기증군이 부착되면 안정화 효과가 있어 화합물의 호모성격이 개선된다. 단, 이 같은 대체물을 제2탄소나 제4탄소에 부착하면 호모콘쥬게이트 교량에서의 대체물질간의 상호작용은 불안정한 효과를 가진다. 따라서 메틸 또는 페닐 대체 시클로옥타테트라엔의 양성화는 호모트로펜실리움 양이온의 1 이소체를 생성하게 된다.[12]
호마로메틱 화합물의 예
최초의 호모자성 화합물이 발견된 이후, 방향성 모화합물과 유사한 안정성을 가진 새로운 호모자성 화합물을 합성하는 연구가 진행되었다. 호모자성 화합물에는 여러 등급이 있는데, 각각 이론적으로 예측되고 실험적으로 증명되었다.
계양 호모로마틱스
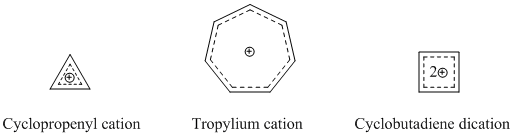
가장 확립되고 잘 알려진 호모자성 종은 계양성 호모자성 화합물이다. 앞서 언급했듯이 호모트로펜닐리움 양이온은 가장 많이 연구된 호모로메틱 화합물 중 하나이다. 많은 호모로메틱 양이온 화합물은 강한 방향성을 나타내기 때문에 사이클로프로페닐 양이온, 트로피룸 양이온 또는 시클로부타디엔 도취를 기본으로 사용한다.[14]
호모트로필리움 양이온 외에 또 다른 잘 확립된 양이온 호모아로메틱 화합물은 노보넨-7-yl 양이온으로, 이론적으로나 실험적으로 모두 입증된 강한 동모체임을 보여 왔다.[15]
σ-bishomomatomic의 흥미로운 사례는 이교도들의 통신에서 찾을 수 있다. 이러한 4-center-2-전자 시스템에서 탈색 현상은 4개의 탄소 원자에 의해 정의된 평면에서 발생한다(omatic-자율현상에 대한 형식은 효과로부터[16] 약 11.3 kcal 몰 안정성을−1 얻는 사이클로프로판이다). decommunication은 pagodane의 산화 또는 해당 bis-seco-dodechedradiene의 산화를 통해 액세스할 수 있다.[17]
그에 상응하는 6개의 전자의 감소가 지금까지는 가능하지 않았다.
중립 호마로마틱스
중성 호모자성 화합물에는 많은 계층이 있지만 실제로 호모자성을 보이는지에 대해서는 많은 논쟁이 있다. 중립적인 호모아로매틱스의 한 부류는 단모아로매틱스라고 불리며, 그 중 하나는 사이클로헥타틴이며, 수많은 복잡한 단모아로매틱스가 합성되었다. 한 가지 특별한 예는 단일 메틸렌 다리를 가진 60-카본 풀레로이드 파생상품이다. UV와 NMR 분석 결과, 이 변형 풀레로이드의 방향족은 호모콘쥬게이트 연계가 추가되어도 교란되지 않으므로, 이 화합물은 확실히 호모노메틱이다.[18]
비쇼모아로마틱스
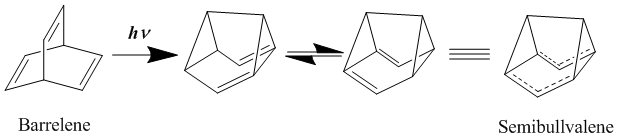
중립적인 호모아로매틱스의 가장 좋은 예는 배럴렌이나 세미불발렌과 같은 비슈모아로매틱스라고 오랫동안 여겨졌다. 1966년에 처음 합성된 [19]세미불발렌은 비록 세미불발렌 유도체들이 진정한 탈색, 지상중립의 호모자성 화합물을 제공할 수 있는지에 대해 많은 논쟁이 있었지만 호모자성에 잘 빌려주어야 할 구조를 가지고 있다. 세미불발렌을 전자 기증 및 수용 집단으로 대체함으로써 탈중앙화된 전이 구조를 더욱 안정화하려는 노력의 일환으로, 이러한 재배치에 대한 활성화 장벽을 낮출 수 있지만 제거하지는 못하는 것으로 나타났다.[20][21] 그러나 주기율의 전략적 추가를 통해 국부적인 지상 상태 구조를 불안정하게 하는 것을 목표로 하는 분자에 링 스트레인이 도입됨으로써, 실로 소산화된 호모자동 지상 상태 구조를 달성할 수 있다.[22]
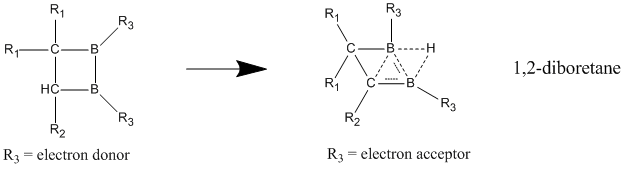
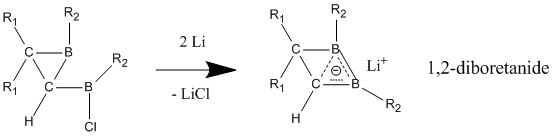
중립적인 호마로마틱스 중에서 중립적인 호마로마틱성을 가장 잘 나타내는 화합물은 1,2-디보레탄과 그 파생물의 화합물을 함유한 붕소다. 대체된 다이보레인은 국부적인 디보레인에 비해 탈초점화된 상태에서 안정성이 훨씬 높은 것으로 나타나 호모자성의 강한 징후를 보이고 있다.[23] 전자 기부 집단이 두 붕소 원자에 부착되면 화합물은 국부적 결합을 가진 고전적 모델을 선호한다. 호모자성 문자는 전자를 밀어내는 집단이 붕소 원자에 결합되어 이 화합물이 비전류적이고 황산화적인 구조를 채택하게 될 때 가장 잘 나타난다.
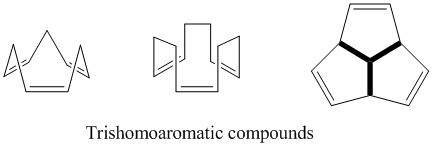
트리쇼모아로마틱스
이름에서 알 수 있듯이 삼류역학은 비슈오마러믹스에 비해 메틸렌교 1개를 추가로 함유하고 있는 것으로 정의되므로, 이러한 호모콘쥬게이트 교량 중 3개를 모두 함유하고 있다. 세미불발렌과 마찬가지로 삼위일체라는 호모적 성격의 정도에 대해서도 여전히 많은 논쟁이 있다. 이론적으로는 호모아로메틱이지만, 이들 화합물은 소산화에 의한 벤젠의 5% 이하의 안정화를 보인다.[24]
음이온 호마로마틱스
중성적인 호마로메틱 화합물과는 달리 음이온적인 호마로매틱스는 "진정한" 호마로메틱성을 나타내는 것으로 널리 받아들여지고 있다. 이러한 음이온성 화합물은 리튬 금속 감소를 통해 중성 모화합물로부터 준비되는 경우가 많다.12-디보레타니드 파생상품은 중성 고전 아날로그보다 짧은 C-B 결합을 함유한 3원자(보론, 붕소, 탄소) 2전자 결합을 통해 강한 호모자성을 보인다.[25] 이 1,2-디보레타니드는 다른 대체물을 가진 더 큰 링 크기로 확장될 수 있으며, 모두 어느 정도 동음이의성을 포함하고 있다.
음이온성 호모마모티즘은 또한 4원자(니트로겐 4개), 6전자 중심인 다이오노믹 bis-diazene 화합물에서도 볼 수 있다. 실험 결과, 초경질소-질소 간 거리가 짧아져 있어 다이노닉 비스-다이아젠이 음이온성 비슈모마토모마토메틱 화합물의 한 유형임을 입증했다. 이들 시스템의 특이한 특징은 4개의 니트로겐이 정의한 σ-평면에서 순환 전자 소산화가 일어나고 있다는 점이다. 따라서 이러한 bis-diazene-dianion은 4-center-6-electron σ-bishomatic의 첫 번째 예다.[26][27] 이에 상응하는 2개의 전자 σ-근체적 체계는 파고단 디커뮤니케이션(위 참조)의 형태로 실현되었다.
반자동성
또한 반호모자성 화합물에 대한 보고도 있다. 방향족 화합물이 탁월한 안정성을 보이듯 허클의 법칙에서 벗어나 4n π 전자의 폐쇄 루프를 포함하는 반자율 화합물은 상대적으로 불안정하다. 브릿지 자전거[3.2.1]옥타-3,6-dien-2-yl cation은 4㎛ 전자만을 포함하고 있어 "비교 반자동"이다. 일련의 이론적 계산을 통해 해당 아군계보다 실제로 안정성이 떨어진다는 것을 확인할 수 있다.[28]
Similarly, a substituted bicyclo[3.2.1]octa-3,6-dien-2-yl cation (the 2-(4'-Fluorophenyl) bicyclo[3.2.1]oct-3,6-dien-2-yl cation) was also shown to be an antiaromate when compared to its corresponding allyl cation, corroborated by theoretical calculations as well as by NMR analysis.[28]
외부 링크
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "Homoaromatic". doi:10.1351/골드북.H02839
- ^ a b Winstein, S (1959). "Homo-Aromatic Structures". J. Am. Chem. Soc. 81 (24): 6523. doi:10.1021/ja01533a052.
- ^ Freeman, P. K. (2005). "Neutral Homoaromaticity in Some Neutral Heterocycles". J. Org. Chem. 70 (6): 1998–2001. doi:10.1021/jo040250o. PMID 15760178.
- ^ Winstein, S.; Sonnenberg, J.; DeVries, L. (1959). "The Tris-Homocyclopropenyl Cation". J. Am. Chem. Soc. 81 (24): 6523–6524. doi:10.1021/ja01533a051.
- ^ 르 노블, W. J. 하이라이트 오브 유기 화학: 고급 교과서; 마르셀 드커, 주식회사: 1974년 뉴욕. ISBN 0-8247-6210-X
- ^ a b c d Childs, R. F. (1984). "The Homotropylium Ion and Homoaromaticity". Acc. Chem. Res. 17 (10): 347–352. doi:10.1021/ar00106a001.
- ^ Schleyer, P. R. (2001). "Introduction: Aromaticity". Chem. Rev. 101 (5): 1115–1118. doi:10.1021/cr0103221. PMID 11749368.
- ^ Rosenburg, J. L.; Mahler, J. E.; Pettit, R. J. (1962). "The Bicyclo[5.1.0]octadienyl Cation, A New Stable Carbonium Ion". J. Am. Chem. Soc. 84 (14): 2842–2843. doi:10.1021/ja00873a051.
- ^ Winstein, S.; Kaesz, H.D.; Kreiter, C.G.; Friedrich, E.C. (1965). "Homotropylium Ion and its Molybdenum Tricarbonyl Complex". J. Am. Chem. Soc. 87 (14): 3267–3269. doi:10.1021/ja01092a060.
- ^ Winstein, S.; Kreiter, C.G.; Brauman, J.I. (1966). "Ring Inversion, Ultraviolet Spectrum, and Electronic Structure of the Monohomotropylium Ion". J. Am. Chem. Soc. 88 (9): 2047–2048. doi:10.1021/ja00961a037.
- ^ Haddon, R.C. (1975). "The structure of the homotropenylium cation". Tetrahedron Lett. 16 (11): 863–866. doi:10.1016/S0040-4039(00)72004-1.
- ^ a b c d Haddon, R.C. (1975). "Perturbational molecular orbital (PMO) theory of homoaromaticity". J. Am. Chem. Soc. 97 (13): 3608–3615. doi:10.1021/ja00846a009.
- ^ Oth, J.F.M.; Smith, D.M.; Prange, U.; Schröder, G. (1973). "A [16]Annulenediyl Dication". Angew. Chem. Int. Ed. Engl. 12 (4): 327–328. doi:10.1002/anie.197303271.
- ^ Sal'nikov, G.E.; Genaev, A.M.; Mamatyuk, V.I.; Shubin, V.G. (2008). "Homophenalenyl cations, new representatives of homoaromatic systems". Russ. J. Org. Chem. 44 (7): 1000–1005. doi:10.1134/S1070428008070099. S2CID 93688550.
- ^ 캐리, F.A.; 선드버그, R.J. 고급 유기 화학: 파트 A: 구조와 메커니즘, 클루워어 아카데미/플레넘 출판사: 뉴욕, 2000; 327-334. ISBN 978-0-387-68346-1
- ^ Exner, Kai; Schleyer, Paul von Ragué (2001). "Theoretical Bond Energies: A Critical Evaluation". J. Phys. Chem. A. 105 (13): 3407–3416. Bibcode:2001JPCA..105.3407E. doi:10.1021/jp004193o.
- ^ Prinzbach, H.; Gescheidt, G.; Martin, H.-D.; Herges, R.; Heinze, J.; Prakash, G. K. Surya; Olah, G. A. "Cyclic electron delocalization in hydrocarbon cages (pagodanes, isopagodanes, (bisseco-/seco-)-(dodecahedradienes))". Pure and Applied Chemistry. 67 (5): 673–682, 1995. doi:10.1351/pac199567050673. S2CID 96232491.
- ^ Suzuki, T.; Li, Q.; Khemani, K.C.; Wudl, F. (1992). "Dihydrofulleroid H3C61: synthesis and properties of the parent fulleroid". J. Am. Chem. Soc. 114 (18): 7301–7302. doi:10.1021/ja00044a055.
- ^ Zimmerman, H. E.; Grunewald, G. L. (1966). "The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene". Journal of the American Chemical Society. 88: 183–184. doi:10.1021/ja00953a045.
- ^ Dewar, M.J.S.; Lo, D.H. (1971). "Ground states of .sigma.-bonded molecules. XIV. Application of energy partitioning to the MINDO/2 method and a study of the Cope rearrangement". J. Am. Chem. Soc. 93 (26): 7201–7207. doi:10.1021/ja00755a014.
- ^ Hoffman, D.; Stohrer, W-D (1971). "Cope rearrangement revisited". J. Am. Chem. Soc. 93 (25): 6941–6948. doi:10.1021/ja00754a042.
- ^ Griffiths, P. R.; Pivonka, D. E.; Williams, R. V. (2011). "The Experimental Realization of a Neutral Homoaromatic Carbocycle". Chemistry: A European Journal. 17 (33): 9193–9199. doi:10.1002/chem.201100025. PMID 21735493.
- ^ Steiner, D.; Balzereit, C.; Winkler, H. J. R.; Stamatis, N.; Massa, W.; Berndt, A.; Hofmann, M.; Von Ragué Schleyer, P. (1994). "Nonclassical 1,2-Diboretanes and 1,2-Diborolanes". Angewandte Chemie International Edition in English. 33 (22): 2303–2306. doi:10.1002/anie.199423031.
- ^ Martin, H.D.; Mayer, B. (1983). "Proximity Effects in Organic Chemistry?The Photoelectron Spectroscopic Investigation of Non-Bonding and Transannular Interactions". Angew. Chem. Int. Ed. Engl. 22 (4): 283–314. doi:10.1002/anie.198302831.
- ^ Steiner, D.; Winkler, H.; Balzereit, C.; Happel, T.; Hofmann, M.; Subramanian, G.; Schleyer, P.V.R.; Massa, W.; Berndt, A. (1996). "1,2-Diboretanides: Homoaromatic 2π-Electron Compounds with High Inversion Barriers". Angew. Chem. Int. Ed. Engl. 35 (17): 1990–1992. doi:10.1002/anie.199619901.
- ^ Exner, K.; Hunkler, D.; Gescheidt, G.; Prinzbach, H. (1998). "Do Nonclassical, Cyclically Delocalized 4N/5e Radical Anions and 4N/6e Dianions Exist? – One- and Two-Electron Reduction of Proximate, Synperiplanar Bis-Diazenes". Angew. Chem. Int. Ed. Engl. 37 (13–14): 1910–1913. doi:10.1002/(SICI)1521-3773(19980803)37:13/14<1910::AID-ANIE1910>3.0.CO;2-D.
- ^ Exner, K.; Cullmann, O.; Vögtle, M.; Prinzbach, H.; Grossmann, B.; Heinze, J.; Liesum, L.; Bachmann, R.; Schweiger, A.; Gescheidt, G. (2000). "Cyclic In-Plane Electron Delocalization (σ-Bishomoaromaticity) in 4N/5e Radical Anions and 4N/6e Dianions – Generation, Structures, Properties, Ion-Pairing, and Calculations". J. Am. Chem. Soc. 122 (43): 10650–10660. doi:10.1021/ja0014943.
- ^ a b Volz, H.; Shin, J. (2006). "Bicyclo[3.2.1]octa-3,6-dien-2-yl Cation: A Bishomoantiaromate". J. Org. Chem. 71 (6): 2220–2226. doi:10.1021/jo0515125. PMID 16526766.