운동 동위원소 효과
Kinetic isotope effect물리적 유기 화학에서, 운동성 동위원소 효과(KIE)는 반응 물질에 있는 원자 중 하나가 동위원소 중 하나로 대체되었을 때 화학 반응의 반응률의 변화를 말한다.[3][4] 공식적으로는 빛(kL)과 무거운(kH) 동위원소 대체 반응제(등소토폴로지)를 포함하는 반응에 대한 속도 상수의 비율이다.
이러한 반응률의 변화는 주로 가벼운 동위원소에 비해 낮은 진동수를 갖는 무거운 동위원소로부터 비롯되는 양자역학적 효과다. 대부분의 경우, 이는 보다 무거운 동위원소가 전환 상태(또는 드물게, 분화 한계)에 도달하기 위해 필요한 더 큰 에너지 입력과 결과적으로 더 느린 반응 속도를 의미한다. 운동성 동위원소 효과 연구는 특정 화학 반응의 반응 메커니즘의 해명에 도움을 줄 수 있으며, 신진대사 취약성 C-H 결합을 보호함으로써 불리한 약동학을 개선하기 위해 약물 개발에 때때로 이용된다.
배경
운동 동위원소 효과는 반응 메커니즘의 연구를 위해 가장 필수적이고 민감한 도구 중 하나로 간주되며, 이에 대한 지식으로 해당 반응의 바람직한 품질을 개선할 수 있다. 예를 들어, 운동동위원소 효과를 사용하여 핵 대체 반응이 단분자(S1N) 경로를 따르는지 또는 이분자(S2N) 경로를 따르는지 여부를 밝힐 수 있다.
메틸브로마이드와 시안화물의 반응에서(이론에서 제시된) 관찰된 메틸 탄소 운동성 동위원소 효과는 S2N 메커니즘을 나타낸다.[1] 경로에 따라, 반응의 요율 결정 단계의 전환 상태를 안정시키고, 산업 용도에 중요한 반응률과 선택성을 개선하기 위해 다른 전략을 사용할 수 있다.
동위원소 속도 변화는 상대적 질량 변화가 가장 클 때 가장 뚜렷하게 나타난다. 그 영향은 영향을 받는 채권의 진동수와 관련이 있기 때문이다. 예를 들어 수소 원자(H)를 동위원소 중수소(D)로 바꾸면 질량이 100% 증가하는 반면 탄소-12를 탄소-13으로 대체하면 질량은 8% 증가하는 데 불과하다. C-H 결합과 관련된 반응 속도는 일반적으로 해당 C-D 결합보다 6-10배 더 빠른 반면, C 반응은 해당 C[5]: 445 반응보다 4% 더 빠를 뿐이다(두 경우 모두 동위원소가 하나의 원자 질량 단위 더 무겁더라도).
동위원소 대체는 다양한 방법으로 반응 속도를 수정할 수 있다. 많은 경우, 원자의 질량이 반응에 대한 잠재적 에너지 표면이 거의 동일하더라도, 원자가 형성하는 화학 결합의 진동 주파수에 영향을 미친다는 점에 주목함으로써 속도 차이를 합리화할 수 있다. 동위원소가 무거우면 진동 주파수가 낮아지거나(일반적으로) 양자 관측 시 0점 에너지가 낮아진다. 0점 이하 에너지에서는 더 많은 에너지를 공급해야 결합을 깨뜨릴 수 있으며, 결과적으로 결합 분할에 대한 활성화 에너지가 더 높아져 측정된 비율이 낮아진다(예: 아르헤니우스 방정식 참조).[3][5]: 427
분류
1차 운동 동위원소 효과
1차 운동동위원소 효과는 동위원소 라벨 원자에 대한 결합이 형성되거나 파손될 때 발견될 수 있다.[3][5]: 427 운동동위원소 효과를 조사하는 방법(율의 병렬 측정 대 분자간 경쟁 대 분자간 경쟁 대 분자 내 경쟁)에 따라, 1차 운동동위원소 효과의 관찰은 속도 제한 단계 또는 후속 제품 결정 단계에서 동위원소에 대한 결합을 끊거나 형성하는 것을 나타낸다. (일차 운동 동위원소 효과가 속도 제한 단계에서 동위원소에 대한 결합 갈라짐/형식을 반영해야 한다는 잘못된 생각은 교과서 및 일차 문헌에서 자주 반복된다: 아래 실험 섹션을 참조).[6]
앞서 언급한 핵동위원소 대체반응의 경우, 1차 운동동위원소 효과는 대체물이 발생하는 이탈군, 핵동위원소 및 α-탄소 모두에 대해 조사되었다. 이탈군 운동동위원소 효과의 해석은 온도 독립인자의 유의한 기여 때문에 처음에는 어려웠다. 비록 이 운동동위원소 효과는 이상적인 것 보다 덜 민감하지만, 또한 비운동적 인자의 기여로 인해 α-탄소에서의 운동동위원소 효과는 S2N 반응에서 전환 상태의 대칭으로 어느 정도 이해를 발전시키는 데 사용될 수 있다.[1]
이차 운동 동위원소 효과
2차 운동동위원소 효과는 반응물질에서 동위원소 라벨이 부착된 원자에 대한 결합이 깨지거나 형성되지 않을 때 관찰된다.[3][5]: 427 2차 운동동위원소 효과는 1차 운동동위원소 효과보다 훨씬 작은 경향이 있다. 그러나 2차 중수소 동위원소 효과는 중수소 원자당 1.4배만큼 클 수 있으며, 중소 동위원소 효과를 매우 높은 정밀도로 측정하는 기법이 개발되어 2차 운동동위원소 효과는 여전히 엘에 매우 유용하다.자극적인 반응 메커니즘
앞서 언급한 핵소화 대체 반응의 경우, α-탄소에서의 2차 수소 운동 동위원소 효과는 S1N 반응과 S2N 반응을 구별하는 직접적인 수단을 제공한다. S1N 반응은 전형적으로 큰 2차 운동 동위원소 효과를 일으켜 이론적 최대치에 근접하는 반면, S2N 반응은 전형적으로 일차 운동 동위원소 효과를 내는데 이는 단일성에 매우 가깝거나 그보다 적은 것으로 밝혀졌다. 1보다 큰 운동동위원소 효과를 정상 운동동위원소 효과라고 하고, 1보다 작은 운동동위원소 효과를 역운동동위원소 효과라고 한다. 일반적으로 전환 상태에서 작은 힘 상수는 정상적인 운동 동위원소 효과를 낼 것으로 기대되며, 전환 상태에서 큰 힘 상수는 진동 기여도가 운동 동위원소 효과를 지배할 때 역운동 동위원소 효과를 낼 것으로 예상된다.[1]
α-탄소에서의 그러한 이차 동위원소 효과의 크기는 주로 C-Hα(D) 진동에 의해 결정된다. S1N 반응의 경우, C-Hα(D) 본드 순서의 증가에 따라 속도 결정 단계의 전환 상태에서 탄소가 스파이드2 혼합 카르베늄 이온으로 변환되기 때문에, 스트레칭 진동만 중요하면 역운동 동위원소 효과가 예상된다. 관측된 큰 정상 운동동위원소 효과는 반응제에서 카르베늄 형성의 전환 상태로 이동할 때 평면 외 휨 진동 기여에 의해 발생하는 것으로 확인된다. S2N 반응의 경우, 휨 진동은 여전히 운동 동위원소 효과에 중요한 역할을 하지만, 스트레칭 진동 기여도는 더 비교 가능한 크기이며, 결과 운동 동위원소 효과는 각 진동의 특정 기여도에 따라 정상 또는 역적일 수 있다.[1][7][8]
이론
동위원소 효과의 이론적 치료는 반응에 대한 단일 잠재적 에너지 표면을 가정하는 전환 상태 이론에 크게 의존하며, 그 위에 전환 상태가 존재하는 반응 물질과 이 표면의 제품 사이의 장벽이 있다.[9][10] 운동동위원소 효과는 주로 잠재적 에너지 표면의 최소 에너지 경로를 따라 동위원소 섭동에 의해 생성된 진동 접지 상태의 변화에서 발생한다. 이 변화는 시스템의 양자 기계적 처리로만 설명될 수 있다. 에너지 장벽의 반작용 좌표와 자연(폭과 높이)을 따라 이동하는 원자의 질량에 따라 양자 기계적 터널링도 관측된 운동동위원소 효과에 큰 기여를 할 수 있으며, 또한 "반분류적" 전환 상태 이론 모델 외에 별도로 고려할 필요가 있을 수 있다.[9]
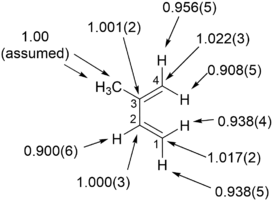
중수소 운동동위원소 효과(2H KIE)는 단연코 가장 일반적이고 유용하며 잘 이해되는 운동동위원소 효과 유형이다. 밀도 함수 이론 계산을 이용한 중수소 운동동위원소 효과의 정확한 수치 예측은 이제 비교적 일상적인 일이다. 더욱이 여러 정성적 및 반정량적 모델은 중수소 동위원소 효과의 대략적인 추정을 계산 없이 할 수 있게 하며, 종종 실험 데이터를 합리화하거나 심지어 서로 다른 기계론적 가능성을 지지하거나 반박할 수 있는 충분한 정보를 제공한다. 중수소를 함유한 출발 재료는 종종 상업적으로 이용이 가능하기 때문에 동위원소 농축 출발 재료의 합성이 비교적 간단하다. 또한 중수소 및 프로토늄 질량의 상대적 차이가 크고 진동 주파수의 동반자 차이 때문에, 동위원소 효과의 크기는 프로토늄과 삼중수소를 제외한 다른 동위원소 쌍보다 크므로 1차 및 2차 동위원소 효과를 모두 쉽게 측정하고 해석할 수 있다.[11] 대조적으로, 이차 효과는 일반적으로 무거운 원소에 대해 매우 작으며 실험 불확실성에 근접하여 이들의 해석을 복잡하게 하고 효용을 제한한다. 동위원소 효과의 맥락에서 수소는 특히 빛 동위원소인 프로튬(1H)을 가리키는 데 자주 사용된다. 이 글의 나머지 부분에서는 병렬 문법구축에서 수소와 중수소를 언급하거나 이들 사이의 직접 비교를 원소와 중수소를 지칭하는 것으로 해석해야 한다.[12]
운동 동위원소 효과 이론은 1949년 제이콥 비글리센에 의해 처음 공식화되었다.[13][5]: 427 중수소 운동동위원소 효과에 대한 비겔리센의 일반 공식(이것은 더 무거운 원소에도 적용된다)은 다음과 같다. 그것은 속도 상수H k와D k의 계산을 위해 전환 상태 이론과 변환, 회전 및 진동 수준의 통계적 기계적 처리를 채택한다. 그러나 이 공식은 별도의 보정 계수로 도입되는 경우가 많은 양자 터널링의 기여를 소홀히 한다는 점에서 '세미클래식'이다. 비글리센의 공식은 또한 C-H 결합에 비해 약간 짧은 C-D 결합으로 인한 비결합 반발 상호작용의 차이도 다루지 않는다. 반면 또는 다량의 double-dagger 없이, ‡, 전이 상태 또는 반응제 기저 상태에 각각 부르는 방정식에서는,, 아래 첨자 H나 D와 함께 다량의 hydrogen- 또는deuterium-substituted종에 각각 참조하십시오.[8][14](엄격히 말하자면, 한κ H/κ D{\displaystyle \kappa_{\mathrm{H}}/\kappa. 전송 계수의 동위원소 차이에 따른 항도 포함되어야 한다.)[15]
- ,
우리가 정의한 곳
- and
여기서 h는 플랑크 상수, k는B 볼츠만 상수, ~ i 는 진동의 주파수로, c는 빛의 속도, N은A 아보가드로 상수, R은 범용 기체 상수다. σX(X = H 또는 D)는 반응제 및 전환 상태의 대칭수이다. M은X 해당 종의 분자질량이며, IqX(q = x, y 또는 z) 용어는 세 개의 주요 축에 대한 관성의 순간이다. u는iX 해당 진동 주파수인 ν과i 진동 제로 포인트 에너지(아래 참조)에 정비례한다. 정수 N과 N은‡ 각각 반응 물질과 전환 상태에 있는 원자의 수입니다.[8] 위에 제시된 복잡한 표현은 다음과 같은 네 가지 개별 요소의 산물로 나타낼 수 있다.[8]
- .
중수소 동위원소 효과의 특별한 경우에 대해, 우리는 처음 3개 항이 통일성과 동등하거나 근사치인 것으로 취급될 수 있다고 주장할 것이다. 첫 번째 요인 S(σX 포함)는 다양한 종에 대한 대칭수의 비율이다. 이는 반응제 및 전환 상태에서 동일한 원자나 집단의 순열화로 이어지는 분자 및 결합 회전 수에 따라 달라지는 합리적인 수(정수의 비율)가 될 것이다.[14] 대칭성이 낮은 시스템의 경우, 모든X ((반응 상태 및 전이 상태)은 통일성이 될 것이므로 S는 종종 방치될 수 있다. MMI 인자(M과X IqX 포함)는 분자 질량과 관성 모멘트의 비율을 가리킨다. 수소와 중수소는 대부분의 반응제 및 전이 상태에 비해 훨씬 가벼운 경향이 있기 때문에 분자를 포함하는 H와 D 사이의 분자 질량과 관성 모멘트에는 거의 차이가 없기 때문에 MMI 인자 또한 대개 단결로서 근사치를 이룬다. EXC 계수(진동 파티션 함수의 산물 포함)는 진동으로 흥분한 분자의 반응에 의해 발생하는 운동 동위원소 효과를 보정한다. 흥분 상태 A–H/D 결합 진동을 가질 수 있을 만큼 충분한 에너지를 가진 분자의 분율은 일반적으로 상온 또는 근방의 반응에 대해 작다(수소에 대한 결합은 보통 1000 cm−1 이상에서 진동하므로 exp(-ui) = exp(-hhi/kTB) 298 K에서 0.01 < 1–exp(-ui) 인자의 기여도는 무시할 수 있다. 따라서 수소/중수소 운동동위원소 효과의 경우 관측된 값은 일반적으로 마지막 요인인 ZPE(진동 제로 포인트 에너지 차이의 지수 함수)에 의해 지배되며, 반응제 및 전환 상태의 각 진동 모드에 대한 영점 에너지 차이의 기여로 구성된다.다음과 같이 얼버무렸다.[8]
- 1}:{1}{n2}}:\
우리가 정의한 곳
- and .
두 번째 표현식의 지수 합계는 반응제 접지 상태와 전환 상태의 모든 진동 모드에서 실행되는 것으로 해석할 수 있다. 또는 반응물 또는 전환 상태에 고유한 모드를 실행하거나 반응 좌표를 따라 전진할 때 진동 주파수가 크게 변하는 것으로 해석할 수 있다. 리액터 및 전환 상태 진동 모드의 나머지 쌍은 i{\와 i {\ 매우 유사하며, 지수 합계가 계산될 때 취소된다. 따라서 실제로 중수소 KIE는 이러한 취소로 인해 소수의 주요 진동 모드에 크게 의존하여 k/k에HD 대한 정성적 분석이 가능하다.[14]
언급한 바와 같이, 특히 수소/중수소 대체물의 경우, 대부분의 운동동위원소 효과는 해당 동위원소의 반응물질과 전환상태 사이의 영점 에너지(ZPE)의 차이에서 발생하며, 이 차이는 Born-Openheimer 근사치 내에서 다음 설명으로 질적으로 이해할 수 있다., 잠재적 에너지 표면은 두 동위원소 종에 대해 동일하다. 그러나 에너지의 양자기계적 처리방법은 이 곡선에 이산 진동 수준을 도입하며, 분자의 가능한 최저 에너지 상태는 잠재적 에너지 곡선의 최소치보다 에너지가 약간 높은 최저 진동 에너지 수준에 해당한다. 영점 에너지로 불리는 이 차이는 C-H 또는 C-D 결합 길이에 불확실성이 필요한 하이젠베르크 불확실성 원리의 발현이다. (이 경우 중수종)이 무거울수록 (이 경우) 고전적인 전위 에너지 곡선에 더 가깝고, 0점 에너지가 더 낮다. 두 동위원소 종 사이의 영점 에너지 차이는 적어도 대부분의 경우 전환 상태에서 감소하는데, 이는 결합 파괴 시 결합력 상수가 감소하기 때문이다. 따라서 중수종의 낮은 영점 에너지는 다음 그림에서 볼 수 있듯이 그 반응에 대한 더 큰 활성화 에너지로 해석되어 정상적인 운동 동위원소 효과를 이끌어 낸다.[16] 이 효과는 원칙적으로 시작 재료에 대한 모든 3N-6 진동 모드와 전환 상태에서 3N-7‡ 진동 모드(결합이 깨지고 운동에 대한 회복력이 없기 때문에 하나의 모드인 반응 좌표에 해당하는 모드가 전환 상태에서 누락됨)를 고려해야 한다. 조화 발진기는 적어도 저에너지 진동 상태에 대해서는 진동 결합에 대한 좋은 근사치가 된다. 양자역학은 진동 영점 에너지를 i( )= 1 h i \}^{0)={\}{2i로 부여한다. 따라서 above의 인자와 = h i/ T 항을 지상 상태 및 전환 상태 진동 모드로 쉽게 해석할 수 있다. 고조파 오실레이터의 경우 진동 주파수는 진동 시스템의 감소된 질량의 제곱근에 반비례한다.
- ,
여기서 k는f 힘이 상수인 것이다. 더욱이 감소된 질량은 X = H 또는 D의 광원자의 질량에 의해 근사치가 된다. m은D 대략 2mH 정도 되기 때문에
- .
균질 C–H/D 채권 분리의 경우 전환 상태 용어가 사라지고, 다른 진동 모드인H k/kD = exp(Δu)를 무시한다.i 따라서 보다 엄격한 ("강력한") C–H/D 결합에 대해 더 큰 동위원소 효과가 관찰된다. 대부분의 관심 반응에서 수소 원자는 두 원자 사이에 전이 상태[A····]로 전달된다.전환 상태의 H···B]‡와 진동 모드를 설명할 필요가 있다. 그럼에도 불구하고, 진동 주파수가 높은 결합의 갈라짐이 더 큰 동위원소 효과를 줄 것이라는 것은 여전히 일반적으로 사실이다.
한non-tunneling 중수소 KIE의 최대 가능한 가치를 계산할 때 우리는 그 사건은 전형적인 전문 채권(3000cm−1)의 스트레칭하는 진동이나 carbon-deuterium 채권(2200명 cm−1)사이의 영점 에너지 차이는 전이 상태에서((는 에너지 차이 1/2)(3000– 있었던 2200명 이상 cm−1)=400cm−1이 사라지라고 생각한다.또는 about 1.15 kcal/mol), 전환 상태의 영점 에너지 차이(예: 대칭 A····)에 대한 보상 없이.H··B 스트레칭, 전환국 고유). 위에 주어진 단순화된 공식은 kH/k에D 대한 최대값을 6.9로 예측한다. 두 개의 휨 진동이 완전히 사라지는 현상도 포함하면 15-20에 달하는 kH/kD 값을 예측할 수 있다. 그러나 전환 상태에서 휨 주파수는 사라질 가능성이 매우 낮으며, 실온에 가까운 kH/kD 값이 7-8을 초과하는 경우는 극히 적다. 더욱이, 터널링이 그러한 값을 초과했을 때 주요 요인이 된다는 것이 종종 발견된다. kH/kD ~ 10의 값은 298 K 주변에서 일어나는 반응에 대한 반분류 1차 운동성 동위원소 효과(터널링 없음)에 대해 최대치로 간주된다(kH/k의D 공식은 온도 의존성이 있으므로 낮은 온도에서 더 큰 동위원소 영향이 가능하다).[17] H-transfer(대칭 vs)의 전환 상태의 특성에 따라 달라진다. "1차 중수소 동위원소 효과가 이 최대치에 근접하는 범위" 또는 "늦은" 및 "선형 대 구부러진"). 웨스트하이머가 개발한 모델은 대칭(열원체, 해몬드 포스트레이트)인 선형 전이 상태가 가장 큰 동위원소 효과를 가지는 반면, "초기" 또는 "후기"인 전환 상태(각각 발열 반응이나 내열 반응의 경우), 또는 비선형(예: 순환)는 더 작은 효과를 나타낸다고 예측했다. 이러한 예측은 그 후 광범위한 실험적인 지지를 받았다.[18]
2차 중수소 동위원소 효과의 경우 스트리트위저는 반응제 접지 상태에서 전환 상태로의 벤딩 모드의 약화(또는 강화)가 관측된 동위원소 효과에 크게 책임이 있다고 제안했다. 이러한 변화는 H/D에 바인딩된 탄소가3 sp에서2 sp로 재혼성(α 이차 운동동위원소 효과) 또는 그 반대인 경우(α 이차 운동동위원소 효과)로 인해 결합이 약화된 경우(β 이차 운동동위원소 효과)에 기인한다. 이러한 동위원소 효과는 이론상 최대치가H k/kD = 20.5 1 1.4이다. α 위치에서 2차 운동동위원소 효과의 경우, sp에서3 sp로2 재교정하면 정상 동위원소 효과가 발생하는 반면, sp에서2 sp로3 재교정하면 이론적 최소치인H k/kD = 2-0.5 ≈ 0.7의 역동위원소 효과가 발생한다. 실제로 α 이차 운동동위원소 효과의H 경우 k/k ~ 1.1-1.2H, kD/k ~ 0.8-0.9가 일반적이고H, β 이차 운동동위원소 효과의D 경우 k/k ~ 1.15-1.3이차 운동동위원소 효과는 k/kD ~ 1.15-1.3이 대표적이다. 여러 개의 동위원소 대체 β-수소 원자를 포함하는 반응물질의 경우, 관측된 동위원소 효과는 일치 작용하는 β 위치에서 여러 개의 H/D의 결과인 경우가 많다. 이 경우 동위원소 라벨이 붙어 있는 각 원자의 효과는 곱하기 마련이며, kH/kD > 2가 흔치 않은 경우다.[19]
스와인 방정식(또는 스와인-샤드-스티버 방정식)으로도 알려져 있는 중수소 및 삼중수소 운동동위원소 영향과 관련된 다음과 같은 간단한 표현은 일부 단순화를 사용하여 위에 주어진 일반적인 표현에서 도출할 수 있다.[9][20]
- ;
즉,
- .
이러한 표현을 도출할 때 감소된 질량이 수소, 중수소 또는 삼중수소의 질량과 거의 같다는 합리적인 근사치를 사용했다. In addition, the vibrational motion was assumed to be approximated by a harmonic oscillator, so that (X = H, D, or T). 첨자 "s"는 양자 터널링을 무시하는 이러한 "반분류" 운동 동위원소 효과를 가리킨다. 터널링 기여금은 별도로 보정 계수로 처리해야 한다.
수소 이외의 원소를 포함하는 동위원소 효과의 경우, 이러한 단순화 중 다수는 유효하지 않으며, 동위원소 효과의 크기는 일부 또는 모든 무시된 요인에 강하게 의존할 수 있다. 따라서 수소 이외의 원소에 대한 운동 동위원소 효과는 합리화하거나 해석하기가 훨씬 더 어려운 경우가 많다. 많은 경우 특히 수소 전달 반응의 경우 터널링으로 인한 운동 동위원소 효과에 대한 기여도가 유의하다(아래 참조).
터널링
어떤 경우에는 양자 기계적 튜닝으로 인해 더 가벼운 동위원소에 대한 추가 속도 향상이 나타난다. 이것은 일반적으로 수소 원자에 대한 결합과 관련된 반응에 대해서만 관찰된다. 터널링은 분자가 에너지 장벽 위로가 아니라 잠재적 에너지 장벽을 통해 침투할 때 발생한다.[21][22] 고전역학의 법칙에 의해 허용되지는 않지만, 입자는 파동-입자 이중성을 기반으로 한 양자역학에서 고전적으로 금지된 우주의 영역을 통과할 수 있다.[23]
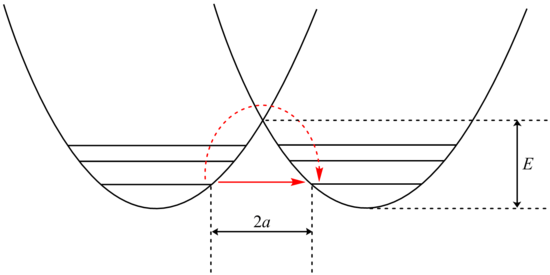
터널링 분석은 Bell이 Arrhenius 방정식을 수정하여 수행할 수 있으며, 여기에는 터널링 계수 Q:
여기서 A는 Arrhenius 매개변수, E는 장벽 높이 및
여기서 = 및 = 2 ( E) /
β 항을 검사하면 입자의 질량에 대한 기하급수적인 의존성이 나타난다. 그 결과, 터널링은 수소 같은 가벼운 입자가 될 가능성이 훨씬 더 높다. 터널링 양성자의 질량을 중수소 동위원소로 교체하여 두 배로 증가시키는 것만으로도 그러한 반응의 속도는 급격히 감소한다. 그 결과 0점 에너지의 차이로 설명할 수 없는 매우 큰 운동 동위원소 영향이 관찰된다.

또한 β 항은 장애물 폭 2a에 선형적으로 의존한다. 질량과 마찬가지로 터널링도 작은 장벽 폭에 가장 크다. 공여자와 수용자 원자 사이의 양성자의 최적 터널링 거리는 0.4 å이다.[25]
터널링(tunneling)은 운동학(kynetics)이 아니라 파동역학의 법칙에 얽매여 있는 양자역학적 효과다. 따라서, 터널링은 저온에서 더 중요해지는 경향이 있는데, 그 곳에서는 아무리 작은 운동 에너지 장벽도 극복하지 못하지만 터널을 통과할 수 있다.[21]
Peter S. Zuev 외 연구진은 1-메틸사이클로부틸플루오로카르베네 1-메틸사이클로부틸프렌의 링 확장에 대한 속도 상수를 질소 4.0 x 10−6/s, 아르곤 4.0 x 10−5/s로 보고하였다. 그들은 8 켈빈에서, 보고된 속도 상수가 온도에 독립적이고 비율에 대한 터널링 기여도가 전환 상태 에너지 장벽을 통과하는 기여도보다 152배 더 크도록 반응 물질의 단일 양자 상태를 통해 반응이 진행된다고 계산했다.[26]
그래서 기존의 화학반응이 온도가 낮아질수록 급격히 느려지는 경향이 있음에도 불구하고 터널반응은 전혀 변하지 않는다. 활성화 장벽을 통과하는 입자는 중간 종, 반응 물질 또는 제품의 파동 기능이 반응의 에너지 표면을 따라 특정 수조의 에너지 웰에 국한되지 않고 다음 에너지 최소값으로 "누출"할 수 있다는 사실의 직접적인 결과물이다. 이 점에 비추어 볼 때 터널링은 온도에 따라 독립적이어야 한다.[21][3]
온도 범위 363–463 K를 초과하는 수소 원자에 의한 기체 n-alkanes 및 사이클로알카인의 수소 추상화에 대해, H/D 운동동위원소 효과 데이터는 0.43 ~ 0.54 범위의 작은 원소 계수H A/A와D 9.0 ~ 9.7 kJ/mol의 큰 활성화 에너지 차이로 특징지어졌다. 전환 상태 이론에 근거하여, 큰 활성화 에너지 차이와 관련된 작은 A 인자 비율(일반적으로 C-H(D) 채권의 경우 약 4.5 kJ/mol)이 터널링에 대한 강력한 증거를 제공했다. 이 논의의 목적상, 그들이 사용한 다양한 파라핀에 대한 A 인자 비율은 온도 범위 전체에 걸쳐 근사적으로 일정하다는 것이 중요하다.[27]
터널링이 온도에 완전히 독립적인 것은 아니라는 관찰은 특정 종의 모든 분자가 다양한 온도에서 진동하는 지상 상태를 점유하지 않는다는 사실에서 설명될 수 있다. 잠재적 에너지 유정에 열 에너지를 추가하면 지상 상태 이외의 진동 수준이 높아질 수 있다. 전통적인 운동학적 추진 반응의 경우, 이러한 흥분은 비율에 작은 영향을 미칠 뿐이다. 그러나 터널링 반응의 경우 제로 포인트 에너지와 첫 번째 진동 에너지 수준의 차이가 클 수 있다. 터널링 보정 조건 Q는 장애물 폭에 선형적으로 의존하며, Morse 전위에 대한 진동 모드 수가 증가함에 따라 이 폭은 현저하게 감소한다. 장벽 폭의 감소는 터널링 속도에 매우 큰 영향을 미칠 수 있기 때문에 흥분된 진동 상태의 적은 인구라도 이 과정을 지배할 것이다.[21][3]터널링이 H 또는 D와의 반응의 KIE에 관련되어 있는지 여부를 판단하기 위해 몇 가지 기준을 고려한다.
- Δ(E-EaHaD) > Δ(ZPE-ZPEHD) (Ea=활성화 에너지; ZPE=영점 에너지)
- 반응은 여전히 낮은 온도에서 계속된다.
- Arrhenius 선행지수 AD/A는H 1과 같지 않다.
- 활성화의 큰 음의 엔트로피.
- 반응물질과 제품의 기하학적 구조는 대개 매우 유사하다.[21]
또한 동위원소가 H, D, T를 포함하는 반응의 경우 터널링의 기준은 H, D 또는 T가 교환되는 반응의 속도 상수(k)를 비교하는 스와인-샤드 관계다.
- kH/kT=(kD/kT)X 및 kH/kT=(kH/kD)Y
유기 반응에서, 이러한 양성자 터널링 효과는 25 °C에서 보고된 KIE가 25인 피리딘 베이스로[28] 방해받는 니트로핀 베이스의 디프로톤화 및 요오드화 등의 반응에서 관찰되었다.
고온에서 낮은 온도까지 얻어진 실험 값을 추정하기는 어렵지만, 1,5방방성 수소[29] 이동에서는 다음과 같은 결과가 나왔다.[30][31]
양성자나 수화이온 전달 반응에서 효소 카탈루션의 높은 효율은 부분적으로 양자역학적 터널링 효과에 기인할 수 있다고 오랫동안 추측되어 왔다. 효소의 활성 부위의 환경은 기증자와 수용자 원자를 최적의 터널링 거리에 가깝게 배치하고, 아미노산 사이드 체인은 정전기적 및 비균질 상호작용에 의해 기증자와 수용자 원자를 "강제"할 수 있다. 또한 효소와 반응 부위 내부의 비정상적인 소수성 환경이 터널링 촉진 진동을 제공하는 것도 가능하다.[32] 케토스테로이드 이소머라아제에 대한 연구는 효소가 촉매화된 효소 조건과 비-엔자임 촉매 조건 하에서 반응의 1차 및 2차 운동 동위원소 효과를 비교함으로써 실제로 결합 운동/수소 터널링을 향상시킨다는 실험 증거를 제공했다.[33]
KIE에 의해 발견된 효소 촉매 반응의 양성자 터널링에 대한 많은 예가 있다. 잘 연구된 예로는 메틸아민 탈수소효소가 있는데, 여기서 양성자 전달 단계에 대해 5–55의 대규모 1차 KIE가 관찰되었다.[34]

효소 반응에서 양성자 전달에 대한 터널링 기여의 또 다른 예는 알코올 탈수소효소에 의해 수행되는 반응이다. 25 °C에서 수소 전달 단계의 경쟁 KIE는 1차 및 2차 KIE는 각각 3.6과 10.2로 나타났다.[35]
과도 운동 동위원소 효과
위에 주어진 방정식으로 표현되는 동위원소 효과는 1차 운동학으로 설명할 수 있는 반응만을 가리킨다. 이것이 불가능한 모든 경우 GEBIK와 GEB를 사용하여 일시적인 운동 동위원소 효과를 고려해야 한다.IF 방정식.[36]
실험
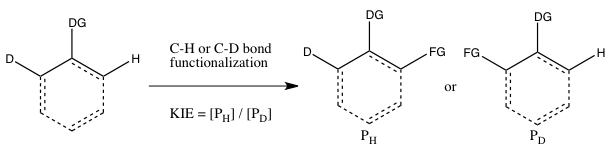
시몬스와 하트비그는 C-H 본드 기능화와 관련된 운동동위원소 효과 실험의 주요 유형으로 다음의 3가지 경우를 가리킨다.[6]
- 가) KIE는 두 개의 평행 반응의 절대 비율로 결정된다.
이 실험에서 정상 기질에 대한 속도 상수와 동위원소 라벨 아날로그에 대한 속도 상수는 독립적으로 결정되며 KIE는 두 기질에 대한 비율로 얻는다. 측정된 KIE의 정확도는 이러한 각각의 속도 상수를 측정할 수 있는 정확도에 의해 심각하게 제한된다. 게다가, 두 개의 평행한 반응에서 정확한 조건을 재현하는 것은 매우 어려울 수 있다. 그럼에도 불구하고, 비율 상수의 직접적인 비교를 통한 큰 운동성 동위원소 효과의 측정은 C-H 본드 갈라짐이 요율 결정 단계에서 발생함을 나타낸다.(더 작은 값은 사전 평형화로 인한 동위원소 효과를 나타낼 수 있으므로 C-H 본드 갈라짐은 요율 결정 단계 이전 어딘가에서 발생할 수 있다.
- 나) 분자간 경쟁으로 결정된 KIE
이러한 유형의 실험에서는 실험 A에서 사용되는 기판과 동일한 기판이 사용되지만, 두 개의 별도 용기 대신 동일한 용기에서 반응하도록 허용된다. 이 실험으로 인한 운동동위원소 효과는 C-H 대 C-D 기능화로 형성된 제품의 상대적 양(또는 비접촉식 시동물질의 상대적 양에서 유추할 수 있음)에 의해 결정된다. 운동 동위원소 효과를 관찰하려면 완료되기 전에 반응을 잠재워야 한다(아래 평가 섹션 참조). 일반적으로 낮은 변환(약 5~10% 변환)에서 반응이 중단되거나 동위원소 혼합물의 큰 초과(> 5 quiv.)가 사용된다. 이 실험 유형은 C-H와 C-D 결합 기능화가 정확히 동일한 조건에서 모두 발생하도록 보장하며, C-H와 C-D 결합 기능화의 제품 비율은 실험 A의 비율 상수보다 훨씬 더 높은 정밀도로 측정할 수 있다. 또한 단일 표본에서 제품 농도의 단일 측정만 필요하다. 단, 이 실험에서 관찰된 운동동위원소 효과는 C-H 본드 분할이 요율 결정 단계 중에 발생하거나 요율 결정 단계를 따르는 제품 결정 단계에서 발생한다는 것을 의미할 수 있기 때문에 해석하기가 더 어렵다. 적어도 시몬스와 하트비히에 따르면 운동 동위원소 효과가 없다는 것은 그럼에도 불구하고 C-H 본드 분할이 요율 결정 단계에서 발생하지 않음을 나타낸다.
- C) 근육내 경합에서 결정된 KIE
이 유형의 실험은 실험 B와 유사하지만, 이번에는 C-H 또는 C-D 결합 기능화를 위한 근육내 경쟁이 있다는 점을 제외한다. 대부분의 경우 기판은 C-H와 C-D 본드 사이의 DG(Direction Group, DG)를 보유하고 있다. 이 실험의 운동 동위원소 효과 계산과 그 해석은 실험 B와 동일한 고려사항을 따른다. 단, C-H 또는 C-D 결합의 갈라짐 이전에 실험 B에서 동위원소 함유 기질의 되돌릴 수 없는 결합이 이루어진다면 실험 B와 C의 결과는 달라진다. 그러한 시나리오에서는 실험 C(기질 결합 후에도 동위원소의 선택이 일어날 수 있는 경우)에서는 동위원소 효과를 관찰할 수 있지만 실험 B에서는 관찰할 수 없다(기질 결합이 불가역적으로 결합되는 즉시 C-H 또는 C-D 결합 분할의 선택이 이미 이루어지기 때문이다). 실험 B와 대조적으로, 정확한 k/k를HD 얻기 위해 동위원소 시작 물질의 저소비량에서 반응을 멈출 필요는 없다. 왜냐하면, 시작 물질의 H와 D의 비율이 변환의 정도에 관계없이 1:1이기 때문이다.
분자간(실험 B)과 분자간(실험 C) 경기에서 서로 다른 동위원소 효과가 관찰되고 있는 비 C-H 활성화 사례 중 하나는 티부틸디아조메테인(t-butylamine)의 광분해다. 이 결과를 설명하기 위해 디페닐카르베네(diphenylcarbene)의 형성에 이어 t-butylamine에 의한 되돌릴 수 없는 핵포함 공격이 제안되었다. 핵동위원소 공격 속도에는 동위원소적 차이가 거의 없기 때문에 분자간 실험은 KIE가 1에 가까운 결과를 낳았다. 그러나 근육내 사례에서 제품 비율은 핵 공격 후 발생하는 양성자 전달에 의해 결정되는데, 이는 2.6의 실질적인 KIE가 존재하는 과정이다.[37]
따라서 실험 A, B, C는 서로 다른 정밀도의 결과를 제공하며 다른 실험 설정과 데이터 분석 방법이 필요하다. 결과적으로, 각 실험 유형의 실현 가능성은 반응의 운동 및 정지계 프로파일과 반응 혼합물의 물리적 특성(예: 동질 대 동질 대 동질)에 따라 달라질 것이다. 이질적인 또한, 위 단락에서 언급한 바와 같이, 실험은 속도 제한 단계, 제품 결정 단계 및/또는 C-H/D 분할 단계의 상대적 위치에 따라 다단계 반응의 다른 단계에 대한 운동 동위원소 효과 데이터를 제공한다.
아래의 가상의 예는 일반적인 시나리오를 예시한다. 다음 반응 좌표도를 고려하십시오. 이 프로파일에 대한 반응의 경우 세 가지 실험(A, B 및 C) 모두 상당한 1차 운동 동위원소 효과를 산출한다.
한편, C-H 또는 C-D 결합 분할은 되돌릴 수 없지만 속도 결정 단계(RDS) 후에 발생하는 다음과 같은 에너지 프로파일에 반응이 따른다면, 전체 비율이 동위원소 치환에 영향을 받지 않기 때문에 실험 A에서 유의미한 운동동위원소 효과는 관찰되지 않을 것이다. 그럼에도 불구하고, C-H 본드 절단 단계는 두 번째 단계가 제품 분포에 여전히 영향을 미치기 때문에 다른 두 실험과 함께 1차 운동 동위원소 효과를 줄 것이다. 따라서 실험 B와 C를 사용하면 C-H나 C-D 본드 균열이 속도 결정 단계가 아니라 제품 결정 단계에서 발생하더라도 운동성 동위원소 효과를 관찰할 수 있다.
운동 동위원소 효과의 큰 부분은 반응제 접지 상태와 반응제 및 그것의 동위원소 대체 아날로그 간에 변화하는 전환 상태 사이의 진동 제로 포인트 에너지 차이에서 발생한다. 계산 화학물질을 이용한 운동동위원소 효과의 관련 계산을 수행할 수 있지만, 수행된 작업의 대부분은 특정 동위원소 대체물이 검출 가능한 운동동위원소 효과를 생성하는지 여부를 조사하는 것을 포함하는 단순한 순서다. 반응이 발생하는 부위에서 멀리 떨어진 원자의 동위원소 치환으로부터의 진동 변화는 반응제와 전환 상태 사이에서 취소되는 경향이 있다. 따라서 운동동위원소 효과가 있다는 것은 동위원소 표지가 있는 원자가 반응 부지에 있거나 매우 가깝다는 것을 나타낸다.
동위원소 효과의 부재는 다음과 같이 해석하기가 더 어렵다. 그것은 동위원소 표지의 원자가 반응 부위에서 멀리 떨어져 있다는 것을 의미할 수 있지만, 또한 관찰 가능한 운동 동위원소 효과의 결여를 초래하는 특정한 보상 효과가 있다는 것을 의미할 수도 있다. 예를 들어, 반응제와 전환 상태 영점 에너지 사이의 차이는 정상 반응제와 동위원소 라벨이 부착된 버전 간에 동일할 수 있다. 또는, 동위원소 대체물이 반응 현장에 있다는 것을 의미할 수 있지만, 이 원자에 대한 결합과 관련된 진동 변화는 요율 결정 단계 이후에 발생한다. ABCD가 분자의 원자 골격을 나타내는 예는 다음과 같다.
중간 ABC에 대한 정상 상태 조건을 가정하면, 전체 반응 속도는 다음과 같다.
첫 번째 단계가 속도 결정인 경우, 이 방정식은 다음과 같이 감소한다.
또는 두 번째 단계가 속도 결정인 경우 방정식은 다음과 같이 감소한다.
대부분의 경우, 특히 무거운 원자일 경우 A에서 동위원소 대체는1 k나2 k를 변경하지 않지만, 아마도 k를3 변경시킬 것이다. 따라서 첫 번째 단계가 요율 결정인 경우 A의 동위원소 라벨링에 대한 전반적인 반응에서 관측 가능한 운동동위원소 효과는 없지만, 두 번째 단계가 요율 결정인 경우에는 한 가지 효과가 있을 것이다. 두 단계가 모두 유사한 비율을 갖는 중간 경우, 운동 동위원소 효과의 크기는 k와3 k의2 비율에 따라 달라질 것이다.
D의 동위원소 대체는 k와1 k를2 변화시키지만 k에는3 영향을 미치지 않는다. k는1 어느 단계가 요율 결정인지에 관계없이 단순화된 비율 표현식에 나타나기 때문에 이 치환으로 항상 운동동위원소 효과를 관측할 수 있지만, 두 번째 단계가 k와1 k에2 대한 동위원소 효과 사이의 일부 취소로 요율 결정인 경우에는 덜 뚜렷해진다. 이 결과는 평형 동위원소 효과가 보통 운동 동위원소 효과보다 작다는 사실과 관련이 있다.
B의 동위원소 대체는 분명히 k를3 변화시키지만, 첫 번째 단계의 전환 상태에서 B-C 본드 진동에 영향을 받는 경우 k를1 덜 변화시킬 수도 있다. 따라서 첫 번째 단계가 요율을 결정하더라도 작은 동위원소 효과가 있을 수 있다.
이 가상의 고려사항은 운동동위원소 효과를 관찰하는 것이 반응 메커니즘을 조사하는데 어떻게 사용될 수 있는지를 보여준다. 운동동위원소 효과가 존재한다는 것은 요율제어 단계 이전이나 그 이전에 동위원소 표지가 붙은 원자와 관련된 결합의 진동력 상수에 대한 변화를 나타낸다. 관찰된 운동동위원소 효과로부터 전환 상태에 대한 많은 세부사항을 배우기 위해 복잡한 계산을 사용할 수 있다. 그러나, 더 일반적으로, 동위원소 표지의 원자와 관련된 결합이 특정한 방식으로 변경된다는 단순한 질적 지식은 매우 유용할 수 있다.[38]분자간 경쟁반응에 의한 비율 상수비 평가
경쟁 반응에서 운동 동위원소 효과는 반응 후 동위원소 제품 또는 잔류 반응제 비율에서 계산되지만, 이러한 비율은 반응의 완료 정도에 따라 크게 달라진다. 가장 일반적으로 동위원소 기질은 특정 위치에 라벨이 부착된 분자와 라벨이 부착되지 않은 일반적인 분자로 구성된다.[9] 또한 유사한 경우뿐만 아니라 C 운동성 동위원소 효과 실험에서 동위원소 탄소의 자연적 풍부함에만 의존하여 동위원소 라벨링의 필요성을 제거하는 것도 가능하다.[39] 두 동위원소 기판은 동일한 메커니즘을 통해 서로 다른 속도로 반응할 것이다. 따라서 반응제 내 두 종과 제품의 양 사이의 비율은 반응 과정에서 점진적으로 변화할 것이며, 이러한 점진적인 변화는 다음과 같은 방법으로 치료할 수 있다.[9] 두 동위원소 분자인 A와1 A가2 다음과 같은 방식으로 되돌릴 수 없는 경쟁 반응을 겪는다고 가정한다.
이 시나리오에 대한 운동 동위원소 효과는 다음과 같은 것으로 밝혀졌다.
여기서 F와1 F는2 각각 동위원소 종 A와1 A의2 변환 분율을 가리킨다.
이 치료에서 다른 모든 반응 물질은 비동시적인 것으로 가정한다. 더 나아가 반응이 동위원소 기질 A에 대해 첫 번째 순서라고 가정하면, 이 두 반응에 대한 다음과 같은 일반적인 비율 식을 작성할 수 있다.
f([B],[C],…)는 A의 동위원소 구성에 의존하지 않기 때문에, A와12 A의 비율 표현식 모두에서 해결할 수 있으며, 이 둘을 동일시하여 다음과 같은 관계를 도출할 수 있다.
여기서 [A1]0와 [A2]0는 각각 A와1 A의2 초기 농도다. 이로 인해 다음과 같은 운동 동위원소 효과 식이 발생한다.
또한 다음과 같이 두 반응, 즉 F와1 F의2 변환 분량으로 표현할 수 있다. 여기서 n = 1 또는 2의 경우 1-Fn=[A]/[Ann]0는 다음과 같다.
운동성 동위원소 효과를 얻기 위해서는 초기 기질(여기서는 [A2]/[0A]=0R로0 정의), 일부 변환 후 기질([A2]/[A11]=R] 또는 제품([P21]=RP)에서 동위원소 분자의 비율을 산출하는 질량 분광계를 사용하여 분석할 수 있다. 2종 중 한 종(예: 2)이 방사성 동위원소일 때 다른 종과의 혼합물도 방사능에 의해 분석할 수 있는데, 방사능은 [A2]0 / ([A1]+[0A2]]0에 비례하는 어금니 활동으로 측정된다. ③ [A2]/[0A1]0 = 초기 기질에 R0, [A2] / ([A1]+[A2]) ④ 일부 변환 후 기질에 [A22]/[A1] = R이 있고, [R] / ([R1]+[R2]]) r2 [R]/[R1] = R이P 있으므로 추적기 양에 방사성 동위원소가 존재하는 한 다른 경우와 동일한 비율을 측정할 수 있다. 그러한 비율은 NMR 분광법을 사용하여 결정할 수도 있다.[40]
기질 조성을 따랐을 때 R과0 R의 관점에서 다음과 같은 운동동위원소 효과 발현을 도출할 수 있다.
이전에2 F에 대해 파생된 식을 사용하여 R과 R의0 비율을 취하면 다음과 같은 결과를 얻을 수 있다.
출발 물질의 동위원소 농축은 다양한 운동동위원소 효과에 대한 R/R의0 F1 의존도로부터 계산할 수 있으며, 다음과 같은 수치를 산출할 수 있다. 지수 의존성 때문에 매우 낮은 운동성 동위원소 영향도 높은 변환에서 출발 물질의 동위원소 구성에 큰 변화를 가져온다.
제품을 따를 경우 다음과 같이 R과0 함께 제품비 R을P 사용하여 운동동위원소 효과를 계산할 수 있다.
자연 풍부에서의 운동 동위원소 효과 측정
자연 풍부에서 운동 동위원소 효과 측정은 자연 풍부 물질로 수행되는 화학 반응에 대한 운동 동위원소 효과(KIE)를 측정하는 단순한 일반 방법이다. 이 KIE 측정 기법은 이전 KIE 측정 방법의 많은 한계를 극복하였다. 동위원소 라벨 재료에서 KIE를 측정하려면 동위원소 라벨이 부착된 각 재료(흔히 엄청나게 어려운 공정), 경쟁 반응 및 분석에 대한 새로운 합성이 필요하다.[6] 자연 풍부에서의 KIE 측정은 고정밀 정량적 기법(핵자기공명 분광법, 동위원소 질량 분광법)을 활용하여 동위원소의 운동성 분율을 특정 화학 반응에 대한 제품 또는 시작 물질 중 하나에 선택적으로 배치함으로써 이러한 문제를 방지한다.
단일 펄스 NMR
양적single-pulse 핵자기 공명 분광 법(NMR)메서드가 동위 원소의 자연 풍도 KIE 측정에 운동 분별을 측정하기 위한 유연합니다. 파스칼 것은 알이다. 연구 다양한 출처에서 나온 중수소의 동일한 화합물 내에 극적인 변화를 보여 줌으로써, 핵자기 공명 자연 존재비에서deuterium 동적 동위 원소 효과를 측정하는데 사용될 수 있다고 가설을 세웠습니다 고무되었다.[41][42] 파스칼과 동료들 시클로 헥산에 디메틸 diazomalonate의 삽입 반응을 연구함으로써 그들의 가설을 시험했다. 파스칼 것은 알. KIE 2.2의 측정된 자연 존재비의 재료비를 하반기 NMR를 이용하고 있다.[42]
싱글 턴과 동료들 개개 NMR기초한 천연 희소 KIE 측정의 아이소프렌이라 불리며의 말레산 무수 물과 함께[4+2]부가의 메커니즘을 공부할 능력을 보여 주었다.[39] Gajewski에 의해 동 위원 소교 환성의 질을 높이다 재료에 대한 이전 연구들이지만, 언제나, 오차 안에 완벽하게 동시 반응 메커니즘을 일관성이 있다면 비동기 전이 상태를 KIE 결과를 관찰했다.[43]
싱글 턴에 의해 이 작품(알. 한 실험의 디자인 내에 여러 개개 KIE의 측정을 설립했다. 이러한 하반기와 개개 KIE 측정 자연 존재비에서 결정 등을 디엔 경험이 더 하반기 KIE은“밖에서”hydrogens"으며, C1과 C4경험보다 두드러진 중요한 KIE의“안에” 기름을 발견했다. 이 핵심적인 관찰 아이소프렌이라 불리며의 말레산 무수 물과 고리화 첨가에 대한 비동기 반응 메커니즘을 제안한다.
자연 존재비에서 NMR를 사용하여 KIE의 결정을 위한 그 제약은 회복된 재료, 관심의 반응을 복구할 수 없게 되야 하고 이 반응 메커니즘을 화학 reacti의 지속 동안을 바꾸지 않아야 한다 핵자기 공명 분석(관심의 신호를 다른 신호로부터 구별되어야 한다)에 적합한 양과 순도 하다..
자연 존재비에서 동적 동위 원소 영향을 측정하기 위해 양적 단일 펄스 NMR를 사용하여 대한 실험적 세부 사항을 실험 5T1의 완화 시간 90도 플립 각도, 적어도 5점의 최고를 가로지르는 디지털 해상도 측정 및 신호 등 정량적인 조건:소음보다 더 큰 250에 따라 수행될 필요가 있다. 원시 FID적어도 256K를 푸리에 변환 전에 zero-filled 있다. NMR스펙트럼 다음 영차 기준 보정에 어떤 기울기 보정 없이 치료 단계별 있다. 에서의 신호 integrations 숫자로 각 통합 신호 필요한 최소한의 허용 오차로 결정된다.[39][해명 필요한]
유기측정 반응 메커니즘 설명 예제
콜레토 외 연구진은 아릴 요오드화물을 결합 파트너로 하여 상온에서 벤조[b]티오페네스의 섭생성 -arylation을 개발하였고, 단일 펄스 NMR을 통해 자연 풍부 운동 동위원소 효과 측정을 수행함으로써 이 반응의 메커니즘을 이해하고자 하였다.[44]
C3, 역 하반기 동위 원소 효과, C2에서 제2의 개개 탄소 동위 원소 효과에 초등13C 동위 원소 효과의 관측,2H 동위 원소 효과의 지휘 통제의 자금난 납 Colletto(알. benzo[b]thiophenes의 방 온도에서aryl 하와이 말똥가리와 위치 선택성 β{\beta\displaystyle}-arylation을 위한Heck-type 반응 메커니즘을 제안하는 것.dides 커플링 파트너로서.[44]
프로스트 외 연구진은 루이스산 첨가물이 단일 펄스 NMR을 통한 자연 풍부 운동동위원소 효과 측정을 이용한 항항체성 팔라듐 촉매 C-N 본드 활성화 메커니즘에 미치는 영향 이해를 도모했다.[45]
BPh가3 없을 때 관측된 일차 C 운동성 동위원소 효과는 cis 산화를 제한하는 반응 메커니즘을 cyanoformamide의 C-CN 결합으로 제안한다. BPh의3 추가는 관측된 C 운동동위원소 효과의 상대적 감소를 야기하여 프로스트 외 연구진은 시스 산화에서 팔라듐의 조정에서 시아노포름아미드까지의 속도 제한 단계의 변화를 시사했다.[45]
DEPT-55 NMR
자연 풍부에서 운동동위원소 효과 측정은 반응 메커니즘을 이해하는 강력한 도구지만 분석에 필요한 물질의 양은 값비싼 시약이나 불안정한 시동 물질을 사용하는 반응에 대해 이 기법을 이용할 수 없게 만들 수 있다. 이러한 한계를 완화하기 위해 제이콥센과 동료들은 자연 풍부에서 운동동위원소 효과 측정에 필요한 시간과 소재를 줄이기 위한 수단으로 H to C 양극화 전달을 개발하였다. 편광전달에 의한 왜곡 없는 강화(DEPT)는 C에 대한 H의 더 큰 자석비를 이용하여 이론적으로 측정 민감도를 4배 향상시키거나 실험 시간을 16배 감소시킨다. 이 자연 풍부 운동 동위원소 측정 방법은 불안정한 시작 물질과 상대적으로 비용이 많이 드는 촉매나 제품을 포함한 반응 분석에 유리하다.[46]
제이콥센과 동료들은 갈락토스의 티우레아 촉매 글리코실화 현상을 앞서 언급한 기준(비용 물질과 불안정한 기질)을 모두 충족하는 반응으로 식별했으며 잘 이해되지 않은 메커니즘을 가진 반응이었다.[47] 글리코실레이션은 S1과N S2N 기계론적 문자 사이에 명확한 정의가 결여된 핵소독성 대체의 특별한 경우다. 변위 부위와 인접한 산소의 존재(즉, C1)는 양의 전하를 안정시킬 수 있다. 이 충전 안정화는 모든 결합 경로를 비동기화하게 할 수 있으며 글리코실화용 S1N 메커니즘의 옥소카베늄 문자와 접근 중개한다.
Jacobsen과 동료들은 전환 상태에서 상당한 옥소카르베늄 특성을 제안하는 C1, C2, C5에서 소규모 정상 KIE를 관찰했으며, 충전 분리가 큰 비동기 반응 메커니즘을 제안했다.
동위원소-비율 질량분석
고정밀 동위원소-비율 질량분석법(IRMS)은 자연 풍부 KIE 측정을 위한 동위원소 운동분석을 측정하는 또 다른 방법이다. 위들란스키와 동료들은 황산염 모노에스터의 가수분해를 위한 자연 풍부 측정에서 S KIE를
시연했다. 대규모 KIE에 대한 그들의 관찰은 S-O 채권 분할이 요율 조절이며 관계 반응 메커니즘을 배제시킬 가능성이 있음을 시사한다.[48]
IRMS를 사용하여 자연 풍부하게 KIE를 결정하기 위한 주요 제한사항은 분석 가능한 작은 분자로 동위원소 분율이 없는 현장 선택적 저하, 즉 비교과업이다.[39]
사례 연구
일차 수소 동위원소 효과
일차 수소 운동 동위원소 효과는 동위원소 라벨이 부착된 수소에 대한 결합이 반응의 속도 및/또는 제품 결정 단계에서 형성되거나 파손되는 경우를 말한다.[6] 이것들은 가장 일반적으로 측정된 운동동위원소 효과로, 앞서 다룬 이론의 많은 부분이 일차 운동동위원소 효과를 가리킨다. 라벨이 부착된 수소의 전달이 반응의 속도 결정 단계에서 발생한다는 충분한 증거가 있을 때, 예를 들어 상온에서 적어도 5-6의 kH/kD 또는 kH/kT 약 10–13의 상당히 큰 운동 동위원소 효과가 관찰되면, 수소 전달이 선형적이고 수소가 상당히 대칭적으로 위치할 가능성이 상당히 높다.과도기에 있는. 일반적으로 효과가 매우 크지 않으면 관측된 동위원소 효과에 대한 기여 터널링에 대한 논평을 할 수 없다. 1차 운동 동위원소 효과가 크지 않은 경우, 수소 전달이 비선형 경로를 따른다는 의미도 있지만, 일반적으로 중원자 운동에서 반응 좌표에 상당한 기여를 나타내는 것으로 간주된다.[9]
이차 수소 동위원소 효과
2차 수소 동위원소 효과 또는 2차 운동 동위원소 효과(SKIE)는 동위원소 대체물이 본드 파손으로부터 멀리 떨어져 있는 경우에 발생한다. 그럼에도 불구하고 원격 원자는 영점 에너지(ZPE)의 변화를 통해 화학 반응 속도에 영향을 미치는 시스템의 내부 진동에 영향을 미친다.[49] 그러한 영향은 중동위원소에 대한 빛 동위원소 비율의 비율로 표현되며 "정상"(비율이 1보다 크거나 같음) 또는 "반전"(비율이 1보다 작음) 효과일 수 있다.[50] SKIE는 α,β (etc.) 이차 동위원소 효과로 정의되며, 이러한 접두사는 반응 중심에 상대적인 동위원소 대체물의 위치를 가리킨다(알파 및 베타 탄소 참조).[51] 접두사 α는 반응 중심과 연관된 동위원소를 의미하며 접두사 β는 반응 중심과 인접한 원자와 연관된 동위원소를 의미한다.
물리적 유기화학에서는 유도, 본드혼합화, 초융합화 등의 전자효과 측면에서 SKIE가 논의된다.[52] 이러한 특성은 전자 분포에 의해 결정되며, 동위원소 대체에 의해 크게 영향을 받지 않는 진동 평균 결합 길이와 각도에 의존한다. 따라서 "전자 동위원소 효과"라는 용어는 합법적인 반면, 동위원소 효과가 진동보다는 본질적으로 전자적이라고 잘못 해석될 수 있으므로 사용을 금한다.[51]
SKIE는 궤도 하이브리드화의 변화 측면에서 설명할 수 있다. 탄소 원자의 혼합화가 sp에서3 sp로2 변경되면 여러 진동 모드(스트레치, 평면 내 및 평면 외 벤딩)가 영향을 받는다. 스피드가3 혼합된 탄소의 평면 내 벤딩과 평면 외 벤딩은 스피드가3 혼합된 탄소의 대칭으로 인해 주파수가 유사하다. 스피드가2 혼합된 탄소에서 평면 내 벤딩은 평면 외 벤딩보다 훨씬 강해서 주파수, ZPE 및 SKIE(반응제 및 전환 상태의 ZPE에 차이가 있을 때 존재한다)에 큰 차이가 발생한다.[21] 벤딩 주파수 차이로 인한 이론적 최대 변화는 1.4로 계산되었다.[21]
탄소가 sp에서3 sp로2 교배되는 반응을 겪을 때 sp문자를2 개발하면서 전환 상태에서 일정하게 존재하는 평면외 굴절력이 약해지고, 1.1~1.2의 전형적인 값으로 "정상적인" SKIE가 관측된다.[21] 반대로 탄소의 하이브리드화가 sp에서2 sp로3 변화하면 전환 상태에서 평면 외 굴절력 상수가 증가하고 전형적인 값이 0.8에서 0.9로 역 SKIE가 관측된다.[21]
일반적으로 SKIE 가역반응에 대한 SKIE는 한 쪽으로는 "정상"이고 다른 쪽으로는 "반전"이 될 수 있으며, 전환 상태에서 결합이 약한 경우 두 쪽 모두 "정상"이 될 수 있으며, 전환 상태에서 결합이 보다 강한 경우 "반전"이 될 수 있다. 반응성의[50]
니트로알카네 음이온과 d-아미노산 산화효소의 반응을 위한 두 가지 제안 경로를 구별하기 위해 그러한 효과를 사용한 피츠패트릭과 커츠 연구에서는 "역전" α 이차 운동동위원소 효과의 예를 볼 수 있다.[53] 경로 A는 코엔자임 FAD에 대한 핵포함 공격을 포함했고, 경로 B는 자유방사선 중간을 포함한다. 경로 A가 중간 탄소를 sp에서2 sp로3 "inverse"로 변화시킴에 따라 SKIE가 예상된다. 경로 B가 발생할 경우 자유급성중개체가 하이브리드화를 변경하지 않으므로 SKIE를 관찰해서는 안 된다. 0.84의 SKIE가 관찰되었으며 A경로는 아래 계획과 같이 검증되었다.
SKIE의 또 다른 예는 다른 메커니즘에 대한 세 가지 전환 상태가 제안된 디메틸디오시레인에 의한 벤질 알코올의 산화다. 다시, 수소 원자가 어떻게 그리고 어떻게 각각의 원자에 관여하는지를 고려함으로써, 연구원들은 그들이 수소 원자의 동위원소 대체 효과를 예상할지 여부를 예측했다. 그런 다음, 반응에 대한 실험 데이터의 분석을 통해 관찰된 동위원소 효과를 기반으로 가장 가능성이 높은 경로를 선택할 수 있었다.[54]
메틸렌 하이드로겐의 2차 수소 동위원소 효과는 또한 1,5헥사디엔의 Cope 재배치가 결합 결합 재조정 경로를 따른다는 것을 보여주기 위해 사용되었으며, 이 모든 것이 다음 계획에 제시된 대안적인 아군 급진 경로 또는 1,4-다이릴 경로 중 하나가 아니다.[55]
Cope의 1,5헥사디엔 재배치를 위한 대안적 메커니즘: (위에서 아래로), allil rightic, 동기식 결합 및 1,4dil 경로. 우세한 통로는 방향성 중간선에 해당하는 6개의 델로컬화 π 전자가 있는 중간 통로인 것으로 파악된다.[55]
스테릭 동위원소 효과
 |
스테릭 동위원소 효과는 접합부 파손이나 형성을 수반하지 않는 SKIE이다. 이 효과는 동위원소의 진동 진폭에 기인한다.[56] 그러한 효과의 예로는 9,10-디하이드로-4,5-디메틸페난트렌의 경주화가 있다.[57] C-H(탄소-수소), C-D(탄소-중수소) 결합의 수소에 비해 중수소에 대한 진동 진폭이 작을수록 둘 사이의 ZPE 차이 외에도 반 데르 발스 반경이 작거나 유효 크기가 작아진다. 다른 분자 위에 하나를 포함하는 보다 효과적인 다수의 분자가 있는 경우, 이는 속도 상수에 대한 강한 효과에 의해 나타날 수 있다. 위의 예에서 중수소 경주는 수소 동위원소보다 더 빨리 진행되어 강체 동위원소 효과가 발생한다. 강체 동위원소 효과에 대한 모델은 바텔에 의해 개발되었다.[58] 위와 같은 경주화 프로세스에서와 같이 변환이 심각한 장황 방해와 함께 전환 상태를 통과하지 않는 한, 스테릭 동위원소 효과는 대개 작다.
스테릭 동위원소 효과의 또 다른 예는 로탁사인의 탈착 반응이다. 중수소 동위원소는 유효 크기가 작기 때문에 매크로 사이클을 통해 스토퍼를 더 쉽게 통과시켜 중수 로탁스(Rotaxanes)의 탈착 속도를 더 빠르게 한다.[59]
역운동 동위원소 효과
중수종이 무중수 아날로그보다 더 빨리 반응하는 것으로 알려져 있으며, 이러한 경우는 역운동동위원소 효과(IKIE)를 나타낸다고 한다. IKIE는 알킬 금속 하이드라이드의 환원 제거(예: (MeNCHCMe2222)PtMe(H)에서 종종 관찰된다. 그러한 경우, 독립된 종인 전환 상태의 C-D 결합은 C-H 결합에 비해 매우 안정화된다.[citation needed]
전체 속도 상수가 역평형 동위원소 효과를 갖는 속도 결정 단계 이전의 평형전위에 의존하는 경우, 다중 단계 반응에서도 역효과가 발생할 수 있다. 예를 들어, 산성 촉매 반응의 비율은 일반적으로 HO가3+[5]: 433 촉매하는 HO의2 유사 반응보다 DO가3+ 촉매하는 DO의2 반응에 대해 2-3배 더 높다. 이는 HO3+(또는 DO3+)가 반응하는 R의 특정 수소 이온 촉매 메커니즘에 대해 설명할 수 있다.
- H3O+ + R ⇌ RH+ + H2O
- RH+ + H2O → H3O+ + P
이때 제품의 형성률은 d[P]/dt = k2[RH+] = kK21[]이다.H3O+][R] = kobs[H3O+][R]. 첫 번째 단계에서 HO는3+ 보통 RH보다+ 더 강한 산이다. 디uteration은 0점 진동 에너지에 대한 디uteration의 효과가 더 큰 보다 강하게 결합된 산종 RD로+ 평형을 이동시켜, 중수 평형 상수 K가1D K보다1H 더 크다. 첫 번째 단계에서 이 평형 동위원소 효과는 대개 두 번째 단계에서 운동 동위원소 효과보다 크므로 명백한 역동위원소 효과가 있고 관찰된 전체 속도 상수obs k = kK가21 감소한다.[5]: 433
용제 수소 운동 동위원소 효과
용제 동위원소 효과를 측정할 수 있으려면 용제의 유한 부분은 나머지 부분과 다른 동위원소 구성을 가져야 한다. 따라서 덜 일반적인 동위원소 종을 다량 사용할 수 있어야 하며, 관측 가능한 용제 동위원소 효과는 수소를 포함하는 동위원소 대체물로 제한한다. 검출 가능한 운동동위원소 효과는 용액이 수소를 용매와 교환하거나 반응 부위 근처에 특정 용액-용액 상호작용이 있을 때만 발생한다. 이러한 두 현상 모두 수소가 교환 가능한 양성 용매에 흔히 나타나며, 극성 분자와 쌍극-디폴 상호작용이나 수소 결합을 형성할 수 있다.[9]
탄소-13 동위원소 효과
대부분의 유기 반응은 탄소에 대한 결합을 깨뜨리고 만드는 것을 포함한다. 따라서, 검출 가능한 탄소 동위원소 효과를 기대하는 것이 타당하다. C를 라벨로 사용할 경우, 동위원소의 질량 변화는 ~8%에 불과하지만, 이것은 관측 가능한 운동동위원소 효과를 수소 동위원소 효과로 관측할 수 있는 값보다 훨씬 작은 값으로 제한한다.
C 자연적 풍요의 변화 보상
종종 탄소의 자연적 풍부함에 의존하는 연구에서 가장 큰 오차의 원인은 자연 C의 풍부함 그 자체의 약간의 변화다. 이러한 변화는 반응에 사용되는 시작 물질 자체가 운동 동위원소 효과와 그에 상응하는 동위원소 농축을 가진 일부 다른 반응의 산물이기 때문에 발생한다. 운동 동위원소 효과를 결정하기 위해 NMR 분광법을 사용할 때 이 오류를 보상하기 위해 다음과 같은 지침이 제안되었다.[40]
- 기준 역할을 할 반응 중심에서 멀리 떨어져 있는 탄소를 선택하고 반응에 운동 동위원소 효과가 없다고 가정한다.
- 아무런 반응도 거치지 않은 시작 재료에서 기준 탄소의 그것과 다른 탄소 NMR 피크 통합의 비율을 결정한다.
- 시작 재료의 샘플에서 탄소에 대한 동일한 비율을 얻으십시오.
- 전자의 비율에 대한 후자의 비율은 R/R을0 산출한다.
만약 이것들뿐만 아니라 얀코프스키가 열거한 다른 주의사항들을 따른다면, 소수점 3자리 정도의 정밀도를 가진 운동동위원소 효과를 얻을 수 있다.[40]
탄소보다 무거운 원소를 가진 동위원소 효과
탄소 동위원소 효과의 해석은 보통 탄소와의 결합을 동시에 형성하고 끊음으로써 복잡하다. S1N 반응과 같이 탄소로부터의 결합 갈라짐만을 수반하는 반응도 탄소에 대한 잔여 결합의 강화를 포함한다. 그러한 많은 반응에서, 그룹 동위원소 효과를 남기는 것은 해석하기 더 쉬운 경향이 있다. 예를 들어 염소가 떠나는 집단으로 작용하는 치환반응과 제거반응은 해석하기 편리하며, 특히 염소는 내부 결합이 없는 단원자종으로 작용하여 반응 좌표를 복잡하게 하고, 두 개의 안정적인 동위원소인 Cl과 Cl이 모두 풍부하게 가지고 있기 때문이다. 그러한 동위원소 영향의 해석에 대한 주요 난제는 떠나는 집단의 위약이다.[9]
실험 불확실성 때문에 동위원소 효과 측정은 상당한 불확실성을 수반할 수 있다. 종종 동위원소 효과는 일련의 동위원소에 대한 보완적 연구를 통해 결정된다. 따라서 수소 동위원소 효과와 중원자 동위원소 효과를 결합하는 것이 상당히 유용하다. 예를 들어, 질소 동위원소 효과와 함께 질소 동위원소 효과를 결정하여 40 °C에서 에탄올에 산화 에산화물을 함유한 2-페닐틸트리메틸아몬늄 이온의 반응이 대체 비인증 메커니즘과 반대로 E2 메커니즘을 따른다는 것을 보여주기 위해 사용되었다. 이러한 결과는 이러한 반응이 1.0133±015.0002의 질소 동위원소 효과와14 함께 잔류 수소에서 3.2의 수소 운동 동위원소 효과를 산출한다는 것을 보여주면서 도출되었다.[9]
마찬가지로 질소와 수소 동위원소 효과를 결합하여 단순한 암모늄 염의 동기 제거도 결합 메커니즘을 따른다는 것을 보여주기 위해 사용되었는데, 이것은 이전에도 논쟁거리였다. 두 가지 모두 1-페닐사이클로펜텐틴을 생성하는 에토산화물을 함유한 2-페닐사이클로펜틸트리메틸아몬늄 이온의 다음 두 반응에서 두 이소머 모두 60°C에서 질소 동위원소 효과14 k/k를15 보였다. 동시 제거를 따르는 트랜스 이소머의 반응은 항 제거(1.0108)를 겪는 시스 이소머에 비해 질소 운동동위원소 효과(1.0064)가 작지만, 두 결과 모두 결합 과정에서 발생할 전환 상태에서 C-N 결합의 약화를 나타낼 만큼 충분히 크다.
기타 예
운동동위원소 효과는 동위원소 질량의 차이에서 발생하므로 관측 가능한 가장 큰 운동동위원소 효과는 동위원소 대체 수소와 중수소(질량 100% 증가) 또는 삼중수소(질량 증가 200%)와 관련이 있다. 동위원소 질량비에서 발생하는 운동동위원소 효과는 뮤온을 사용하여 36.4까지 클 수 있다. 이들은 전자가 206개의 전자를 가진 양의 뮤온(μ+) '핵' 주위를 공전하는 가장 가벼운 수소 원자 H(0.113 amu)를 생산했다. 또 헬륨 내 전자 1개를 음의 뮤온(μ−)으로 대체해 원자 질량이 4.116au인 헤μ를 형성하는 방식으로 가장 무거운 수소 원자 아날로그를 준비했다. 음의 뮤온은 전자보다 훨씬 무겁기 때문에 핵에 훨씬 더 가까운 궤도를 돌기 때문에 한 양성자를 효과적으로 차폐하여 헤μ는 H로 행동하게 한다. 이러한 외래종과 함께 H와 H의2 반응이 조사되었다. H와2 가장 가벼운 수소 아날로그 및 가장 무거운 수소 아날로그 반응에서 발생하는 속도 상수를 사용하여 동위원소 질량 차이가 36.4배인 k0.11/k4.1 운동동위원소 효과를 계산했다. 이 반응의 경우, 동위원소 대체는 역운동동위원소 효과를 생성하기 위해 발생하며, 저자는 지금까지 보고된 운동동위원소 효과 중 가장 작은 운동동위원소 효과인 1.74 x 10까지−4 운동동위원소 효과를 보고한다.[60]
운동 동위원소 효과는 자연에서 합성된 경로에 따라 천연물에서 중수소 동위원소의 특정 분포를 유도한다. 따라서 NMR 분광법을 통해 포도주의 알코올이 포도당에서 발효되었는지, 아니면 불법적으로 첨가된 사카로스에서 발효되었는지 쉽게 검출할 수 있다.
운동성 동위원소 효과를 사용하여 해명된 또 다른 반응 메커니즘은 톨루엔의 할로겐화다.[61]
이 특정한 "근육 KIE" 연구에서 벤질 수소는 브로민화제로 N-브로모수치니미드를 사용하여 브롬인에 의해 급진적인 치환 과정을 거친다. PhCH3 브롬화 속도가3 PhCD보다 4.86배 빠른 것으로 나타났다. 5.56의 큰 KIE는 브로민 및 수산화나트륨을 사용한 케톤 반응과 관련이 있다.[62]
이 반응에서 속도 제한 단계는 케톤 감응에 의한 에놀레이트 형성이다. 본 연구에서 KIE는 일반 2,4-디메틸-3-펜타논의 반응 속도 상수와 광학 밀도 측정을 통해 그 중수 이질체로부터 계산된다.
비대칭 촉매에서 운동동위원소 효과가 비중수 기질에 비해 중수 기질에 대해 관측된 항독성에서 유의미한 차이로 나타나는 경우는 드물다. 한 예는 Tose와 동료들에 의해 보고되었는데, 그 결과, 무중수 기질에 대한 93% ee에 비해, 중수 기질이 83% ee의 항저항성을 생성했다. 그 효과는 활성화 단계에서 C-H/D 결합의 분리를 제안하는 근육간 및 근육내 경쟁 KIE 데이터를 추가로 보강하기 위해 취해졌다.[63]
참고 항목
- 교차 실험(화학)
- 평형 상수#동위원소 치환 효과
- 지질 과산화물에 대한 동위원소 효과
- RubbisCO(리불로스-1,5-bisphosphate carboxylase 산소효소)의 운동동위원소 효과
- 자기 동위원소 효과
- 반응 메커니즘
- 과도 운동 동위원소 분율
참조
- ^ a b c d e Westaway KC (2006). "Using kinetic isotope effects to determine the structure of the transition states of SN2 reactions". Advances in Physical Organic Chemistry. 41: 217–273. doi:10.1016/S0065-3160(06)41004-2.
- ^ Lynn KR, Yankwich PE (5 August 1961). "Isotope Fractionation at the Methyl Carbon in the Reactions of Cyanide Ion with Methyl Chloride and Methyl Bromide". Journal of the American Chemical Society. 83 (15): 3220–3223. doi:10.1021/ja01476a012.
- ^ a b c d e f Atkins P, de Paula J (2006). Atkins' Physical Chemistry (8th ed.). Oxford University Press. pp. 286–288, 816–818. ISBN 978-0-19-870072-2.
- ^ Srinivasan, Bharath. "A Guide to the Michaelis-Menten equation: Steady state and beyond". The FEBS Journal. n/a (n/a). doi:10.1111/febs.16124. ISSN 1742-4658.
Section 1.8 Kinetic isotope effects and magnifying the information content of the Michaelis-Menten equation
- ^ a b c d e f g h Laidler KJ (1987). Chemical Kinetics (3rd ed.). Harper & Row. ISBN 978-0-06-043862-3.
- ^ a b c d Simmons EM, Hartwig JF (March 2012). "On the Interpretation of Deuterium Kinetic Isotope Effects in C–H Bond Functionalizations by Transition‐Metal Complexes". Angewandte Chemie International Edition. 51 (1): 3066–72. doi:10.1002/anie.201107334. PMID 22392731.
- ^ Poirier RA, Wang Y, Westaway KC (March 1994). "A Theoretical Study of the Relationship between Secondary .alpha.-Deuterium Kinetic Isotope Effects and the Structure of SN2 Transition States". Journal of the American Chemical Society. 116 (6): 2526–2533. doi:10.1021/ja00085a037.
- ^ a b c d e Buncel E, Lee CC (1977). Isotopes in cationic reactions. Isotopes in Organic Chemistry. Vol. 5. Amsterdam: Elsevier. ISBN 978-0-444-41927-9. OCLC 867217247.
- ^ a b c d e f g h i Melander L, Saunders WH (1980). Reaction Rates of Isotopic Molecules. New York: Wiley.
- ^ Bigeleisen J, Wolfsberg M (January 1957). "Theoretical and experimental aspects of isotope effects in chemical kinetics". Advances in Chemical Physics. 1: 15–76.
- ^ 무오늄(μe+–)을 수소의 동위원소로 처리하면 원칙적으로 더 큰 KIE가 가능하다. 그러나, 연구 뮤오늄을 포함한 뮤온(22의 1초)((1998년 11월 Villà JCorchado JC, González-Lafont A, Lluch JM, Truhlar 이용 추이를 보)의 짧은 반감기의 제한을 받는다."중수소와muonium 동적 동위 원소 효과의 olefin에 수소 원자가 추가에 설명".미국 화학 회지.120(46):kMu/kH 동위 원소 효과의 예를 보면 12141–2. doi:10.1021/ja982616i..).
- ^ 이 관습은 명명상의 편의와 중수소 운동동위원소 효과가 일반적으로 실험적으로 연구되는 방법을 반영하기 위해 존재한다. 중수소는 IUPAC에 의해 흡수된 기호 D = H를 가지고 있지만, 특별히 프로튬(1H)을 가리키는 일반적인 기호는 없다. 그럼에도 불구하고, 프로토늄 또는 중수소 함유 동위원소의 각각의 속도 상수를 참조하는 라벨이 있는 것이 유용하다는 것이 입증되었기 때문에, 각각H k와D k가 일반적으로 사용되어 왔다. 더욱이, 운동동위원소 효과의 크기는 k/k로HD 표현될 수 있다. 이 표기법은 실험적으로 중수소 운동동위원소 효과를 자연 풍부에서 수소를 함유한 비농축 시작물질과 비교하여 측정한다는 사실과 일치한다. 이것은 거의 항상 유효하다. 왜냐하면 프로티움은 천연 수소의 99.9885%를 차지하기 때문에, "프로티움-농축" 샘플을 얻기 위해 일반적으로 시작 재료의 중수소를 더 고갈시킬 필요가 없다. 표기법과 실험 설정을 결합하면 동위원소 효과 연구에서 "일반적인" 수소를 대신하는 "대체물"로서 중수소를 공통적으로 개념화하게 되었다.
- ^ Bigeleisen J (August 1949). "The Relative Reaction Velocities of Isotopic Molecules". Journal of Chemical Physics. 17 (8): 675–678. Bibcode:1949JChPh..17..675B. doi:10.1063/1.1747368.
- ^ a b c Lowry TH, Richardson KS (1987). Mechanism and theory in organic chemistry (3rd ed.). New York: Harper & Row. pp. 256. ISBN 978-0-06-044084-8. OCLC 14214254.
- ^ Carpenter BK (1984). Determination of organic reaction mechanisms. New York: Wiley. p. 86. ISBN 978-0-471-89369-1. OCLC 9894996.
- ^ Carpenter BK (February 2010). "Kinetic isotope effects: unearthing the unconventional". Nature Chemistry. 2 (2): 80–2. Bibcode:2010NatCh...2...80C. doi:10.1038/nchem.531. PMID 21124393.
- ^ Carroll FA (2010). Perspectives on structure and mechanism in organic chemistry (2nd ed.). Hoboken, N.J.: John Wiley. ISBN 978-0-470-27610-5. OCLC 286483846.
- ^ Kwart H (1 December 1982). "Temperature dependence of the primary kinetic hydrogen isotope effect as a mechanistic criterion". Accounts of Chemical Research. 15 (12): 401–408. doi:10.1021/ar00084a004. ISSN 0001-4842.
- ^ Streitwieser A, Jagow RH, Fahey RC, Suzuki S (May 1958). "Kinetic isotope effects in the acetolyses of deuterated cyclopentyl tosylates1, 2". Journal of the American Chemical Society. 80 (9): 2326–32. doi:10.1021/ja01542a075.
- ^ Swain CG, Stivers EC, Reuwer Jr JF, Schaad LJ (1 November 1958). "Use of Hydrogen Isotope Effects to Identify the Attacking Nucleophile in the Enolization of Ketones Catalyzed by Acetic Acid". Journal of the American Chemical Society. 80 (21): 5885–5893. doi:10.1021/ja01554a077.
- ^ a b c d e f g h i j Anslyn EV, Dougherty DA (2006). Modern Physical Organic Chemistry. University Science Books. pp. 428–437. ISBN 978-1-891389-31-3.
- ^ Razauy M (2003). Quantum Theory of Tunneling. World Scientific. ISBN 978-981-238-019-7.
- ^ Silbey RJ, Alberty RA, Bawendi MG (2005). Physical Chemistry. John Wiley & Sons. pp. 326–338. ISBN 978-0-471-21504-2.
- ^ Borgis D, Hynes JT (1993). "Dynamical theory of proton tunneling transfer rates in solution: General formulation". Chemical Physics. 170 (3): 315–346. Bibcode:1993CP....170..315B. doi:10.1016/0301-0104(93)85117-Q.
- ^ a b Krishtalik LI (May 2000). "The mechanism of the proton transfer: an outline". Biochimica et Biophysica Acta. 1458 (1): 6–27. doi:10.1016/S0005-2728(00)00057-8. PMID 10812022.
- ^ Zuev PS, Sheridan RS, Albu TV, Truhlar DG, Hrovat DA, Borden WT (February 2003). "Carbon tunneling from a single quantum state". Science. 299 (5608): 867–70. Bibcode:2003Sci...299..867Z. doi:10.1126/science.1079294. PMID 12574623.
- ^ Fujisaki N, Ruf A, Gaeumann T (1987). "Tunnel effects in hydrogen-atom-transfer reactions as studied by the temperature dependence of the hydrogen deuterium kinetic isotope effects". Journal of Physical Chemistry. 91 (6): 1602–1606. doi:10.1021/j100290a062.
- ^ Lewis ES, Funderburk L (1967). "Rates and isotope effects in the proton transfers from 2-nitropropane to pyridine bases". Journal of the American Chemical Society. 89 (10): 2322–2327. doi:10.1021/ja00986a013.
- ^ Dewar MJ, Healy EF, Ruiz JM (1988). "Mechanism of the 1,5-sigmatropic hydrogen shift in 1,3-pentadiene". Journal of the American Chemical Society. 110 (8): 2666–2667. doi:10.1021/ja00216a060.
- ^ von Doering W, Zhao X (July 2006). "Effect on kinetics by deuterium in the 1,5-hydrogen shift of a cisoid-locked 1,3(Z)-pentadiene, 2-methyl-10-methylenebicyclo[4.4.0]dec-1-ene: evidence for tunneling?". Journal of the American Chemical Society. 128 (28): 9080–5. doi:10.1021/ja057377v. PMID 16834382.
- ^ 이 연구에서 KIE는 민감한 양성자 NMR에 의해 측정된다. 25 °C에서 외삽된 KIE는 16.6이지만 오차 범위는 높다.
- ^ Kohen A, Klinman JP (July 1999). "Hydrogen tunneling in biology". Chemistry & Biology. 6 (7): R191-8. doi:10.1016/S1074-5521(99)80058-1. PMID 10381408.
- ^ Wilde TC, Blotny G, Pollack RM (May 2008). "Experimental evidence for enzyme-enhanced coupled motion/quantum mechanical hydrogen tunneling by ketosteroid isomerase". Journal of the American Chemical Society. 130 (20): 6577–85. doi:10.1021/ja0732330. PMID 18426205.
- ^ Truhlar DG, Gao J, Alhambra C, Garcia-Viloca M, Corchado J, Sánchez M, Villà J (2002). "The Incorporation of Quantum Effects in Enzyme Kinetics Modeling". Accounts of Chemical Research. 35 (6): 341–349. doi:10.1021/ar0100226.
- ^ Kohen, A; Klinman, J. P (1998). "Enzyme Catalysis: Beyond Classical Paradigms". Accounts of Chemical Research. 31 (7): 397–404. doi:10.1021/ar9701225.
- ^ Maggi F, Riley WJ (2010). "Mathematical treatment of isotopologue and isotopomer speciation and fractionation in biochemical kinetics". Geochimica et Cosmochimica Acta. 74 (6): 1823. Bibcode:2010GeCoA..74.1823M. doi:10.1016/j.gca.2009.12.021.
- ^ Newall, A. Raymond; Hayes, John; Bethell, Donald (1 January 1974). "Intermediates in the decomposition of aliphatic diazo-compounds. Part XI. Mechanistic studies on the reaction of diphenylmethylene with amines in solution". Journal of the Chemical Society, Perkin Transactions 2 (11): 1307–1312. doi:10.1039/P29740001307. ISSN 1364-5471.
- ^ Buncel E, Lee CC (1977). Carbon-13 in Organic Chemistry. Isotopes in Organic Chemistry. Vol. 3. Amsterdam: Elsevier. ISBN 978-0-444-41472-4. OCLC 606113159.
- ^ a b c d Singleton DA, Thomas AA (September 1995). "High-Precision Simultaneous Determination of Multiple Small Kinetic Isotope Effects at Natural Abundance". Journal of the American Chemical Society. 117 (36): 9357–9358. doi:10.1021/ja00141a030.
- ^ a b c Jankowski S (January 2009). "Application of NMR spectroscopy in isotope effects studies". Annual Reports on NMR Spectroscopy. 68: 149–191. doi:10.1016/S0066-4103(09)06803-3. ISBN 9780123810410.
- ^ Martin GJ, Martin ML (1984). "Deuterium labelling at the natural abundance level as studied by high field quantitative 2H NMR". Tetrahedron Letters. 22 (36): 3525–3528. doi:10.1016/s0040-4039(01)81948-1.
- ^ a b Pascal Jr RA, Baum MW, Wagner CK, Rodgers LR (September 1984). "Measurement of deuterium kinetic isotope effects in organic reactions by natural-abundance deuterium NMR spectroscopy". Journal of the American Chemical Society. 106 (18): 5377–5378. doi:10.1021/ja00330a071.
- ^ Gajewski JJ, Peterson KB, Kagel JR, Huang YJ (December 1989). "Transition-state structure variation in the Diels-Alder reaction from secondary deuterium kinetic isotope effects. The reaction of nearly symmetrical dienes and dienophiles is nearly synchronous". Journal of the American Chemical Society. 111 (25): 9078–9081. doi:10.1021/ja00207a013.
- ^ a b Colletto C, Islam S, Juliá-Hernández F, Larrosa I (February 2016). "Room-Temperature Direct β-Arylation of Thiophenes and Benzo[b]thiophenes and Kinetic Evidence for a Heck-type Pathway". Journal of the American Chemical Society. 138 (5): 1677–83. doi:10.1021/jacs.5b12242. PMC 4774971. PMID 26788885.
- ^ a b Frost GB, Serratore NA, Ogilvie JM, Douglas CJ (April 2017). "Mechanistic Model for Enantioselective Intramolecular Alkene Cyanoamidation via Palladium-Catalyzed C-CN Bond Activation". The Journal of Organic Chemistry. 82 (7): 3721–3726. doi:10.1021/acs.joc.7b00196. PMC 5535300. PMID 28294618.
- ^ Kwan EE, Park Y, Besser HA, Anderson TL, Jacobsen EN (January 2017). "13C Kinetic Isotope Effect Measurements Enabled by Polarization Transfer". Journal of the American Chemical Society. 139 (1): 43–46. doi:10.1021/jacs.6b10621. PMC 5674980. PMID 28005341.
- ^ Park Y, Harper KC, Kuhl N, Kwan EE, Liu RY, Jacobsen EN (January 2017). "Macrocyclic bis-thioureas catalyze stereospecific glycosylation reactions". Science. 355 (6321): 162–166. Bibcode:2017Sci...355..162P. doi:10.1126/science.aal1875. PMC 5671764. PMID 28082586.
- ^ Burlingham BT, Pratt LM, Davidson ER, Shiner VJ, Fong J, Widlanski TS (October 2003). "34S isotope effect on sulfate ester hydrolysis: mechanistic implications". Journal of the American Chemical Society. 125 (43): 13036–7. doi:10.1021/ja0279747. PMID 14570471.
- ^ Hennig C, Oswald RB, Schmatz S (March 2006). "Secondary kinetic isotope effect in nucleophilic substitution: a quantum-mechanical approach". The Journal of Physical Chemistry A. 110 (9): 3071–9. Bibcode:2006JPCA..110.3071H. doi:10.1021/jp0540151. PMID 16509628.
- ^ a b Cleland WW (December 2003). "The use of isotope effects to determine enzyme mechanisms". The Journal of Biological Chemistry. 278 (52): 51975–84. doi:10.1074/jbc.X300005200. PMID 14583616.
- ^ a b IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "2차 동위원소 효과". doi:10.1351/골드북.S05523
- ^ "Definition of isotope effect, secondary". Chemistry Dictionary. Chemitool.
- ^ Kurtz KA, Fitzpatrick PF (1997). "pH and Secondary Kinetic Isotope Effects on the Reaction of D-Amino Acid Oxidase with Nitroalkane Anions: Evidence for Direct Attack on the Flavin by Carbanions". Journal of the American Chemical Society. 119 (5): 1155–1156. doi:10.1021/ja962783n.
- ^ Angelis YS, Hatzakis NS, Smonou I, Orfanopoulos M (2006). "Oxidation of benzyl alcohols by dimethyldioxirane. The question of concerted versus stepwise mechanisms probed by kinetic isotope effects". Tetrahedron Letters. 42 (22): 3753–3756. doi:10.1016/S0040-4039(01)00539-1.
- ^ a b Houk KN, Gustafson SM, Black KA (October 1992). "Theoretical secondary kinetic isotope effects and the interpretation of transition state geometries. 1. The Cope rearrangement". Journal of the American Chemical Society. 114 (22): 8565–72. doi:10.1021/ja00048a032.
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 보정 버전: (2006–) "스테릭 동위원소 효과". doi:10.1351/골드북.S06001
- ^ Mislow K, Graeve R, Gordon AJ, Wahl GH (1963). "A Note on Steric Isotope Effects. Conformational Kinetic Isotope Effects in The Racemization of 9,10-Dihydro-4,5-Dimethylphenanthrene". Journal of the American Chemical Society. 85 (8): 1199–1200. doi:10.1021/ja00891a038.
- ^ Bartell LS (1 September 1961). "The Role of Non-bonded Repulsions in Secondary Isotope Effects. I. Alpha and Beta Substitution Effects.1". Journal of the American Chemical Society. 83 (17): 3567–3571. doi:10.1021/ja01478a006.
- ^ Felder T, Schalley CA (May 2003). "Secondary isotope effects on the deslipping reaction of rotaxanes: high-precision measurement of steric size". Angewandte Chemie. 42 (20): 2258–60. doi:10.1002/anie.200350903. PMID 12772156.
- ^ Fleming DG, Arseneau DJ, Sukhorukov O, Brewer JH, Mielke SL, Schatz GC, Garrett BC, Peterson KA, Truhlar DG (January 2011). "Kinetic isotope effects for the reactions of muonic helium and muonium with H2". Science. 331 (6016): 448–50. Bibcode:2011Sci...331..448F. doi:10.1126/science.1199421. PMID 21273484.
- ^ Wiberg KB, Slaugh LH (1958). "The Deuterium Isotope Effect in the Side Chain Halogenation of Toluene". Journal of the American Chemical Society. 80 (12): 3033–3039. doi:10.1021/ja01545a034.
- ^ Lynch RA, Vincenti SP, Lin YT, Smucker LD, Subba Rao SC (1972). "Anomalous kinetic hydrogen isotope effects on the rate of ionization of some dialkyl substituted ketones". Journal of the American Chemical Society. 94 (24): 8351–8356. doi:10.1021/ja00779a012.
- ^ Zi W, Wang YM, Toste FD (September 2014). "An in situ directing group strategy for chiral anion phase-transfer fluorination of allylic alcohols". Journal of the American Chemical Society. 136 (37): 12864–7. doi:10.1021/ja507468u. PMC 4183625. PMID 25203796.
추가 읽기
- Bell RP, Crooks JE (20 July 1965). "Kinetic Hydrogen Isotope Effects in the Ionization of Some Ketonic Substances". Proceedings of the Royal Society of London A. 286 (1406): 285–299. Bibcode:1965RSPSA.286..285B. doi:10.1098/rspa.1965.0144.
![{\displaystyle {\begin{matrix}\\{\ce {{CN^{-}}+{^{12}CH3-Br}->[k_{12}]{^{12}CH3-CN}+Br^{-}}}\\{\ce {{CN^{-}}+{^{13}CH3-Br}->[k_{13}]{^{13}CH3-CN}+Br^{-}}}\\{}\end{matrix}}\qquad {\text{KIE}}={\frac {k_{12}}{k_{13}}}=1.082\pm 0.008}](https://wikimedia.org/api/rest_v1/media/math/render/svg/438109ea220fd190ccc57f3e2c3726c47c24aae0)




![{\displaystyle {\frac {k_{{\ce {H}}}}{k_{{\ce {D}}}}}=\left({\frac {\sigma _{{\ce {H}}}\sigma _{{\ce {D}}}^{\ddagger }}{\sigma _{{\ce {D}}}\sigma _{{\ce {H}}}^{\ddagger }}}\right)\left({\frac {M_{{\ce {H}}}^{\ddagger }M_{{\ce {D}}}}{M_{{\ce {D}}}^{\ddagger }M_{{\ce {H}}}}}\right)^{\frac {3}{2}}\left({\frac {I_{x{\ce {H}}}^{\ddagger }I_{y{\ce {H}}}^{\ddagger }I_{z{\ce {H}}}^{\ddagger }}{I_{x{\ce {D}}}^{\ddagger }I_{y{\ce {D}}}^{\ddagger }I_{z{\ce {D}}}^{\ddagger }}}{\frac {I_{x{\ce {D}}}I_{y{\ce {D}}}I_{z{\ce {D}}}}{I_{x{\ce {H}}}I_{y{\ce {H}}}I_{z{\ce {H}}}}}\right)^{\frac {1}{2}}\left({\frac {\prod \limits _{i=1}^{3N^{\ddagger }-7}{\frac {1-e^{-u_{i{\ce {D}}}^{\ddagger }}}{1-e^{-u_{i{\ce {H}}}^{\ddagger }}}}}{\prod \limits _{i=1}^{3N-6}{\frac {1-e^{-u_{i{\ce {D}}}}}{1-e^{-u_{i{\ce {H}}}}}}}}\right)e^{-{\frac {1}{2}}\left[\sum \limits _{i=1}^{3N^{\ddagger }-7}(u_{i{\ce {H}}}^{\ddagger }-u_{i{\ce {D}}}^{\ddagger })-\sum \limits _{i=1}^{3N-6}(u_{i{\ce {H}}}-u_{i{\ce {D}}})\right]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/93f26faede9d0fba35d6f675e641c716e7284c0d)


 진동의 주파수로, c는
진동의 주파수로, c는 
![{\displaystyle {\begin{aligned}{\frac {k_{{\ce {H}}}}{k_{{\ce {D}}}}}&\cong \exp \left\{-{\frac {1}{2}}\left[\sum \limits _{i=1}^{3N^{\ddagger }-7}(u_{i{\ce {H}}}^{\ddagger }-u_{i{\ce {D}}}^{\ddagger })-\sum \limits _{i=1}^{3N-6}(u_{i{\ce {H}}}-u_{i{\ce {D}}})\right]\right\}\\&\cong \exp \left[\sum _{i}^{\mathrm {(react.)} }{\frac {1}{2}}\Delta u_{i}-\sum _{i}^{\mathrm {(TS)} }{\frac {1}{2}}\Delta u_{i}^{\ddagger }\right]\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20d669d624e10fcb89d116442c5543998ea4fbf8)






















![{\frac {d[A]}{dt}}={\frac {k_{1}k_{3}[ABCD]}{k_{2}[D]+k_{3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f71c52221df559ae3b305086cf125e2cfbfa62c4)
![{\frac {d[A]}{dt}}=k_{1}[ABCD]](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cfaea2beb4c13e320a49b4f66ede1c5a85d0fba)
![{\frac {d[A]}{dt}}={\frac {k_{1}k_{3}[ABCD]}{k_{2}[D]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea50a8acf1a1307f4d9c2b4605f62578e2f79771)
![{\displaystyle {\begin{aligned}{\ce {{A1}+{B}+{C}+\cdots }}\ &{\ce {->[k_{1}]P1}}\\{\ce {{A2}+{B}+{C}+\cdots }}\ &{\ce {->[k_{2}]P2}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8a3e1c66994bddc0e6b39e89f23e4e0ec7a47b5c)

![{\displaystyle {\text{rate}}={-d[{\ce {A}}_{n}] \over dt}=k_{n}\times [{\ce {A}}_{n}]\times f([{\ce {B}}],[{\ce {C}}],\cdots ){\text{ where }}n=1{\text{ or }}2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/26ca6ed80abd2295998fb23de5de165477f2848e)
![{\displaystyle {1 \over k_{1}}\times {\ce {{\mathit {d}}[A1] \over [A1]}}={1 \over k_{2}}\times {\ce {{\mathit {d}}[A2] \over [A2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec95ce0a836f8db29e8a86da2d3a2390214f462c)
![{\displaystyle {1 \over k_{1}}\times \int \limits _{\ce {[A1]^{0}}}^{\ce {[A1]}}{d[{\ce {A}}'_{1}] \over [{\ce {A}}'_{1}]}={1 \over k_{2}}\times \int \limits _{\ce {[A2]^{0}}}^{\ce {[A2]}}{d[{\ce {A}}'_{2}] \over [{\ce {A}}'_{2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b3f5c1311b00398d60afa93ae27d58ac423fd32)
![{\displaystyle {k_{1} \over k_{2}}={\frac {\ce {\ln([A1]/[A1]^{0})}}{\ce {\ln([A2]/[A2]^{0})}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4f8b9f334d8799e9e6fc51d105e53d0148086f1)


![{\displaystyle {\text{KIE}}={\frac {k_{1}}{k_{2}}}={\frac {\ln(1-F_{1})}{\ln[(1-F_{1})R/R_{0}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9f819291ca2e6641dfaf1a2d31025c40927bdd7a)
![{\displaystyle {R \over R_{0}}={\ce {{\frac {[A2]/[A1]}{[A2]^0/[A1]^0}}}}={\ce {{\frac {[A2]/[A2]^0}{[A1]/[A1]^0}}}}={\frac {1-F_{2}}{1-F_{1}}}=(1-F_{1})^{(k_{2}/k_{1})-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/61529d236e7c75ed167c0a1e43f996134b54b908)

![{k_{1} \over k_{2}}={\frac {\ln(1-F_{1})}{\ln[1-(F_{1}R_{P}/R_{0})]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37f721659b133bfa69404286f90a8309fea92944)