스토우딩거 합성
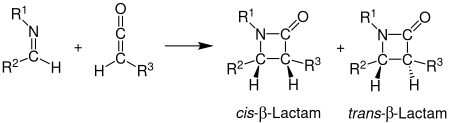
Staudinger synthesisStaudinger ketene-imine cycloaddition이라고도 불리는 Staudinger 합성은 이미네 1이 비포토화학 2+2 cycloaddition을 통해 케틴 2와 반응하여 β-락탐 3을 생성하는 화학 합성이다.[1]이 반응은 β-락탐 항생제 합성에 특히 중요하다.[2]슈타우딩거 합성은 아민에 대한 아지드화물을 줄이기 위해 사용되는 인산 또는 인산염 반응인 슈타우딩거안 된다 혼동해서는 반응과.
그 반응의 메커니즘, 입체화학, 적용에 대한 검토가 발표되었다.[3][4][5]
역사
이 반응은 1907년 독일의 화학자 헤르만 스토우딩거에 의해 발견되었다.[6]그 반응은 페니실린의 구조가 해명된 1940년대까지 관심을 끌지 못했다.최초의 합성 페니실린의 β-락탐 모이티는 이 사이클로어데이션(cycloaddition)을 사용하여 만들어졌으며,[7] 합성 유기화학에서 귀중한 도구로 남아 있다.
메커니즘
첫 번째 단계는 이미인 질소가 카보닐 카본에 작용하여 zwitterionic 중간을 생성하는 핵포함이다.이미네에 전자 기부를 하는 집단은 이 단계를 촉진하는 반면 전자 기증을 하는 집단은 공격을 방해한다.[8]두 번째 단계는 분자 내 핵동결 고리 폐쇄 또는 결합형 전기 순환 고리 폐쇄 중 하나이다.[9]두 번째 단계는 우드워드-호프만 규칙에 의해 예측된 일반적인 전기 순환 고리 폐쇄와는 다르다.광화학 및 마이크로파 조건에서 중간 4˚ 전자 시스템은 β-락탐을 형성하기 위해 탈회성 링 폐쇄를 겪을 수 없으며, 이는 두 개의 이중 결합이 동일라나가 아니기 때문일 수 있다.[10]Staudinger 합성물의 일부 제품은 토르쿠오전자 모델에 의해 예측된 것과 다르다.[11]또한 전환 상태의 전자적 구조는 다른 컨트로터리 링 폐쇄와 다르다.[11]모델 시스템에 대한 컴퓨터 연구로부터 가스 단계에서 메커니즘이 결합된다는 증거가 있다.[5]
입체화학
Staudinger 합성의 입체화학은 어느 단계든 요율을 결정할 수 있기 때문에 예측하기 어려울 수 있다.[12]링 폐쇄 단계가 속도 결정인 경우, 토르쿠셀률에 기반한 입체화학 예측을 신뢰할 수 있다.[12]입체화학에 영향을 미치는 다른 요인으로는 이미인의 초기 역화학이 있다.일반적으로 (E)-imines는 cis β-락탐을 형성하고, (Z)-imines는 trans β-락탐을 형성한다.[5]다른 대체물들은 입체화학에도 영향을 미친다.강한 전자 기부 대체물을 가진 케틴은 주로 시스 β-락탐을 생산하며, 강한 전자 배출 대체물을 가진 케틴은 일반적으로 트랜스 β-락탐을 생산한다.케틴 대체제는 β-락탐을 향한 진행 속도를 높이거나 늦춰 전환 상태에 영향을 미친다.반응이 느리면 이미인의 이성질화가 가능해져 일반적으로 트랜스 제품이 된다.[11]
변형
유기 촉매와 유기 촉매의 사용을 포함한 Staudinger 합성의 비대칭 유도에 대한 검토가 발표되었다.[1][5][13]
이미인은 올레핀을 넣어 사이클로부타논을 생산하거나, 카르보디미드를 넣어 β-락톤을 생산하거나, 카르보디미드를 넣어 4-이미노 β-락탐을 생산할 수 있다.[1]Staudinger 합성과 변형은 모두 케틴 사이클로어다.
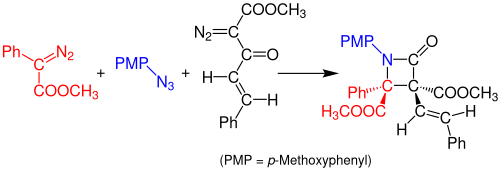
2014년 도일과 동료들은 아지드화합물과 디아조화합물 2개의 β-락탐을 원팟 다중물질로 합성했다고 보고했다.반응은 아릴디아조아세테이트(빨간색)와 유기 아지드(파란색) 사이에 있는 로듐 아세테이트-고분해반응에 의해 발생하여 이미인을 형성한다.디아조아세토아세테이트 에논(검은색)의 월프 재배열은 안정된 케틴을 형성하며, 이는 이미인과 반응하여 안정적인 β-락탐 화합물을 형성한다.이 반응에 사용되는 용제는 디클로로메탄(DCM)으로 상온에서 3시간 정도 쉬어야 한다.반응의 수율은 약 99%[14]이다.
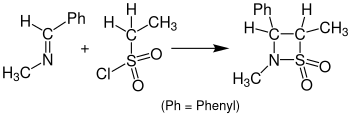
β-sultams로 이어지는 케틴 대신 sulfenes와 반응하는 것을 술파-스토딩거 사이클로어딕트라고 한다.다음 그림은 설파-스토딩거 사이클로어데이션의 예를 보여준다.벤질리데네메틸아민(Benzylidenemethylamine)은 염화 에탄셀포닐과 β-술탐에 반응한다.이 반응의 경우 용매로 사용되는 테트라하이드로푸란(THF)이었고 용액은 24시간 동안 쉬어야 했다.[15]
참조
- ^ a b c Wright, Stephen in Corey, edited by Jie Jack Li ; foreword by E.J. (2010). Name reactions for carbocyclic ring formations. Hoboken, N.J.: Wiley. p. 45. ISBN 9780470872208.
{{cite book}}:first=일반 이름 포함(도움말) - ^ Tidwell, T. T. (2008). "Hugo (Ugo) Schiff, Schiff Bases, and a Century of β-Lactam Synthesis". Angew. Chem. Int. Ed. 47 (6): 1016–1020. doi:10.1002/anie.200702965. PMID 18022986.
- ^ 푸, N.; 티드웰, T. T. "케틴과 이미인의 [2+2] 사이클 추가에 의한 β-락탐의 준비" 테트라헤드론 2008, 64, 10465-10496.([1])
- ^ Georg, Gunda I. (1992). Organic Chemistry of β-Lactams. New York: Verlag Chemie. ISBN 978-0471187998.
- ^ a b c d Cossio, F. P.; Arrieta, A.; Sierra, M. G. (2008). "The Mechanism of the Ketene-Imine (Staudinger) Reaction in Its Centennial: Still an Unsolved Problem?". Accounts of Chemical Research. 41 (8): 925–936. doi:10.1021/ar800033j. PMID 18662024.
- ^ H. Staudinger (1907). "Zur Kenntniss der Ketene. Diphenylketen". Justus Liebigs Ann. Chem. 356 (1–2): 51–123. doi:10.1002/jlac.19073560106.
- ^ J.C. Sheehan, E.L. Buhle, E.J. Corey, G.D. Laubach, J.J. Ryan (1950). "The Total Synthesis of a 5-Phenyl Penicillin: Methyl 5-Phenyl-(2-Carbomethoxyethyl)-Penicillinate". J. Am. Chem. Soc. 72 (8): 3828–9. doi:10.1021/ja01164a534.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Wright, Stephen in Corey, edited by Jie Jack Li ; foreword by E.J. (2010). Name reactions for carbocyclic ring formations. Hoboken, N.J.: Wiley. p. 47. ISBN 9780470872208.
{{cite book}}:first=일반 이름 포함(도움말) - ^ Qi, Hengzhen; Li, Xinyao; Xu, Jiaxi (December 2010). "Stereoselective control in the Staudinger reactions involving monosubstituted ketenes with electron acceptor substituents: experimental investigation and theoretical rationalization". Organic and Biomolecular Chemistry. 9 (8): 2702–2714. doi:10.1039/C0OB00783H. PMID 21359284. S2CID 37085450.
- ^ Liang, Yong; Jiao, Lei; Zhang, Shiwei; Xu, Jiaxi (2005). "Microwave- and Photoirradiation-Induced Staudinger Reactions of Cyclic Imines and Ketenes Generated from α-Diazoketones. A Further Investigation into the Stereochemical Process". Journal of Organic Chemistry. 70 (1): 334–337. doi:10.1021/jo048328o. PMID 15624943.
- ^ a b c Jiao, Lei; Liang, Yong; Xu, Jiaxi (2006). "Origin of the Relative Stereoselectivity of the β-Lactam Formation in the Staudinger Reaction". Journal of the American Chemical Society. 128 (18): 6060–6069. doi:10.1021/ja056711k. PMID 16669675.
- ^ a b Liang, Yong; Jiao, Lei; Zhang, Shiwei; Yu, Zhi-Xiang; Xu, Jiaxi (2009). "New Insights into the Torquoselectivity of the Staudinger Reaction". Journal of the American Chemical Society. 131 (4): 1542–1549. doi:10.1021/ja808046e. PMID 19132931.
- ^ Palomo, Claudio; Aizpurua, Jesus M.; Ganboa, Iñaki; Oiarbide, Mikel (1999). "Asymmetric Synthesis of β-Lactams by Staudinger Ketene-Imine Cycloaddition Reaction". European Journal of Organic Chemistry. 1999 (12): 3223–3235. doi:10.1002/(SICI)1099-0690(199912)1999:12<3223::AID-EJOC3223>3.0.CO;2-1.
- ^ Mandler, Michael D.; Truong, Phong M.; Zavalij, Peter Y.; Doyle, Michael P. (2014). "Catalytic Conversion of Diazocarbonyl Compounds to Imines". Organic Letters. 16 (3): 740–743. doi:10.1021/ol403427s. PMID 24423056.
- ^ Yang, Zhanhui; Chen, Ning; Xu, Jiaxi (2015). "Substituent-Controlled Annuloselectivity and Stereoselectivity in the Sulfa-Staudinger Cycloadditions". The Journal of Organic Chemistry. 80 (7): 3611–3620. doi:10.1021/acs.joc.5b00312. ISSN 0022-3263. PMID 25756543.