쿰메러 재배열
Pummerer rearrangement| 쿰메러 재배열 | |
|---|---|
| 이름을 따서 명명됨 | 루돌프 품메러 |
| 반응형 | 재배열반응 |
| 식별자 | |
| RSC 온톨로지 ID | RXNO:0000220 |
쿰메러 재배열은 아세트산 무수화물 존재에서 황산화알킬을 α-아시록시-티오에더(원뿔소-에스테르)로 재배열하는 유기 반응이다.[1][2][3]
반작용의 확률 측정법은 다음과 같다.
- RS(O)CHR'2 + AcO2 → RSC(OAC)R'2 + AcOH
합성 구현
아세트산 무수화물 외에도 삼불화수소 무수화물, 삼불화수소 무수화물 등이 활성제로 채택됐다.[4]아세테이트 이외의 일반적인 핵은 아레스, 알케네, 아미드, 페놀이다.
TiCl4, SnCl과4 같은 α-아킬 황산화물과 루이스 산을 사용하면 저온(0°C)에서 반응이 진행될 수 있다.[5]
염화 티오닐은 아세트산 무수화물 대신 전기생성 중간을 형성하고 α-염소-염화물을 핵분열체로 공급하기 위한 제거를 촉발하기 위해 사용될 수 있다.[6]
다른 무수화물이나 아킬 할리드는 비슷한 제품을 줄 수 있다.무기산은 또한 이런 반응을 일으킬 수 있다.이 제품은 가수분해로 알데히드나 케톤으로 전환할 수 있다.[7]
메커니즘
쿰메러 재배치의 메커니즘은 아세트산 무수화물(아세트산염)에 의한 황산화물(리소스 구조 1과 2)의 아틸화에서 시작하여 3을 주고, 아세트산을 부산물로 한다.아세트산염은 아세트산을 부산물로 하여 양이온-치알 구조 4를 생성하기 위한 제거 반응을 유도하는 촉매 역할을 한다.마지막으로 아세테이트가 티알을 공격하여 최종 제품 5를 준다.
활성화된 혈전기는 다양한 분자 내 및 분자간 핵물질에 의해 갇혀 탄소-탄소 결합과 탄소-히터 원자 결합을 형성할 수 있다.
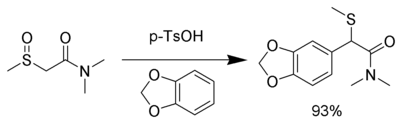
중간은 매우 전기영양적이어서 1,3-벤조디오스콜과 같은 전자 기증 집단이 있는 방향족 고리를 포함하여 중성 핵분열도 사용할 수 있다.[8]
유황 대신 셀레늄을 이용한 재배치가 가능하다.[9]
쿰메러 단편화
α 위치에 대한 대체물이 안정된 탄수화물을 형성할 수 있을 때, α-수소 원자가 아닌 이 그룹은 중간 단계에서 제거될 것이다.이 변이를 쿰메러 단편화라고 한다.[10]이 반응 유형은 아래에 황산화물과 삼불화수소 무수화물(TFAA)의 세트로 설명된다.
오른쪽 하단의 다이어그램에 나타난 유기 그룹 "R2"는 메틸 바이올렛 카바토리로, 9.4의 pK는R+ H의+ 손실보다 경쟁할 만큼 충분하지 않아 고전적인 쿰메러 재배치가 발생한다.왼쪽의 반응은 pKR+ = 23.7의 이탈군이 특히 안정적이기 때문에 단편화된다.
역사
이 반응은 1909년에 보고한 루돌프 [de에 의해 발견되었다.[11][12]
참고 항목
- 오르간황 화학
- 폴로노프스키 반응 - 아민 산화물 관련 유사 반응
- Boekelheide 반응 - 피리딘 산화물 관련 유사 반응
참조
- ^ de Lucchi, Ottorino; Miotti, Umberto; Modena, Giorgio (1991). The Pummerer Reaction of Sulfinyl Compounds. Organic Reactions. Vol. 40. pp. 157–184. doi:10.1002/0471264180.or040.03. ISBN 978-0471264187.
- ^ Padwa, Albert; Gunn, David E., Jr.; Osterhout, Martin H. (1997). "Application of the Pummerer Reaction Toward the Synthesis of Complex Carbocycles and Heterocycles". Synthesis. 1997 (12): 1353–1377. doi:10.1055/s-1997-1384.
- ^ Padwa, Albert; Bur, Scott K.; Danca, Diana M.; Ginn, John D.; Lynch, Stephen M. (2002). "Linked Pummerer-Mannich Ion Cyclizations for Heterocyclic Chemistry". Synlett. 2002 (6): 851–862. doi:10.1055/s-2002-31891.
- ^ Smith, Laura H. S.; Coote, Susannah C.; Sneddon, Helen F.; Procter, David J. (2010). "Beyond the Pummerer Reaction: Recent Developments in Thionium Ion Chemistry". Angewandte Chemie International Edition. 49 (34): 5832–44. doi:10.1002/anie.201000517. PMID 20583014.
- ^ Stamos, Ioannis K. (1986). "Arylation of α-phosphoryl sulfides via their pummerer rearrangement intermediates generated from the corresponding sulfoxides". Tetrahedron Letters. 27 (51): 6261–6262. doi:10.1016/S0040-4039(00)85447-7.
- ^ Kosugi, Hiroshi; Watanabe, Yasuyuki; Uda, Hisashi (1989). "Lewis Acid-Mediated Carbon-Carbon bond forming reaction using the Pummerer Rearrangement Products from Chiral beta-Hydroxy Sulfoxides". Chemistry Letters. 18 (10): 1865–1868. doi:10.1246/cl.1989.1865.
- ^ Meffre, Patrick; Durand, Philippe; Le Goffic, François (1999). "Methyl (S)-2-phthalimido-4-methylthiobutanoate". Organic Syntheses. 76: 123. doi:10.15227/orgsyn.076.0123.
- ^ Ishibashi, Hiroyuki; Miki, Yumiko; Ikeda, Yoshiaki; Kiriyama, Akiko; Ikeda, Masazumi (1989). "Synthesis of α-(Methylthio)arylacetamides and Their Conversion into Some Biologically Active Arylethylamines". Biological & Pharmaceutical Bulletin. 37 (12): 3396–3398. doi:10.1248/cpb.37.3396.
- ^ Gilmour, Ryan; Prior, Timothy J.; Burton, Jonathan W.; Holmes, Andrew B. (2007). "An organocatalytic approach to the core of eunicellin". Chemical Communications (38): 3954–6. doi:10.1039/B709322E. PMID 17896044.
- ^ Laleu, Benoît; Santarém Machado, Marco; Lacour, Jérôme (25 May 2006). "Pummerer fragmentation vs. Pummerer rearrangement: a mechanistic analysis". Chemical Communications (26): 2786–2788. doi:10.1039/b605187a. PMID 17009463.
- ^ Pummerer, Rudolph (1909). "Über Phenyl-sulfoxyessigsäure". Chemische Berichte. 42 (2): 2282–2291. doi:10.1002/cber.190904202126.
- ^ Pummerer, Rudolph (1910). "Über Phenylsulfoxy-essigsäure. (II.)". Chemische Berichte. 43 (2): 1401–1412. doi:10.1002/cber.19100430241.