첼레티방성 반응
Cheletropic reaction첼로티방성[1] 반응으로도 알려진 첼로티방성 반응은 순환성 반응의 일종이다. 순환 반응이란 원자의 주기적 배열과 상호 작용하는 궤도들의 관련 주기적 배열과 함께 전환 상태를 수반하는 반응이다. 이 순환배열에서 σ과 π의 결합의 재편이 일어난다.[2]
특히, 첼레토닉 반응은 사이클로아데이션의 하위종류다. 청결성 반응의 주요 특징 중 하나는 시약에서 두 개의 새로운 결합이 동일한 원자에 만들어지고 있다는 것이다.[3] 오른쪽에는 몇 가지 예가 나와 있다. 첫 번째 경우, 단일 원자는 일산화탄소로 끝나는 카보닐 탄소다. 최종 결과는 원자 하나에 두 개의 새로운 결합을 만드는 것이다. 처음 두 예는 반응에서 작은 안정 분자가 발산되기 때문에 첼레티안성 외류라고 알려져 있다. 이러한 반응의 원동력은 기체 진화의 이방성 이익(예: CO2 또는 N)이다.[2]
이론적 분석
순환 순환 전환 상태에서는 작은 분자가 두 개의 전자를 링에 기증한다. 반응 과정은 두 개의 다른 기하학적 구조를 사용하여 보여질 수 있으며, 작은 분자는 선형 또는 비선형 방식으로 접근할 수 있다. 선형 접근법에서 작은 분자의 궤도상에 있는 전자는 π계통을 직접 가리키게 된다. 비선형 접근법에서는 궤도경사가 비스듬히 접근한다. 작은 분자가 다가옴에 따라 π체계가 회전하는 능력은 새로운 결합을 형성하는데 결정적이다. 시스템에 얼마나 많은 π전자가 있느냐에 따라 회전 방향이 달라질 것이다. 아래는 프런티어 분자 궤도를 이용하여 2전자의 파편이 4전자의 π체계에 접근하는 도표다. 작은 분자가 선형적으로 접근하면 회전이 되고, 분자가 비선형적으로 접근하면 회전이 된다. 멸절과 환절은 π계 내의 결합이 어떻게 회전하고 있는지를 표현하는 정교한 용어다. 탈곡은 반대 방향을 의미하고, 회향은 같은 방향을 의미한다. 이것은 아래 도표에도 설명되어 있다.
후켈의 법칙을 이용하면 π체계가 방향인지 반자율인지 알 수 있다. 방향성이 있는 선형 접근방식은 탈회전을 사용하는 반면 비선형 접근방식은 회절운동을 사용한다. 그 반대는 반(反)자율제도와도 맞먹는다. 선형 접근방식은 회전운동을 하는 반면, 비선형 접근방식은 회전운동을 하게 된다.[2]
SO를2 수반하는 첼레틱 리액
열역학
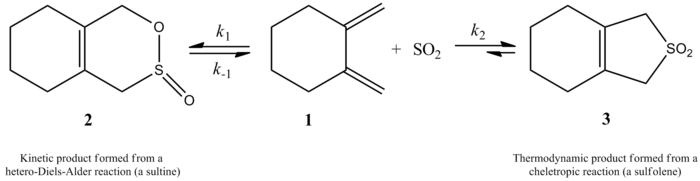
1995년 수아레즈와 소르도는 부타디엔과 이솝렌이 반응했을 때 이산화황은 메커니즘에 따라 두 가지 다른 제품을 준다는 것을 보여주었다. 이것은 실험적으로 보여졌고 ab initio 계산을 사용했다. 운동학적, 열역학적 제품이 모두 가능하지만 열역학적 제품이 더 유리하다. 운동성 제품은 디엘-알데르 반응에서 발생하는 반면, 첼레틱성 반응은 열역학적으로 안정된 제품을 만들어 낸다. 이 방음통로는 보다 안정적인 5mmb의 링 인덕트를 낳기 때문에 선호된다. 아래 도표는 두 제품의 차이를 나타내고, 오른쪽으로 가는 길은 보다 안정적인 열역학적 제품을 보여주고, 왼쪽으로 가는 길은 운동학적 제품을 보여준다.[4]
키네틱스
이산화황에 대한 1,3-다이엔의 방광반응은 운동학적 측면에서 광범위하게 조사되었다(일반적인 반응은 위의 내용 참조).
이 반응에 대한 운동 매개변수의 첫 번째 정량적 측정에서 아이작스와 라일라의 1976년 연구는 부타디엔 유도체에 아황산가스를 첨가하는 비율을 측정했다. 초기 20배 이상의 아황산가스를 가진 30 °C의 벤젠에서 첨가 속도를 모니터링하여 유사 1차 주문 근사치를 허용했다. SO의2 소멸은 분광학적으로 320 nm로 이어졌다. 그 반응은 사이비 1차 운동학을 보여주었다. 몇몇 흥미로운 결과는 디엔에 전자 인출 집단이 반응 속도를 줄인다는 것이었다. 또한, 부피가 큰 집단이 더 많은 집단이 반응 속도를 증가시키면서, 반응률은 2-대체제의 강직 효과에 의해 상당히 영향을 받았다. 저자들은 이를 부피가 큰 집단이 반응에 필수적인 디엔의 시소이드 순응을 선호하는 경향 때문이라고 본다(아래 표 참조). 또한 4개의 온도에서의 속도는 아르헤니우스 방정식을 통해 이러한 반응에 대한 활성화 엔탈피(ΔH‡)와 활성화 엔트로피(ΔS‡)의 계산을 허용하는 디엔 7개의 디엔에 대해 측정되었다.[5]
| -부타디엔 | 104 k /min−1 (30 °C)(± 1-2%) 절대 | 상대4 10 k /min−1(30°C)(± 1-2%) | ΔH‡ /kcal−1 몰 | ΔS‡ /cal mol−1 K−1 |
|---|---|---|---|---|
| 2-메틸 | 1.83 | 1.00 | 14.9 | -15 |
| 2-에틸 | 4.76 | 2.60 | 10.6 | -20 |
| 2-이소프로필 | 13.0 | 7.38 | 12.5 | -17 |
| 2-테르트부틸 | 38.2 | 20.8 | 10.0 | -19 |
| 2-나절 | 17.2 | 9.4 | 11.6 | -18 |
| 2-클로로 | 0.24 | 0.13 | 해당 없음 | 해당 없음 |
| 2-아세토에틸 | 0.72 | 0.39 | 해당 없음 | 해당 없음 |
| 2-플톨 | 24.7 | 13.5 | 10.4 | -19 |
| 2제곱슬 | 17.3 | 9.45 | 해당 없음 | 해당 없음 |
| 2-(p-페르소페닐) | 9.07 | 4.96 | 해당 없음 | 해당 없음 |
| 2,3-아세틸 | 3.54 | 1.93 | 12.3 | -18 |
| 시스-1-메틸 | 0.18 | 0.10 | 해당 없음 | 해당 없음 |
| trans-1-methyl | 0.69 | 0.38 | 해당 없음 | 해당 없음 |
| 1,2-142-에틸렌사이클로헥산 | 24.7 | 13.5 | 11.4 | -16 |
| 2-메틸-1,1,4,4-d4 | 1.96 | 해당 없음 | 해당 없음 | 해당 없음 |
더 최근에, 몬나트, 보겔, 그리고 소르도의 2002년 연구는 1,2-디메틸리덴사이클로알카네스에 아황산가스를 첨가한 운동성을 측정했다. 이 논문에서 제시된 흥미로운 점은 1,2-디메틸리덴사이클로헥산 이산화황의 반응으로 반응 조건에 따라 두 가지 다른 제품이 나올 수 있다는 것이다. 이 반응은 운동 제어 하에서 이질-다이얼-알데르 반응을 통해 해당 황산을 생성하지만, 열역학 제어(≥ -40 °C)에서는 해당 설플렌을 셀레틱 반응을 통해 생성한다. 이질-다이얼-알데르 반응의 활성화 엔탈피는 해당 첼레틱 반응의 활성화 엔탈피보다 약 8 kJ/mol 작다. 설포는 CHCl22/SO2 용액의 등축 황산염보다 약 40 kJ/mol이 안정적이다.[6]
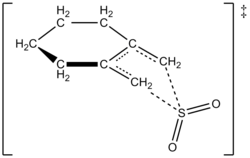
저자들은 실험적으로 1,2-디메틸리덴사이클로헥산의 반응에 대해 261.2K로 비율법을 결정할 수 있었다. 반응은 1차 순서는 1,2-디메틸리덴사이클로헥산이었지만 2차 순서는 이산화황이었다(아래 참조). 이것은 높은 수준의 아비니시오 양자 계산에 근거한 예측을 확인했다. 저자들은 계산법을 이용해 이산화황과 함께 1,2-디메틸리덴사이클로헥산(cylitelidene cyclohexane)의 첼레티방성 반응을 위한 전이 구조를 제안했다(오른쪽 그림 참조).[6] 이 반응은 아황산가스의 두 번째 순서인데, 왜냐하면 다른 분자의 아황산가스는 그것을 안정시키기 위해 전환 상태에 결합할 가능성이 있기 때문이다.[7] 수아레스, 소르도, 소르도가 1995년에 실시한 연구에서 유사한 결과가 발견되었는데, 아비니시오 계산을 사용하여 1,3-다이엔으로 아황산가스의 반응에 대한 운동학적 및 열역학적 제어를 연구했다.[4]
용제 효과
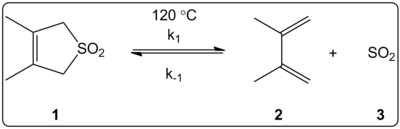
3,4-디메틸-2,5-디하이드로티오펜-1,1-디옥시드(오른쪽 표시)의 첼레방성 반응 용제의 효과는 14개의 용매에서 운동학적으로 조사되었다. 평형 상수 외에 전방 및 역방향 반응의 반응 속도 상수는 E(30T) 용매 극성 척도와 선형 상관 관계가 있는 것으로 밝혀졌다.
반응은 120 °C에서 이루어졌으며 반응 혼합물의 1H-NMR 분광법에 의해 연구되었다. 전진율 k는1 사이클로헥산에서 메탄올까지 4.5배 감소하는 것으로 나타났다. 역률 k는−1 사이클로헥산에서 메탄올까지 53배 증가하는 반면 평형 상수 K는eq 140배 감소하는 것으로 나타났다. 평형 데이터와 운동 데이터의 상관관계에 의해 입증된 바와 같이 활성화 과정 중에 극성의 변화가 있을 것으로 제안한다. 저자들은 이 반응이 용매의 극성에 의해 영향을 받는 것으로 보이며, 이는 반응제에서 전환 상태로 가는 쌍극자 모멘트의 변화에 의해 설명될 수 있다고 말한다. 저자들은 또한 방광반응이 용제 산도나 기본성의 영향을 받지 않는 것 같다고 말한다.
이 연구의 결과는 저자들이 다음과 같은 행동을 기대하도록 이끈다.
1. 용매 극성의 변화는 평형보다 낮은 속도에 영향을 미칠 것이다.
2. 속도 상수는 극성에 대한 반대 효과로 특징지어진다:k는1 E(30T)가 증가하면 약간 감소하고, k는−1 같은 조건에서 증가하게 된다.
3. k에−1 대한 효과는 k에1 비해 클 것이다.[8]
연골에 카베네 추가
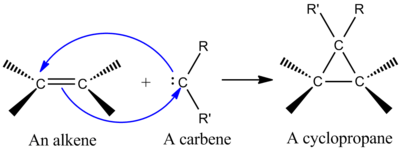
가장 종합적으로 중요한 첼레틱 반응 중 하나는 사이클로프로판(cyclopropane)을 만들기 위해 알켄에 싱글렛 카베인을 첨가한 것이다(왼쪽 그림 참조).[2] 카베네는 발란스 껍질 안에 6개의 전자가 있는 분열 탄소를 함유하고 있는 중성 분자다. 이 때문에 카르베네는 반응성이 높은 전기영역이며 반응 매개체로 생성된다.[9] 싱글레 카베네에는 빈 p 궤도, 두 개의 전자를 가진 대략적인 sp2 하이브리드 궤도 등이 들어 있다. 싱글렛 카베네는 알케인에 특히 입체감을 더하고 알케네 입체화학은 사이클로프로판 제품에 보존된다.[2] 알켄에 카베인을 추가하는 메커니즘은 [2+1] 사이클로어데이션(그림 참조)이다. 클로로포름이나 브로모포름에서 파생된 카르베네는 알켄에 CX를2 첨가하여 디할로시클로프로판(dihalocyclopropane)을 주는 데 사용할 수 있고, 시몬스-스미스 시약은 CH를2 첨가한다.[10]
알켄 π 시스템과 공전된 카베네 오비탈의 상호작용은 4 전자 시스템을 생성하며 비선형 접근법을 선호한다. 카베네 빈 p 궤도(carbene 빈 p 궤도)와 채워진 알켄 π 궤도(bottal)를 섞는 것도 유리하다. 비선형 접근법을 통해 양호한 혼합이 발생한다(오른쪽 그림 참조). 그러나 이론은 분명히 비선형 접근법을 선호하지만, 선형 대 비선형 접근법에 대한 명백한 실험적 의미는 없다.[2]
참조
- ^ 첼로티방성반응 IUPAC 골드북
- ^ a b c d e f 에릭 V. 앤슬린과 데니스 A. Dougherty Modern Physical Organical Chemistry University Science Books, 2006.
- ^ 이언 플레밍. 프런티어 궤도 및 유기 화학 반응. 와일리, 1976년
- ^ a b Suarez, D.; Sordo, T. L.; Sordo, J. A. (1995). "A Comparative Analysis of the Mechanisms of Cheletropic and Diels-Alder Reactions of 1,3-Dienes with Sulfur Dioxide: Kinetic and Thermodynamic Controls". J. Org. Chem. 60 (9): 2848–2852. doi:10.1021/jo00114a039.
- ^ Isaacs, N. S.; Laila, A. A. R. (1976). "Rates of addition of sulphur dioxide to some 1,3-dienes". Tetrahedron Lett. 17 (9): 715–716. doi:10.1016/S0040-4039(00)74605-3.
- ^ a b Monnat, F.; Vogel, P.; Sordo, J. A. (2002). "Hetero-Diels-Alder and Cheletropic Additions of Sulfur Dioxide to 1,2-Dimethylidenecycloalkanes. Determination of Thermochemical and Kinetics Parameters for Reactions in Solution and Comparison with Estimates From Quantum Calculations". Helv. Chim. Acta. 85 (3): 712–732. doi:10.1002/1522-2675(200203)85:3<712::AID-HLCA712>3.0.CO;2-5.
- ^ Fernandez, T.; Sordo, J. A.; Monnat, F.; Deguin, B.; Vogel, P. (1998). "Sulfur Dioxide Promotes Its Hetero-Diels−Alder and Cheletropic Additions to 1,2-Dimethylidenecyclohexane". J. Am. Chem. Soc. 120 (50): 13276–13277. doi:10.1021/ja982565p.
- ^ Desimoni, G.; Faita, G.; Garau, S.; Righetti, P. (1996). "Solvent effect in pericyclic reactions. X. The cheletropic reaction". Tetrahedron. 52 (17): 6241–6248. doi:10.1016/0040-4020(96)00279-7.
- ^ 존 맥머리 유기화학, 6번 에드 톰슨, 2004년
- ^ 로버트 B. Grossman The Art of Writing Organ Reaction Mechanism Springer, 2003.

![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][{\ce {SO2}}]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/daf1918f0d2b67189681e12fe5b4bb71b0920384)