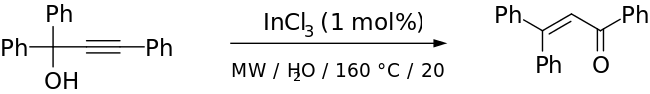마이어-슈스터 재배치
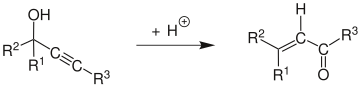
Meyer–Schuster rearrangement마이어-슈스터 재배열은 알카인 그룹이 내부일 경우 2차 및 3차 프로파르길 알코올을 α,β-불포화 케톤으로 산성 분석된 재배열로 설명되며, 알카인 그룹이 단자일 경우 α,β-불포화 알데히드에 대한 화학 반응이다.[1] Swaminathan과 Narayan,[2] Vartanyan과 Banbanyan,[3] 그리고 Engely와 Dudley에 의해 리뷰가 발표되었는데,[4] 그 중 마지막은 프로파글 알코올이 사용할 수 있는 다른 반응에 대해 Meyer-Schuster 재정비를 촉진하는 방법을 기술하고 있다.
기초에 의해 촉매될 때, 그 반응은 프루프스키 반응이라고 불린다.
메커니즘
반응 메커니즘은[5] 알킨에서 알렌을 형성하기 위해 E1 반응을 남기는 알코올의 양성으로부터 시작된다. 탄수화물 및 탈염화 물질에 물 분자의 공격은 α, β-불포화 카보닐 화합물을 주기 위한 tautomerization에 따른다.
에덴스 외 반응 메커니즘을 조사하였다.[6] 그들은 그것이 세 가지 주요한 단계로 특징지어졌다는 것을 발견했다: (1) 산소의 빠른 양성화, (2) 양성자 수산화 그룹의 1,3교대로 구성된 느리고, 속도 결정적인 단계, (3) 케토-에놀 토토머리즘, 그리고 급속한 감응이 뒤따른다.
안드레스 외 연구진은 마이어-슈스터 반응의 속도 제한 단계에 관한 연구에서 반응의 원동력이 카보늄 이온을 통한 불포화 카보닐 화합물의 되돌릴 수 없는 형성이라는 것을 보여주었다.[7] 그들은 또한 그 반응이 용제에 의해 도움을 받는다는 것을 발견했다. 이는 용매 케이징이 전환 상태를 안정화한다는 것을 보여준 타피아 외 연구진에 의해 추가적으로 조사되었다.[8]
루피 재배열
α-아세틸렌 그룹을 포함하는 3차 알코올의 반응은 기대 알데히드가 아니라 에닌 중간을 통해 α,β-불포화 메틸케톤을 생성한다.[9][10] 이러한 대체반응을 루페반응이라고 하며, 3차 알코올의 경우 마이어-슈스터 재배열과 경쟁한다.
촉매 사용
전통적인 마이어-슈스터 재배열은 강한 산을 촉매로 하여 가혹한 조건을 사용하는 반면, 이는 알코올이 3차인 경우 루페 반응과의 경쟁을 도입한다.[2] 전환 금속 기반 및 루이스 산 촉매(예: Ru-[11] 및 Ag-기반[12] 촉매)에서는 온건한 조건이 성공적으로 사용되어 왔다. 카디르노 외 연구진은 반응 시간이 짧고 입체감이 뛰어난 우수한 수율을 제공하기 위한 촉매로서 InCl 와 함께 마이크로파 방사선을 사용했다고 보고한다.[13] 그들의 논문의 예는 다음과 같다.
적용들
그 Meyer–Schuster 자리 옮김 다양한 애플리케이션에, ω-alkynyl-ω-carbinol lactams의 enamides 촉매 PTSA[14]을 사용하도록α,β-unsaturated thioesters의 적 γ-sulfur에서 변환 3-alkynyl-3-hydroxyl-1H-isoindoles의 약간 산성 상태로 재배열에 alcohols[15]propargyl 대체에서 사용되어 왔다.sgive α,β-불포화 카보닐 화합물.[16] 그러나, 가장 흥미로운 응용 프로그램 중 하나는 오직 E-alkene으로 이어지는 이질적 선택적 방법으로 pacitracel의 일부를 합성하는 것이다.[17]
위와 같은 단계는 70%의 수율을 보였다(부품을 다른 단계로 마이어-슈스터 제품으로 전환했을 때 91%). 저자들은 방해받은 케톤을 나머지 분자를 파괴하지 않고 알켄으로 바꾸고 싶었기 때문에 마이어-슈스터 재배열을 이용했다.
참조
- ^ 마이어, K. H.; 슈스터, K. Ber. 1922, 55, 819. (doi:10.1002/cber.19220550403)
- ^ a b S.S.의 스와미나탄; K. V. "루페와 마이어-슈스터 재배열" 화학. 1971년 개정판, 71, 429–438. (검토)
- ^ 바탄얀, S. A.; 반바얀, S. 오. 러스. 화학. 1967년 개정판, 36, 670. (검토)
- ^ 엥겔, D.A.; 더들리, G.B. 유기농 및 생체 분자 화학 2009, 7, 4149–4158. (검토)
- ^ Li, J.J. Meyer-Schuster 재정비; 이름 반응: 상세한 반응 메커니즘 모음; 스프링거: 베를린, 2006; 380–381. (doi:10.1007/978-3-642-01053-8_159)
- ^ 에덴스, M.; Boerner, D.; 체이스, C. R.; 나스, D. 나스; Schabiaelli, M. D. J. Org. Chem. 1977, 42, 3403–3408. (doi:10.1021/jo00441a017)
- ^ 안드레스, J, 카르데나스, R, 신라, E; 타피아, O. J. Am. Chem. Soc. 1988, 110, 666–674. (doi:10.1021/ja00211a002)
- ^ 타피아, O.; Lluch, J.M.; 카데나, R.; 안드레스, J. Am. Chem. Soc. 1989, 111, 829–835. (doi:10.1021/ja00185a007)
- ^ 루피, H.; 캄블리, E. 헬프. 침. 액타 1926, 9, 672. (doi:10.1002/hlca.19260090185)
- ^ Li, J.J.의 루페 재배열; 이름 반응: 상세한 반응 메커니즘 모음; 스프링거: 베를린, 2006; 513–514. (doi:10.1007/978-3-642-01053-8_224)
- ^ 카디르노, V.; 크로셰, P.; 기메노, J. 싱렛 2008, 1105–1124. (doi:10.1055/s-2008-1072593)
- ^ 스가와라, Y.; 야마다, 요시다, S.; 이케노, T.; 야마다, T.J. Am. Chem. Soc. 2007, 129, 12902-12903. (doi:10.1021/ja074350y)
- ^ 카디에르노, 브이, 프랑코스, J, 기메노, J. 테트라헤드론 레트. 2009, 50, 4773–476. (doi:10.1016/j.problet.2009.06.040)
- ^ 치하브-에딘, A.; 다이히, A.; 질레, A.; 데크룩스, B. J. 헤테로시클. 화학. 2000, 37, 1543–1548. (doi:10.1002/jet.5570370622)
- ^ 요시마쓰, M. 나이토, M., M. 가와히가시, 시미즈, H., 카타오카, T. J. Org. Chem. 1995, 60, 4798–4802. (doi:10.1021/jo00120a024)
- ^ 오마르, E.A.; Tu, C.; 위갈, C.T.; 브라운, L.L. J. 헤테로사이클. Chem. 1992, 29, 947–951. (doi:10.1002/jet.557029045)
- ^ 크리치, 디, 나타라얀, 크리치, J.Z. 4면체 1997, 53, 7139–7158. (doi:10.1016/S0040-4020(97)00411-0)