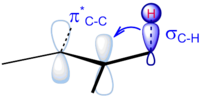
초점화
Hyperconjugation유기화학에서 과점화(高σ化, no-bond conjuation, no-bond concommunity)는 주로 σ-문자의 결합이 참여하여 전자의 소산화를 말한다. 보통 초점화(hyper conconjuation)는 한 쌍의 연장된 분자 궤도를 주기 위해 인접한 비번딩 p 또는 항균 ** 또는 ** 궤도와 시그마(σ) 궤도(예: C–H 또는 C–C)에서 전자의 상호작용을 포함한다. 그러나 때로는 저지대 항균 σ* 궤도도 음의 하이퍼 컨버전스라고 하는 것에서 외로운 쌍 문자(n)의 채워진 궤도와 상호작용할 수 있다.[1] 초융합과 관련된 전자소산화가 증가하면 시스템의 안정성이 높아진다.[2][3] 특히 본딩 특성이 있는 새로운 궤도형태가 안정화돼 분자의 전체적인 안정화가 이뤄진다.[4] β 위치에 있는 본드에 있는 전자들만이 이러한 종류의 직접 안정화 효과를 가질 수 있다 - 원자의 시그마 본드에서 직접 부착된 다른 원자의 궤도까지 기증한다. 그러나, 확장된 하이퍼 통합 버전(예: 이중 하이퍼[5] 통합)도 중요할 수 있다. 때때로 초점화(hyper conconjuation)와 동의어로 사용되기도 하는 베이커-네이단 효과는 특정 화학 반응이나 구조 유형에 그것을 구체적으로 적용하는 것이다.[6][7]
적용들
고농축은 변칙 효과, 거슈 효과, 에탄의 회전 장벽, 베타 실리콘 효과, 엑소사이클릭 카보닐 그룹의 진동수, 대체 탄화수소와 대체탄소 중심 활성산소의 상대적 안정성 등 다양한 화학적 현상을 합리화하는 데 사용될 수 있다.알켄 안정성에 대한 모디 다이내믹 자이체프의 규칙 더 논쟁적으로, 초점화 현상은 양자역학 모델링에 의해 제안되며, 이는 오래된 교과서 개념인 강직 장애보다는 시차적 순응을 선호하기 위한 더 나은 설명이다.[8][9]
화학적 특성에 미치는 영향
초점화 현상은 몇 가지 특성에 영향을 미친다.[6][10]
- 결합 길이: 시그마 본드(시그마 본드)의 단축의 핵심 요인으로 과점화가 제시되고 있다. 예를 들어, 1,3-부타디엔과 프로피네의 단일 C-C 결합은 길이가 약 1.46 앙스트롬으로, 포화 탄화수소에서 발견된 약 1.54 å의 값보다 훨씬 작다. 부타디엔의 경우, 이것은 두 알케닐 부분의 정상적인 결합으로 설명할 수 있다. 하지만 프로핀의 경우 알킬 부분과 알킬 부분 사이의 초점화.
- 쌍극자 모멘트: 클로로포름에 비해 1,1,1-트리클로로에탄의 쌍극자 모멘트가 크게 증가한 것은 과혼탁 구조 때문이라고 볼 수 있다.
- 고농축 분자의 형성 열은 결합 에너지의 합계보다 크고 이중 결합당 수소화 열은 에틸렌의 수소화 열보다 적다.
- 탄화물의 안정성:
- (C3)3C+ > (CH3)2CH+ > (CH3)CH2+ > CH3+
- 카보트에 부착된 메틸 그룹의 C-H σ 본드 3개는 안정화 상호작용을 할 수 있지만 탄소-탄소 본드의 순응에 따라 그 중 하나만 빈 p-오르비탈과 완벽하게 정렬할 수 있다. 잘못 정렬된 두 C-H 채권의 기부가 약하다.[11] 인접한 메틸 집단이 많을수록 고주화 안정화가 더 큰 것은 인접 C-H 채권의 증가 때문이다.
불포화화합물에서의 과열도
대체 정도가 높아짐에 따라 탄소-탄소 이중 결합의 안정성이 높아진 이유로 초연결화가 제시됐다. 초기의 초기의 연구들은 George Kistiakowsky의 연구 그룹에서 수행되었다. 1937년에 처음 출판된 그들의 연구는 다양한 불포화성분과 순환성분들의 추가 반응 동안에 에너지 변화에 대한 열화학적인 연구의 예비 진행 보고서로서 의도되었다. 이러한 효과의 회계처리에 있어서 초점화의 중요성은 양자 화학적 계산으로부터 지지를 받았다.[12] 핵심 상호작용은 인접 C–H σ 결합으로부터 알켄의 antib* 항균 궤도( orbitalσC–H→π*)로 전자 밀도를 기부하는 것으로 생각된다. 그 효과는 미충전 p 궤도이 에너지가 더 낮기 때문에 carb 결합에 보다 에너지적으로 더 잘 매칭되기 때문에 탄화수소에 대한 알킬 대체의 경우( magnitude→pC–HC)보다 거의 약하다. 이러한 효과가 열역학적으로 제어되는 E1 반응에서 더 대체된 제품의 형성에 나타날 때, 비록 많은 경우에 운동성 제품도 이 규칙을 따르지만 자이체프의 규칙으로 알려져 있다. (운동성 제품이 덜 대체되는 경우는 호프만의 규칙을 참조한다.)
Kistiakowsky의 한 세트의 실험은 하나의 알켄 단위를 포함하는 다양한 화합물의 기체 위상 반응 동안 수소화 데이터의 열 수집을 포함했다. 모노칼크릴 대체 알켄의 범위를 비교했을 때, 그들은 어떤 알킬 그룹도 눈에 띄게 안정성을 증가시켰지만, 서로 다른 특정 알킬 그룹의 선택은 거의 영향을 미치지 않는다는 것을 발견했다.[13]
Kistiakowsky의 연구의 일부는 CH2=CH(CH2)n-CH=CH2(n=0,1,2) 형태의 다른 불포화 화합물의 비교를 포함한다. 이 실험들은 중요한 결과를 보여주었다; n=0일 때, ΔH 값이 3.5 kcal 낮아지는 분자에 대한 결합의 효과가 있다. 이것은 에틸렌에 두 알킬 그룹을 첨가한 것에 비유된다. Kistiakowsky는 또한 개방 체인 시스템을 조사했는데, 여기서 해방된 열의 가장 큰 가치는 1,4 위치의 분자에 더해지는 동안인 것으로 밝혀졌다. 순환 분자는 분자의 변형을 고려해야 할 것으로 밝혀졌기 때문에 가장 문제가 되는 것으로 판명되었다. 5mb의 고리의 변형률도 증가하면서 미생물의 정도가 줄어들었다. 이것은 나중에 순환산 무수화물과 유당을 사용한 연구에서 더욱 연구된 놀라운 결과였다. 벤젠과 그 유도체와 같은 순환 분자 또한 연구되었는데, 이들의 행동이 다른 불포화 화합물들과 다르기 때문이다.[13]
키스티아코프스키의 연구가 철저했음에도 불구하고, 그것은 완전하지 않았고 그의 연구 결과를 뒷받침할 추가적인 증거가 필요했다. 그의 작품은 초융합과 결합 효과의 사상의 시작에 결정적인 첫걸음이었다.
1,3부타디엔과 1,3부타디엔의 안정화
1,3-부타디엔의 결합은 키스티아코프스키가 처음 평가한 것으로, 결합종과 비주사유동체 사이의 수소화 비교에 에너지적인 결과를 바탕으로 3.5 kcal/mol의 결합 기여도를 알아냈다.[13] 키스티아코프스키가 처음 적용한 방법을 사용한 로저스는 1차 수소와 2차 수소의 ΔHhyd 차이가 0이므로 1,3-부타디엔의 결합 안정화가 0이라고 보고했다. 수소화(ΔHhyd)의 가열은 계산 G3(MP2) 양자화학 방법에 의해 얻어졌다.[14]
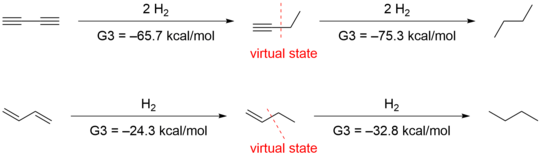
Houk이[15] 이끄는 또 다른 그룹은 Rogers와 Kistiakowsky가 채택한 방법은 부적절하다고 제안했다. 왜냐하면 수소화 가열 비교는 결합 효과뿐만 아니라 다른 구조 및 전자적 차이도 평가하기 때문이다. ab initio 계산으로 1차 수소와 2차 수소에 대해 각각 -70.6kcal/mol, -70.4kcal/mol을 획득해 로저스의 데이터를 확인했다. 다만 초점화 안정화를 고려해 데이터를 다르게 해석했다. 초점화 효과를 정량화하기 위해, 그들은 1-부티네와 1-부틴으로 다음과 같은 이질 반응을 설계했다.
하이퍼주전 상호작용을 삭제하면 각각 1-부티네 및 1-부틴보다 높은 4.9 및 2.4 kcal/mol의 에너지를 갖는 가상 상태가 된다. 이러한 가상 상태를 고용하면 1,3-부타디엔의 경우 9.6 kcal/mol의 결합 안정화와 1,3-부타디엔의 경우 8.5 kcal/mol이 된다.
초점화 경향
비교적 최근의 페르난데스와 Frenking(2006)의 연구(2006)는 에너지 분해 분석 또는 EDA를 이용하여 다양한 순환 분자군 사이의 하이퍼콘주화 추세를 요약하였다. 페르난데스와 Frenking은 이러한 유형의 분석을 "...파이의 상호작용을 추정하기 위해 분자의 기하학에서 상호작용하는 파편들의 pi 궤도만을 사용하는 방법"이라고 정의한다.[16] 이러한 유형의 분석을 위해 다양한 분자 모이에티 사이의 결합 형성은 세 가지 성분 항을 조합한 것이다. ΔE는elstat 페르난데스와 프랑킹이 분자의 "정전기적 명소"라고 부르는 것을 나타낸다.[16] 두 번째 용어인 ΔE는Pauli 분자의 Pauli refusion을 나타낸다. 제3항인 ΔE는orb 궤도 사이의 안정화 교호작용을 나타내며, ΔE와pi ΔE의sigma 합으로 정의된다. 교호작용의 총 에너지 ΔE는int 3항 합계의 결과물이다.[16]
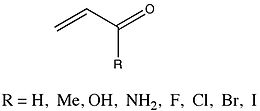
ΔEpi 값이 매우 철저하게 분석된 그룹은 대체물이 다양한 에논 그룹이었다.
페르난데스와 Frenking은 메틸, 히드록실, 아미노 대체물이 부모 2-프로펠러로부터 ΔE의pi 감소를 초래했다고 보고했다. 반대로 원자 질량 증가의 할로겐화 대체물은 ΔE를pi 증가시켰다. 에논 연구와 해밋 분석 연구 모두 대체 효과(다른 종에 속하기는 하지만)를 연구하기 때문에 페르난데스나 프레드킹은 가능한 추세를 조사하기 위해 둘을 비교하는 것이 그들 자신의 결과에 대해 상당한 통찰력을 산출할 수 있을 것이라고 생각했다. 그들은 대체 에논에 대한 ΔEpi 값과 해당 해밋 상수 사이의 선형 관계를 관찰했다. 그래프의 기울기는 -51.67로 조사되었으며 상관 계수는 -0.97이고 표준 편차는 0.54이다.[16] 페르난데스와 Frenking은 이 자료로부터 ...라고 결론짓는다."호모계 및 이성교체계에서의 파이 결합에 대한 대체물 R의 전자적 효과는 유사하므로 결합계통의 성격과 다소 무관하게 보인다."[16][17]
에탄의 회전 장벽
화학적 설명으로서 과점화가 간과될 수 있는 예는 에탄의 회전 장벽26(CH)을 합리화하는 것이다. 에탄의 시차적 순응이 에탄의 순응보다 더 안정적이라는 것은 1930년대 초에 받아들여졌었다. 윌슨은 어떤 한 쌍의 에클리핑된 순응과 시차적 순응 사이의 에너지 장벽이 대략 3kcal/mol이라는 것을 증명했고, 이에 대한 일반적으로 인정되는 근거는 수소 원자 사이의 불리한 강직 상호작용이었다.
그러나 2001년 논문에서 팝어리즘과 굿맨은[8] 이 설명이 너무 단순할 수도 있다고 밝혔다.[18] Goodman은 세 가지 주요 물리적 요인에 초점을 맞췄다: 고주파 상호작용, Pauli 제외 원리에 의해 정의된 교환 거부반응, 정전기 상호작용(Coulomb 상호작용). 기존의 에탄 분자와 가상의 에탄 분자를 교환 거부반응이 모두 제거된 상태에서 비교함으로써 각 분자에 대한 비틀림 각도 대 에너지를 그려 전위 곡선을 작성했다. 곡선의 분석은 시차적 순응이 분자 내 정전기 반발 양과 아무런 관련이 없다고 판단했다. 이러한 결과는 중앙 결합 스트레칭이 정전기 교호작용을 감소시킨다는 사실에도 불구하고, 쿨롬빅 힘이 선호되는 시차적 순응을 설명하지 않는다는 것을 보여준다.[8]
Goodman은 또한 과대결합에 대한 Visinal (두 메틸 그룹 사이의) 대 보석 (단일 메틸 그룹의 원자 사이의) 상호작용의 기여를 결정하기 위한 연구를 수행했다. 별개의 실험에서 보석과 골수 상호작용은 제거되었고, 각 상호작용에 대해 가장 안정적인 컨포머를 추론했다.[8]
| 삭제된 상호 작용 | 비틀림 각도 | 해당 컨포머 |
|---|---|---|
| 없음 | 60° | 시차드 |
| 모든 초점화 | 0° | 에클립스드 |
| 부신성초결절 | 0° | 에클립스드 |
| 보석과정화 | 60° | 시차드 |
이러한 실험들을 통해, 과잉주전 효과가 전하를 분해하고 분자를 안정화시킨다는 결론을 내릴 수 있다. 또한 분자를 시차 순응에 유지시키는 것은 바로 변상성 하이퍼결합 효과다.[8] 이 작업 덕분에, 에탄의 시차적 순응의 안정화 모델은 이제 더 많이 받아들여지고 있다.
또한 하이퍼 통합은 에탄의 회전 장벽에 대한 설명만큼 직관적이지 않을 수 있는 몇 가지 다른 현상도 설명할 수 있다.[18]
에탄의 회전 장벽 문제는 과학계 내에서 해결되지 않는다. 정량적 분자 궤도 이론 내에서의 분석은 2-Orbital-4-Electron (steric) reversulation이 초동화보다 우세하다는 것을 보여준다.[19] 용맹결속 이론 연구는 또한 강직 효과의 중요성을 강조한다.[20]
참고 항목
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "하이퍼 컨버전스". doi:10.1351/골드북.H02924
- ^ 존 맥머리 유기화학, 2판. ISBN0-534-07968-7
- ^ Alabugin, I.V.; Gilmore, K.; Peterson, P. (2011). "Hyperconjugation". WIREs Comput Mol Sci. 1: 109–141. doi:10.1002/wcms.6. S2CID 222197582.
- ^ 항균성의 혼합궤도는 사실 원래의 항균궤도에 비해 에너지에서 상승한다. 그러나 항응궤도는 대부분의 경우 채우지 않은 상태로 남아 있기 때문에, 이것은 보통 시스템의 에너지에 영향을 미치지 않는다.
- ^ 알라부진, I. V. (2016) 원격 스테레오전자 효과에서: 구조와 반응성의 교량, 존 와일리 & 선스, Ltd, Chichester. doi:10.1002/9781118906378.ch8
- ^ a b Deasy, C.L. (1945). "Hyperconjugation". Chem. Rev. 36 (2): 145–155. doi:10.1021/cr60114a001.
- ^ Madan, R.L. (2013). "4.14: Hyperconjugation or No-bond Resonance". Organic Chemistry. Tata McGraw–Hill. ISBN 9789332901070.
- ^ a b c d e Pophristic, V.; Goodman, L. (2001). "Hyperconjugation not steric repulsion leads to the staggered structure of ethane". Nature. 411 (6837): 565–8. Bibcode:2001Natur.411..565P. doi:10.1038/35079036. PMID 11385566. S2CID 205017635.
- ^ Frank Weinhold (2001). "Chemistry. A new twist on molecular shape". Nature. 411 (6837): 539–41. Bibcode:2001Natur.411..539W. doi:10.1038/35079225. PMID 11385553. S2CID 9812878.
- ^ Schmeising, H.N.; et al. (1959). "A Re-Evaluation of Conjugation and Hyperconjugation: The Effects of Changes in Hybridisation on Carbon Bonds". Tetrahedron. 5 (2–3): 166–178. doi:10.1016/0040-4020(59)80102-2.
- ^ Alabugin, Igor V.; Bresch, Stefan; dos Passos Gomes, Gabriel (2014). "Orbital hybridization: a key electronic factor in control of structure and reactivity". Journal of Physical Organic Chemistry. 28 (2): 147–162. doi:10.1002/poc.3382.
- ^ Braida, Benoit; Prana, Vinca; Hiberty, Philippe C. (2009). "The Physical Origin of Saytzeff's Rule". Angewandte Chemie International Edition. 48 (31): 5724–5728. doi:10.1002/anie.200901923. ISSN 1521-3773. PMID 19562814.
- ^ a b c Kistiakowsky, G. B.; et al. (1937). "Energy Changes Involved in the Addition Reactions of Unsaturated Hydrocarbons". Chem. Rev. 20 (2): 181–194. doi:10.1021/cr60066a002.
- ^ Rogers,D. W.; et al. (2003). "The Conjugation Stabilization of 1,3-Butadiyne is Zero". Org. Lett. 5 (14): 2373–5. doi:10.1021/ol030019h. PMID 12841733.
- ^ Houk, K.N.; et al. (2004). "How Large is the Conjugative Stabilization of Diynes?". J. Am. Chem. Soc. 126 (46): 15036–7. doi:10.1021/ja046432h. PMID 15547994.
- ^ a b c d e Fernandez, I., Frenking, G. (2006). "Direct Estimate of the Strength of Conjugation and Hyperconjugation by the Energy Decomposition Analysis Method". Chem. Eur. J. 12 (13): 3617–29. doi:10.1002/chem.200501405. PMID 16502455.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ 그래프 및 전체 분석에 대해서는 참조 12를 참조하십시오.
- ^ a b Schreiner, P. (2002). "Teaching the Right Reasons: Lessons from the Mistaken Origin of the Rotational Barrier in Ethane". Angew. Chem. Int. Ed. 41 (19): 3579–81, 3513. doi:10.1002/1521-3773(20021004)41:19<3579::AID-ANIE3579>3.0.CO;2-S. PMID 12370897.
- ^ Bickelhaupt, F.M.; Baerends (2003). "The case for steric repulsion causing the staggered conformation of ethane". Angew. Chem. Int. Ed. 42 (35): 4183–4188. doi:10.1002/anie.200350947. PMID 14502731.
- ^ Mo, Y.R.; et al. (2004). "The magnitude of hyperconjugation in ethane: A perspective from ab initio valence bond theory". Angew. Chem. Int. Ed. 43 (15): 1986–1990. doi:10.1002/anie.200352931. PMID 15065281.