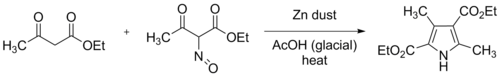크노르 피롤 합성
Knorr pyrrole synthesis
| 크노르 피롤 합성 | |
|---|---|
| 이름을 따서 명명됨 | 루트비히 노르 |
| 반응형 | 링 형성 반응 |
| 식별자 | |
| RSC 온톨로지 ID | RXNO:0000497 |
크노르 피롤 합성은 대체 피롤(3)을 합성하는 널리 사용되는 화학 반응이다.[1][2][3]이 방법은 카보닐 그룹(2)에 대한 α-아미노-케톤(1)과 전자 인출 그룹(예: 그림처럼 에스테르)을 포함하는 화합물의 반응을 포함한다.[4]
방법
이 메커니즘은 촉매로서 아연과 아세트산을 필요로 한다.상온에서 진행될 것이다.α-아미노-케톤은 매우 쉽게 자가 응결되기 때문에 반드시 현장에서 준비해야 한다.통상적인 방법은 관련 소고기능에서, 네버 재배치를 통해서이다.[5][6]
원래의 Knor 합성은 에틸 아세토아세테이트의 등가물 2개를 채용했는데, 그 중 하나는 빙하 아세트산에 용해하여 에틸 2-옥시미노아세토아세테이트로 전환되었고, 외부 냉각하에 포화 아큐어 아세트산나트륨에 해당하는 1개를 천천히 첨가하였다.그리고 나서 아연 먼지를 휘저어 소시미 집단을 아민으로 줄였다.이 감소는 아연 2개와 아세트산 4개를 소비한다.
현대적인 관행은 빙하 아세트산 에틸 아세토아세테이트의 잘 굳어진 용액에 니트로스와 아연 분진에 의해 발생하는 옥시메이트 용액을 점진적으로 첨가하는 것이다.반응은 발열성이며, 외부 냉각을 적용하지 않으면 혼합물이 끓는점에 도달할 수 있다.결과물인 디에틸 3,5-디메틸피롤레-2,4-디카르복실산염은 그 이후로 크노르의 피롤레로 불렸다.위의 체계에서 R2 = COOEt, R1 = R3 = R = Me는 이 원래의 반응을 나타낸다.
Knorr의 피롤은 많은 유용한 매너로 파생될 수 있다.수산화나트륨에 상당하는 1가지는 2-에스터를 선택적으로 사포화한다.크노르의 피롤을 농축 황산에 녹인 다음, 그 결과로 생긴 용액을 물에 부으면 4-에스터 그룹이 선택적으로 가수 분해된다.5-메틸군은 빙하 아세트산 내 염화계 황푸릴(sulfuryl)을 사용하여 클로로메틸, 알데히드 또는 카르복실산(carboxylic acid) 기능까지 다양하게 산화시킬 수 있다.[7]대신에 질소 원자는 알킬화 될 수 있다.두 에스테르 위치는 해당 아세토아세테이트 에스테르를 통해 벤질 또는 테르트부틸 그룹을 통합하여 보다 원활하게 구분할 수 있다.벤질 그룹은 탄소에 있는 팔라듐 위의 촉매 수소 분해로 제거할 수 있으며, 3차 부틸 그룹은 트리플루오로아세트산 처리 또는 수성 아세트산 끓임으로 제거할 수 있다.R과1 R3(R과2 "Et"뿐만 아니라)은 산성염화물, 멜드럼의 산, 그리고 자신이 선택한 알코올에서 나오는 합성에 의해 쉽게 만들어진 적절한 β-케토스터의 적용에 의해 변화될 수 있다.에틸과 벤질 에스테르를 쉽게 만들 수 있으며, 이 합성에서는 장애가 심한 테르트부틸 알코올도 매우 높은 수율을 제공한다는 점에서 그 반응이 주목할 만하다.[8]
레비와 자네티는 에틸 2-옥시미노아세토아세테이트와 반응하여 1894년 크노르 합성을 아세틸라세톤(2,4-펜타네디온)의 사용으로 확대했다.결과는 에틸 4-아세틸-3,5-디메틸피롤-2-카르복실산(Ethyl 4-dimethylpyrole-2-carboxylt)이었다. 여기서 "OET" = R13 = R = Me, R2 = COOEt"는 다음과 같다.[9]4-아세틸 그룹은 월프-키슈너 감소(하이드라진과 알칼리, 가열) 또는 수소폴리시스 또는 디보레인 사용에 의해 4-에틸 그룹으로 쉽게 전환될 수 있었다.벤질 또는 테르트부틸 아세토아세테이트도 이 시스템에서 잘 작동하며, 긴밀한 온도 조절을 통해 테르트부틸 시스템은 매우 높은 수율(80%[10]에 근접)을 제공한다.N, N-dialkyl pyrrole-2- 및/또는 4-carboxamides는 합성 시 N,N-dialkyl 아세토아세타미드를 사용하여 준비할 수 있다.심지어 테이스터도 그 방법을 사용하여 성공적으로 준비되었다.[11]β-케토스터의 니트로스에 대해서는, 니트로스에 대한 엄격한 온도 조절에 관한 수많은 문헌 사양에도 불구하고, 반응은 거의 적정화처럼 작용하며, 혼합물은 최종 수율에 큰 영향을 미치지 않고 40 °C까지 도달할 수 있도록 할 수 있다.
Knorr pyrrole 합성의 메커니즘은 이미인을 주기 위한 아민과 케톤의 응결에서 시작된다.그리고 나서 이미인은 에나민에 토토머라이즈를 하고, 이어서 사이클링, 물 제거, 피롤에 이소머라이징을 한다.
관련합성
시작 재료와 화농 제품 사이에 매우 다른 연결성의 메커니즘을 가지고 있음에도 불구하고 크노르 합성의 방식으로 운영되는 많은 중요한 화농 합성이 있다.
한스 피셔와 에미 핑크는 자네티가 2,4펜타네디온과 에틸 2-옥시미노아세토아세테이트에서 합성된 것이 에틸 3,5-디메틸피롤-2-카르복시산을 미량 부산물로 제공했다는 사실을 발견했다.마찬가지로 3-케토부티알데히드 디에틸 아세트산도 에틸 5-메틸피롤-2-카복실산(ethyl 5-methylpyrole-2-carboxyl)이 형성되었다.이 두 제품 모두 추론된 에틸 2-아미노아세토아세테이트 중간에서 아세틸 그룹을 상실한 결과였다.피셔-핀크 합성의 중요한 산물은 에틸 4,5-디메틸피롤레-2-카르복실산염으로 에틸 2-옥시미노아세토아세테이트와 2-메틸-3-옥소부타날로 만든 에틸 4,5-디메틸피롤-2-카르복실산염이었다.[12]
조지 클레인스펜은 피셔-핑크 연결은 2,4-펜타네디온 또는 그것의 3-알킬 대체 유도체를 합성하는 데 디에틸 옥시미노말론산염을 사용함으로써 독점적으로 발생할 수 있다고 보고했다.수율은 약 60%로 높았고, 이 합성은 결국 레퍼토리에서 가장 중요한 것 중 하나가 되었다.[13]수율은 전성형 아미노말론산염(Pd/C를 통해 에탄올에 있는 디에틸 옥시미노말론산염의 수소 분해로 준비)을 사용하고, 디에틸아미노말론산염과 β-디케톤을 혼합하여 빙하 아세트산을 적극적으로 끓이는 방법으로 크게 개선되었다.[14]
한편, 존슨은 2-산소산화 에스테르(에틸, 벤질 또는 3-부틸)[15]를 2,4-펜타네디온으로 대체한 3-알킬을 반응시켜 피셔-핀크 합성을 연장했다.클라인스펀 합성은 비대칭 β-디케톤(예: 3알킬 대체 2,4헥사네디온 등)을 사용함으로써 데이비드 돌핀에 의해 확장되었는데, 처음에는 덜 방해되는 아세틸 그룹에서 우선적으로 반응하고 그에 상응하는 5-메틸피롤-2-카복시산 에스테르를 공급했다.N,N-Dialkyl 2-oxinoacetoacetamids 또한 Knorr 조건 하에서 3-대체-2,4-pentanedion으로 반응할 때 해당 에스테르(약 45%)와 유사한 수율(약 45%)으로 피롤을 주는 것으로 밝혀졌다.그러나 비대칭 다이케톤을 사용했을 때 아세토아세타미드(acetoacetamide)의 아세틸(acetyl) 그룹이 제품에 그대로 남아 있었고, 디케톤(diketone)의 아세틸(acyl) 그룹 중 하나가 소실된 것으로 밝혀졌다.[16]이와 같은 메커니즘은 아세토아세테이트 에스테르 시스템에서 미미한 범위에서 발생하며, 이전에 하벅과 라포포포트에 의해 방사화학적으로 검출되었다.[17]위에서 설명한 대부분의 합성물은 포르피린, 담즙색소, 디피린 등의 합성에도 응용된다.
참조
- ^ Knorr, Ludwig (1884). "Synthese von Pyrrolderivaten" [Synthesis of pyrrole derivatives]. Berichte der deutschen chemischen Gesellschaft (in German). 17 (2): 1635–1642. doi:10.1002/cber.18840170220.
- ^ Knorr, Ludwig (1886). "Synthetische Versuche mit dem Acetessigester" [Synthetic experiments with the ester of acetoacetic acid]. Annalen der Chemie (in German). 236 (3): 290–332. doi:10.1002/jlac.18862360303.
- ^ Knorr, L.; Lange, H. (1902). "Ueber die Bildung von Pyrrolderivaten aus Isonitrosoketonen" [On the formation of pyrrole derivatives from isonitrosoketones]. Berichte der deutschen chemischen Gesellschaft (in German). 35 (3): 2998–3008. doi:10.1002/cber.19020350392.
- ^ Corwin, Alsoph Henry (1950). "The Chemistry of Pyrrole and its Derivatives". In Elderfield, Robert Cooley (ed.). Heterocyclic Compounds. Vol. 1. New York: Wiley. pp. 287 ff.
- ^ Fischer, Hans (1935). "2,4-Dimethyl-3,5-dicarbethoxypyrrole (2,4-Pyrroledicarboxylic acid, 3,5-dimethyl-, diethyl ester)". Organic Syntheses. 15: 17. doi:10.15227/orgsyn.015.0017.; Collective Volume, vol. 2, p. 202
- ^ Fischer, Hans (1941). "Kryptopyrrole (Pyrrole, 2,4-dimethyl-3-ethyl)". Organic Syntheses. 21: 67. doi:10.15227/orgsyn.021.0067.; Collective Volume, vol. 3, p. 513
- ^ Corwin, Alsoph H.; Bailey, William A.; Viohl, Paul (1942). "Structural Investigations upon a Substituted Dipyrrylmethane. An Unusual Melting Point-Symmetry Relationship". Journal of the American Chemical Society. 64 (6): 1267–1273. doi:10.1021/ja01258a007.
- ^ Oikawa, Yuji; Sugano, Kiyoshi; Yonemitsu, Osamu (1978). "Meldrum's acid in organic synthesis. 2. A general and versatile synthesis of β-keto esters". The Journal of Organic Chemistry. 43 (10): 2087–2088. doi:10.1021/jo00404a066.
- ^ Zanetti, C. U.; Levi, E. (1894). "Sintesi di composti pirrolici dai nitrosochetoni" [Synthesis of pyrrole compounds from nitrosoketones]. La Gazzetta Chimica Italiana (in Italian). 24 (1): 546–554.
- ^ Treibs, Alfred; Hintermeier, Karl (1954). "tert-Butylester von Pyrrolcarbonsäuren". Chemische Berichte (in German). 87 (8): 1167–1174. doi:10.1002/cber.19540870818.
- ^ Bullock, E.; Chen, T. S.; Loader, C. E. (1966). "Preparation and reactions of some pyrrylthiol esters". Canadian Journal of Chemistry. 44 (9): 1007–1111. doi:10.1139/v66-149.
- ^ Fischer, Hans; Fink, Emmy (1948). "Über eine neue Pyrrolsynthese" [On a new synthesis of pyrroles]. Zeitschrift für Physiologische Chemie (in German). 283 (3–4): 152–161. doi:10.1515/bchm2.1948.283.3-4.152.
- ^ Kleinspehn, George G. (1955). "A Novel Route to Certain 2-Pyrrolecarboxylic Esters and Nitriles". Journal of the American Chemical Society. 77 (6): 1546–1548. doi:10.1021/ja01611a043.
- ^ Paine, John B.; Dolphin, David (1985). "Pyrrole chemistry. An improved synthesis of ethyl pyrrole-2-carboxylate esters from diethyl aminomalonate". The Journal of Organic Chemistry. 50 (26): 5598–5604. doi:10.1021/jo00350a033.
- ^ Bullock, E.; Johnson, A. W.; Markham, E.; Shaw, K. B. (1958). "287. A synthesis of coproporphyrin III". Journal of the Chemical Society (Resumed): 1430–1440. doi:10.1039/JR9580001430.
- ^ Paine, John B.; Brough, Jonathan R.; Buller, Kathy K.; Erikson, Erika E.; Dolphin, D. (1987). "Mechanism of the formation of N,N-dialkyl-2-pyrrolecarboxamides from 1,3-diketones and N,N-dialkyloximinoacetoacetamides". The Journal of Organic Chemistry. 52 (18): 3993–3997. doi:10.1021/jo00227a010.
- ^ Rapoport, Henry; Harbuct, John W. (1971). "Mechanism of a modified Knorr pyrrole condensation". The Journal of Organic Chemistry. 36 (6): 853–855. doi:10.1021/jo00805a030.