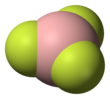삼불화 붕어
Boron trifluoride| | |||
| 이름 | |||
|---|---|---|---|
| 기타 이름 보론 플루오린화, 트리플루오로보레인 | |||
| 식별자 | |||
| |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.028.699 | ||
| EC 번호 |
| ||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 압축: 1008. 붕소 삼불화수소: 2851. | ||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| BF3 | |||
| 어금질량 | 67.82 g/㎥(무수) 103.837 g/㎥(수화물) | ||
| 외관 | 무색 가스(무수) 무색 액체(디하이드레이트) | ||
| 밀도 | 0.00276 g/cm3(무수 가스) 1.64 g/cm3(수화물) | ||
| 녹는점 | -126.8°C(-196.2°F, 146.3K) | ||
| 비등점 | -100.3°C(-148.5°F, 172.8K) | ||
| 발열 분해(무수) 매우 용해성(디하이드레이트) | |||
| 용해성 | 벤젠, 톨루엔, 헥산, 클로로포름, 염화메틸렌에 녹는다. | ||
| 증기압 | >50 atm (20 °C)[2] | ||
| 0 D | |||
| 열화학 | |||
열 용량 (C) | 50.46 J/mol K | ||
성 어금니 엔트로피 (S | 254.3 J/mol K | ||
의 성 엔탈피 대형화 (ΔfH⦵298) | -1137 kJ/mol | ||
기브스 자유 에너지 (ΔfG˚) | -1120 kJ/mol | ||
| 위험[4][5] | |||
| 안전자료표 | ICSC | ||
| GHS 픽토그램 |     | ||
| GHS 시그널 워드 | 위험 | ||
| H280, H330, H314, H335, H373 | |||
| P260, P280, P303+361+353, P304+340, P310, P305+351+338, P403+233 | |||
| NFPA 704(화재 다이아몬드) | |||
| 플래시 포인트 | 불연성 | ||
| 치사량 또는 농도(LD, LC): | |||
LC50(중간농도) | 1227ppm(시간, 2시간) 39ppm(돼지 1마리, 4시간) 418ppm(랫드, 4시간)[3] | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | C 1ppm(3mg/m3)[2] | ||
REL(권장) | C 1ppm(3mg/m3)[2] | ||
IDLH(즉시 위험) | 25ppm[2] | ||
| 관련 화합물 | |||
기타 음이온 | 삼염화 붕소 붕소 트리브로미드 붕소 삼요오드화 | ||
기타 양이온 | 플루오르화 알루미늄 불소 갈륨(III) 인듐(III) 불소화 탈륨(III) 불소화 | ||
관련 화합물 | 붕소 모노플루오라이드 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
붕소삼불화합물은 BF라는 공식을3 가진 무기 화합물이다. 이 자극적인 무색 독성 가스는 습한 공기 속에서 하얀 연기를 형성한다. 그것은 유용한 루이스 산이며 다른 붕소 화합물들을 위한 다용도 빌딩 블록이다.
구조 및 본딩
BF3 분자의 기하학은 삼각 평면이다. 그것의3h D 대칭은 VSEPR 이론의 예측과 일치한다. 그 분자는 대칭성이 높기 때문에 쌍극자 모멘트가 없다. 이 분자는 탄산 음이온인 CO2-3과
함께 등전자로 되어 있다.
BF는3 루이스 기지에 대한 발열 반응성에 의해 강화된 설명으로 흔히 "전자 결핍"이라고 불린다.
BX의3 붕소삼할라이드에서 B-X 본드의 길이(1.30 å)는 단일 본드에 대해 예상된 것보다 짧으며,[7] 이 짧음은 불소에 B-X π-결합이 더 강하다는 것을 나타낼 수 있다. 유연한 설명은 불소 원자에 대해 유사한 방향의 p 궤도 3개의 위상 조합과 붕소 원자에 대한 p 궤도상의 대칭 허용 중첩을 불러 일으킨다.[7] 다른 이들은 BF에3 있는 채권의 이온성을 지적한다.[8]
종합 및 취급
BF는3 붕소산화물과 불소화수소의 반응에 의해 제조된다.
- BO23 + 6 HF → 2 BF3 + 3 HO2
일반적으로 HF는 황산과 플루오르산(CaF2)으로부터 현장에서 생산된다.[9] 매년 약 2300-4500톤의 붕소 3불화물이 생산된다.[10]
실험실 척도
실험실 체중계 반응의 경우 BF는3 통상 상업적으로 구할 수 있는 액체인 붕소 3불화 에테르산물을 이용하여 현장에서 생산된다.
무용제 재료로 가는 실험실 경로는 여러 가지가 있다. 잘 문서화된 경로에는 BF-4의
디아조늄염의 열분해가 포함된다.[11]
또는 사트라플루오보국 나트륨, 삼산화 붕소 및 황산의 반응에서 발생한다.[12]
- 6 NaBF4 + B2O3 + 6 H2SO4 → 8 BF3 + 6 NaHSO4 + 3 H2O
특성.
무수 붕소 3불화화물은 비등점이 -100.3℃이고 임계온도가 -12.3℃이므로 그 온도 사이에서만 냉장액으로 저장할 수 있다. 보관 또는 운반 용기는 냉장 시스템 고장으로 인해 압력이 49.85bar(4.985 MPa)의 임계 압력까지 상승할 수 있으므로 내부 압력에 견딜 수 있도록 설계해야 한다.[13]
붕소 삼불화물은 부식성이 있다. 붕소 3불화합물 취급에 적합한 금속은 스테인리스강, 모넬, 해스텔로이 등이다. 습기가 있을 때 스테인리스강을 포함한 강철을 부식시킨다. 폴리아미드와 반응한다. 폴리테트라플루오로에틸렌, 폴리염소화리플루오로에틸렌, 폴리비닐리덴불화, 폴리프로필렌 등이 만족스러운 저항을 보인다. 장비에 사용되는 그리스는 불소화탄소 기반이어야 한다. 붕소 3불화탄소와 반응하기 때문이다.[14]
반응
알루미늄과 갈륨 삼할리드와 달리 붕소 삼할리드는 모두 단조롭다. 그들은 급속한 할로겐화 교환 반응을 겪는다.
- BF3 + BCl3 → BFCl2 + BCl2f
이 교환 과정의 시설 때문에 혼합 할로겐화물은 순수한 형태로 얻을 수 없다.
Boron trifluoride는 다재다능한 Lewis 산으로 불소와 에테르와 같은 Lewis 베이스로 인덕트를 형성한다.
테트라플루오보트염은 일반적으로 비조정 음이온으로 사용된다. 디에틸에테르, 붕소 삼불화 디에틸 에테르산 또는 그냥 붕소 삼불화 에테르산염(BF3·O(Et))2이 첨가된 첨가물은 편리하게 처리되는 액체로서 결과적으로 BF의3 실험실 공급원으로서 널리 접하게 된다.[15] 또 다른 일반적인 유도체는 깔끔한 액체로 취급할 수 있는 디메틸황화합물(BF3·S(Me))2을 첨가한 유도물이다.[16]
루이스 산도 비교
3개의 밝은 붕소 삼할라이드, BX3(X = F, Cl, Br)는 모두 루이스의 공통 베이스와 함께 안정적인 인덕트를 형성한다. 그들의 상대적 루이스 산도는 유도 형성 반응의 상대적 발열성의 관점에서 평가될 수 있다. 그러한 측정으로 루이스 산성에 대한 다음과 같은 순서가 밝혀졌다.
- BF3 < BCL3 < BBr3 (가장 강한 루이스산)
이러한 경향은 일반적으로 BX3 분자의 피라미드화 시 손실되는 평면 붕소 3할라이드의 π-결합 정도에서 기인한다.[17] 이 추세를 따르는 것:
- BF3 > BCl3 > BBr3 (가장 쉽게 피라미드화)
그러나 π본딩의 상대강도 평가기준은 명확하지 않다.[7] 한 가지 제안은 더 큰 Cl과 Br 원자에 비해 F 원자가 작으며, F의 p에z 있는 한 쌍의 전자는 쉽고 쉽게 기증되어 붕소의 빈 p 궤도상에z 중첩된다는 것이다. 그 결과 F의 pi 기증은 cl이나 br보다 크다.
대안으로 설명하면, BF에3 대한 루이스 산도가 낮은 것은 유도 FB-L에3 있는 채권의 상대적 약점에 기인한다.[18][19]
가수 분해
3불화붕소는 물과 반응하여 붕산과 불소산을 준다. 반응은 아쿠오 인덕트인 HO-BF의23 형성으로 시작되며, 그 후 붕소 3불화화합물로 불소산을 주는 HF를 잃게 된다.[20]
- 4 BF3 + 3 HO2 → 3 HBF4 + B(OH)3
무거운 삼할리드는 4면 이온 BCl-4와
BBr-4의
낮은 안정성으로 인해 유사한 반응을 일으키지 않는다. 불소산의 높은 산도 때문에 불소이온을 사용하여 디아조늄 이온과 같이 특별히 고체로 분리하기 어려운 전기생성 양이온을 분리할 수 있다.
사용하다
유기 화학
보론 삼불화합물은 유기합성 시약으로 가장 중요하게 사용되며, 일반적으로 루이스 산으로 사용된다.[10][21] 예를 들면 다음과 같다.
- 폴리에테르와 같은 불포화 화합물의 중합반응을 개시한다.
- 일부 이성질화, 아킬화,[22] 알킬화, 에스테르화, 탈수,[23] 응결, 무카이야마 알돌 첨가, 기타 반응의[24][citation needed] 촉매로서
틈새 용도
붕소삼불화합물의 다른 덜 일반적인 용도는 다음과 같다.
- 이온 이식 시 도판트로서 도판트로서 도포함
- p형 상피성 실리콘 도판트
- 지구 대기의 방사선 수준을 감시하기 위해 이온화 챔버와 장치의 민감한 중성자 검출기에 사용된다.
- 훈증 소독을 받고
- 납땜 마그네슘의 유동성으로서.
- 디보란을[12] 준비하다
디스커버리
1808년 조셉 루이스 게이-루삭과 루이 자크 테나르가 불화칼슘과 유리화 붕산을 결합해 '불화산'(즉, 불화수소산)을 격리시키려다 발각됐다. 그 결과로 생긴 증기는 유리를 에칭하지 못했기 때문에, 그들은 그것을 플루오르산 가스라고 명명했다.[25][26]
참고 항목
참조
- ^ Prudent Practices in the Laboratory. nap.edu. 16 August 1995. doi:10.17226/4911. ISBN 978-0-309-05229-0. Archived from the original on 14 December 2014. Retrieved 7 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0062". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Boron trifluoride". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Index no. 005-001-00-X of Annex VI, Part 3, to Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. OJEU L353, 31.12.18, 페이지 1–1355(페이지 341).
- ^ "Boron trifluoride", Pocket Guide to Chemical Hazards, U.S. Department of Health and Human Services (NIOSH) Publication No. 2005-149, Washington, DC: Government Printing Office, 2005, ISBN 9780160727511.
- ^ Inc, New Environment. "New Environment Inc. - NFPA Chemicals". www.newenv.com. Archived from the original on 27 August 2016. Retrieved 7 May 2018.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Gillespie, Ronald J. (1998). "Covalent and Ionic Molecules: Why Are BeF2 and AlF3 High Melting Point Solids whereas BF3 and SiF4 Are Gases?". Journal of Chemical Education. 75 (7): 923. Bibcode:1998JChEd..75..923G. doi:10.1021/ed075p923.
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ a b Brotherton, R. J.; Weber, C. J.; Guibert, C. R.; Little, J. L. "Boron Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a04_309.
- ^ Flood, D. T. (1933). "Fluorobenzene". Organic Syntheses. 13: 46.; Collective Volume, 2, p. 295
- ^ a b Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry. 1 (2nd ed.). New York: Academic Press. p. 220 & 773. ISBN 978-0121266011.
- ^ Yaws, C. L., ed. (1999). Chemical Properties Handbook. McGraw-Hill. p. 25.
- ^ "Boron trifluoride". Gas Encyclopedia. Air Liquide. 2016-12-15. Archived from the original on 2006-12-06.
- ^ Cornel, Veronica; Lovely, Carl J. (2007). "Boron Trifluoride Etherate". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/9780470842898.rb249.pub2. ISBN 978-0471936237.
- ^ Heaney, Harry (2001). "Boron Trifluoride-Dimethyl Sulfide". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rb247. ISBN 0471936235.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Boorman, P. M.; Potts, D. (1974). "Group V Chalcogenide Complexes of Boron Trihalides". Canadian Journal of Chemistry. 52 (11): 2016–2020. doi:10.1139/v74-291.
- ^ Brinck, T.; Murray, J. S.; Politzer, P. (1993). "A Computational Analysis of the Bonding in Boron Trifluoride and Boron Trichloride and their Complexes with Ammonia". Inorganic Chemistry. 32 (12): 2622–2625. doi:10.1021/ic00064a008.
- ^ Wamser, C. A. (1951). "Equilibria in the System Boron Trifluoride–Water at 25°". Journal of the American Chemical Society. 73 (1): 409–416. doi:10.1021/ja01145a134.
- ^ Heaney, H. (2001). "Boron Trifluoride". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rb250. ISBN 0-471-93623-5.
- ^ Mani, Rama I.; Erbert, Larry H.; Manise, Daniel (1991). "Boron Trifluoride in the Synthesis of Plant Phenolics: Synthesis of Phenolic Ketones and Phenyl Stryl Ketones" (PDF). Journal of Tennessee Academy of Science. 66 (1): 1–8. Archived from the original (PDF) on 27 October 2016. Retrieved 27 October 2016.
- ^ Sowa, F. J.; Hennion, G. F.; Nieuwland, J. A. (1935). "Organic Reactions with Boron Fluoride. IX. The Alkylation of Phenol with Alcohols". Journal of the American Chemical Society. 57 (4): 709–711. doi:10.1021/ja01307a034.
- ^ "Boron Trifluoride (BF3) Applications". Honeywell. Archived from the original on 2012-01-29.
- ^ Gay-Lussac, J. L.; Thénard, L. J. (1809). "Sur l'acide fluorique". Annales de Chimie. 69: 204–220.
- ^ Gay-Lussac, J. L.; Thénard, L. J. (1809). "Des propriétés de l'acide fluorique et sur-tout de son action sur le métal de la potasse". Mémoires de Physique et de Chimie de la Société d'Arcueil. 2: 317–331.
외부 링크
- "Safety and Health Topics: Boron Trifluoride". OSHA.
- "BORON TRIFLUORIDE ICSC: 0231". International Chemical Safety Cards. CDC. Archived from the original on 2017-11-23. Retrieved 2017-09-08.
- "Boron & Compounds: Overview". National Pollutant Inventory. Australian Government.
- "Fluoride Compounds: Overview". National Pollutant Inventory. Australian Government.
- "Boron trifluoride". WebBook. NIST.
- "Boron Trifluoride (BF3) Applications". Honeywell. Archived from the original on 2012-01-29. Retrieved 2012-02-14.