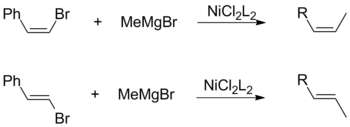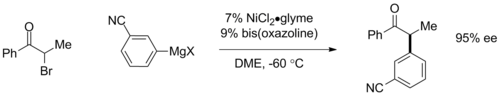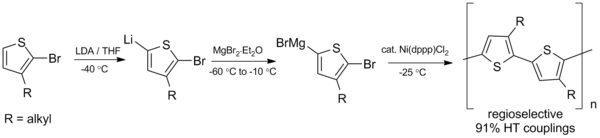쿠마다 커플링
Kumada coupling
| 쿠마다 커플링 | |
|---|---|
| 의 이름을 따서 명명됨 | 쿠마다 마코토 |
| 반응형 | 결합 반응 |
| 식별자 | |
| 유기화학 포털 | 쿠마다의 매개에 의한 |
| RSC 온톨로지 ID | RXNO:0000144 |
유기화학에서 Kumada 커플링은 Gridnard 시약과 유기 할로겐화물의 반응에 의해 탄소-탄소 결합을 생성하는데 유용한 일종의 교차 결합 반응이다.이 절차에서는 전이 금속 촉매(일반적으로 니켈 또는 팔라듐)를 사용하여 두 개의 알킬기, 아릴기 또는 비닐기를 결합합니다.Robert Corriu와 Makoto Kumada의 그룹은 1972년에 [1][2]이 반응을 독립적으로 보고했다.
이 반응은 최초로 보고된 촉매 교차 결합 방법 중 하나로 알려져 있습니다.그 후의 대체 반응(스즈키, 소노가시라, 스틸, 히야마, 네기시)의 개발에도 불구하고, 구마다 커플링은 유기 전자 소자에 유용한 알리스키렌, 폴리티오펜의 산업 규모의 제조를 포함한 많은 합성 애플리케이션에 계속 채용되고 있다.
역사
Gridnard 시약과 유기 할로겐화물의 촉매 결합에 대한 첫 번째 연구는 1941년 Morris S의 코발트 촉매 연구로 거슬러 올라간다. 카라쉬와 E.K.필드[3]1971년 다무라 씨와 고치 씨는 은,[4] 구리[5], [6]철을 기반으로 한 촉매의 유효성을 증명하는 일련의 출판물에서 이 작업에 대해 자세히 설명했습니다.그러나 이러한 초기 접근법은 두 개의 동일한 종이 결합되는 균질 결합 생성물의 실질적인 형성으로 인해 낮은 수확량을 산출했다.
이러한 노력은 1972년 코리우와 쿠마다 그룹이 니켈 함유 촉매의 사용을 동시에 보고하면서 절정에 달했다.1975년 무라하시 그룹에 의해 팔라듐 촉매가 도입되면서 반응 범위가 더욱 [7]넓어졌다.그 후, 많은 추가적인 결합 기술이 개발되어 2010년 노벨 화학상 수상자인 네기시 에이이치, 스즈키 아키라, 리처드 F.를 정점으로 한다. 그 분야에 대한 그들의 공헌은 괘씸하다.
메커니즘
팔라듐 촉매 작용
널리 인정되는 메커니즘에 따르면 팔라듐 촉매 쿠마다 커플링은 다른 교차 커플링 반응에서 팔라듐의 역할과 유사한 것으로 이해된다.제안된 촉매 사이클은 팔라듐(0)과 팔라듐(Paladium)을 모두 포함합니다.II) 산화 상태처음에는 전자가 풍부한 Pd(0) 촉매(1)가 유기 할로겐화물의 R–X 결합에 삽입됩니다.이 산화 첨가물은 유기-Pd(II)-복합체(2)를 형성한다.그리냐드 시약을 사용한 후속 금속 변환은 헤테로 유기 금속 복합체(3)를 형성한다.다음 단계 전에 서로 옆에 있는 유기배위자를 서로 시스 위치에 놓기 위해 이성질화가 필요하다.마지막으로 (4)의 환원적 제거는 탄소-탄소 결합을 형성하고, Pd(0) 촉매([8]1)를 재생하면서 교차 결합 생성물을 방출한다.팔라듐 촉매의 경우 니켈 촉매 시스템의 [8]경우보다 속도 결정 산화 첨가 속도가 더 느립니다.
니켈 촉매
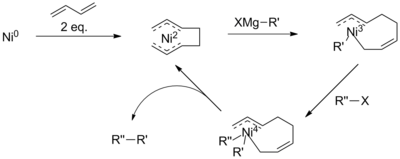
니켈촉매결합기구에 대한 현재의 이해는 제한되어 있다.실제로, 반응 메커니즘은 다른 반응 조건과 다른 니켈 [9]배위자를 사용할 때 다르게 진행되는 것으로 여겨진다.일반적으로 이 메커니즘은 여전히 팔라듐 스킴(오른쪽)과 유사한 것으로 설명할 수 있다.그러나 특정 반응 조건에서는 메커니즘이 모든 관측치를 설명하지 못합니다.Vicic과 동료에 의한 삼위일체 Terpyridine 배위자 사용 검사에서 Ni(I)-Ni(I)-Ni(III)[10] 촉매 사이클의 중간체가 확인되었으며, 이는 보다 복잡한 방법을 시사한다.또한 부타디엔을 첨가함으로써 해당 반응은 Ni(IV)[11] 중간체를 포함하는 것으로 생각된다.
범위
유기 할로겐화물 및 의사 할로겐화물
쿠마다 커플링은 다양한 아릴 또는 할로겐화 비닐에 대해 성공적으로 입증되었습니다.할로겐화물 시약인 의사할라이드도 사용할 수 있으며, 다양한 조건에서 토실레이트[12] 및 트리플레이트종을[13] 사용하여 결합이 상당히 효과적인 것으로 나타났다.
아릴과 비닐 커플링에 대한 광범위한 성공에도 불구하고, 알킬 할로겐화물의 사용은 몇 가지 복잡한 요인 때문에 덜 일반적입니다.할로겐화 알킬은 γ전자가 없기 때문에 아릴기 또는 비닐기와는 다른 산화첨가기제를 필요로 하며, 이러한 과정은 현재 [9]잘 알려져 있지 않다.또한 β-히드로겐의 존재는 할로겐화 알킬을 경쟁적 제거 과정에 [14]민감하게 만든다.
이러한 문제는 반응을 촉진하는 α-브로모케톤의 카르보닐과 같은 활성 그룹의 존재로 인해 회피되었다.그러나 Kumada 커플링은 종종 추가 촉매 또는 시약을 사용하여 비활성화 알킬 체인으로도 수행되었습니다.예를 들어, 1,3-부타디엔을 첨가하여 캠베와 동료들은 니켈 촉매 알킬-알킬 커플링을 시연했는데, 그렇지 않으면 [15]반응하지 않을 것입니다.
이 반응의 메커니즘은 잘 이해되지 않지만 옥타디에닐 니켈 착체의 형성을 수반하는 것으로 제안되고 있다.이 촉매는 할로겐화물을 환원적으로 제거하기 전에 그리냐드 시약을 사용하여 먼저 트랜스메탈화를 수행하도록 제안되어 β-수소화물 제거의 위험을 낮춥니다.그러나 Ni(IV) 중간체의 존재는 아릴 또는 할로겐화비닐 커플링에 [11]대해 제안된 메커니즘에 반한다.
그리냐르 시약
아릴과 비닐 그리냐르 시약이 포함된 커플링은 Kumada와 Corriu에 [2]의해 최초 출판물에 보고되었다.또한 알킬 그리냐르 시약은 β-수소화물 제거 과정을 거치지 않기 때문에 어렵지 않게 사용할 수 있다.그리냐르 시약은 본래 관능기 내성이 낮지만, 저온 합성물은 고기능화 아릴기로 [16]제조되었다.
촉매
다양한 니켈로 쿠마다 커플링을 할 수 있습니다.II) 또는 팔라듐(II) 촉매.촉매 전구체의 구조는 일반적으로 MLX로22 공식화될 수 있으며, 여기서 L은 포스핀 [17]배위자이다.L에 대한2 일반적인 선택으로는 dppe 및 dppp와 같은 이인산 디포스핀 배위자가 포함된다.
Alois Fürstner와 동료들의 철 기반 촉매에 대한 연구는 합리적인 수율을 보여주었다.이러한 반응에서 촉매종은 다음과 같이 구성된 "유기 그리냐드 시약"으로 제안됩니다.Fe(MgX)2.[18]
반응 조건
반응은 일반적으로 테트라히드로프랑 또는 디에틸에테르에서 용매로 수행됩니다.이러한 에테르 용제는 그리냐드 [2]시약을 생성하기 위한 일반적인 용제이기 때문에 편리합니다.Gridnard 시약의 높은 반응성으로 인해 Kumada 커플링은 관능기 내성이 제한되어 있어 대형 합성에서 문제가 발생할 수 있습니다.특히 그리냐드 시약은 알코올과 같은 미산성 그룹의 양성자 분해에 민감합니다.그들은 또한 카르보닐과 다른 산화기에도 첨가된다.
많은 커플링 반응에서와 같이 전이 금속 팔라듐 촉매는 종종 공기에 민감하므로 비활성 Argon 또는 질소 반응 환경이 필요합니다.
샘플 합성 제제는 Organic Synthes 웹 사이트에서 구할 수 있습니다.
선택성
입체선택성
시스 할로겐화물과 트랜스 올레핀 할로겐화물 모두 알킬 그리냐스와 결합하면 기하학적 구성의 전체적인 유지를 촉진한다.이러한 관찰은 촉매 리간드 및 비닐산 [17]치환기 선택을 포함한 다른 요인과는 무관합니다.
반대로, Vinylic Gridnard 시약을 사용한 Kumada 결합은 입체특이성 없이 진행되어 시스와 트랜스 알켄의 혼합물을 형성한다.이성질화 정도는 시약 비율과 할로겐화물 그룹의 동일성 등 다양한 요인에 따라 달라집니다.쿠마다에 의하면, 이러한 입체 화학의 손실은, 아릴 그리냐르 [17]시약의 2개의 등가물간의 부작용에 기인하고 있다.
에난티오셀렉티비티
키랄 리간드를 사용하면 비대칭 구마다 커플링을 할 수 있다.평면 키랄 페로센 리간드를 사용하여 아릴 [19]커플링에서 95% 이상의 에난티오머 초과(ee)가 관찰되었다.최근 Gregory Fu와 동료들은 bis-oxazoline 리간드에 기초한 촉매를 사용하여 α-브로모케톤의 에난티오 컨버전트 커플링을 시연했으며, 여기서 키랄 촉매는 시작 물질의 라세믹 혼합물을 최대 95% [20]ee의 제품의 에난티오머 1개로 변환한다.후자의 반응은 전통적으로 접근할 수 없었던 할로겐화 알킬 결합을 수반하는 경우에도 중요하다.
화학 선택성
그리냐드 시약은 일반적으로 염소화 아렌과 결합하지 않습니다.이러한 낮은 반응성은 NiCl 기반2 [21]촉매를 사용하여 브로모클로로벤젠의 C-Br 결합에 니켈을 삽입하는 화학 선택성의 기초입니다.
적용들
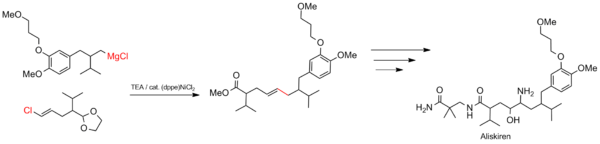
알리스키렌 합성
구마다 커플링은 약물 합성 등 대규모 공업 공정에 적합합니다.이 반응은 고혈압 [22]치료제인 알리스키렌(상표명 Tekturna)의 탄소 골격을 구성하는 데 사용된다.
폴리티오펜 합성
또, 유기 태양전지나 발광 다이오드에 [23]다양한 응용 가능성을 가지는 폴리알킬티오페네스(PAT)등의 복합 폴리머의 합성에 있어서도 유망하다.1992년 맥콜로우와 로우는 영하의 [24]온도를 필요로 하는 쿠마다 결합 방식을 이용하여 레지오레귤러 폴리알킬티오펜의 첫 합성을 개발했다.
이 초기 준비 이후, 합성은 더 높은 수율을 얻고 [25]상온에서 작동하도록 개선되었습니다.
「 」를 참조해 주세요.
인용문
- ^ Corriu, R. J. P.; Masse, J. P. (1 January 1972). "Activation of Grignard reagents by transition-metal complexes. A new and simple synthesis of trans-stilbenes and polyphenyls". Journal of the Chemical Society, Chemical Communications (3): 144a. doi:10.1039/C3972000144A.
- ^ a b c Tamao, Kohei; Sumitani, Koji; Kumada, Makoto (1 June 1972). "Selective carbon–carbon bond formation by cross-coupling of Grignard reagents with organic halides. Catalysis by nickel-phosphine complexes". Journal of the American Chemical Society. 94 (12): 4374–4376. doi:10.1021/ja00767a075.
- ^ Kharasch, M. S.; Fields, E. K. (1 September 1941). "Factors Determining the Course and Mechanisms of Grignard Reactions. IV. The Effect of Metallic Halides on the Reaction of Aryl Grignard Reagents and Organic Halides1". Journal of the American Chemical Society. 63 (9): 2316–2320. doi:10.1021/ja01854a006.
- ^ Jay K. Kochi and Masuhiko Tamura (1971). "Mechanism of the silver-catalyzed reaction of Grignard reagents with alkyl halides". J. Am. Chem. Soc. 93 (6): 1483–1485. doi:10.1021/ja00735a028.
- ^ Kochi, Jay K.; Tamura, Masuhiko (1 March 1971). "Alkylcopper(I) in the coupling of Grignard reagents with alkyl halides". Journal of the American Chemical Society. 93 (6): 1485–1487. doi:10.1021/ja00735a029.
- ^ Tamura, Masuhiko; Kochi, Jay K. (1 March 1971). "Vinylation of Grignard reagents. Catalysis by iron". Journal of the American Chemical Society. 93 (6): 1487–1489. doi:10.1021/ja00735a030.
- ^ Yamamura, Masaaki; Moritani, Ichiro; Murahashi, Shun-Ichi (27 May 1975). "The reaction of σ-vinylpalladium complexes with alkyllithiums. Stereospecific syntheses of olefins from vinyl halides and alkyllithiums". Journal of Organometallic Chemistry. 91 (2): C39–C42. doi:10.1016/S0022-328X(00)89636-9.
- ^ a b Knappke, Christiane E. I.; Jacobi von Wangelin, Axel (2011). "35 years of palladium-catalyzed cross-coupling with Grignard reagents: how far have we come?". Chemical Society Reviews. 40 (10): 4948–62. doi:10.1039/c1cs15137a. PMID 21811712.
- ^ a b Hu, Xile (2011). "Nickel-catalyzed cross coupling of non-activated alkyl halides: a mechanistic perspective". Chem. Sci. 2 (10): 1867–1886. doi:10.1039/c1sc00368b.
- ^ Jones, Gavin D.; McFarland, Chris; Anderson, Thomas J.; Vicic, David A. (1 January 2005). "Analysis of key steps in the catalytic cross-coupling of alkyl electrophiles under Negishi-like conditions". Chemical Communications (33): 4211–3. doi:10.1039/b504996b. PMID 16100606.
- ^ a b Frisch, Anja C.; Beller, Matthias (21 January 2005). "Catalysts for Cross-Coupling Reactions with Non-activated Alkyl Halides". Angewandte Chemie International Edition. 44 (5): 674–688. doi:10.1002/anie.200461432. PMID 15657966.
- ^ Limmert, Michael E.; Roy, Amy H.; Hartwig, John F. (1 November 2005). "Kumada Coupling of Aryl and Vinyl Tosylates under Mild Conditions". The Journal of Organic Chemistry. 70 (23): 9364–9370. doi:10.1021/jo051394l. PMID 16268609.
- ^ Busacca, Carl A.; Eriksson, Magnus C.; Fiaschi, Rita (1999). "Cross coupling of vinyl triflates and alkyl Grignard reagents catalyzed by nickel(0)-complexes". Tetrahedron Letters. 40 (16): 3101–3104. doi:10.1016/S0040-4039(99)00439-6.
- ^ Rudolph, Alena; Lautens, Mark (30 March 2009). "Secondary Alkyl Halides in Transition-Metal-Catalyzed Cross-Coupling Reactions". Angewandte Chemie International Edition. 48 (15): 2656–2670. doi:10.1002/anie.200803611. PMID 19173365.
- ^ Terao, Jun; Watanabe, Hideyuki; Ikumi, Aki; Kuniyasu, Hitoshi; Kambe, Nobuaki (1 April 2002). "Nickel-Catalyzed Cross-Coupling Reaction of Grignard Reagents with Alkyl Halides and Tosylates: Remarkable Effect of 1,3-Butadienes". Journal of the American Chemical Society. 124 (16): 4222–4223. doi:10.1021/ja025828v. PMID 11960446.
- ^ Adrio, Javier; Carretero, Juan C. (15 November 2010). "Functionalized Grignard Reagents in Kumada Cross-Coupling Reactions". ChemCatChem. 2 (11): 1384–1386. doi:10.1002/cctc.201000237. S2CID 98429919.
- ^ a b c Kumada, M. (1 January 1980). "Nickel and palladium complex catalyzed cross-coupling reactions of organometallic reagents with organic halides". Pure and Applied Chemistry. 52 (3): 669–679. doi:10.1351/pac198052030669.
- ^ Fürstner, Alois; Leitner, Andreas; Méndez, María; Krause, Helga (1 November 2002). "Iron-Catalyzed Cross-Coupling Reactions". Journal of the American Chemical Society. 124 (46): 13856–13863. doi:10.1021/ja027190t. PMID 12431116.
- ^ Hayashi, Tamio; Yamamoto, Akihiro; Hojo, Masahiro; Kishi, Kohei; Ito, Yoshihiko; Nishioka, Eriko; Miura, Hitoshi; Yanagi, Kazunori (1989). "Asymmetric synthesis catalyzed by chiral ferrocenylphosphine-transition metal complexes". Journal of Organometallic Chemistry. 370 (1–3): 129–139. doi:10.1016/0022-328X(89)87280-8.
- ^ Lou, Sha; Fu, Gregory C. (3 February 2010). "Nickel/Bis(oxazoline)-Catalyzed Asymmetric Kumada Reactions of Alkyl Electrophiles: Cross-Couplings of Racemic α-Bromoketones". Journal of the American Chemical Society. 132 (4): 1264–1266. doi:10.1021/ja909689t. PMC 2814537. PMID 20050651.
- ^ Ikoma, Yoshiharu; Ando, Kazuhiko; Naoi, Yoshitake; Akiyama, Takeo; Sugimori, Akira (1 February 1991). "Halogen Selectivity in Nickel Salt-Catalyzed Cross-Coupling of Aryl Grignard Reagents with Bromochlorobenzenes a Novel Synthetic Method of Unsymmetrical Terphenyl". Synthetic Communications. 21 (3): 481–487. doi:10.1080/00397919108016772.
- ^ Johnson and Lee (2010). Modern Drug Synthesis. Hoboken, NJ: John Wiley & Sons, Inc. pp. 153–154. ISBN 978-0-470-52583-8.
- ^ Cheng, Yen-Ju; Yang, Sheng-Hsiung; Hsu, Chain-Shu (11 November 2009). "Synthesis of Conjugated Polymers for Organic Solar Cell Applications". Chemical Reviews. 109 (11): 5868–5923. doi:10.1021/cr900182s. PMID 19785455.
- ^ McCullough, Richard D.; Lowe, Renae D. (1 January 1992). "Enhanced electrical conductivity in regioselectively synthesized poly(3-alkylthiophenes)". Journal of the Chemical Society, Chemical Communications (1): 70. doi:10.1039/C39920000070.
- ^ Loewe, Robert S.; Ewbank, Paul C.; Liu, Jinsong; Zhai, Lei; McCullough, Richard D. (1 June 2001). "Regioregular, Head-to-Tail Coupled Poly(3-alkylthiophenes) Made Easy by the GRIM Method: Investigation of the Reaction and the Origin of Regioselectivity". Macromolecules. 34 (13): 4324–4333. Bibcode:2001MaMol..34.4324L. doi:10.1021/ma001677+.