존슨-코리-차이콥스키 반응
Johnson–Corey–Chaykovsky reaction
| 존슨-코리-차이콥스키 반응 | |
|---|---|
| 이름은 다음과 같습니다. | A. 윌리엄 존슨 엘리아스 제임스 코리 마이클 차이콥스키 |
| 반응형 | 고리형성반응 |
| 식별자 | |
| 유기화학포털 | corey-chaykovsky- |
존슨-코리-차이콥스키 반응(, CCR)은 에폭시드, 아지리딘, 사이클로프로판의 합성을 위해 유기화학에서 사용되는 화학 반응입니다. 이것은 1961년 A에 의해 발견되었습니다. 윌리엄 존슨과 E.J. 코리와 마이클 차이코프스키에 의해 크게 발전했습니다. 반응은 해당 3원 고리를 생성하기 위해 케톤, 알데히드, 이민 또는 에논에 황화물을 첨가하는 것을 포함합니다. 반응은 초기 입체화학에 관계없이 생성물의 전이를 선호하는 디아스테레오 선택적 반응입니다. 이 방법을 통한 에폭시드의 합성은 올레핀의 전통적인 에폭시화 반응에 대한 중요한 역합성 대안으로 작용합니다.

반응은 메틸렌 전이를 통한 에폭시화에 가장 많이 사용되며, 이를 위해 여러 가지 주목할 만한 총 합성에 사용되었습니다(아래의 에폭시드 합성 참조). 아래에 추가로 상세하게 설명된 것은 반응의 이력, 메커니즘, 범위 및 병인 선택적 변이체입니다. 여러 리뷰가 게재되었습니다.[1][2][3][4][5][6]
역사
존슨의 원본 출판물은 9-디메틸술포늄 플루오레닐라이드와 치환된 벤즈알데히드 유도체의 반응에 관한 것이었습니다. 시도된 위티그 유사 반응은 실패했고 대신 벤잘플루오렌 산화물을 얻었으며 "황실리드와 벤잘데하이드 사이의 반응은 인과 비소실리드와 같이 벤잘플루오렌을 감당하지 못했습니다."[7]라고 언급했습니다.

효율적인 메틸렌-전달 시약으로서 코리(Corey)와 차이콥스키(Chaykovsky)에 의한 (dimethyloxosulfaniumyl)메타나이드, (CH3)2SCH2 및 (dimethylsulfaniumyl)메타나이드, (CH3)2SCH2(Corey-Chaykovsky 시약으로 알려져 있음)의 후속 개발은 유기 캐논의 일부로서 반응을 확립했습니다.[8]

메카니즘
Johnson-Corey-Chaykovsky 반응의 반응 메커니즘은 carbonyl 또는 imine 그룹에 ylide를 친핵성으로 추가하는 것으로 구성됩니다. 음전하는 헤테로 원자로 전달되고, 술포늄 양이온이 양호한 이탈기이기 때문에 고리를 형성하면서 방출됩니다. 이와 관련된 위티그 반응에서 훨씬 더 강한 인-산소 이중 결합의 형성은 옥시란 형성을 방해하고 대신 올레핀화는 4원 고리형 중간체를 통해 이루어집니다.[4]

관찰된 트랜스디아스테레오 선택성은 초기 첨가의 가역성에서 비롯되며, 이는 신베타인보다 선호되는 안티베타인에 대한 평형을 허용합니다. 초기에 ylide를 첨가하면 인접한 전하를 가진 베타인이 생성됩니다. 밀도 함수 이론 계산에 따르면 속도 제한 단계는 중심 결합이 술포늄에 대한 후면 공격에 필요한 컨포머로 회전하는 것입니다.[1]

초기 단계에서 가역성의 정도(따라서 질병 선택성)는 4가지 요인에 따라 달라지며, 더 높은 선택성에 해당하는 더 큰 가역성은 다음과 같습니다.[1]
- 안정성이 높은 기판의 안정성은 베타인보다 출발 물질을 선호함으로써 더 큰 가역성으로 이어집니다.
- 더 높은 안정성을 갖는 ylide의 안정성은 유사하게 더 큰 가역성으로 이어집니다.
- 베타인의 입체 장애는 중간체의 형성을 저해하고 중심 결합의 속도 제한 회전을 늦춤으로써 더 큰 가역성으로 이어집니다.
- 용해도가 더 큰 리튬과 같은 대항 이온에 의한 베타인의 전하의 용해는 베타인 중간체에서 더 쉽게 회전할 수 있게 하여 가역성의 양을 낮춥니다.
범위
유기 합성에서 Johnson-Corey-Chaykovsky 반응의 응용은 다양합니다. 반응은 원래 출판물을 훨씬 뛰어넘는 다양한 유형의 유황화물과 친전자체의 반응을 포괄하게 되었습니다. 아래에 자세히 설명된 바와 같이 많은 유명한 토탈 합성에 사용되었으며 일반적으로 유기 레퍼토리에서 강력한 변형 도구로 인식되고 있습니다.
일리드의 종류

많은 종류의 일라이드는 음이온 탄소 중심과 황 모두에서 다양한 작용기로 준비될 수 있습니다. 치환 패턴은 시약(일반적으로 할로겐화술포늄, 예를 들어, 요오드화트리메틸술포늄)의 제조 용이성 및 전체 반응 속도에 다양한 방식으로 영향을 미칠 수 있습니다. 시약의 일반적인 형식은 오른쪽에 나와 있습니다.[1]
설폭소늄을 사용하면 설폭소늄일라이드에 비해 약한 염기를 사용하여 시약을 쉽게 준비할 수 있습니다. (다른 점은 술폭소늄은 이중 결합된 산소를 함유하고 있는 반면 술폭소늄은 그렇지 않다는 것입니다.) 전자는 안정성이 향상되어 반응 속도가 느려집니다. 또한, 술포늄 시약의 디알킬설폭사이드 부산물은 술포늄 시약의 독성, 휘발성 및 악취성 디알킬설폭사이드 부산물보다 훨씬 더 선호됩니다.[1]
대부분의 시약은 일중합 탄소(수소로서1 R 또는 R2)로 단일 치환됩니다. 치환 시약은 훨씬 드물지만 다음과 같이 설명되어 있습니다.[1]
- 이와 같이, 전자 인출기(EWG)에 의해 유리기 탄소가 치환된 경우, 시약은 안정화된 유리기(stabilized ylide)라고 합니다. 이들은 설폭소늄 시약과 마찬가지로 반응 속도가 훨씬 느리고 일반적으로 준비하기 쉽습니다. 이들은 반응이 엄청나게 부진해질 수 있기 때문에 유용성이 제한됩니다. 아마이드와 관련된 예는 널리 퍼져 있으며 에스테르와 관련된 예는 훨씬 적으며 다른 EWG와 관련된 예는 사실상 없습니다. 이들의 경우 일반적으로 관련 Darzens 반응이 더 적합합니다.
- 아릴기 또는 알릴기로 치환된 경우, 시약은 반안정화된 아릴기(semi-stableized ylide)로 지칭됩니다. 이들은 기존 메틸렌 시약(R=R=H) 다음으로 광범위하게 개발되었습니다. 아릴 시약에 대한 치환 패턴은 상기 기준에 따라 반응의 선택도에 크게 영향을 미칠 수 있습니다.
- 알킬기로 치환된 경우 시약을 불안정화된 일라이드라고 합니다. 알킬기의 크기는 이러한 시약의 선택성의 주요 요소입니다.
황에 있는 R-기는 일반적으로 메틸이지만 반응의 선택적 변이를 수행할 수 있는 시약을 합성하는 데 사용되었습니다(아래의 변이 참조). 그룹의 크기는 지환족 기질의 식이 선택성에도 영향을 미칠 수 있습니다.[1]
에폭시드의 합성
황화물과 케톤 및 알데히드를 반응시켜 에폭시드를 형성하는 것은 존슨-코리-차이코프스키 반응의 가장 일반적인 응용입니다. 아래와 같이 복잡한 기질과 '이색적인' 일리드와 관련된 예가 보고되었습니다.[9][10]

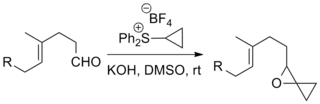
이 반응은 화학요법 약물인 택솔을 생산하는 Danishefsky Taxol total synthesis와 살충제인 Strychnine을 생산하는 Kuehene Strychnine total synthesis를 포함한 다수의 주목할 만한 총 합성에 사용되었습니다.[11][12]


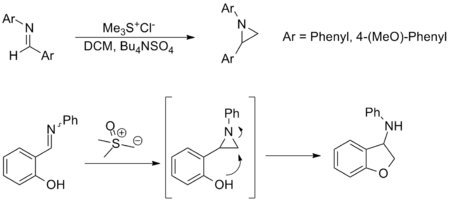
아지리딘의 합성
이민으로부터 아지리딘의 합성은 존슨-코리-차이코프스키 반응의 또 다른 중요한 응용이며 옥사지리딘으로부터 아민 전달에 대한 대안을 제공합니다. 덜 광범위하게 적용되지만 반응은 카르보닐 당량과 유사한 기질 범위 및 작용기 내성을 갖습니다. 아래에 표시된 예가 대표적이며, 후자에서는 아지리딘이 제자리에서 형성되고 친핵성 공격을 통해 개방되어 상응하는 아민을 형성합니다.[3][9]
사이클로프로판의 합성
에논에 황실라이드를 첨가하는 경우, 일반적으로 술포늄 시약보다 술포늄 시약에서 더 높은 1,4-선택성이 얻어집니다. 케톤, 에스테르 및 아미드를 포함한 많은 전자 인출 그룹이 반응과 호환되는 것으로 나타났습니다(아래 예는 Weinrebamide를 포함합니다). 추가 공액계에서는 1,4- 덧셈보다 6- 덧셈이 우세한 경향이 있습니다.[3][9]

기타반응
원래 Johnson, Corey, Chaykovsky에 의해 보고된 반응 외에도 황화물은 같은 이름으로 그룹화되는 경향이 있는 여러 관련 상동 반응에 사용되었습니다.
- 에폭시드와 아지리딘을 사용하면 반응은 고리 확장 역할을 하여 상응하는 옥세탄 또는 아제티딘을 생성합니다. 이러한 반응에 소요되는 반응 시간이 길기 때문에 에폭시드와 아지리딘을 합성할 때 중요한 부반응으로 일어나지 않습니다.[9]

![[4+1] cycloaddition with Corey–Chaykovsky reagent](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cc/CCR41.png/320px-CCR41.png)

선택적 선택형 변량
Johnson-Corey-Chaykovsky 반응의 거울상 선택적 (즉, "ee"로 분류되는 거울상이성질체 과잉을 생성하는) 변이체의 개발은 여전히 활발한 학술 연구 영역으로 남아 있습니다. 화학량론적 방식으로 카이랄 설파이드의 사용은 해당 촉매 변이체보다 더 성공적인 것으로 입증되었지만 기질 범위는 모든 경우에서 여전히 제한적입니다. 촉매 변이체는 거의 독점적으로 에난티오 선택적 목적으로 개발되었습니다. 일반적인 유기황화물 시약은 엄청나게 비싸지 않으며 비용을 크게 올리지 않고 등몰량의 일라이드를 사용하여 라세미 반응을 수행할 수 있습니다. 그러나 카이랄 설파이드는 제조 비용이 더 많이 들어 촉매 선택적 방법의 발전에 박차를 가하고 있습니다.[2]
화학양론시약
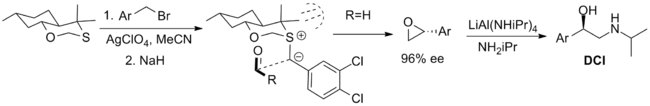
화학량론적 방식으로 사용되는 가장 효과적인 시약은 다음과 같습니다. 첫 번째는 β-아드레날린 화합물 디클로로이소프로테레놀(DCI)의 합성에 사용되었지만 시약의 하나의 거울상이성질체의 이용 가능성에 의해 제한되는 이환식 옥사티안입니다. 축 방향 디아스테레오머의 합성은 적도의 단독 쌍의 친핵성을 감소시키는 1,3-아노머 효과를 통해 합리화됩니다. 일라이드의 형태는 환형 변형에 의해 제한되며 알데히드의 접근은 메틸 치환기와의 입체적 상호작용에 의해 일라이드의 일면으로 제한됩니다.[5][2]
또 다른 주요 시약은 브리스톨 대학의 Varinder Aggarwal이 개발한 장뇌 유래 시약입니다. 두 거울상이성질체는 옥사시안 시약보다 수율이 낮지만 쉽게 합성됩니다. ylide 형태는 교두수 수소와의 상호작용에 의해 결정되며 알데히드의 접근은 장뇌 부분에 의해 차단됩니다. 반응은 포스파젠 염기를 사용하여 ylide의 형성을 촉진합니다.[5][2]
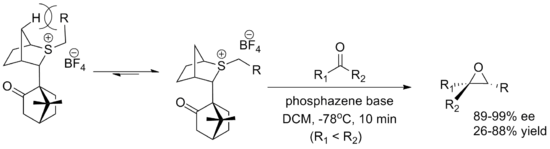
촉매 시약
촉매 시약은 대부분의 변형이 낮은 수율, 낮은 선택성 또는 둘 다로 인해 덜 성공적이었습니다. 또한 기판 범위에 대한 문제도 있으며 대부분 메틸렌 전달 및 지방족 알데히드에 대한 제한이 있습니다. 문제는 에폭사이드를 형성하기 위한 좋은 이탈기로도 작용할 수 있는 일라이드를 효율적으로 생성하는 친핵성 황화물의 필요성에서 비롯됩니다. 이러한 데시데라타의 기초가 되는 요인들이 서로 상충되기 때문에 촉매 특성을 조정하는 것은 어려운 것으로 판명되었습니다. 아래는 (E)-스틸벤 옥사이드 합성에 사용하기 위한 수율 및 거울상이성질체 과잉과 함께 가장 성공적인 촉매 중 몇 가지입니다.[5][2]
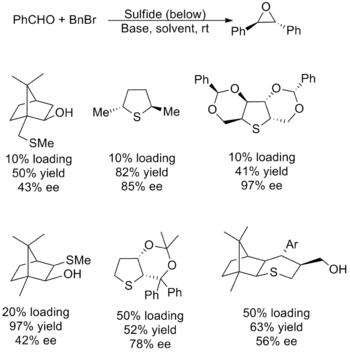
Aggarwal은 상기와 동일한 황화물을 사용하는 대체 방법 및 제자리에서 형성된 로듐 카르베노이드를 포함하는 신규 알킬화 방법을 개발했습니다. 이 방법 역시 기판 범위가 제한되어 있어 카르베노이드의 경쟁적인 소비로 인해 기본적인 대체물을 보유한 모든 전자 소자에 실패합니다.[2]

참고 항목
참고문헌
- ^ a b c d e f g Aggarwal, V. K.; Richardson, J. (2003). "The complexity of catalysis: origins of enantio- and diastereocontrol in sulfur ylide mediated epoxidation reactions". Chemical Communications (21): 2644–2651. doi:10.1039/b304625g. PMID 14649793.
- ^ a b c d e f Aggarwal, V. K.; Winn, C. L. (2004). "Catalytic, Asymmetric Sulfur Ylide-Mediated Epoxidation of Carbonyl Compounds: Scope, Selectivity, and Applications in Synthesis". Accounts of Chemical Research. 37 (8): 611–620. doi:10.1021/ar030045f. PMID 15311960.
- ^ a b c Gololobov, Y. G.; Nesmeyanov, A. N.; lysenko, V. P.; Boldeskul, I. E. (1987). "Twenty-five years of dimethylsulfoxonium ethylide (corey's reagent)". Tetrahedron. 43 (12): 2609–2651. doi:10.1016/s0040-4020(01)86869-1.
- ^ a b Li, A.-H.; Dai, L.-X.; Aggarwal, V. K. (1997). "Asymmetric Ylide Reactions: Epoxidation, Cyclopropanation, Aziridination, Olefination, and Rearrangement". Chemical Reviews. 97 (6): 2341–2372. doi:10.1021/cr960411r. PMID 11848902.
- ^ a b c d Aggarwal, Varinder K.; Ford, J. Gair; Fonguerna, Sílvia; Adams, Harry; Jones, Ray V. H.; Fieldhouse, Robin (1998-08-08). "Catalytic Asymmetric Epoxidation of Aldehydes. Optimization, Mechanism, and Discovery of Stereoelectronic Control Involving a Combination of Anomeric and Cieplak Effects in Sulfur Ylide Epoxidations with Chiral 1,3-Oxathianes". Journal of the American Chemical Society. 120 (33): 8328–8339. doi:10.1021/ja9812150.
{{cite journal}}: CS1 유지보수: 날짜 및 연도(링크) - ^ McGarrigle, E. M.; Myers, E. L.; Illa, O.; Shaw, M. A.; Riches, S. L.; Aggarwal, V. K. (2007). "Chalcogenides as Organocatalysts". Chemical Reviews. 107 (12): 5841–5883. doi:10.1021/cr068402y. PMID 18072810.
- ^ Johnson, A.W.; LaCount, R.B. (1961). "The Chemistry of Ylids. VI. Dimethylsulfonium Fluorenylide—A Synthesis of Epoxides". J. Am. Chem. Soc. 83 (2): 417–423. doi:10.1021/ja01463a040.
- ^ Corey, E. J.; Chaykovsky, M. (1965). "Dimethyloxosulfonium Methylide ((CH3)2SOCH2) and Dimethylsulfonium Methylide ((CH3)2SCH2). Formation and Application to Organic Synthesis". J. Am. Chem. Soc. 87 (6): 1353–1364. doi:10.1021/ja01084a034.
- ^ a b c d e Li, Jack Jie (2005). Named Reactions in Heterocyclic Chemistry. Hoboken, New Jersey: John Wiley & Sons, Inc. pp. 2–14. ISBN 9780471704140.
- ^ Mundy, Bradford, P.; Ellerd, Michael D.; Favaloro, Frank G. Jr. (2005). Name Reactions and Reagents in Organic Chemistry (2 ed.). Hoboken, New Jersey: John Wiley & Sons, Inc. pp. 174–175, 743. ISBN 9780471739869.
{{cite book}}: CS1 maint: 다중 이름: 저자 목록 (링크) - ^ Danishefsky, S. J.; Masters, J. J.; Young, W. B.; Link, J. T.; Snyder, L. B.; Magee, T. V.; Jung, D. K.; Isaacs, R. C. A.; Bornmann, W. G.; Alaimo, C. A.; Coburn, C. A.; Di Grandi, M. J. (1996). "Total Synthesis of Baccatin III and Taxol". Journal of the American Chemical Society. 118 (12): 2843–2859. doi:10.1021/ja952692a.
- ^ Kuehne, M. E.; Xu, F. (1993). "Total synthesis of strychnan and aspidospermatan alkaloids. 3. The total synthesis of (.+-.)-strychnine". The Journal of Organic Chemistry. 58 (26): 7490–7497. doi:10.1021/jo00078a030.
- ^ Luo, J.; Shea, K. J. (2010). "Polyhomologation. A Living C1 Polymerization". Accounts of Chemical Research. 43 (11): 1420–1433. doi:10.1021/ar100062a. PMID 20825177.


