알돌반응
Aldol reaction| 알돌반응 | |
|---|---|
| 반응형 | 커플링 반응 |
| 식별자 | |
| 유기화학포털 | 알돌박이 |
| RSC 온톨로지 ID | RXNO:0000016 |
알돌반응은 유기화학에서 탄소-탄소 결합을 형성하는 수단이다.[1][2][3]1869년[4] 러시아의 화학자 알렉산더 보로딘에 의해 독립적으로 발견되고 1872년 프랑스의 화학자 샤를-아돌프 우르츠에 의해 발견된 이 반응은 두 개의 카보닐 화합물(알데히드를 사용한 원래 실험)을 결합하여 새로운 β-히드로시 카보닐 화합물을 형성한다.[5][6][7]이 제품들은 알데히드+알코올에서 알돌로 알려져 있는데, 알데히드+알코올은 많은 제품에서 볼 수 있는 구조적인 모티브가 된다.알돌 구조 단위는 자연적으로 발생하든 합성적이든 많은 중요한 분자에서 발견된다.[8][9][10]예를 들어 알돌반응은 상품화학적 펜타에리톨의[11] 대규모 생산과 심장병 약물인 리피터(아토르바스타틴, 칼슘염)의 합성 등에 사용되어 왔다.[12][13]
알돌 반응은 비교적 단순한 두 개의 분자를 더욱 복잡한 분자로 통합시킨다.복잡성이 증가하게 되는 이유는 (아래 구조에서 별표로 표시된 알돌 인덕트의 α와 β-탄소 위에) 최대 2개의 새로운 입체 중심부가 형성되기 때문이다.현대적인 방법론은 알돌 반응이 높은 수율에서 진행될 수 있을 뿐만 아니라 이러한 입체파의 상대적 구성과 절대적 구성을 모두 조절할 수 있다.[14]특정 스테레오소머를 선택적으로 합성하는 이 능력은 스테레오소머가 독특한 화학적, 생물학적 특성을 가질 수 있기 때문에 중요하다.
예를 들어, 입체적인 알돌 단위는 생물학적 유기체에서 발견되는 분자의 한 종류인 폴리케티드에서 특히 흔하다.자연에서 폴리케티드는 반복성 클라이센 응축에 영향을 주는 효소에 의해 합성된다.이러한 반응의 1,3-디카르보닐 제품들은 다양한 파생으로 다양한 흥미로운 구조를 만들어낼 수 있다.종종 그러한 파생은 알돌 부대를 생산하면서 카보닐 그룹 중 하나를 감소시키는 것을 포함한다.이러한 구조들 중 일부는 면역억제제 FK506, 항투석제 디스코데르몰라이드 또는 항응고제 암포테리신 B와 같은 강력한 생물학적 특성을 가지고 있다.비록 한때 그러한 많은 화합물의 합성이 거의 불가능하다고 여겨졌지만, 알돌 방법론은 많은 경우에 효율적인 합성을 허용해 왔다.[15]
위와 같이 전형적인 현대의 알돌 첨가 반응은 알데하이드에 케톤 에놀레이트(ketone enolate)의 뉴클레오필릭 첨가와 관련이 있을 수 있다.일단 형성되면, 알돌 제품은 때때로 α, β-불포화 카보닐 화합물을 형성하기 위해 물 분자를 잃을 수 있다.이것을 알돌 응결이라고 한다.알돌 반응에는 케톤, 알데히드 및 많은 다른 카보닐 화합물의 에놀, 에놀 에테르, 에놀 에테르를 포함한 다양한 핵물질이 사용될 수 있다.전기생성 파트너는 보통 알데히드나 케톤(Mannich reaction과 같은 많은 변형이 존재한다)이다.핵소포체와 전기소포체가 다르면 그 반응을 교차된 알돌반응이라고 하고, 반대로 핵소포체와 전기소포체가 같을 때는 그 반응을 알돌조영이라고 한다.

오른쪽 플라스크는 테트라하이드로푸란(THF)의 리튬 이소프로필아미드(LDA) 용액이다.왼쪽 플라스크는 테르트부틸프로피오네이트의 리튬 에놀레이트 용액이다(테르트부틸프로피오네이트에 LDA를 추가하여 형성함).알데히드는 에놀레이트 플라스크에 첨가되어 알돌 첨가 반응을 일으킬 수 있다.
두 개의 플라스크는 열전대(왼쪽 전선)에 의해 온도가 감시되는 드라이아이스/아세톤 냉각 욕조(-78°C)에 잠긴다.
메커니즘
알돌 반응은 두 가지 뚜렷한 메커니즘에 의해 진행될 수 있다.알데히드나 케톤과 같은 카보닐 화합물은 에놀이나 에놀 에테르로 변환될 수 있다.이 종들은 α-탄소에서의 핵소독성이기 때문에 양성자 알데히드 같은 특히 반응성이 강한 양성자 카보닐을 공격할 수 있다.이것이 바로 '에놀 메커니즘'이다.탄소산이 되는 카보닐 화합물도 감압하여 에놀이나 에놀 에테르보다 훨씬 더 핵성분이 많고 직접 전기세포를 공격할 수 있다.케톤은 반응성이 훨씬 낮기 때문에 일반적인 전기생성기는 알데히드다.이것이 바로 '증강 메커니즘'이다.
알돌 다지관의 매력에도 불구하고 공정을 촉매적이고 효과적으로 만들기 위해 해결해야 할 몇 가지 문제가 있다.첫 번째 문제는 열역학이다: 대부분의 알돌 반응은 되돌릴 수 있다.게다가, 평형도 단순한 알데히드-케톤 알돌 반응의 경우 제품 측면에 거의 미치지 못한다.[16]조건이 특히 가혹한 경우(예:NaOMe/MeOH/환류), 응결이 발생할 수 있지만, 보통 약한 시약과 저온(예: LDA(강력한 베이스), THF, -78°C)에서는 이를 방지할 수 있다.비록 알돌 덧셈은 보통 돌이킬 수 없는 조건하에서 거의 완성될 정도로 진행되지만, 고립된 알돌 인덕트는 출발 재료를 반환하기 위해 기저 유도 역돌 갈라짐에 민감하다.이와는 대조적으로, 레트로 알돌 응축은 드물지만 가능하다.[17]이것은 자연에 존재하는 클래스 I 알돌라제의 촉매 전략의 기초는 물론 수많은 소분자 아민 촉매의 기초가 된다.[18]
에놀 메커니즘
산성 촉매를 사용할 때, 반응 메커니즘의 초기 단계는 에놀에 대한 카보닐 화합물의 산성 분석 tautomerization을 포함한다.이 산은 또한 양성자에 의해 다른 분자의 카보닐 그룹을 활성화시키는 역할을 하는데, 이것은 그것을 매우 전기적인 것으로 보이게 한다.에놀은 α 탄소의 핵포질로서 양성자 카보닐 화합물을 공격할 수 있게 하여 탈염 후 알돌로 이어진다.이것은 보통 불포화 카보닐 화합물을 만들기 위해 탈수된다.그 계획은 알데히드의 전형적인 산성화 자가응집법을 보여준다.
산성분해알돌기전
산성화 탈수증
에놀레이트 메커니즘
촉매가 수산화이온이나 알카산화물과 같은 적당한 염기라면 다른 분자의 카르보닐 그룹에 공명안정화 에놀레이트(enolate)에 의한 핵포질 공격을 통해 알돌 반응이 일어난다.제품은 알돌제품의 알카산화염이다.알돌 자체가 형성되고, 그 다음 불포화 카보닐 화합물을 주기 위해 탈수증을 겪을 수 있다.이 계획은 알데히드 자체로 염기성 알돌 반응을 위한 간단한 메커니즘을 보여준다.
염기성 알돌 반응(OCH를3 베이스로 사용)
기저 분석 탈수(단일 단계로 잘못 표기되는 경우가 많으며, E1cB 제거 반응 참조)
염기성 물질만 필요한 경우도 있지만 LDA나 NaHmDS와 같은 강한 염기성의 확률계량계를 사용하는 것이 통상적인 절차다.이 경우 에놀레이트 형성은 되돌릴 수 없으며, 알돌 제품의 알크산화 금속이 별도의 작업 단계에서 양성될 때까지 알돌 제품이 형성되지 않는다.
짐머만-트랙슬러 모델
그 메커니즘의 보다 정교한 형태는 알려져 있다.1957년 하워드 짐머만과 마조리 D.트랙슬러 박사는 일부 알돌 반응에 대해 "의자 순응이 가능한 6mb의 과도기 상태"[19]라고 제안했다.이것은 현재 짐머만-트랙슬러 모델로 알려져 있다.E-enolate는 안티 제품을, Z-enolate는 동기화 제품을 발생시킨다.선택성을 제어하는 요인은 적도에 대체물을 배치하기 위한 선호도와 동기-펜탄 상호작용을 각각 회피하는 것이다.[20]E와 Z는 양의 반작용(positive counterion)을 갖는 에놀레이트 산소와 알파 탄소에서 가장 높은 우선순위 그룹 사이의 시스-트랜스 입체화학 관계를 가리킨다.실제로는 리튬과 같은 일부 금속만이 짐머만-트랙슬러 모델을 안정적으로 따르고 있다.따라서 어떤 경우에는 반응의 입체화학적인 결과를 예측할 수 없을 수도 있다.
교차알돌반응제 제어
알돌 덧셈의 '통제' 문제는 예를 들어 가장 잘 드러난다.다음과 같은 가상의 반응의 결과를 고려하십시오.
이 반응에서 비대칭 케톤 2개가 에산화나트륨을 사용하여 응축되고 있다.이산화나트륨의 기본성은 어느 한 케톤도 완전히 감압할 수 없을 정도로 높지만 두 케톤 모두 소량의 에놀레이트 나트륨을 생산할 수 있다.이것은 잠재적 알돌 전기소체일 뿐만 아니라, 두 케톤 모두 에놀레이트 나트륨을 통해 핵물질로 작용할 수도 있다는 것을 의미한다.그러면 두 개의 전기영양체와 두 개의 핵영양체가 네 가지 가능한 제품을 만들 수 있다.
그러므로 만약 어떤 사람이 단 하나의 교차 제품만을 얻기를 원한다면, 어떤 카보닐이 핵성 에놀/엔올레이트가 되고 어떤 카보닐이 그것의 전기영양 카보닐 형태로 남아 있는지를 통제해야 한다.
산도
가장 간단한 조절은 반응제 중 하나만 산성의 양성자를 가지고 있고, 오직 이 분자만이 에놀레이트(Enolate)예를 들어, 벤츠알데히드에 디에틸 말론산염을 첨가하면 한 가지 제품만 생산될 것이다.말론산염만이 α 하이드로겐을 가지고 있기 때문에 핵포질 파트너인 반면, 비엔롤화성 벤즈알데히드는 전기영양체만 될 수 있다.
말론산염은 특히 α 위치가 둘 이상의 카보닐로 측면에 있기 때문에 감압하기 쉽다.이중 활성화는 활성화가 더욱 안정되게 하므로, 그것을 형성하는 데 강한 기반이 필요하지 않다.이 효과의 확장은 두 카보닐 반응제 중 어느 것이 에놀레이트(α 수력)가 되더라도 어느 것이 에놀레이트(enolate)가 되는지를 제어할 수 있게 한다.한 파트너가 다른 파트너보다 상당히 산성이 높으면 가장 산성도가 높은 양성자가 베이스에 의해 추상화되고 그 카보닐에 에놀레이트(enolate)가 형성되는 반면 산도가 낮은 카보닐은 베이스에 영향을 받지 않는다.이러한 유형의 제어는 산성의 차이가 충분히 크고 반응에 대한 염기초과가 사용되지 않는 경우에만 작용한다.이러한 상황에 대한 일반적인 기질은 둘 이상의 카보닐 유사 그룹에 의해 탈착 가능한 위치가 활성화되는 것이다.일반적인 예로는 두 개의 카보닐 또는 니트릴이 측면으로 배치된 CH2 그룹이 있다(예: Knoevenagel 응축과 말론 에스테르 합성과 아세트아틱 에스테르 합성의 첫 번째 단계 참조).
덧셈순번
한 가지 일반적인 해결책은 먼저 한 파트너의 에놀레이트(enolate)를 형성한 다음 다른 파트너를 운동 조절 하에 추가하는 것이다.[21]운동 조절은 전방 알돌 덧셈 반응이 역방향 역방향 알돌 반응보다 현저히 빨라야 함을 의미한다.이 접근방식이 성공하기 위해서는 두 가지 다른 조건도 충족되어야 한다; 한 파트너의 신장(enolate)을 정량적으로 형성할 수 있어야 하며, 전방 알돌반응은 한 파트너에서 다른 파트너로 신장(enolate)을 이전하는 것보다 현저히 빨라야 한다.일반적인 운동 조절 조건은 -78 °C에서 LDA로 케톤의 에놀레이트 형성에 이어 알데히드를 천천히 첨가하는 것을 포함한다.
에놀라테스
포메이션
에놀레이트는 강한 베이스("하드 조건", 아래의 경로 1)를 사용하거나 루이스 산과 약한 베이스("부드러운 조건", 아래의 경로 2)를 사용하여 형성될 수 있다.
감응이 발생하려면 알파-C-H 시그마 본드가 카보닐의 pi* 궤도(궤도)와 겹칠 수 있어야 한다는 것이 스테레오 전자 요구사항이다.
기하학
에놀레이트 형성에 대한 광범위한 연구가 수행되었다.대부분의 경우 원하는 신장 형상을 생성할 수 있다.[22]
케톤에 대해서는 대부분의 에놀레이트 조건이 Z 에놀레이트를 준다.에스테르의 경우 대부분의 에놀레이트 조건은 E 에놀레이트를 준다.HMPA의 추가는 탈조화의 입체성을 역전시키는 것으로 알려져 있다.
에놀레이트의 입체적 형성은 타당성이 다소 의심스럽기는 하지만 아일랜드 모델로 합리화되었다.[23][24][25][26]대부분의 경우, 만약 있다면, 어떤 매개체가 자연에서 단수적이거나 과두적이지는 알려져 있지 않다; 그럼에도 불구하고, 아일랜드 모델은 에놀레이트 이해를 위한 유용한 도구로 남아 있다.
아일랜드 모델에서, 감응은 6-membared 또는 순환[27] 단층 전환 상태에 의해 진행되는 것으로 가정한다.전기영역에 대한 두 대체물 중 큰 것(위의 경우 메틸은 양성자보다 크다)은 선호 전이 상태에서 적도적 성질을 채택하여 E 에놀레이트 선호로 이어진다.모델은 많은 경우에 분명히 실패한다. 예를 들어 용매 혼합물이 THF에서 23% HMPA-THF로 변경되면(위 참조), 신장 형상이 역전되어 이 모델 및 순환 전환 상태와 일치하지 않는다.
레지화학
비대칭 케톤이 베이스를 받는 경우, 두 개의 레지오이소메릭 에놀레이트(에놀레이트 기하학 무시)를 형성할 가능성이 있다.예를 들면 다음과 같다.
삼분해성 에놀레이트는 운동 에놀레이트로, 사분해성 에놀레이트는 열역학적 에놀레이트로 간주된다.운동성 에놀레이트를 형성하기 위해 감압된 알파 수소는 방해가 덜 되고, 따라서 더 빨리 감압된다.일반적으로 4분위 올레핀은 초경화 안정화 때문에 3분위 올레핀보다 안정적이다.에놀레이트 레지오이소머의 비율은 베이스의 선택에 의해 많은 영향을 받는다.위의 예에서 운동 제어는 -78°C에서 LDA로 설정하여 99:1 운동 선택성: 열역학적 에놀레이트, 열역학적 제어는 상온에서 트리페닐메틸리튬으로 설정하여 10:90 선택성을 부여할 수 있다.
일반적으로 운동성 에놀레이트는 냉온도, 비교적 이온적인 금속-산소 결합을 주는 조건, 강하고 강직하게 방해를 받는 기초가 약간 초과된 것을 이용한 급속한 감응에 의해 선호된다.큰 베이스는 접근성이 더 좋은 수소만을 감압시킬 뿐이고, 낮은 온도와 과도한 베이스는 초기 에놀레이트 형성 후 보다 안정적인 대체 에놀레이트와의 등가교정을 피하는데 도움이 된다.열역학적 에놀레이트는 높은 온도에서 더 긴 등진동 시간, 비교적 공밸런스한 금속-산소 결합을 제공하는 조건, 약간의 강기층 이하의 사용으로 선호된다.모든 카보닐 분자를 분해하는 데 충분한 기반을 사용함으로써, 에놀레이트와 카보닐은 양성자를 서로 교환할 수 있고 그들의 보다 안정된 이성질체와 평형시킬 수 있다.다양한 금속과 용매를 사용하면 금속-산소 결합에서 이온 성질의 양을 제어할 수 있다.
입체도
알돌 반응은 한 반응에서 두 개의 새로운 입체적인 중심이 생성되기 때문에 특히 유용하다.syn/anti 규약은 α-와 β-탄소의 상대적 입체화학을 나타내기 위해 일반적으로 사용된다.
이 규칙은 알데히드에 프로피온산(또는 더 높은 순서) 핵종이 첨가될 때 적용된다.케톤 R군과 알데히드 R군은 종이(또는 화면)의 평면에서 "지그재그" 패턴으로 정렬되어 있으며, 형성된 스테레오센트의 처리는 메인 체인의 같은 면이나 반대 면에 있는 경우에 따라 동기화 또는 반(反)으로 간주된다.
오래된 논문들은 사카리드 화학에서 익숙한 에리스로/threo 명명법을 사용한다.
에놀레이트 기하학
E와 Z 에놀레이트에서 관측된 스테레오 유도 수준에는 큰 차이가 없다.각 알켄 기하학은 주로 제품에서 특정 상대적 입체화학으로 연결되며, E는 반(anti)을, Z는 다음과 같은 동기화를 제공한다.[22]
금속 이온
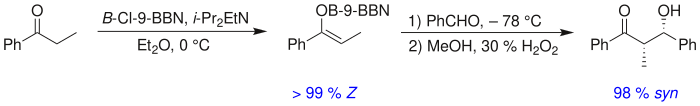
알돌 반응의 입체성 수준을 결정하는 데 고엽제 금속 양이 큰 역할을 할 수 있다.붕소는 리튬, 알루미늄, 마그네슘과 같은 금속보다 결합 길이가 현저히 짧기 때문에 자주 사용된다[28][29].
예를 들어 붕소-탄소 및 붕소-산소 결합은 길이가 각각 1.4–1.5 å, 1.5–1.6 å인 반면, 일반적인 금속-탄소 결합은 각각 1.9–2.2 2, 2.0–2.2 2이다.금속이 아닌 붕소를 사용하면 전환 상태를 "긴축"할 수 있고 반응에서 입체감을 더 크게 줄 수 있다.[30]따라서 위의 반응은 비부틸보론 에놀레이트를 사용한 97:3과 비교하여 에놀레이트 리튬을 사용한 80:20의 시니:안티비를 제공한다.
에놀레이트 상의 알파 스테레오컨텍터
알돌 반응은 "하향 기반 스테레오콘트롤"을 나타낼 수 있으며, 두 반응제 중 하나에 대한 기존 치례성이 반응의 입체 화학적 결과에 영향을 미친다.이것은 광범위하게 연구되어 왔으며, 많은 경우 이질적 역률의 절대 수준은 아니더라도 비대칭 유도의 감각을 예측할 수 있다.에놀레이트(enolate)가 알파 위치에 스테레오 입자를 포함하면 우수한 스테레오콘트롤을 실현할 수 있다.
E 에놀레이트(E enolate)의 경우 지배적인 제어 요소는 우군 1,3-스트레인인 반면, Z 에놀레이트(Z enolate)의 경우 지배적인 제어 요소는 1,3-디아록스 상호작용을 회피하는 것이다.일반 모델은 다음과 같다.
확실히 하기 위해, 에놀레이트 위의 스테레오 입자는 인식되었다; 현실에서는 알데히드의 반대편 디아스테로이드 표면이 공격되었을 것이다.두 경우 모두 1,3합성 디아스테레오머가 선호된다.이러한 유형의 스테레오콘트롤에는 다음과 같은 예가 있다.[31]
전기식 알파 스테레오콘텍터
에놀레이트 항공이 알파 스테레오 입자로 알데히드를 공격하면 뛰어난 스테레오콘트롤도 가능하다.일반적으로 E 에놀레이트는 펠킨 디스테레오페이스 선택을, Z 에놀레이트는 안티 펠킨 선택성을 보인다는 것이 일반적인 관측이다.일반 모델은[32][33] 다음과 같다.
Z 에놀레이트는 불안정한 싱-펜탄 상호작용이나 안티-펠킨 로타머를 포함하는 전환 상태를 통해 반응해야 하므로, Z 에놀레이트는 이 경우 이질제거율이 낮다.몇 가지 예는 다음과 같다.[34][35]
스테레오 유발 통합 모델
에놀레이트 및 알데히드 둘 다 기존의 치맛을 함유하고 있다면, 에놀레이트 안면편향, 에놀레이트 기하학, 알데히드 안면편향 등을 고려한 병합된 입체화학 모델을 사용하여 "이중 입체분화" 알돌 반응의 결과를 예측할 수 있다.[36]이 모델의 적용 예는 다음과 같다.[35]
에반스의 옥사졸리디논 화학
널리 사용되는 방법은 에반스의 아킬옥사졸리디논법이다.[37][38]1970년대 후반과 1980년대에 David A에 의해 개발되었다. 에반스와 동료들, 이 방법은 일시적으로 치랄 보조기를 추가하여 치랄 에놀레이트(chiral enolate)를 만드는 방식으로 작용한다.그 후 보조에서 기존에 있던 음운은 이염성 알돌반응을 일으켜 알돌 인덕트로 옮겨진다.이후 보조기를 제거하면 원하는 알돌 입체체가 드러난다.
에반스의 방법의 경우, 첨가된 키랄 보조는 옥사졸리디논이고, 그 결과 발생하는 카보닐 화합물은 이미드다.많은 옥사졸리디논이 현재 두 가지 항정신병적 형태로 쉽게 구할 수 있다.그것들은 비교적 비싸다.다만 엔노푸레 옥사졸리디논은 비교적 저렴한 아미노산으로부터 2단계 합성수단으로 도출돼 대규모 합성이 자체 준비로 보다 경제적일 수 있다는 것을 의미한다.이것은 보통 산성의 보로 무수화물 매개 감소를 수반하며, 그 결과 아미노 알코올이 디에틸카본산염과 같은 단순한 탄산 에스테르로 응결/사이클로 생성된다.
옥사졸리디논의 아틸화(acylation)는 편리한 시술로, 비공식적으로 "적재완료(loading done)"라고 한다.Z-enolate는 붕소 매개 소프트 에놀레이션을 사용하여 안정적으로 형성될 수 있다.[39]
종종, 하나의 이질화 물질은 알돌 성분의 결정체를 통해 얻을 수 있다.그러나 에반스식 방법으로는 반알돌 인덕트를 안정적으로 얻을 수 없다.동기화 인덕트만 주는 비용과 한계에도 불구하고, 이 방법은 우수한 신뢰성, 사용 편의성, 다재다능성으로 많은 상황에서 선택 방법을 제공한다.보조 장치의 갈라짐에는 여러 가지 방법을 사용할 수 있다.[40]
이미드를 건설하면 동기 및 반선택적 알돌 추가 반응이 모두 수행되어 가능한 네 가지 스테레오선 중 세 가지를 조합할 수 있다: 동기 선택적:[41] 및 반선택적합:[42]
동기화 선택 반응에서 두 에놀레이트 방법은 모두 예상대로 Z 에놀레이트(Enolate)를 주지만, 반응의 입체화학적인 결과는 옥사졸리디논의 치례성보다는 메틸 스테레오코인에 의해 제어된다.[citation needed]기술된 방법들은 알돌 레트론을 특징으로 하는 천연물의 한 종류인 폴리케티드의 입체적인 조립을 가능하게 한다.
근육내반응
분자 내 알돌 반응은 같은 분자 내 알데히드 그룹이나 케톤 그룹의 응축 반응이다.5, 6흡입 α, β-불포화 케톤 또는 알데히드가 제품으로 형성된다.이러한 반응은 링 시스템을 포함하는 유기 분자 내 탄소-탄소 결합의 형성에 중요한 접근법이다.예를 들어, 강한 기본 조건(예: 수산화나트륨)에서는 헥산-2,5-디온(그림 1의 조합 A)이 분자 내 알돌 반응을 통해 사이클링하여 3-메틸사이클로펜트-2-엔-1-1(조합 B)을 형성할 수 있다.
근육내 알돌반응의 메커니즘은 핵심 에놀레이트 중간의 형성에 이어 근육내 핵포함 과정을 수반한다.첫째, 수산화물은 단자 탄소의 α-수소를 추상화하여 에놀레이트를 형성한다.다음으로, 다른 케토 그룹에 대한 에놀레이트 핵포질 공격이 탄소 2와 6 사이에 새로운 탄소-탄소 결합(빨간색)을 형성한다.마지막으로, 보통 가열 조건에서는 물 분자가 제거되면 사이클화된 α,β-불포화 케톤이 발생한다.
분자 내 알돌 반응은 다양한 천연물, 특히 알칼로이드와 스테로이드의 총합물에서 널리 사용되어 왔다.예를 들면, 시게히사의 (+-Wortmanin by Shigehisa, et al.)([43]그림 2)에 의한 총합성에 대한 링 폐쇄 단계에서 근육내 알돌반응의 적용이다.
변형 및 방법
아세테이트알돌반응
앞에서 설명한 키랄 보조 접근법의 주요 제한사항은 선택적으로 반응하는 N-아세틸 이미드의 실패다.초기 접근방식은 다음과 같은 임시 테오테더 그룹을 사용하는 것이었다.[40][44]
무카이야마알돌반응
무카이야마 알돌반응은[45] 루이스 산(boron trifluoride etherate, boron trifluoride etherate) 또는 티타늄 테트라클로라이드와 같은 알데히드에 실릴 에놀 에테르를 첨가한 핵포필 반응이다.[46][47]무카이야마 알돌 반응은 짐머만-트랙슬러 모델을 따르지 않는다.카레이라는 특히 유용한 비대칭 방법론을 실릴 케틴 아세탈과 함께 설명했는데, 높은 수준의 항전율과 넓은 기질 범위로 주목할 만하다.[48]
이 방법은 종종 촉매 비대칭 공정을 위한 불충분한 전기식인 갈지 알데히드(brackched aliphatic aldehydes)에 작용한다.이것은 아마도 그들의 엔티오페스 사이의 전자적이고 견고한 분화 때문일 것이다.
유사성 빈니로거스 무카이야마 알돌 공정도 촉매와 비대칭으로 렌더링할 수 있다.아래 예제는 방향족(알리파틱은 아님) 알데히드에 대해 효율적으로 작동하며 메커니즘은 치랄, 금속 결합 디에놀레이트를 포함하는 것으로 간주된다.[49][50]
크림민스 티아졸리디네티온 알돌
크림민스 티아졸리디네티온 접근법에서[51][52] 티아졸리디네티온느는 아세테이트 알돌 반응을 수행한다.[53]단순히 (--sparteine)의 양을 변경하여 "Evans syn" 또는 "Non-Evans sync" 인덕트를 생성할 수 있다.이 반응은 에반스 보조에 대해 제안된 전환 상태와 유사하게 6-membed의 티타늄 결합 전환 상태를 통해 진행되는 것으로 생각된다.참고: 아래에 표시된 스파르타인의 구조에는 N 원자가 누락되어 있다.
조직투석
치랄 2차 아민 촉매는 일부 알돌 반응을 촉진시킨다.이러한 2차 아민은 케톤에 노출되었을 때 일시적인 에나민을 형성하며, 이는 적절한 알데히드 전기로 항혈관신생반응을[54] 일으킬 수 있다.아민은 카보닐과 반응하여 에나민을 형성하고, 에나민은 에놀과 같은 핵성분 역할을 하며, 아민은 제품에서 모두 방출된다. 아민 그 자체가 촉매다.이 에나민 카탈루션 방법은 촉매가 전적으로 작은 유기 분자에 기초하기 때문에 유기물 투석의 일종이다.세미나의 예에서 프롤린은 트리케톤의 사이클링을 효율적으로 촉매화했다.
이러한 반응은 하조스-파리시 반응[55][56](하조스-파리시-에더-사우어-위처트 반응이라고도 하며, 더 가혹한 조건에서 반응을 스크링(Shering))의 동시적 보고를 가리킨다.[57]Hajos-Parrish 조건에서는 프로라인의 촉매 양만 필요하다(3 mol%).과도성 에나민 중간체는 모체 케톤 에놀보다 훨씬 더 핵포화성이 강하기 때문에 아핵 배경 반응의 위험은 없다.이 전략은 독성이 있거나 비용이 많이 든다는 가능한 단점이 있는 전이 금속을 사용하지 않고 반응에서 항저항성을 발생시키는 간단한 방법을 제공한다.
프로라인 촉매 알돌 반응은 비선형 효과를 보이지 않는다(제품의 항균성은 촉매의 항균성에 정비례한다).동위원소 라벨 표시 증거 및 계산 연구와 결합하여 프로라인 분석 알돌 반응에 대해 제안된 반응 메커니즘은 다음과 같다.[58]
이 전략은 두 알데히드 사이의 다른 도전적인 교차 알돌 반응을 허용한다.일반적으로 알데히드 사이의 교차 알데히드 반응은 쉽게 중합하거나 선택적이지 않게 반응하여 제품의 통계적 혼합을 제공할 수 있기 때문에 전형적으로 도전적이다.첫 번째 예는 다음과 같다.[59]
에놀레이트 기반 알돌 첨가물에서 일반적으로 관찰되는 동기 첨가물에 대한 선호와 대조적으로, 이러한 유기 분석 알돌 첨가물은 반선택적이다.많은 경우, 유기체 분석적 조건은 중합성을 피할 수 있을 만큼 충분히 온화하다.그러나 선택성은 반응하는 두 파트너 모두 일반적으로 양자를 사용할 수 없기 때문에 원하는 전기영동 파트너의 느린 주사기-펌프 제어 추가가 필요하다.알데히드 1개에 굴절 가능한 양성자, 알파 또는 베타 분지 등이 없는 경우 추가 통제를 할 수 있다.
비대칭 유기농 알돌반응의 위력에 대한 우아한 시범은 2004년 맥밀런과 동료들이 차등보호 탄수화물을 합성하는 과정에서 공개되었다.기존의 합성 방법은 8-14단계가 필요한 반복적 보호-폐쇄 전략의 변형을 사용하여 육각 합성을 달성하는 반면, 조직분석은 탠덤 무카이야마에 이어 알파-옥시알데히드의 프로라인-분석적 조광화와 관련된 효율적인 2단계 프로토콜을 사용하여 많은 동일한 기질에 접근할 수 있다.ldol 사이클링
알파-옥시알데히드의 알파-옥시알데히드의 알돌 조광화는 알데히드 자체인 알돌 유도체가 더 이상 반응하지 않도록 불활성화하도록 요구한다.[60]기존 연구에서는 알파알키록시 또는 알파실록시 대체물을 함유한 알데히드가 이 반응에 적합했고, 아세톡시 등 일렉트로닉을 함유한 알데히드는 비활성이었다.보호되는 에리스로즈 제품은 이후 유골 형성에 따라 무카이야마 알돌 첨가물을 통해 4개의 가능한 당으로 변환될 수 있다.이를 위해서는 무카이야마 알돌 덧셈에 적절한 디아스테레오콘트롤과 제품 실록시카르베늄 이온이 더 이상의 알돌반응을 겪지 않고 우선 사이클링을 해야 한다.결국 포도당, 마노오스, 알로스가 합성되었다.
"직접" 알돌 추가
통상적인 알돌 첨가물에서는 카르보닐 화합물이 감압되어 에놀레이트를 형성한다.에놀레이트는 알데히드나 케톤에 첨가되어 알코산화물을 형성하고, 그 다음 작업에서 양성된다.원칙적으로 우월한 방법은 단일 프로세스 단계에서 수행될 수 있는 "직접" 반응에 유리한 다단계 시퀀스의 요건을 피할 수 있다.한 가지 아이디어는 알돌 첨가 메커니즘 후에 방출되는 금속 촉매를 사용하여 에놀레이트 생성을 하는 것이다.일반적인 문제는 그 첨가물이 알카산화물을 생성한다는 것인데, 이것은 시작 물질보다 훨씬 더 기본적인 것이다.이 제품은 금속과 단단하게 결합돼 추가 카보닐 반응제와 반응하지 않는다.
에반스에 의해 증명된 한 가지 접근법은 알돌의 기물을 밀링하는 것이다.[61][62]반응에 TMSCl과 같은 실리콘 시약이 첨가되어 알카산화물의 금속을 대체하여 금속 촉매가 회전할 수 있다.반응 단계의 수와 사용된 반응 화학 물질의 양을 최소화하면 비용 효율적이고 산업적으로 유용한 반응을 얻을 수 있다.
생물학적 알돌반응
생화학에서 알돌반응의 예로는 프락토스-1,6-비스포스페이트를 글리코알데히드3-인산염의 4단계에서 디히드록시아세톤과 글리세알데히드-3-인산염으로 분할하는 것을 들 수 있는데, 이는 알돌아제 A 효소에 의해 촉매된 역("레트로") 알돌반응의 예다.
식물과 일부 원핵생물의 글리옥실산염 주기에서 이소시틸레이트 리아제는 글리옥실산염을 생성하며 이소시틸산염으로부터 굴복한다.OH 집단의 감응에 이어 이소시레이트 리아제 클리브스는 4-탄소 숙사체로 이소시틸레이트를, 2-탄소 글리옥실레이트는 알돌 클리바지 반응에 의해 4-탄소 리아제 클리브스.이 갈라짐은 기계적으로 당분해의 알돌라아제 A반응과 유사하다.
참고 항목
참조
- ^ Wade, L. G. (2005). Organic Chemistry (6th ed.). Upper Saddle River, New Jersey: Prentice Hall. pp. 1056–66. ISBN 978-0-13-236731-8.
- ^ Smith, M. B.; March, J. (2001). Advanced Organic Chemistry (5th ed.). New York: Wiley Interscience. pp. 1218–23. ISBN 978-0-471-58589-3.
- ^ Mahrwald, R. (2004). Modern Aldol Reactions, Volumes 1 and 2. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. pp. 1218–23. ISBN 978-3-527-30714-2.
- ^ 참조:
- 보로딘은 헵탄(Oenanthaldehid)이 헵탄(Oenanthaldehood)으로 응결된 것에 대해 V. von Richter, aus St. 페테르부르크는 17이다. 1869년 10월 (V. von Richter [보고])17번지 페테르부르크.1869년 10월), 베리히테 데 도이체첸 게셀샤프트(독일어), 2 : 552-553.
- 리히터 보고서의 영문판: (스태프) (1869년 12월 10일) "외국의 화학적 통지: 베리히테 데르 도이체첸 게셀샤프트 주 베를린, 제16호, 1869호: 발레리안 알데히드와 오에난트 알데히드 – M. 보로딘," 화학 뉴스 및 산업 과학 저널 20: 286.
- 가너, 수잔 에이미(2007) "수소 매개 탄소-탄소 결합 형성:환원성 알돌과 만니치 반응에 적용" 텍사스 대학교(오스틴), 페이지 4, 51의 박사 논문.
- 보로딘, A. (1873) "Uber einen neuen Abkömmling des Valerals"(발레리안 알데히드의 새로운 파생상품에 대하여), 베리히테 데르 도이체첸 게셀샤프트(독일어), 6 : 982–985.
- ^ Wurtz, C. A. (1872). "Sur un aldéhyde-alcool" [On an aldehyde alcohol]. Bulletin de la Société Chimique de Paris. 2nd series (in French). 17: 436–442.
- ^ Wurtz, C. A. (1872). "Ueber einen Aldehyd-Alkohol" [About an aldehyde alcohol]. Journal für Praktische Chemie (in German). 5 (1): 457–464. doi:10.1002/prac.18720050148.
- ^ Wurtz, C. A. (1872). "Sur un aldéhyde-alcool" [On an aldehyde alcohol]. Comptes rendus de l'Académie des sciences (in French). 74: 1361.
- ^ Heathcock, C. H. (1991). "The Aldol Reaction: Acid and General Base Catalysis". In Trost, B. M.; Fleming, I. (eds.). Comprehensive Organic Synthesis. Vol. 2. Elsevier Science. pp. 133–179. doi:10.1016/B978-0-08-052349-1.00027-5. ISBN 978-0-08-052349-1.
- ^ Mukaiyama T. (1982). The Directed Aldol Reaction. Org. React. Vol. 28. pp. 203–331. doi:10.1002/0471264180.or028.03. ISBN 978-0471264187.
- ^ Paterson, I. (1988). "New Asymmetric Aldol Methodology Using Boron Enolates". Chem. Ind. 12: 390–394.
- ^ Mestres R. (2004). "A green look at the aldol reaction". Green Chemistry. 6 (12): 583–603. doi:10.1039/b409143b.
- ^ M. Braun; R. Devant (1984). "(R) and (S)-2-acetoxy-1,1,2-triphenylethanol – effective synthetic equivalents of a chiral acetate enolate". Tetrahedron Letters. 25 (44): 5031–4. doi:10.1016/S0040-4039(01)91110-4.
- ^ Jie Jack Li; et al. (2004). Contemporary Drug Synthesis. Wiley-Interscience. pp. 118–. ISBN 978-0-471-21480-9.
- ^ Wulff W. D.; Andersson B. A (1994). "Stereoselective aldol addition reactions of Fischer carbene complexes via electronic tuning of the metal center for enolate reactivity". Inorganica Chimica Acta. 220 (1–2): 215–231. doi:10.1016/0020-1693(94)03874-0.
- ^ Schetter, B.; Mahrwald, R. (2006). "Modern Aldol Methods for the Total Synthesis of Polyketides". Angew. Chem. Int. Ed. 45 (45): 7506–7525. doi:10.1002/anie.200602780. PMID 17103481.
- ^ Molander, G. A., ed. (2011). Stereoselective Synthesis 2: Stereoselective Reactions of Carbonyl and Imino Groups (1 ed.). Stuttgart: Georg Thieme Verlag. doi:10.1055/sos-sd-202-00331. ISBN 978-3-13-154121-5.
- ^ Guthrie, J.P.; Cooper, K.J.; Cossar, J.; Dawson, B.A.; Taylor, K.F. (1984). "The retroaldol reaction of cinnamaldehyde". Can. J. Chem. 62 (8): 1441–1445. doi:10.1139/v84-243.
- ^ Molander, ed. (2011). Stereoselective Synthesis 2: Stereoselective Reactions of Carbonyl and Imino Groups (1 ed.). Stuttgart: Georg Thieme Verlag. doi:10.1055/sos-sd-202-00331. ISBN 978-3-13-154121-5.
- ^ Zimmerman, H. E.; Traxler, M. D. (1957). "The Stereochemistry of the Ivanov and Reformatsky Reactions. I". Journal of the American Chemical Society. 79 (8): 1920–1923. doi:10.1021/ja01565a041.
- ^ Heathcock, C. H.; Buse, C. T.; Kleschnick, W. A.; Pirrung, M. C.; Sohn, J. E.; Lampe, J. (1980). "Acyclic stereoselection. 7. Stereoselective synthesis of 2-alkyl-3-hydroxy carbonyl compounds by aldol condensation". Journal of Organic Chemistry. 45 (6): 1066–1081. doi:10.1021/jo01294a030.
- ^ 발, B, B, C. T; 스미스, C. H. 히스콕, C. H., (2SR,3RS)-2,4-디메틸-3-히드록시펜타노산 2011-06-06 보관. 신스, 콜제7권, 제185권 (1990년); 제63권, 제89권 (1985년)
- ^ a b Brown, H. C.; Dhar, R. K.; Bakshi, R. K.; Pandiarajan, P. K.; Singaram, B. (1989). "Major effect of the leaving group in dialkylboron chlorides and triflates in controlling the stereospecific conversion of ketones into either E- or Z-enol borinates". Journal of the American Chemical Society. 111 (9): 3441–3442. doi:10.1021/ja00191a058.
- ^ Ireland, R. E.; Willard, A. K. (1975). "The stereoselective generation of ester enolates". Tetrahedron Letters. 16 (46): 3975–3978. doi:10.1016/S0040-4039(00)91213-9.
- ^ Narula, A. S. (1981). "An analysis of the diastereomeric transition state interactions for the kinetic deprotonation of acyclic carbonyl derivatives with lithium diisopropylamide". Tetrahedron Letters. 22 (41): 4119–4122. doi:10.1016/S0040-4039(01)82081-5.
- ^ Ireland, RE; Wipf, P; Armstrong, JD (1991). "Stereochemical control in the ester enolate Claisen rearrangement. 1. Stereoselectivity in silyl ketene acetal formation". Journal of Organic Chemistry. 56 (2): 650–657. doi:10.1021/jo00002a030.
- ^ Xie, L; Isenberger, KM; Held, G; Dahl, LM (October 1997). "Highly Stereoselective Kinetic Enolate Formation: Steric vs Electronic Effects". Journal of Organic Chemistry. 62 (21): 7516–7519. doi:10.1021/jo971260a. PMID 11671880.
- ^ 지시 알돌합성 – E-Enolate와 Z-Enolate의 형성
- ^ Cowden, C. J.; Paterson, I. Org. 반응하라 1997, 51, 1
- ^ Cowden, C. J.; Paterson, I. (2004). Asymmetric Aldol Reactions Using Boron Enolates. Organic Reactions. pp. 1–200. doi:10.1002/0471264180.or051.01. ISBN 978-0471264187.
- ^ Evans, D. A.; Nelson J. V.; Vogel E.; Taber T. R. (1981). "Stereoselective aldol condensations via boron enolates". Journal of the American Chemical Society. 103 (11): 3099–3111. doi:10.1021/ja00401a031.
- ^ Evans, D. A.; Rieger D. L.; Bilodeau M. T.; Urpi F. (1991). "Stereoselective aldol reactions of chlorotitanium enolates. An efficient method for the assemblage of polypropionate-related synthons". Journal of the American Chemical Society. 113 (3): 1047–1049. doi:10.1021/ja00003a051.
- ^ 에반스 D.A. 외탑. 스테레오케미컬. 1982, 13, 1–115 (검토)
- ^ Roush W. R. (1991). "Concerning the diastereofacial selectivity of the aldol reactions of .alpha.-methyl chiral aldehydes and lithium and boron propionate enolates". Journal of Organic Chemistry. 56 (13): 4151–4157. doi:10.1021/jo00013a015.
- ^ Masamune S.; Ellingboe J. W.; Choy W. (1982). "Aldol strategy: coordination of the lithium cation with an alkoxy substituent". Journal of the American Chemical Society. 104 (20): 1047–1049. doi:10.1021/ja00384a062.
- ^ a b Evans, D. A.; Dart M. J.; Duffy J. L.; Rieger D. L. (1995). "Double Stereodifferentiating Aldol Reactions. The Documentation of "Partially Matched" Aldol Bond Constructions in the Assemblage of Polypropionate Systems". Journal of the American Chemical Society. 117 (35): 9073–9074. doi:10.1021/ja00140a027.
- ^ Masamune S.; Choy W.; Petersen J. S.; Sita L. R. (1985). "Double Asymmetric Synthesis and a New Strategy for Stereochemical Control in Organic Synthesis". Angew. Chem. Int. Ed. Engl. 24: 1–30. doi:10.1002/anie.198500013.
- ^ Evans, D. A. (1982). "Studies in Asymmetric Synthesis: The Development of Practical Chiral Enolate Synthons" (PDF). Aldrichimica Acta. 15: 23.
- ^ Gage J. R.; 에반스 D.A, 치랄옥사졸리디논 보조기를 이용한 탈수성 알돌 응결 : (2S*,3S*)-3-하이드록시-3-페닐-2-메틸프로파노산 2012-09-29 보관 웨이백머신, 유기합성, 콜라.제8권, 제339권(1993); 제68권, 제83권(1990).
- ^ Evans, D. A.; Bartroli J.; Shih T. L. (1981). "Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates". Journal of the American Chemical Society. 103 (8): 2127–2129. doi:10.1021/ja00398a058.
- ^ a b Evans, D. A.; Bender S. L.; Morris J. (1988). "The total synthesis of the polyether antibiotic X-206". Journal of the American Chemical Society. 110 (8): 2506–2526. doi:10.1021/ja00216a026.
- ^ Evans, D. A.; Clark J.S.; Metternich R.; Sheppard G.S. (1990). "Diastereoselective aldol reactions using .beta.-keto imide derived enolates. A versatile approach to the assemblage of polypropionate systems". Journal of the American Chemical Society. 112 (2): 866–868. doi:10.1021/ja00158a056.
- ^ Evans, D. A.; Ng, H.P.; Clark, J.S.; Rieger, D.L. (1992). "Diastereoselective anti aldol reactions of chiral ethyl ketones. Enantioselective processes for the synthesis of polypropionate natural products". Tetrahedron. 48 (11): 2127–2142. doi:10.1016/S0040-4020(01)88879-7.
- ^ 시게히사, 시게히사, 미즈타니, T. Y. 토사키, T. 오시마, T. 시바사키, M, 테트라헤드론 2005, 61, 5057-5065.
- ^ 이 반응에서 핵소체는 디부틸보론 트리플레이트(nBuBOTf2)와의 반응에서 파생된 붕소 에놀레이트(boron enolate)이며, 그 베이스는 N,N-diisopropyletylamine이다.2단계에서 래니 니켈/수소 감소에 의해 티오에더가 제거됨
- ^ S. B. Jennifer Kan; Kenneth K.-H. Ng; Ian Paterson (2013). "The Impact of the Mukaiyama Aldol Reaction in Total Synthesis". Angewandte Chemie International Edition. 52 (35): 9097–9108. doi:10.1002/anie.201303914. PMID 23893491.
- ^ Teruaki Mukaiyama; Kazuo Banno; Koichi Narasaka (1974). "Reactions of silyl enol ethers with carbonyl compounds activated by titanium tetrachloride". Journal of the American Chemical Society. 96 (24): 7503–7509. doi:10.1021/ja00831a019.
- ^ 3-히드록시-3-메틸-1-페닐-1-부타논 크로스 알돌반응 무카이야마 테루아키와 나라사카 유기합성체 코이치, 콜.제8권, 페이지 323 (1993); 제65권, 페이지 6 (1987)
- ^ Carreira E.M.; Singer R.A.; Lee W.S. (1994). "Catalytic, enantioselective aldol additions with methyl and ethyl acetate O-silyl enolates — a chira; tridentate chelate as a ligand for titanium(IV)" (PDF). Journal of the American Chemical Society. 116 (19): 8837–8. doi:10.1021/ja00098a065.
- ^ Kruger J.; Carreira E.M. (1998). "Apparent catalytic generation of chiral metal enolates: Enantioselective dienolate additions to aldehydes mediated by Tol-BINAP center Cu(II) fluoride complexes". Journal of the American Chemical Society. 120 (4): 837–8. doi:10.1021/ja973331t.
- ^ Pagenkopf B.L.; Kruger J.; Stojanovic A.; Carreira E.M. (1998). "Mechanistic insights into Cu-catalyzed asymmetric aldol reactions: Chemical and spectroscopic evidence for a metalloenolate intermediate". Angew. Chem. Int. Ed. 37 (22): 3124–6. doi:10.1002/(SICI)1521-3773(19981204)37:22<3124::AID-ANIE3124>3.0.CO;2-1.
- ^ Crimmins M. T.; King B. W.; Tabet A. E. (1997). "Asymmetric Aldol Additions with Titanium Enolates of Acyloxazolidinethiones: Dependence of Selectivity on Amine Base and Lewis Acid Stoichiometry". Journal of the American Chemical Society. 119 (33): 7883–7884. doi:10.1021/ja9716721.
- ^ Crimmins M. T.; Chaudhary K. (2000). "Titanium enolates of thiazolidinethione chiral auxiliaries: Versatile tools for asymmetric aldol additions". Organic Letters. 2 (6): 775–777. doi:10.1021/ol9913901. PMID 10754681.
- ^ Crimmins, Michael T.; Shamszad, Mariam (2007). "Highly Selective Acetate Aldol Additions Using Mesityl-Substituted Chiral Auxiliaries". Org. Lett. 9: 149–152. doi:10.1021/ol062688b.
- ^ Carreira, E. M.; Fettes, A.; Martl, C. (2006). Catalytic Enantioselective Aldol Addition Reactions. Org. React. Vol. 67. pp. 1–216. doi:10.1002/0471264180.or067.01. ISBN 978-0471264187.
- ^ Z. G. Hajos, D. R. Parrish, 독일 특허 DE 2102623 1971
- ^ Hajos, Zoltan G.; Parrish, David R. (1974). "Asymmetric synthesis of bicyclic intermediates of natural product chemistry". Journal of Organic Chemistry. 39 (12): 1615–1621. doi:10.1021/jo00925a003.
- ^ Eder, Ulrich; Sauer, Gerhard; Wiechert, Rudolf (1971). "New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures". Angewandte Chemie International Edition in English. 10 (7): 1615–1621. doi:10.1002/anie.197104961.
- ^ List, Benjamin (2006). "The ying and yang of asymmetric aminocatalysis". Chemical Communications (8): 819–824. doi:10.1039/b514296m. PMID 16479280.
- ^ Northrup, Alan B.; MacMillan David W. C. (2002). "The First Direct and Enantioselective Cross-Aldol Reaction of Aldehydes" (PDF). Journal of the American Chemical Society. 124 (24): 6798–6799. doi:10.1021/ja0262378. PMID 12059180.
- ^ Northrup A. B.; Mangion I. K.; Hettche F.; MacMillan D. W. C. (2004). "Enantioselective Organocatalytic Direct Aldol Reactions of -Oxyaldehydes: Step One in a Two-Step Synthesis of Carbohydrates". Angewandte Chemie International Edition in English. 43 (16): 2152–2154. doi:10.1002/anie.200453716. PMID 15083470.
- ^ Evans, D. A.; Tedrow, J. S.; Shaw, J. T.; Downey, C. W. (2002). "Diastereoselective Magnesium Halide-Catalyzed anti-Aldol Reactions of Chiral N-Acyloxazolidinones". Journal of the American Chemical Society. 124 (3): 392–393. doi:10.1021/ja0119548. PMID 11792206.
- ^ Evans, David A.; Downey, C. Wade; Shaw, Jared T.; Tedrow, Jason S. (2002). "Magnesium Halide-Catalyzed Anti-Aldol Reactions of Chiral N-Acylthiazolidinethiones". Organic Letters. 4 (7): 1127–1130. doi:10.1021/ol025553o. PMID 11922799.
외부 링크
- Chem 206, 215 강의 노트(2003, 2006) by D. A. 에반스, A. G. 마이어스, 외, 하버드 대학교 (pp. 345, 936)