아노메릭 효과
Anomeric effect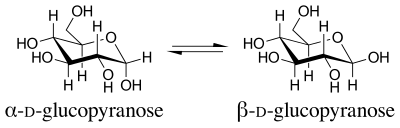
유기화학에서 변칙 효과 또는 에드워드-레미우 효과(Endward-Lemiux effect)는 스테레오 전자적 효과로서, 사이클로헥산 링 내에서 이단 원자 가까이에 있는 이단 원자 대체물이 스테레오적 고려에서 예상할 수 있는 덜 방해받지 않는 적도 방향 대신에 축 방향을 선호하는 경향을 설명하는 것이다.[1] 이 효과는 원래 1955년 J. T. 에드워드에 의해 탄수화물 화학 연구를 할 때 피라노스 링에서 관측되었다.
아노마틱 효과라는 용어는 1958년에 도입되었다.[2] 이 명칭은 피라노스의 가장 낮은 번호의 고리 탄소인 변칙 탄소를 지정하는 데 사용되는 용어에서 유래되었다. 변이성 탄소에서의 구성에서만 차이가 나는 이소머를 아노미어라고 한다. D-글루코피라노스의 평균은 이산화물 제거기로 베타 아노머는 적도를 가리키는 OH 집단을 가지고 있고 알파 아노머는 그 OH 집단이 축방향으로 아래를 가리킨다.
또한 변칙 효과는 일반 공식 C-Y-C-X로 모든 사이클로헥실 또는 선형 시스템으로 일반화할 수 있다. 여기서 Y는 하나 이상의 단독 쌍을 가진 이단 원자이고 X는 전기 원자 또는 그룹이다.[3] 변칙 효과의 크기는 설탕의 경우 약 1-2 kcal/mol로 추정되지만, 분자마다 다르다.
위의 경우 사이클로헥산 링(상단)에 있는 메톡시 그룹은 적도 위치를 선호한다. 그러나 테트라히드롭디란 링(하단)에서는 메톡시 그룹이 축 위치를 선호한다. 이는 사이클로헥산 링에서는 이질 원자가 아닌 Y=탄소(carbon)로 되어 있어 변칙적인 효과가 관찰되지 않고 스테로닉이 관측된 대체 위치를 지배하기 때문이다. 테트라히드롭디란 링에서는 이질 원자인 Y=산소(산소)가 나타나므로 변칙적인 효과는 관찰된 대체물 위치에 기여하고 안정화시킨다. 두 경우 모두 X= OMe.
변칙적인 효과는 Y=산소일 때 가장 많이 관찰되지만, 질소, 황, 인과 같이 링에 이질소가 있는 다른 외로운 쌍에서도 볼 수 있다.[4] 변칙적인 효과가 안정화를 일으키는 정확한 방법은 논란의 여지가 있으며, 이를 설명하기 위해 여러 가지 가설이 제시되어 왔다.
물리적 설명과 논란
변칙적인 효과의 물리적 이유는 완전히 이해되지 않는다. 일부 상충되는 부분에서는 설명이 제공되었고 주제가 아직 해결되지 않았다.[5]
초점화
순환분자
널리 받아들여지는 설명은 (설탕 고리 내) 내복성 이질 원자에 있는 비공유 전자 쌍과 축(외복) C-X 결합의 σ* 궤도 사이에 안정화 상호작용(초점화)이 있다는 것이다. 이로 인해 분자는 기증되는 한 쌍의 전자 반페리플라나(180°)를 외생 C-X σ 결합에 맞추어 정렬하게 되어 시스템의 전체 에너지를 낮추고 더 많은 안정성을 야기한다.[6]
일부 저자들은 또한 분자 내 원자의 양자 이론의 결과에 근거한 이 초점화 모델의 타당성에 의문을 제기한다.[7] 그 변칙적인 효과에 대한 대부분의 연구가 본질적으로 이론적이었지만, 이 가설에서 제안된 산술의 전자 밀도 재분배가 산술의 알려진 실험 화학적 화학적, 특히 m의 화학적 작용과 합치되지 않는다는 근거에 근거하여 n–1999* (초점화) 가설도 널리 비판되어 왔다.과당류[8][9]
악순환분자
초융합은 또한 변칙 효과의 또 다른 형태인 이질문을 포함하는 순환 분자에서도 발견된다. 만약 분자가 한 쌍의 전자를 가진 원자를 가지고 있고 인접한 원자가 electrons* 궤도 안으로 전자를 받아들일 수 있다면, 초융합이 일어나 분자를 안정화시킨다. 이것은 "무연고" 공명 형태를 형성한다. 이러한 궤도 오버랩이 발생하기 위해서는 대부분의 헤테로아톰에 대해 트랜스, 트랜스 컨포메이션이 선호되지만, 디메톡시메탄, 거슈, 거슈 컨포메이션이 트랜스 컨포메이션보다 에너지(더 안정적)가 약 3~5kcal/mol 낮다. 이는 트랜스 컨포메이션이 있기 때문에 당분 내 효과의 약 2배 정도 크다.e 영향을 받는 두 개의 회전 가능한 결합([10]두 개의 결합 또는 둘 다의 거슈 둘레 둘레를 돈다).
쌍극자 최소화
변칙적인 효과에 대한 또 다른 인정된 설명은 적도 구성이 두 이단계를 부분적으로 정렬하여 서로 밀어내는 쌍극점을 가지고 있다. 이와는 대조적으로 축 구성은 이러한 쌍극이 대략 반대 방향으로 나타나므로 보다 안정적이고 낮은 에너지 상태를 나타낸다.
하이퍼 통합과 쌍극자 최소화 모두 (E) 적합성보다 에스테르가 우선 (Z) 적합성에 기여한다. (Z) 순응에서 알파 산소의 유일한 전자 한 쌍은 이웃한 ** C-O 궤도상에 기부할 수 있다. 또한 (Z) 적합성에서는 쌍극이 최소화되고 (E) 적합성에서는 최대화된다.[6]
n-n 반발 및 C-H 수소 결합
2-메톡시피란의 변칙적인 중심에서 옥시겐에 있는 한 쌍의 전자가 나타난다면, 분석기의 순응에 대한 간단한 검사 결과 β-아노머는 항상 적어도 한 쌍의 에클립싱(코플라나 1,3-인터랙션)의 단독 쌍을 가지고 있는 것으로 나타났으며, 이 n-n 반발은 높은 에너지 상황이다. 반면 α-아노머는 n-n 거부반응이 없는 순응을 가지고 있으며, 이는 엑소-아노메릭 순응에서도 사실이다. β-아노머에 존재하는 정력적으로 불리한 n-n 반발력과 축방향 H-5와 축방향 α-아노메릭 대체물질(C-H/n 수소결합)의 단독 전자쌍 사이의 정력적으로 유리한 수소 결합이 결합되어, 평균자 사이의 정력적인 차이를 대부분 설명하기 위해 [참고자료 7과 8]이 제안되었다. 변칙 효과 분자역학 프로그램 StruMM3D는 변증학적 효과에 대해 특별히 파라미터화되지 않은 것으로, 변증학적 효과에 대한 2극 기여도(주로 위에서 논의한 n-n rejection, C-H 수소 본딩)가 약 1.5 kcal/mol이라고 추정한다.
영향
분자에 대한 이러한 유형의 안정화에 대한 일반적인 설명인 반면, 안정화의 종류와 양은 연구 중인 용매뿐만 아니라 검사 중인 대체 물질에 의해 영향을 받을 수 있다.
대체효과
폐쇄형 시스템에서는 사이클로헥산 또는 테트라히드롭시란 링(Y=Oxygen)에서 서로 다른 대체물에 대한 평균 효과에 차이가 관찰된다. X=OH일 때 앞에서 설명한 것처럼 일반적 변칙 효과를 볼 수 있다. X=CN에서는 같은 결과가 나타나는데, 사이클로헥산 링에서는 적도 위치를 선호하지만 테트라히드롭시란 링에서는 축 위치를 선호한다. 이것은 변칙 효과 안정화와 일치한다. X=F일 때, 두 링에 대해 사실상 변칙적인 효과가 관찰된다. 그러나 X=NH에서는2 변칙적인 효과 안정화가 관찰되지 않고 두 시스템 모두 적도 위치를 선호한다. 이는 역분석 효과(아래 참조)[3]라는 효과와 스테로이드 둘 다에 기인한다.
용제 효과
초점화 이론에 대한 일반적인 비판 중 하나는 대체된 테트라히드롭란 분자를 극성 용제에 넣었을 때 왜 변칙적인 효과가 관찰되지 않는지를 설명하지 못하고, 적도의 위치를 다시 한 번 선호한다는 것이다. 그러나 초점화는 시스템의 용매에 따라 결정된다는 것이 밝혀졌다. 위에서 설명한 각 대체 시스템은 가스 단계(즉, 용제가 없는 경우)와 수용액(극성 용제)에서 시험되었다. X=F일 때는 두 매체에서 모두 변칙적인 효과가 관찰되었으며, 축 위치를 항상 선호하였다. 이것은 과당화 때문이라고 한다. X=OH 또는 CN일 때, 축 위치를 선호하는 가스 단계에서 변칙적인 효과가 나타났다. 그러나 수용액에서는 두 대체물이 모두 적도 위치를 선호했다. 이는 축방향 위치 대체제와 극성 용매로 정전기 역류 현상이 많아져 적도 위치가 선호되기 때문으로 풀이된다. X=NH2, 다시 말하지만, 변칙적인 효과는 관찰되지 않았고 적도 위치를 항상 선호했다.[11]
변칙적인 효과 극복
변칙적인 효과는 분자의 안정화를 유발할 수 있지만, 그것은 안정화에 큰 영향을 미치고, 어떤 경우에는 이 값을 다른, 더 불안정하게 하는 효과에 의해 극복할 수 있다.
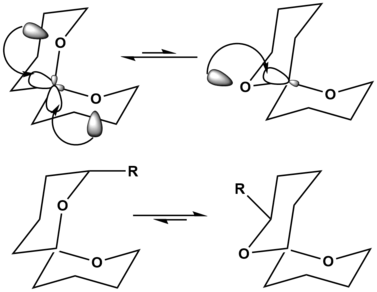
스피로케탈의 예에서 왼쪽 상단의 방향은 두 번 이상 고압적 변칙 효과에 의한 안정화를 보여줌으로써 분자의 방향성을 크게 안정시킨다. 오른쪽 상단의 방향은 이러한 초주전적 변이학적 안정화를 한 번만 보여주므로 선호도가 낮은 구조가 된다. 단, 척추뼈에 대체물을 추가하면 선호도가 높은 구조를 변경할 수 있다. 왼쪽 하단에서 볼 수 있듯이 큰 대체물이 척추 척추에 추가될 때, 이 큰 대체물질인 R을 축 위치에 두었을 때 발생하는 스트레인은 분자로 하여금 크게 불안정하게 만든다. 우측 하단의 분자에서는 R이 이제 적도 위치에 있어 분자에 더 이상 불안정을 일으키지 않는다. 따라서 대체물이 없는 상태에서 상평형반응은 왼쪽이 선호되는 반면, 하평형은 오른쪽이 선호되는 것으로 단순히 크고 불안정한 대체물을 추가하는 것에서 비롯된다.[12]
엑소 아노마틱 효과
변칙 효과의 확장인 exo 변칙 효과는 거슈 순응을 채택하기 위해 링에서 나오는 대체물을 선호하는 반면, 스테릭스는 항페리플라네르 순응이 선호된다는 것을 시사한다.
그 예로는 2메톡시테트라하이드롭디란(two-methytrahdropyran)이 있다. 평균 효과가 예측하는 바와 같이 메톡시 대체물은 축방향 순응에 대한 선호도가 증가하는 것을 보여준다. 그러나, 메톡시 대체물과 링 사이의 C-O 결합에 대한 회전으로 인해 실제로 둘 이상의 축방향 순응이 가능하다. 역분석 효과의 원리를 적용할 때, 거슈 컨포머를 선호한다고 예측할 수 있는데, 이는 상단 왼쪽 컨포머가 위의 그림에서 최선임을 시사한다. 이 예측은 실험적인 증거에 의해 뒷받침된다. 게다가, 거슈 위치에 대한 이러한 선호도는 여전히 적도 순응에서 나타난다.[13]
역분석 효과
이 용어는 산소와 같은 전기 원자를 포함하는 고리에서 정상적인 강직 상호작용이 예측할 수 있는 수준을 넘어 적도 순응을 위해 양전하 질소 대체물의 명백한 선호를 가리킨다. 부분 양성 전하의 탄소를 함유한 대체 물질은 동일한 효과를 나타내지 않는다.[14] 역분석학적 효과에 대한 이론적 설명은 정전기적 설명과 비정상적 탄소 및 산소 단독 쌍의 sp3 전자의 황색화를 포함한다.[15] 이것이 진짜 현상인지 아닌지에 대해서는 약간의 논쟁이 있다. 보고된 대체 물질을 함유한 질소는 부피가 상당히 커서 강직 부피의 정상 효과와 역분석 효과가 있는 경우 분리하기가 어렵다.[16] 예를 들어, 아래에 표시된 분자에서 피리디늄 대체물은 강인자가 예측하는 것처럼 적도 위치를 강하게 선호하지만, 실제로 이러한 순응에 대한 선호도가 예측보다 더 강하다는 것을 보여주며 역분석적 효과가 기여하고 있음을 시사한다.
메탈로-아노메릭 효과
변칙 탄소에 놓였을 때 그룹 10, 11, 12의 후기 전이 금속은 강한 축 선호도를 보여준다.[17] 이 현상을 야금효과라고 부르는 것은 산소와 다른 이성질체들 사이의 고농축 상호작용과 좋은 수용체 역할을 하는 C-M 반결합 궤도를 안정시키는 것에서 유래한다. 일반화된 금속-항산화 효과는 일반 공식 M-CH-OR로2 화합물 싱클라이널 컨포머의 열역학적 안정화를 의미한다. 축/등가 선호도는 금속 및 전자 구성에 부착된 리간드의 영향을 받을 수 있다. 일반적으로, 그룹의 라이터에서 무거운 원소로 이동하면, 야금 효과의 크기는 증가한다. 또한 산화 상태가 높을수록 축/동기 컨포머를 선호한다.
합성 응용 프로그램
그 변칙적인 효과는 종합적으로 고려된다. 설탕에서 발견되었기 때문에 설탕과 탄수화물 화학은 변칙적인 효과의 더 흔한 합성 용법 중 하나이다. 예를 들어, Koenigs-Knorr glycosidation은 α-OR 또는 β-OR 그룹을 높은 이질회수성으로 설치하며, 이는 변칙적인 효과에 의해 영향을 받는다. 소포롤리피드 락톤, (+----Lepicidin A), (--------Littospermoside)[18]는 코에니그-Knorr 글리코시드를 통해 합성된 몇 가지 제품이다.
참고 항목
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (1996) "아노메릭 효과". doi:10.1351/골드북.A00372
- ^ Juaristi, E.; Cuevas, G. (1992). "Recent studies of the anomeric effect". Tetrahedron. 48 (24): 5019–5087. doi:10.1016/S0040-4020(01)90118-8.
- ^ a b Bauerfeldt, Glauco F.; Cardozo, Thiago M.; Pereira, Márcio S.; da Silva, Clarissa O. (1 January 2013). "The anomeric effect: the dominance of exchange effects in closed-shell systems". Organic & Biomolecular Chemistry. 11 (2): 299. doi:10.1039/c2ob26818c.
- ^ Kirby, Anthony J. (1983). The anomeric effect and related stereoelectronic effects at oxygen; with 24 tables. Berlin [u.a.]: Springer. ISBN 978-0-387-11684-6.
- ^ "Chemistry World Blog » Anomeric argument". Archived from the original on 2019-05-16. Retrieved 2013-09-13.
- ^ a b Cuevas, Eusebio Juaristi, Gabriel (1995). The anomeric effect. Boca Raton: CRC Press. ISBN 978-0-8493-8941-2.
- ^ Vila, A.; Mosquera, R. A. (2007). "Atoms in molecules interpretation of the anomeric effect in the O—C—O unit". J. Comput. Chem. 28 (9): 1516–1530. doi:10.1002/jcc.20585. PMID 17330885.
- ^ Box, V. G. S. (1990). "The role of lone pair interactions in the chemistry of the monosaccharides. The anomeric effect". Heterocycles. 31 (6): 1157–1181. doi:10.3987/REV-90-414.
- ^ Box, V. G. S. (1991). "The role of lone pair interactions in the chemistry of the monosaccharides. Stereo-electronic effects in unsaturated monosaccharides". Heterocycles. 32 (4): 795–807. doi:10.3987/REV-91-425.
- ^ Sundberg, Francis A. Carey; Richard J. (2007). Advanced Organic Chemistry : Part A: Structure and Mechanisms (5. ed.). Berlin: Springer US. ISBN 978-0-387-68346-1.
- ^ Freitas, Matheus P. (1 January 2013). "The anomeric effect on the basis of natural bond orbital analysis". Organic & Biomolecular Chemistry. 11 (17): 2885–90. doi:10.1039/c3ob40187a. PMID 23515623.
- ^ Perron, Francoise; Albizati, Kim F. (1 November 1989). "Chemistry of spiroketals". Chemical Reviews. 89 (7): 1617–1661. doi:10.1021/cr00097a015.
- ^ Szarek, Walter A. (1979). Anomeric Effect: Origins and Consequences. Washington: American Chemical Society. ISBN 978-0-8412-0470-6.
- ^ Kirby, A.J. (1983). The Anomeric Effect and Related Stereoelectronic Effects at Oxygen. New York: Springer-Verlag. ISBN 978-0-387-11684-6.
- ^ Perrin, Charles L. (October 1995). "Reverse anomeric effect: fact or fiction?". Tetrahedron. 51 (44): 11901–11935. doi:10.1016/0040-4020(95)00560-u. ISSN 0040-4020.
- ^ Thatcher, Gregory R. J. (1993). The Anomeric Effect and Associated Stereoelectronic Effects. Washington: American Chemical Society. ISBN 978-0-8412-2729-3.
- ^ Zhu, Feng; Walczak, Maciej A. (4 August 2020). "Stereochemistry of Transition Metal Complexes Controlled by the Metallo-Anomeric Effect". Journal of the American Chemical Society. doi:10.1021/jacs.0c06882.
- ^ Kürti, László; Czakó, Barbara (2007). Strategic applications of named reactions in organic synthesis : background and detailed mechanisms; 250 named reactions (Pbk. ed., [Nachdr.]. ed.). Amsterdam [u.a.]: Elsevier Academic Press. ISBN 978-0-12-429785-2.
외부 링크
 Wikimedia Commons의 Anomeric 효과와 관련된 미디어
Wikimedia Commons의 Anomeric 효과와 관련된 미디어