우드워드-호프만 규칙
Woodward–Hoffmann rules로버트 번스 우드워드(Robert Burns Woodward)와 로알드 호프만([1]Roald Hoffmann)이 고안한 우드워드-호프만(또는 순환 선택 규칙)은 유기화학에서 중요한 반응 등급인 순환 반응의 입체화학 및 활성화 에너지의 특정 측면을 합리화하거나 예측하기 위해 사용되는 규칙의 집합이다. 이 규칙들은 궤도상관도를 이용한 궤도 대칭의 보존의 개념에서 가장 잘 이해된다(아래 제3절 참조). 우드워드-호프만 규칙은 순환 순환 반응 동안 발생하는 전자 구조 변화의 결과물이며 상호작용하는 분자 궤도의 단계화에 따라 예측된다. 그것들은 (1) 전기 싸이클레이션, (2) 사이클로아데이션, (3) 시그마틱 반응,[4] (4) 그룹 전이 반응, (5) 에네 반응, ([2]6) 첼레틱 반응,[3] (7) 등 모든 종류의 순환 반응에 적용된다. 그들의 우아함, 단순함, 일반성 때문에 우드워드-호프만 법칙은 우선 실험 화학자들에게 분자 궤도 이론의 힘을 예시하는 것으로 여겨진다.[5]
우드워드(Woodward)와 호프만은 반응제와 제품 궤도(즉, 반응 좌표의 함수인 연속적인 기하학적 왜곡에 의해 반응제와 제품 궤도가 서로 어떻게 관련되어 있는지)의 상관관계를 조사하여 순환 선택 규칙을 개발했다. 그들은 궤도 대칭의 보존을 순환 과정의 결과(또는 실현 가능성)를 지시하는 중요한 이론 원리로 식별했다. 같은 선발 룰로 이어지는 다른 이론적 접근법도 진전됐다. 호프만은 후쿠이 겐이치(福義)와 공유한 순환기 반응에서 궤도 대칭의 중요성을 해명해 1981년 노벨 화학상을 받았다. 후쿠이는 프런티어 분자 궤도(FMO) 이론의 틀 안에서 유사한 일련의 생각들을 개발했다. 우드워드는 2년 전에 세상을 떠났기 때문에, 그의 두 번째 노벨 화학상을 받을 자격이 없었다.[6]
배경 및 용어
순환 순환 반응은 하나의 결합 및 순환 전환 상태를 통해 진행되는 유기적인 반응으로, 기하학적 구조는 (경주 및/또는 σ) 궤도 주기의 지속적인 중복을 허용한다. 궤도 대칭의 언어에서, 제품의 흥분된 상태 전자 구성과 출발 물질의 지상 상태 전자 구성의 의도된 상관관계에서 발생하는 추가적인 대칭에 의해 발생하는 에너지 장벽이 있는 경우, 순환반응은 대칭-포기입이라고 불린다.(비-비-비-비-비-비-비-비-비-비-비-비-비-비-비-비-비드)교차 규칙은 그러한 상관관계를 허용하지 않는다. 의도된 교차점에 접근하는 에너지 상승은 그럼에도 불구하고 추가적인 에너지 장벽을 초래한다.) 이러한 대칭이 가해지는 장벽이 존재하지 않는 경우, 순환순환 반응은 대칭이 허용되는 것으로 분류된다. 따라서 이 용어들은 문제의 반응이 실제로 일어날지를 암시하지는 않는다. 오히려, 다른 모든 에너지 요인이 동일하기 때문에, 대칭 포입 과정은 추가적인 에너지 장벽에 의해 방해될 것이다. 대칭에 의한 장벽은 종종 가공할 수 있지만(금지된 [2+2] 사이클로 추가의 경우 ca. 5 eV 또는 480 kJ/mol까지), 금지는 절대적이지 않으며, 다른 요인(예: 변형률 방출)이 반응에 호의적인 경우 여전히 순환 경로를 통해 대칭-불충전 반응이 일어날 수 있다. 마찬가지로 대칭 허용 반응은 궤도 대칭과 무관한 요인에서 비롯되는 극복할 수 없는 에너지 장벽에 의해 선점될 수 있다.
우드워드-호프만 규칙은 열과 광화학 제어 하에서 전기 순환 반응의 현저한 입체성을 설명하기 위해 1965년에 처음 공식화되었다. 전기사이클로스의 입체화학은 우드워드가 비타민 B를12 합성하려는 오랜 노력의 맥락에서 종합적으로 중요했으며, 합성 과정에서 이루어진 관찰은 우드워드-호프만 규칙의 제정을 고무하는 역할을 했다. 열(난방) 및 광화학(초자외선 조사) 조건 하에서 모델 시클로부텐과 부타디엔 파생상품의 상호 변환이 해당된다.[7] trans-1,2,3,4-tetramethyl-1-cyclobutene(1)의 열분해효과는 하나의 기하학적 이소머만을 제공했으며, (E,E)-3,4-디메틸-2,4-헥사디엔(2), (Z,Z)과 (E,Z) 기하학적 이소머는 혼합물에서 검출되지 않았다. 마찬가지로 시스-1,2,3,4-테트라메틸-1-사이클로부틴(3)의 열분해도 (E,Z) 이소머 4가 제공된다.[8] 두 링 오프닝 반응에서, 깨지는 ond-본드의 끝단에 있는 탄소가 같은 방향으로 회전한다.[9] 반면 광화학 활성화에 따라 반대편 입체화학 코스가 이어졌다. 관련 화합물(E,E)-2,4-헥사디엔(5)이 빛에 노출되었을 때, 전기 순환 고리 폐쇄의 결과로 시스-3,4-디메틸-1-사이클로부틴(6)이 독점적으로 형성되었다.[10] 이를 위해서는 π-system의 끝이 반대 방향으로 회전하여 새로운 σ-본드를 형성해야 한다. 열분해 6은 3과 같은 입체화학 과정을 따른다: 전기 순환 고리 개방은 (E,Z)-2,4-헥사디엔(7)[11]의 형성을 유도한다.
이 용어는 전기 순환 고리 개폐 반응과 관련된 결합 회전의 상대적 감각을 설명하기 위해 만들어졌다. 끊기거나 형성되는 결합의 양쪽 끝이 동일한 방향으로 회전할 때(시계 방향 또는 시계 반대 방향 모두 - 열 조건에서 1, 3 또는 6의 링 개방의 경우처럼) 이 과정을 conrotative라고 한다. 두 끝이 반대 방향으로 회전할 때(화학적 링 닫힘 5에서처럼 시계 반대 방향, 반시계 방향) 이 과정을 불회전이라고 한다. 일반적으로 4n 전자의 열과 (4n + 2) 전자의 광화학 전기 순환 반응은 혼합적이었고, 4n 전자의 광화학 반응과 (4n + 2) 전자의 열 전기 순환 반응은 비회전적이었던 것으로 밝혀졌다. 이러한 패턴은 1965년 우드워드(Woodward)와 호프만(Hoffmann)이 전기순환 반응의 입체화학 과정을 지배하는 핵심 원리로 궤도 대칭의 보존(아래 참조)을 제안하면서 처음 설명되었다.
결국, 일반적으로 열에 의해 촉진되는 순환 순환 반응은 전자 카운트와 궤도 상호작용의 위상에 따라 일반화된 선택 규칙의 단일 세트를 준수한다는 것이 인정되었다. 궤도 위상 또는 안면성의 핵심 개념을 도입하여 하나의 개념 체계로 여러 종류의 순환기 반응을 통일하였다. 요컨대 순환반응에서 하나의 단위로 반응하는 일련의 연속 원자와 그 관련 궤도를 성분이라고 하며, 반응 동안에 상호작용하는 궤도 로브가 각각 결절면의 반대편에 있는지 아니면 같은 쪽에 있는지 여부에 따라 각 성분은 난자 또는 초선자성이라고 한다.(구형)r 전기적 순환 고리 개폐에만 적용되는 컨트로터레이션 및 탈회전의 용어는 이 보다 일반적인 분류 체계에서 각각 한족 및 초임파성 용어로 요약된다.) 이러한 일반적인 정의에 비추어 볼 때 우드워드-호프만 규칙은 한 문장으로 간결하게 진술할 수 있다.[12]
일반화된 순환 선택 규칙. N 전자 쌍과 항난성 구성요소를 포함하는 지상 상태 순환 과정은 N + A가 홀수인 경우에만 대칭이 허용된다.
지상 상태 순환 과정은 열 에너지(즉, Δ로 상징되는 시스템 가열)의 추가에 의해 발생한다. 이와는 대조적으로, 반응제가 자외선으로 활성화되어 전자적으로 흥분된 상태로 촉진되는 경우(즉, hν로 상징되는 시스템 조사) 흥분 상태의 순환 과정이 일어난다. 그러나 광화학 조사 하에서 공식적으로 일어나는 순환 순환 반응의 작용 메커니즘은 일반적으로 이 이분법이 시사하는 것처럼 단순하거나 명확한 절단이 아니라는 점을 인식하는 것이 중요하다. 전자적 흥분은 보통 여러 가지 방법으로 가능하며, 전자적으로 흥분된 분자는 흥분 상태 순환 과정이 일어나기 전에 시스템 간 교차, 방사선 없는 붕괴 또는 불리한 평형 기하학으로 이완할 수 있다. 따라서, 조사 하에서 일어나는 많은 명백한 주기적 반응들은 실제로 일사량 중간체를 포함하는 단계적 과정으로 생각된다. 그럼에도 열에서 광화학 활성으로 전환하면 순환 선택 규칙이 뒤바뀌는 것이 자주 관찰된다. 이는 반응제 및 제품의 첫 전자 흥분 상태의 상관관계를 고려함으로써 합리화할 수 있다. 규칙보다는 유용한 휴리스틱스(huristic)에 가깝지만 광화학 순환순환 반응에 대한 일반화된 선택 원리는 다음과 같이 명시할 수 있다. N 전자쌍과 항성성분자를 포함하는 순환 과정은 N + A가 짝수라면 광화학 조건에서 선호되는 경우가 많다. 홀수의 전자를 수반하는 순환 반응도 알려져 있다. 일반화된 순환 선택 규칙의 적용과 관련하여, 이러한 시스템은 일반적으로 하나의 전자가 더 포함된 것처럼 취급될 수 있다.[13]
궤도 함수 대칭 보존의 원리가 1965년 우드워드와 호프만이 처음 개발과 일반 페리 고리 모양 선택 규칙의 1969년에 그들의 진술 사이에, 하워드 Zimmerman[14][15]와 마이클 J.S.Dewar[16][17] 동일하게 일반적 개념적 체제, Möbius-Hückel 개념이나 향이 좋은 transi으로 알려져 제안했다.tion 상태 theory는 순환계통의 반응성과 선택성을 설명하며, 후쿠이[18][19] 겐이치(福井)는 프런티어 궤도이론의 원리를 이용하여 순환계통을 분석했다. 드와르-지메르만 접근에서 궤도 오버랩의 위상(Hukel 또는 Möbius)과 시스템의 총 전자 계수(4n + 2 또는 4n)는 방향족 또는 반자동성으로 분류되는 전환 상태를 초래한다. 방향 전환 상태 이론의 언어에서 우드워드-호프만 규칙은 다음과 같이 재작성할 수 있다. 휴켈 위상이 있는 (4n + 2) 전자 또는 뫼비우스 위상이 있는 4n 전자를 포함하는 순환 전환 상태는 방향성이 있고 허용되는 반면, 뫼비우스 위상이 있는 (4n + 2) 전자 또는 뫼비우스 위상이 있는 4n 전자를 포함하는 순환 전환 상태는 반자동이며 금지된다. 반면 후쿠이 접근방식은 각 반응물질의 호모와 루모 사이의 상호작용을 분석하거나 반응물질 내에서 분석한다. HOMO-LUMO 상호작용(순 본딩 상호작용의 결과)이 건설적이고 대칭성이 허용되는 것으로 간주되는 프로세스인 반면, HOMO-LUMO 상호작용은 비구축적(취소되는 본딩 및 안티콘딩 상호작용의 결과)인 프로세스는 바람직하지 않으며 입찰 대칭성으로 간주된다. 우드워드와 호프만이 제안하고 롱게트-하이긴스 등이 명확히 한 상관 다이어그램 접근법(궤도 대칭, 비데오 초프라)은 초임파성분 4q + 2의 수와 난타성분 4r 성분수의 합이 홀수일 경우 순환반응이 허용된다는 일반적 진술로 이어졌다. 중요한 것은 개념적으로는 구별되지만 방향 전환 상태 이론(Zimmerman and Dewar), 프런티어 분자 궤도 이론(Fukui), 궤도 대칭 보존 원리(Woodward and Hoffmann)는 동일한 예측을 한다.
궤도 "대칭"은 궤도 및 상태 상관 도표를 스케치하는 도구로 사용되지만, 대칭 원소의 절대 유무는 반동이 허용되는지 금지되는지 여부를 결정하는 데 중요하지 않다. 즉, 대칭면이나 축(예: 메틸 그룹)을 공식적으로 교란시키는 단순한 대체물의 도입은 일반적으로 반응이 허용되는지 금지되는지의 평가에 영향을 미치지 않는다. 대신, 미신격 아날로그에 존재하는 대칭은 궤도 상관 다이어그램의 구성을 단순화하고 계산을 수행할 필요가 없도록 하기 위해 사용된다.[20] 오직 궤도 사이의 위상 관계만이 어떤 반응이 "대칭성" 허용인지 금지인지를 판단할 때 중요하다. 더욱이, 대칭 원소가 보존되지 않더라도 궤도 상관관계는 여전히 만들어질 수 있다. (예를 들어, 1,5-시방성 이동과 에네 반응). 이러한 이유로, 우드워드-호프만, 후쿠이, 드워-짐머만 분석의 적용가능성은 동일하지만, 분석하고자 하는 반응에 따라 특정 접근법이 다른 접근법보다 적용하기 쉬우거나 직관적일 수 있다.
오리지널 제형
Woodward-Hoffmann 규칙은 열(열 반응) 또는 빛의 적용(화학적 반응)에 의해 개방 체인 결합 폴리엔의 끝에서 전기-순환 고리 개방 및 링 클로징 반응의 관측된 입체성을 설명하기 위해 처음으로 실행되었다.
1965년 초판에서는 실험 증거와 분자 궤도 분석에서 증류된 세 가지 규칙이 다음과 같이 나타났다.[21]
- 4n π 전자를 포함하는 오픈 체인 시스템에서, 가장 많이 점유된 분자 궤도 궤도 대칭은 끝 사이의 결합 상호작용이 시스템의 반대 면에 있는 궤도 외피 사이에 중첩을 수반해야 하며, 이는 응축 과정에서만 달성될 수 있다.
- (4n + 2) π 전자를 포함하는 개방 시스템에서, 지상 상태 분자 내의 단자 본딩 상호작용은 시스템의 같은 면에 있는 궤도 봉투의 중첩을 필요로 하며, 이는 오직 탈회성 변위만으로 달성할 수 있다.
- 광화학 반응에서 반응물질의 HOMO에 있는 전자는 흥분된 상태로 촉진되어 말단 대칭 관계와 입체성이 역전된다.
이 제형을 사용하면 아래 그림에 표시된 대체 부타-1,3-다이엔의 전기 순환 링 클로징의 입체감을 이해할 수 있다. Buta-1,3-diene은 접지 상태에 4 -electron을 가지고 있으며, 따라서 결합 링 클로징 메커니즘을 통해 진행된다. (우드워드-호프만 규칙은 순환 과정을 위한 평형 위치에 대해 아무 것도 말하지 않는다. 사이클로부텐 부타디엔의 경우 평형은 오른쪽으로 멀리(링 개방) 있고, 사이클로헥사디엔 헥사틴의 경우 평형은 왼쪽으로 멀리(링 폐쇄) 있다. 일반성을 상실하지 않는 한 여기의 모든 분석은 링 클로징 방향으로 수행된다.)
반대로 아래 그림에 표시된 대체 헥사-1,3,5-트리엔의 전기 순환 링 클로즈에서 반응은 탈회전 메커니즘을 통해 진행된다.
광화학적으로 구동되는 부타-1,3-diene의 전기순환 고리 폐쇄의 경우, 전자 프로모션으로 인해 가 HOMO가 되고 반응 메커니즘이 불활성화되어야 한다.
이 규칙들을 따르는 유기적인 반응은 대칭성이 허용된다고 한다. 반대 방향으로 가는 반응은 대칭성이 금지되어 있고, 만약 그것들이 조금이라도 일어난다면 실질적으로 더 많은 에너지가 필요하다.
상관 다이어그램
롱구엣-하이긴스와 E. W. Abrahamson에서 알 수 있듯이, 우드워드-호프만 규칙은 주어진 반응의 상관관계도를 조사하여 도출하는 것이 가장 좋다.[22][13][23][24] 대칭 요소는 대칭 연산과 관련하여 물체가 대칭인 기준점(대개 평면 또는 선)이다. 대칭 요소가 반응 메커니즘(반응, 전이 상태, 제품) 전체에 걸쳐 존재하는 경우 보존된 대칭 원소라고 한다. 그런 다음, 반응 전체에서 이 원소에 대한 분자 궤도의 대칭성을 보존해야 한다. 즉, 시작 물질에서 대칭 원소와 관련하여 대칭인 분자 궤도는 제품의 해당 원소와 대칭적으로 (변환) 궤도와 상관되어야 한다. 반대로, 보존된 대칭 요소에 대한 대칭성은 동일한 문장으로 유지된다. 분자 궤도 상관 도표는 대칭 보존에 기초하여 시작 물질과 제품의 분자 궤도를 상관시킨다. 분자 궤도 상관관계 다이어그램에서 제품의 전자 상태와 반응물질의 전자 상태(즉, 지상 상태 및 흥분 상태)를 상호 연관시키는 전자 상태 상관관계 다이어그램을 구성할 수 있다. 그런 다음 상관관계도를 사용하여 전환 상태 장벽의 높이를 예측할 수 있다.[25]
전기순환반응
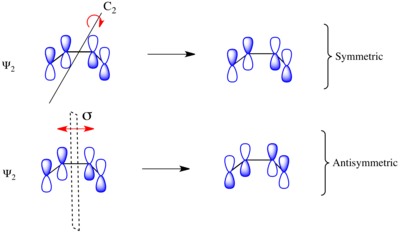
대체된 1,3-부타디엔의 전기 순환 링 폐쇄를 고려할 때, 이 반응은 콘로터 또는 불회전 반응 메커니즘을 통해 진행될 수 있다. 왼쪽에 보이는 것처럼, 결합 전이 상태에는 대칭의 C축이2 있고, 탈환 전이 상태에는 대칭의 σ 거울면이 있다. 출발 물질과 생산물의 궤도를 상관시키기 위해서는 분자 궤도가 이러한 대칭 원소와 관련하여 대칭인지 대칭인지 대칭인지 판단해야 한다. 부타디엔의 π계 분자 궤도는 대칭인 대칭 원소와 함께 오른쪽에 나타난다. 그들은 다른 것에 대해 비대칭이다. 예를 들어, 1,3-부타디엔의 ψ은2 C축에2 대한 180o 회전과 관련하여 대칭이며, 거울 평면에 반사되는 것과 관련하여 대칭이다.
symmetry과1 ψ은3 대칭 변환 하에서 p-오르비탈 로브의 기호가 보존되기 때문에 거울 평면에 대해 대칭이다. 마찬가지로 ψ과1 ψ은3 회전이 p-오르비탈 로브의 기호를 균일하게 반전시키기 때문에 C축과2 관련하여 대칭성이 없다. 반대로 ψ과2 ψ은4 C축에2 대하여 대칭이고 σ 미러 평면에 대하여 대칭이다.
사이클로부틴의 분자궤도에 대해서도 동일한 분석을 실시할 수 있다. 각 MO에 대한 양쪽 대칭 연산의 결과는 왼쪽에 표시된다. σ과 σ* 궤도는 전체적으로 to에 수직인2 C를 포함하는 평면에 위치하기 때문에 양쪽 대칭 원소에 대해 균일하게 대칭적이고 대칭성이 없는(존중하게)이다. 반면 π은 반사에 대해서는 대칭이고 회전에 대해서는 대칭이며, π은* 반사에 대해서는 대칭이고 회전에 대해서는 대칭이다.
보존된 대칭 원소에 대해 동일한 대칭성을 갖는 생성물과 시작 재료의 분자 궤도를 연결하기 위해 상관선을 그린다. 1,3-부타디엔의 4 전자 전기 순환 링 폐쇄의 경우, 가장 낮은 분자 궤도 ψ은1 C2 축에 관한 비대칭(A)이다. 그래서 이 분자궤도는 C축에2 관해서도 (A)인 가장 낮은 에너지궤도인 사이클로부텐의 π 궤도(cyclobutene)와 상관관계가 있다. 마찬가지로, C축과 관련하여2 대칭(S)인 ψ은2 사이클로부텐의 σ과 상관관계가 있다. 최종 두 개의 상관관계는 대칭(A) 분자궤도 ψ과3 σ*, 대칭(S) 분자궤도 ψ과4 π* 사이에 있다.[13]
마찬가지로, 탈곡 메커니즘에 대한 상관관계 도표가 존재한다. 이 메커니즘에서 전체 메커니즘에 걸쳐 지속되는 대칭 요소는 reflection 거울 반사면이다. 여기서 가장 낮은 에너지 MO ene 1,3-부타디엔은1 반사면에 관해서 대칭이며, 따라서 사이클로부틴의 대칭 ric MO와 상관관계가 있다. 이와 유사하게 대칭 분자 궤도 and과3 π의 높은 에너지 쌍은 상관관계가 있다. 비대칭 분자 궤도에 대해서는 ψ과4 σ과* 같이 낮은 에너지 쌍 ψ과2 π이* 상관 쌍을 형성한다.[13]
두 메커니즘을 평가하면, 반응물질의 지상주 궤도(Ⅱ와1 ψ2)에서 제품의 지상주 궤도(σ地對地對道, π)로 전자를 변환하기 때문에(σ and, π)가 더 낮은 장벽을 가질 것으로 예측된다. 반대로, 탈곡 메커니즘은 forces1 궤도 궤도 변환을 σ 궤도, ψ2 궤도 궤도 변환을 π* 궤도 진입으로 강제한다. 따라서 지상주 ψ2 궤도상에 있는 두 전자는 흥분된 항균 궤도궤도에 전달되어 두 배로 흥분된 사이클로부틴 전자 상태를 생성한다. 이것은 반작용에 대한 과도기 상태의 장벽을 현저히 높게 이끌 것이다.[13]
그러나 분자 궤도가 분리되어 있는 것이 아니라 전자 상태 사이에 반응이 일어나기 때문에 최종 분석은 주 상관관계도를 포함한다. 상태 상관 도표는 시작 재료와 제품에서 전자 상태의 전체적인 대칭성을 연관시킨다. 지상 상태 1,3-부타디엔은 위와 같이 ψ에는1 2개의 전자가, ψ에는2 2개의 전자가 있으므로 ψψ로 표현된다.1222 국가의 전체 대칭은 이중으로 채워진 궤도상에 대한 다중성을 가진 각 채워진 궤도 대칭의 산물이다. 따라서 ψ은1 C축에2 대하여 비대칭이며 ψ은2 대칭이므로 총 상태는 AS로22 나타낸다. 이 특정 제품이 수학적으로 전체 S인 이유를 확인하기 위해 S는 (+1)로, A는 (-1)로 나타낼 수 있다. 이는 p-orbitals의 로브 기호가 대칭 변환에 대해 대칭이면 (+1)으로 곱하고 대칭 변환에 관해서 대칭이면 (-1)로 곱하는 사실에서 유래한다. 따라서 AS22=(-1)(+21)=+21=S. 첫 번째 흥분 상태(ES-1)는 HOMO에서 루모로 전자를 촉진하는 것에서 형성되어 ψψψ로 표현된다.1223 ψis A, ψ은2 S, ψ은3 A이므로 이 상태의 대칭은 ASA2=A에 의해 주어진다.
이제 제품의 전자 상태인 사이클로부테네를 고려하면, 지상 상태는 대칭 SA22=S를 갖는 σπ에22 의해 주어진다. 첫 번째 흥분 상태(ES-1')는 다시 HOMO에서 루모로 전자를 촉진하는 것으로 형성되므로, 이 경우 σππ로2* 표현된다. 이 상태의 대칭은 SAS2=A이다.
지상 상태 Ⅱψ 1,3-부타디엔은 위의 MO 상관관계 다이어그램에서 입증된 바와 같이 사이클로부텐의 지상 상태 σπ과22 상관관계가 있다. ψ은1 π과 상관관계가 있고 ψ은2 σ과 상관관계가 있다. 따라서 ψψ을 구성하는 궤도들은 반드시 σ22 up을 구성하는 궤도들로 변모해야 한다. 단, 분자 궤도상관도에서 볼 수 있는 대칭-필수 하에서는 분자궤도가 서로 변형되지 않기 때문에 상태 ES-1'과 상관관계가 없다. 대신 ψ은1 π과 상관관계가 있고, ψ은23* with과 상관관계가 있기 때문에 πψ 상태는 πσ과 다른 흥분상태인 πσ로2* 변신을 시도한다. 그래서 ES-1은 ES-2'=σπσσ2*'보다 에너지가 높은 ES-2'=σπσσ과 상관관계를 시도한다. 마찬가지로 ES-1'=1998년2* ES-2=1998년 ES-2=1998년 ES-2와 상관관계를 시도한다.1224 이러한 상관관계는 회피된 교차 규칙으로 알려진 양자-기계적 규칙 때문에 실제로 일어날 수 없다. 이것은 동일한 대칭의 에너지 구성이 에너지 수준 상관 관계 도표에서 교차할 수 없다고 말한다. 간단히 말해서, 이것은 에너지에 충분히 가까이 왔을 때 동일한 대칭 상태를 혼합하여 발생한다. 그래서 대신에 ES-1을 ES-1로 강제 변환하는 사이에 높은 에너지 장벽이 형성된다. 아래 다이어그램에서 대칭 선호 상관 관계는 점선으로 표시되며 굵은 곡선 선은 높은 에너지 장벽과의 실제 상관 관계를 나타낸다.[13][25]
동일한 분석을 탈회 메커니즘에 적용하여 다음과 같은 상태 상관 도표를 작성할 수 있다.[13][25]
따라서 분자가 지면 상태일 경우 전자 장벽을 피하기 위해 응축 메커니즘(즉, 열 제어 하에서)을 통해 진행된다. 그러나 분자가 첫 번째 흥분 상태(즉 광화학 제어 하에서)에 있는 경우, 전자 장벽이 응축 메커니즘에 존재하며, 그 반응은 탈회성 메커니즘을 통해 진행될 것이다. 이러한 것들이 완전히 구별되는 것은 아니다. 두 개의 결합 메커니즘이 동일한 잠재적 표면에 놓여 있기 때문이다. 따라서 보다 정확한 설명은 접지 상태 분자가 잠재적 에너지 표면을 탐사함에 따라 활성 장벽을 달성하여 응축 메커니즘을 거칠 가능성이 더 높다는 것이다.[25]
사이클로어 추가 반응
우드워드-호프만 규칙은 또한 상관 도표를 통한 2분자 사이클로어 추가 반응을 설명할 수 있다.[26] [πp + q] 사이클로어데이션은 p π 전자와 q q 전자와 함께 다른 두 구성 요소를 결합한다. 사이클로어드 추가 반응은 각각의 π 성분과 관련하여 초선형(s) 또는 황색(a)으로 더욱 특징지어진다. (모든 순환 과정에 대한 WH 표기법의 일반화에 대한 자세한 설명은 아래의 "일반 공식"을 참조하십시오.)
[2+2] 사이클로어딕션
[2+2] 사이클로어데이션에는 π[2s + 2s], π[2a + 2s], π[2s + 2], π[2a + 2a], [2 + 2a] 등 4가지 화학적 결과가 있을 수 있다. 열 조건에서는 기하학적으로 가장 그럴듯한 π[2s + 2s] 모드가 금지되는 반면 [2as + 2s]π 접근법은a π대칭의 관점에서 허용되지만 불리한 변형과 강직 프로파일로 인해 드물다는 것이 나타날 것이다.[13] 반면 광화학 활성화 하에서는 [2+2] 사이클로아드가 일반적이다.
[π2s + 2s] 사이클로 추가 고려. 이 메커니즘은 오른쪽 그림처럼 제품에 입체화학이 유지되도록 한다. 출발 물질에는 전환 상태와 제품 두 가지 대칭 원소가 있다: σ과1 σ2. σ은1 p-오르비탈에 직각인 성분들 사이의 미러 면이다; σ은2 분자를 σ-본드에 직각으로 반분한다.[26] 이 두 가지 요소는 성분이 동일하지 않은 경우 국소대칭 요소들이다.
σ과1 σ에2 관한 대칭과 비대칭을 결정하기 위해서는 출발 물질 분자 궤도를 동시에 고려해야 한다. 오른쪽 그림은 π[2s + 2s] 사이클로어 추가에 대한 분자 궤도 상관관계도를 나타낸다. 출발 물질의 2 two과 π* 분자 궤도는 1 σ과1 그 다음 σ에2 대해 대칭이 되는 것이 특징이다. 마찬가지로 제품의 molecular과 σ* 분자 궤도는 대칭으로 특징지어진다. 상관 도표에서, 반응 과정에 걸친 분자 궤도 변환은 분자 궤도의 대칭을 보존해야 한다. 따라서 π은SS σ과SS 상관관계, ,은AS with과*AS 상관관계, π은*SA σ과SA 상관관계, 마지막으로 π은*AA σ과*AA 상관관계다. 궤도 대칭의 보존 때문에 본딩 궤도 orbital은AS 항균 궤도 σ과*AS 상관할 수밖에 없다. 따라서 높은 장벽이 예측된다.[13][25][26]
이것은 아래의 상태 상관 관계 도표에서 정밀하게 작성된다.[13][25] 어디 πSS과 πAS 주(SS)2(AS)2 즉 둘 다 두배로 인구가 밀집되어 있는 –은 시동 재료의 접지 상태는 전자 상태.그렇게, 이 주 둘 다 σSS과 σ*AS 두배로 주(SS)2(AS)2 즉 – 인구가 밀집되어 있는 해당 상품에 대한 전자 상태와 관련되려고 시도한다.cy의 neither 기저 상태(SS)2(SA)2 하지만, 이 상태다.클로부탄도 아니고, 첫 번째 흥분 상태 ES-1'=(SS)(2SA)(AS)도 아니다. 여기서 전자는 호모에서 루모로 승격된다. 따라서 반응 물질의 지상 상태는 두 번째 흥분 상태 ES-2'=(SS)(2AS)와 상관관계를 시도한다.2
마찬가지로, 위의 분자 궤도 다이어그램에서 볼 수 있는 것처럼, 제품 사이클로부탄의 접지 상태는 σ과SS σ이SA 모두 이중으로 채워지는 전자적 상태, 즉 상태(SS)(SA)2이다.2 이는 π과SS π이*SA 모두 이중으로 채워진 상태, 즉 두 번째 흥분된 상태 ES-2=(SS)(SA)2와 상관관계를 갖기 위한 시도다.2
마지막으로, 출발 재료의 첫 번째 흥분 상태는 전자 구성으로 π이SS 이중으로 채워지고, π과AS π은*SA 둘 다 단독으로 점유된다. 즉, 상태(SS)(2AS)(SA)이다. 제품의 첫 번째 흥분 상태는 σ이SS 이중으로 채워져 있고, σ과SA σ이*AS 둘 다 단독으로 점유되어 있기 때문에 상태(SS)(2SA)(AS)이기도 하다. 그러므로 이 흥분된 두 상태는 상관관계가 있다.
출발 물질의 지상 상태는 전체적인 동일한 대칭을 가진 상태들로 인해 중간에 교차되지 않는 교차점이 있기 때문에 두 번째 흥분 상태와 상관관계를 시도한다. 따라서 실제로 반응제의 지상 상태는 높은 에너지 장벽을 달성한 후에야 제품의 지상 상태로 전환된다. 그러나 반응제가 첫 번째 흥분 상태에 있다면 큰 활성화 장벽은 없다. 따라서 이 반응은 광화학 제어에서는 쉽게 진행되지만 열 제어에서는 반응에 대한 장벽이 매우 높다.
[4+2] 사이클로어딕션
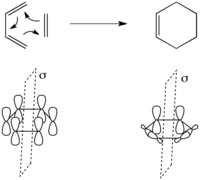
[4+2] 사이클로어데이션은 Diels-Alder 반응에 의해 예시된 조합된 2-성분 순환 순환 반응이다. 가장 간단한 경우는 1,3-부타디엔과 에틸렌의 반응으로 왼쪽에 보이는 사이클로헥센을 형성하는 것이다.
이 변환에는 단 하나의 보존된 대칭 원소가 있다. 즉 왼쪽에 보이는 반응제 중심을 통과하는 거울 평면이다. 이것으로부터 우리는 반응물질의 분자 궤도의 대칭을 아주 간단하게 할당할 수 있다. 반응물질의 분자궤도는 에틸렌의 π1, π2*, π, ψ3, ψ4}과 함께 위에 나타낸 1,3부타디엔의 분자궤도 집합에 불과하다. ψ은1 대칭, ψ은2 대칭, ψ은3 대칭, ψ은 대칭, ψ은4 대칭이다. 마찬가지로 π은 대칭이고 π은* 거울 평면에 대하여 대칭이다.
제품의 분자궤도는 아래와 같이 새로 형성된 두 개의 σ 및 σ* 본드와 π* 본드의 대칭 및 대칭적 결합이다.
같은 대칭의 시작 물질과 생산물의 궤도 쌍을 상관시키고 에너지를 증가시키면 상관 도표가 오른쪽에 나타난다. 이것은 시작 물질의 분자 궤도를 제품의 지반 상태 결합 궤도로 대칭 보수적인 방식으로 변환하므로 위의 지반 상태[2+2] 반응에 존재하는 큰 에너지 장벽이 없을 것으로 예측된다.
분석을 정밀하게 하기 위해 일반 [4+2]-사이클로 추가에 대한 상태 상관 도표를 작성할 수 있다.[25] 이전과 같이, 지면 상태는 오른쪽의 분자 궤도 상관 관계 도표에 묘사된 전자 상태 입니다. 이것은 총대칭 SS22 A2=S의 ψπ로12222 설명할 수 있다. 이것은 또한 SSA222=S인 사이클로헥센 σσ의SA2 지상 상태와 관련이 있다. 이와 같이 지상 상태 반응은 높은 대칭으로 인한 장벽이 있을 것으로 예측되지 않는다.
또한 위에서와 같이 흥분 상태의 상관관계를 구성할 수 있다. 여기서, 아래와 같이 회피된 교차점 때문에 초임파적-초임파적 결합 위상하에서의 광 유도 디엘-알데르 반응에 대한 높은 에너지 장벽이 있다.
그룹 전이 반응
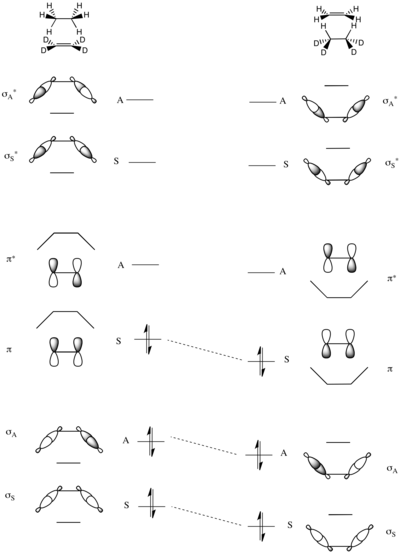
집단 전달 반응의 대칭에 의해 좌우되는 장애물 높이도 상관 도표를 사용하여 분석할 수 있다. 모델 반응은 한 쌍의 수소 원자가 에탄에서 오른쪽으로 보이는 페르데우테리오에틸렌으로 전달되는 것이다.
이 반응에서 유일하게 보존된 대칭 원소는 왼쪽에 보이는 것처럼 분자의 중심을 통과하는 거울 평면이다.
계통의 분자 궤도는 에탄의 σ과 σ* C–H 결합과 디우테로 대체된 ethene의 σ과 π의 σ과 π* 결합의 대칭적이고 대칭적인 조합으로 구성된다. 따라서 가장 낮은 에너지 MO는 두 개의 C-H σ-bond (σS)의 대칭 합이고, 그 다음에 대칭 합 (σA)이 된다. 가장 높은 두 개의 에너지 MO는 σCH 항성의 선형 결합으로 형성된다. 가장 높은 것은 약간 낮은 에너지에서 대칭 σ이*A 앞에 있는 대칭 σ이다*A. 정력적인 규모의 중간에는 에테네의 of과CC π인*CC 두 개의 남은 MO가 있다.
전체 분자 궤도 상관관계 도표는 위에서 설명한 총 에너지 증가의 대칭 MO와 비대칭 MO 쌍을 일치시켜 에 생성된다. 인접한 도표에서 볼 수 있듯이 반응물질의 본딩 궤도는 제품의 본딩 궤도와 정확히 상관관계가 있으므로, 이 반응은 높은 전자 대칭에 의한 장벽을 가지고 있다고 예측되지 않는다.[13][25]
선택 규칙
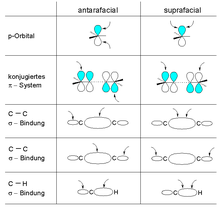
상관 도표를 사용하면 다음과 같은 일반화된 종류의 순환 반응에 대한 선택 규칙을 도출할 수 있다. 이러한 각각의 특정 계층은 일반화된 우드워드-호프만 규칙에서 더욱 일반화된다. 보다 포괄적인 본드 위상 설명자는 난타민족과 초임파적 표현은 각각 혼성적 표현과 불성실적 표현이라는 용어를 사용하게 된다. 안타라프티컬은 system계, p 궤도, σ 본드의 반대쪽 면을 만들거나 뚫는 것을 말하며, 초대칭은 같은 얼굴을 통해 발생하는 과정을 가리킨다. 치랄 중심에서 초선형 변환은 입체화학성을 보존하는 반면, 안타성 변환은 입체화학성을 역전시킨다.
전기순환반응
전기 자전거 반응의 선택 규칙은 우드워드-호프만 규칙의 원문에 제시되어 있다. 일반화된 전기 순환 고리 폐쇄가 4n π 전자의 폴리에네에서 발생하는 경우, 열 조건에서는 응축되고 광화학 조건에서는 불활성화된다. 반대로 4n + 2 π 전자의 폴리엔에서, 전기 순환 고리 폐쇄는 열 조건에서 탈회하고 광화학 조건에서는 환회한다.
이 결과는 폴리엔의 HOMO의 p 궤도 로브 기호에 기초한 FMO 분석이나 상관관계 도표를 통해 도출될 수 있다. 첫 번째 가능성을 생각해 보면, 지상 상태에서 폴리에네가 4n 전자를 가지고 있다면, 전기사이클링된 제품에서 in 결합을 형성하는 호모의 바깥쪽 p-orbital은 반대 신호들이다. 따라서 건설적 중첩은 오직 화합적/반핵적 과정에서만 발생한다. 반대로 4n + 2 전자를 가진 폴리엔의 경우, 접지 상태 HOMO의 외부 p-orbitals는 같은 부호다. 따라서 건설적인 궤도 중첩은 불순물/초기물적 과정과 함께 발생한다.[21]
또한, 4n 전기 순환 반응에 대한 상관 도표는 1,3-부타디엔의 4 전자 사이클링 도표와 유사하며, 4n + 2 전자 전기 사이클링 도표는 1,3,5-헥사트리엔의 6 전자 사이클링에 대한 상관 도표와 유사할 것이다.[13]
이는 다음 표에 요약되어 있다.
| 열적 허용 | 광화학적으로 허용되는 | |
|---|---|---|
| 4n | 혼음사의 | 불멸의 |
| 4n + 2 | 불멸의 | 혼음사의 |
시그마티방성 재배열 반응
일반적인 시그문방성 재배열은 순서[i,j]로 분류할 수 있는데, 이는 하나 이상의 π계통에 인접하여 원래 1과 1을 나타내는 원자 사이의 σ 결합이 원자 i와 j 사이에 이동되는 것을 의미한다. 따라서 원자는 원래 위치에서 멀어진다(i - 1), (j - 1) 원자는 이동한다.
일반적으로 전환 상태에는 대칭 요소만 존재하기 때문에, 상관 도표를 통한 형식 대칭 분석은 시그마티방성 재배열 연구에 유용하지 않다. 특별한 경우(예: [3,3]-재범)를 제외하고, 반응 좌표를 통과할 때 보존되는 대칭 요소는 없다.[13][25] 그럼에도 불구하고 출발 물질과 제품의 궤도 상관관계는 여전히 분석할 수 있으며, 출발 물질 궤도 및 높은 에너지 제품 궤도와의 상관관계는 평상시처럼 "대칭-강제" 과정을 초래할 것이다. 그러나 FMO 기반 접근법(또는 Dewar-Zimmerman 분석)은 적용하기가 더 쉽다.
가장 보편적인 기호성 이동의 종류 중 하나는 [1,j]로 분류되는데, 여기서 j는 홀수다. 즉, σ-본드 마이그레이션(j - 1) 본드 결합의 한 종단부는 system-시스템에 걸쳐 멀어지고 다른 종단부는 이동하지 않는다는 것을 의미한다. 그것은 π계로부터 j + 1 전자: j - 1, --본드에서 2를 포함하는 반응이다. Using FMO analysis, [1,j]-sigmatropic rearrangements are allowed if the transition state has constructive overlap between the migrating group and the accepting p orbital of the HOMO. In [1,j]-sigmatropic rearrangements if j + 1 = 4n, then supra/antara is thermally allowed, and if j + 1 = 4n + 2, then supra/supra or antara/antara is thermally all빚진[25]
다른 일반적인 분류 체계적 재배열은 [3,3]이며, 특히 Cope와 Claisen 재배열이다. 여기서, 건설적인 상호작용은 전환국가의 두 동맹 급진파 조각들의 호모들 사이에 있어야 한다. alliel 파편의 지상주 HOMO Ⅱ는2 아래와 같다. 단자 p-orbitals는 반대 기호에 있으므로, 이 반응은 초라/초프라 위상 또는 안타라/안타라 위상에서 발생할 수 있다.[25]
[i,j]-시방성 재배치의 선정 규칙은 다음과 같다.
- 초프라/초프라 또는 안타라/안타라[i,j]-시그마틱스 이동의 경우 i + j = 4n + 2일 경우 열적으로 허용되고 i + j = 4n일 경우 광화학적으로 허용된다.
- 초프라/antara[i,j]-시방성 이동의 경우 i + j = 4n이면 열적으로, i + j = 4n + 2이면 광화학적으로 허용된다.
이는 다음 표에 요약되어 있다.
| i + j | 열적 허용 | 광화학적으로 허용되는 |
|---|---|---|
| 4n | isas + j 또는a i + j | isaa + j 또는s i + j |
| 4n + 2 | isaa + j 또는s i + j | isas + j 또는a i + j |
사이클로어 추가 반응
일반 [p+q]-사이클로어데이션은 두 구성 요소 사이에 결합된 추가 반응으로, 하나는 p π 전자와 다른 하나는 q elect 전자와 함께 한다. 이 반응은 다음과 같은 조건에서 허용되는 대칭이다.[13]
- Supra/supra 또는 Antara/antara/cycloaddition의 경우 p + q = 4n + 2이면 열적으로 허용되고 p + q = 4n이면 광화학적으로 허용된다.
- 초왕/안타라 사이클로어데이션의 경우 p + q = 4n이면 열적으로, p + q = 4n + 2이면 광화학적으로 허용된다.
이는 다음 표에 요약되어 있다.
| p + q | 열적 허용 | 광화학적으로 허용되는 |
|---|---|---|
| 4n | psa + qa 또는 p + qs | psa + qs 또는 p + qa |
| 4n + 2 | psa + qs 또는 p + qa | psa + qa 또는 p + qs |
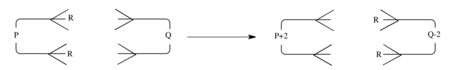
그룹 전이 반응
동기식인 일반 이중 그룹 전송 반응은 그림과 같이 p π 전자를 가진 성분과 q π 전자를 가진 성분 사이의 상호 작용으로 나타낼 수 있다.
그러면 선택 규칙은 일반화된 사이클로어 추가 반응과 동일하다.[13] 그것은
- Supra/supra 또는 Antara/antara/antara 이중 그룹 전송의 경우, p + q = 4n + 2일 경우 열적으로 허용되며, p + q = 4n일 경우 광화학적으로 허용된다.
- Supra/antara 이중 그룹 전송의 경우, p + q = 4n이면 열적으로, p + q = 4n + 2이면 광화학적으로 허용된다.
이는 다음 표에 요약되어 있다.
| p + q | 열적 허용 | 광화학적으로 허용되는 |
|---|---|---|
| 4n | psa + qa 또는 p + qs | psa + qs 또는 p + qa |
| 4n + 2 | psa + qs 또는 p + qa | psa + qa 또는 p + qs |
q = 0의 경우는 "전송된" R 그룹의 열 제거에 해당한다. 각각 1,4-사이클로헥사디엔과 3,3,6-테트라메틸-1,4-사이클로헥사디엔에서 탈수소 및 에탄의 발열 제거가 이러한 유형의 순환 과정의 예를 나타낸다는 증거가 있다.
ene reaction은 종종 두 개의 σ-결합 그룹의 이전을 수반하지 않더라도, 집단 이체 과정의 한 종류로 분류된다. 오히려 σ본드는 1개만 이관되고, broken본드는 깨진 b본드에서 2번째 σ본드는 형성된다. 6개의 전자가 포함된 모든 초선형 공정으로서, 그것은 열 조건에서 대칭성이 허용된다. ene 반응에 대한 Woodward-Hoffmann 기호는 [π2ss + 2s]이다(아래 참조).
일반 제형
우드워드-호프만 규칙은 처음에는 전기적 순환 과정 측면에서 명시되었지만, 결국 위의 선택 규칙의 유사성과 패턴이 나타내야 하는 것처럼 모든 순환 반복 반응으로 일반화되었다.
일반화된 우드워드-호프만 규칙에서, 모든 것은 난인종과 초선종적 결합 토폴로지의 관점에서 특징지어진다. 회절과 불회절이라는 용어는 오른쪽 그림처럼 전기 순환 고리 닫힘 또는 개방 반응에서 결합 회전의 상대적 감각을 설명하기에 충분하다. 그러나 그것들은 일반적인 순환 순환 반응에서 발생하는 결합 형성 및 파괴의 토폴로지를 설명하기에는 적합하지 않다. 아래에 자세히 기술된 바와 같이, 우드워드-호프만 규칙의 일반적인 공식화에서, 결합 회전 용어는 각각 결합 위상(또는 안면성) 용어와 초선성 용어로 요약된다. 이 설명자들은 어떤 순환 과정에서도 발생하는 결합 형성 및 파괴의 위상 특성을 나타내는 데 사용될 수 있다.
우드워드-호프만 표기법
성분은 순환 반응에서 하나의 단위로서 기능하는 분자나 분자의 어떤 부분이다. 성분은 하나 이상의 원자와 다음과 같은 유형의 관련 궤도로 구성된다.
- 분리된 p- 또는 sp-orbitalx(채우지 않거나 채우지 않음, 기호 Ω)
- 결합 π 시스템(심볼 π)
- A σ 본드(기호 σ)
성분의 전자 카운트는 성분의 궤도 내에 있는 전자 수입니다.
- 채워지지 않은 Ω 궤도(즉, 빈 p 궤도)의 전자 카운트는 0인 반면 채워진 Ω 궤도(즉, 외로운 쌍)의 전자 카운트는 2이다.
- n 이중 결합이 있는 결합 system 시스템의 전자 카운트는 2n(또는 이형 원자 또는 카르바니온의 (공식) 단독 쌍이 결합되는 경우 2n + 2이다.
- σ 본드의 전자 카운트는 2이다.
구성요소의 결합 위상은 초선형 및 한태형일 수 있다.
- π계통 또는 p 궤도와의 상호작용이 목도면의 같은 면(생각의 동기화)에서 발생할 때 관계는 초선형(심볼:s)이다. σ 결합의 경우, 그것은 결합의 두 "내부" 로브 또는 두 "외부" 로브에서 발생하는 상호작용에 해당한다.
- π계 또는 p 궤도와의 교호작용이 결절면의 반대편(생각 반대)에서 발생할 때 그 관계는 한탄(기호: a)이다. σ 결합의 경우, 그것은 결합의 한 "내측"엽과 한 "외측"엽에서 발생하는 상호작용에 해당한다.
이 표기법을 사용하면 모든 주기적 반응에 대해 설명자를 할당할 수 있는데, 일련의 기호s/a N으로 구성되며, + 부호로 연결되고 괄호로 둘러싸이며, 각 성분에 관련된 궤도 유형, 전자 수, 결합 위상 등을 순서대로 기술한다. 다음과 같은 예시를 들 수 있다.
- Diels-Alder 반응 (a (4+2)-cycloaddition)은 [π4s + 2s]이다.
- 오존과 올레핀의 1,3극성 사이클로어데이션 (a (3+2)-사이클로데이션)은 π[4ss + 2]이다.
- 1,3부타디엔 (a (4+1)-첨가성 첨가)에 이산화황의 첨가는 ω[0a + 4s] + [ω2s + 4s][27]이다.
- Cope 재배열([3,3]-시방성 이동)은 π[2s + 2ss] 또는 π[2as + 2 + 2a]이다.
- [1,3]-알킬 이동은 Berson에 의해 발견된 탄소에서 역전을 갖는 이동([1,3]-시방성 이동)σ은 [2a + 2s]이다.
- 1,3-부타디엔 (4㎛ 전기사이클링)의 응축 전기 순환 링 클로징은 [π4a]이다.
- 사이클로부텐(역방향 4㎛ 전기사이클링)의 회전식 전기순환 고리 개방은 σ[2a + 2s] 또는 σ[2s + 2a]이다.
- 1,3-사이클로크타디엔-5이상의 음이온의 탈회전기순환 고리 폐쇄는 [π6s]이다.
- 탄수화물의 바그너-메르바인 시프트(A [1,2]-시방성 시프트)ω는s [0s + 2]이다.
안타르족과 초선종은 각각 (변환/반전) 및 (변환/보존)과 연관되어 있다. 단일 설명자는 화학적으로 구별되는 두 개의 순환 과정과 일치할 수 있으며, 어떤 반응과 그것의 미시적인 역이 종종 두 개의 다른 설명자로 설명되며, 하나의 과정이 한 개 이상의 정확한 설명자를 가질 수 있다. 아래에 제시된 순환 선택 규칙을 사용하여 이러한 모든 반응이 허용되는지 확인할 수 있다.
원문
1969년 우드워드 주와 호프만 주는 이 표기법을 사용하여 모든 주기적 반응에 대한 일반적인 공식화를 다음과 같이 검토한다.
지상 상태 주기적 변화는 (4q+2) s및 (4r)a 성분의 총 수가 홀수일 때 대칭이 허용된다.[13]
여기서 (4q + s2)와 (4r)a는 각각 초임파 (4q + 2) 전자와 난타 (4r) 전자 성분을 가리킨다. 또한, 이 기준은 필요한 만큼(위에서 명시적으로 언급하지 않은 경우: if 및 if만) 충분하고 필요한 것으로 해석되어야 한다.
대체 문장의 파생
또는, 일반 문장은 2개의 경우를 직접 분석하여 단순 불분명한 규칙을 사용하여 전자 총수의 관점에서 공식화할 수 있다.
첫째, 전자의 총수가 4n + 2인 경우를 고려한다. 그러면 우리는 쓸 수 있다.
- 4n + 2 = a(4q + 2)s + b(4p + 2)a + c(4t)s + d(4r)a,
여기서 a, b, c 및 d는 각 성분 유형의 수를 나타내는 계수다. 이 방정식은 a와 b가 짝수이거나 둘 다 홀수인 경우, 4개 항의 합계가 0(모드 4)이기 때문에 a와 b 둘 다 홀수가 아니라는 것을 의미한다.
우드워드-호프만 규칙의 일반화된 성명은 반응이 허용될 경우 +d가 이상하다고 명시한다. 자, 만약 a가 짝수라면, 이것은 d가 이상하다는 것을 암시한다. 이 경우 b가 홀수이기 때문에 한탄성분 b + d의 수는 짝수다. 마찬가지로 a가 홀수라면 d도 짝수다. b가 이 경우에도 한탄성분인 b + d의 수는 다시 짝수다. 따라서 a와 b에 대한 패리티의 초기 가정과 관계없이, 일란성분의 수는 전자 카운트가 4n + 2일 때도 있다. 반대로, 금지된 경우, + d가 짝수인 경우, 초기 가정과 관계없이 b + d가 홀수임을 보여줄 수 있다.
전자의 총수가 4n인 경우, 유사한 논거(여기 들어 있음)는 허용한 경우, 그리고 금지된 경우에도 한란성분 b + d의 수가 홀수여야 한다는 결론을 내리게 한다.
마지막으로, 주장을 완성하고, 이 새로운 기준이 정말로 원래의 기준과 동등하다는 것을 보여주기 위해, 역문도 주장할 필요가 있다. 즉, 한란성분의 수 b + d와 전자수(4n + 2 또는 4n)는 우드워드-호프만 규칙(허용에 대한 규정)에 의해 주어진 + d의 동등성을 내포하고 있다는 것이다.d, 심지어 금지된 경우에도. 또 다른 (몇 가지 지루한) 사례 분석은 이러한 경우를 쉽게 보여 줄 것이다.
요약하면, 본래의 일반화된 순환 선택 규칙과 수학적으로 동등한 다음과 같은 문장이 있다.
4n+2 또는 4n 전자를 포함하는 순환 과정은 관련된 한란성분의 수가 각각 짝수이거나 홀수인 경우에만 열적으로 허용된다.
| 후켈 | 뫼비우스 | |
|---|---|---|
| 4n+2 e– | 허용된 향기로운 | 금지된 반독점주의 |
| 4n e– | 금지된 반독점주의 | 허용된 향기로운 |
이 공식에서 전자 카운트는 우드워드와 호프만의 원래 진술에 열거된 대로 개별 성분이 아닌 전체 반응 시스템을 가리킨다. 실제로, 둘 이상의 안타성 요소를 포함하는 전이 상태는 일반적으로 스트레인에 의해 선호되지 않기 때문에 짝수 또는 홀수 수의 안타성 요소는 각각 0 또는 1개를 의미한다. 예외로서, 특정 근육내 반응은 다중 구성요소에 대해 난형궤도를 강제하는 방법으로 기하학적으로 제약될 수 있다. 또한, 예를 들어, Cope 재정렬과 같은 경우에, 동일한 (필요하게 긴장되지 않는) 전환 상태 기하학은 궤도 로브 사이의 연결을 어떻게 그리느냐에 따라 2개의 Supra 또는 2개의 Antara ara 성분을 포함하는 것으로 간주할 수 있다. (이 모호성은 σ 구성 요소의 내부 또는 외부 로브 둘 다와 겹치는 협약의 결과물이다.)
이 대체 공식은 Dewar-Zimmerman 분석(아래 참조)에 대한 Woodward-Hoffmann 규칙의 동등성을 명확히 한다. 고른 수의 위상 역전은 짝수 수의 난형성분과 동등하며, 후켈 위상에 해당하며, 방향성을 위해 4n + 2 전자가 필요한 반면, 홀수 총 위상 역전은 홀수 수의 난형성분과 같으며, 뫼비우스 위상에 해당하므로 a에 대해 4n 전자가 필요하다.애교[28] 방향 전환 상태 이론을 요약하려면: 열순환 반응은 (4n + 2) 후켈 전자의 또는 (4) 전자의 뫼비우스 전환 상태를 통해 진행된다.
니모닉으로서, 위의 공식은 다음과 같이 더욱 재작성할 수 있다.
N 전자 쌍과 항난성 구성요소를 포함하는 지상 상태 순환 과정은 N + A가 홀수인 경우에만 대칭이 허용된다.
대체 동등성 증명
두 공식의 등가성은 사례 분석에 호소하지 않고 단순한 패리티 인수로도 볼 수 있다.
제안. 우드워드-호프만 규칙의 다음과 같은 공식은 동일하다.
(A) 주기적 반응의 경우, 초임계 4q + 2 성분과 난임계 4r 성분 수의 합이 홀수인 경우 열적으로 허용된다. 그렇지 않으면 반응이 열적으로 금지된다.
(B) 주기적 반응의 경우, a(4n + 2) 전자 반응의 한난성 성분의 총 개수가 짝수이거나 4n 전자 반응의 한난성 성분의 총 개수가 홀수인 경우 열적으로 허용된다. 그렇지 않으면 그 반응은 열적으로 금지된다.
동등성 증명: 주기 반응 i= ,,…, k i의 성분을 색인화하고 다음 규칙에 따라 Woodward-Hoffmann 기호 N을s/a 사용하여 성분 i를 전자 카운트 및 위상 패리티 기호 , }i을 지정한다.
수학적으로 동등한 (A):
(A') 기호 모음 , i, ) 속성이 있는 기호의 수가 있는 경우에만 열적으로 허용된다. 이상하다
전자기 성분의 수)가 각각 홀수 또는 짝수인 반면, \sum }}}}{i는 항독성 성분 수를 줄 때 총 전자수(B):도 가능하다.
(B') , , 의 기호 모음은 다음 중 하나일 경우에만 열적으로 허용된다. 또는 p }}}}은는) 이상하다.
(A')와 (B')가 동등하다는 것을 보여주기만 하면 된다. Exactly one of or is odd if and only if is odd. If , holds; hence, omission of symbols with the property from a collection will not change the parity of . On the other hand, when , we have , but simply enumerates the number of components with the property 그러므로
.
따라서 + 이 i p 인 집합의 기호 수는 동일한 패리티를 가진다. 제형(A')과 (B')가 동일하므로 (A)와 (B)도 주장대로 동일하다. □
구체적인 예를 들어 설명자[π6s + 4a + 2a]와의 가상적 반응에 대해 상기 체계에서 {(1, 0, 1), (0, 1, 2,), (1, 1, 3)}의 집합이 할당될 것이다. (1, 0, 1)와 (0, 1, 2) 두 개의 성분이 있는데, 은 i{ {\이(가)므로 (A)'에 의해 반응이 허용되지 않는다. 로 = 및 = 2 \sum 는 둘 다 같으므로 (B') 반응도 허용되지 않는다.
예
2개 성분의 반응에 대한 이 공식은 다음 표에 나타난 [p + q]-사이클로 추가 반응에 대한 선택 규칙과 동일하다.
| p + q | 열적 허용 | 광화학적으로 허용되는 |
|---|---|---|
| 4n | psa + qa 또는 p + qs | psa + qs 또는 p + qa |
| 4n + 2 | psa + qs 또는 p + qa | psa + qa 또는 p + qs |
만약 전자의 총수가 4n + 2라면, 그 중 하나는 테이블의 맨 아래 줄에 있다. 이 반응은 두 구성 요소에 대해 초선형일 경우 열적으로 허용되며, 두 구성 요소에 대해 난타형일 경우 모두 허용된다. 즉, 한탄성분의 수는 짝수(0 또는 2)이다. 마찬가지로 전자의 총수가 4n이라면, 그 중 하나는 표의 맨 위 행에 있다. 이것은 한 요소에 대해 초선형이고 다른 요소에 대해 황색인 경우 열적으로 허용된다. 따라서 한족 성분의 총 수는 항상 1이기 때문에 항상 홀수다.
다음은 일반화된 우드워드-호프만 규칙에 비추어 분석된 몇 가지 공통 접지 상태(즉, 열) 반응 등급이다.
[2+2] 사이클로어데이션
[2+2]-사이클로 추가는 4개의 전자 공정으로 두 개의 성분을 합친 것이다. 따라서 위의 일반적인 WH 규칙에 의해 정확히 하나의 구성요소에 대해 반동이 불규칙적인 경우에만 허용된다. 이는 위 절의 상관관계 도표를 통해 도달한 것과 동일한 결론이다.
[π2s + 2a] 사이클로어데이션의 희귀하지만 입체적으로 명확하지 않은 예가 오른쪽에 표시된다. 트랜스 더블 본드의 변형률과 강직성 특성은 일반적으로 키네틱적으로 불리한 과정을 가능하게 한다. cis, trans-1,5-Cycloctadiene 또한 이 모드를 통해 조광화를 겪는 것으로 여겨진다.[13] 케틴은 올레핀으로 [2 + 2] 사이클로어드레이션을 선호하는 많은 종류의 반응제다. 케틴 사이클로어데이션의 MO 분석은 케틴의 직교 궤도의 동시적이지만 독립적인 상호작용에 의해 복잡하고 모호하게 렌더링되지만 π[2s + 2a] 상호작용도 수반될 수 있다.[29]
[4+2] 사이클로 추가
동기식 6π 전자 Diels-Alder 반응은 우측에 대한 반응에서 예시된 바와 같이 π[4s + 2s] 사이클로 추가(즉, 두 구성 요소에 대한 초선형)이다.
따라서 한탄성분의 총수가 0이므로 짝수인 대칭성이 허용된다.[13] 이 예측은 Diels-Alder 반응이 다소 쉬운 순환 순환 반응이기 때문에 실험에 동의한다.
4n 전기 순환 반응
4n 전자 전기 순환 고리 개방 반응은 π 시스템과 끊어지는 σ-본드의 두 가지 구성요소를 갖는 것으로 간주할 수 있다. π체계에 관해서, 그 반응은 초선적이다. 그러나 위의 그림에서 보듯이 응축 메커니즘으로 σ-본드에 관해서 반작용은 난타적이다. 반대로 탈회성 메커니즘을 가진 그것은 깨지는 σ-본드에 관하여 초선적이다.
위의 규칙에 따르면, 2개 성분의 4n 전자 주기적 반응에 대해, 한 개의 난인성 성분이 있어야 한다. 따라서 그 반응은 반드시 응축적 메커니즘을 통해 진행되어야 한다.[13] 이는 위의 상관관계 도표에서 도출된 결과와 일치한다.
4n + 2 전기 순환 반응
4n + 2 전기 순환 고리 개방 반응도 π 시스템에 대해 과대망상적인 2-성분 순환 반응이다. 따라서 반동이 허용되려면 한란성 성분의 수가 0이어야 한다. 즉, 깨지는 σ-본드에 관해서도 초정대적이어야 한다. 따라서 탈회전의 메커니즘은 대칭성이 허용된다.[13]
[1,j]-효능적 재배열
[1,j]-시방성 재배열은 또한 두 가지 구성 요소 순환 반응이다. 하나는 π-시스템이고, 다른 하나는 마이그레이션 그룹이다. 가장 간단한 경우는 j가 홀수인 π-시스템에 걸친 [1,j]-수화물 이동이다. 이 경우 수소는 spherrally 대칭의 s 궤도만 가지고 있으므로 수소에 대한 반응은 초선명적이어야 한다. 관여하는 전자의 총수는 (j - 1)/2 --본드 + 반응에 관여하는 σ 본드가 있으므로 (j + 1)이다. j = 4n - 1이면 안타성, j = 4n + 1이면 초선형이어야 한다.[13] 이는 대칭 허용 난형 이동 과정이 실현 가능하지 않기 때문에 일반적으로 [1,3]-수체 이동이 관찰되지 않는다는 실험과 일치하지만 [1,5]-수체 이동은 상당히 쉽다.
[1,j]-alkyl 시프트의 경우, 탄소 중심과 관련하여 반작용(즉, 역방향 스테레오화학)이 될 수 있는 경우, 동일한 규칙이 적용된다. j = 4n - 1인 경우, π-system에 대한 안타라이크이거나 탄소의 입체화학성을 반전시킬 경우 대칭성이 허용된다. j = 4n + 1인 경우, π-시스템에 대해 초선형이고 탄소 중심에서 입체화학성을 유지하는 경우 대칭성이 허용된다.[13]
오른쪽은 1967년 버슨이 보고한 [1,3]-시방성 이동의 첫 번째 예 중 하나이다.[30] 구성의 역전을 허용하기 위해 σ 본드가 끊어질 때 C(H)(D) moiety가 전환 상태에서 탄소 근사치 sp의2 하이브리드화로 휘감아 나머지 비혼합 p 궤도 는 탄소 1과 3 둘 다와 중첩되게 유지된다.
기타 이론적 모형의 동등성
드와르-짐머만 분석
일반화된 우드워드-호프만 규칙은 1969년에 처음 제시된 이전의 일반적 접근방식인 짐머만의 뫼비우스-후켈 개념과 동일하며, 1966년에 처음 언급되어 방향 전환 상태 이론으로도 알려져 있다.[14][31][32] 그것의 중심 테닛으로서 방향 전환 상태 이론은 '허용된' 순환 주기 반응은 방향성을 가진 전환 상태를 통해 진행되는 반면, '포기된' 순환 주기 반응은 자연적으로 반자율적인 전환 상태에 직면할 것이라고 주장한다. 드와르-지머만 분석에서 하나는 순환기 반응의 전환 상태의 위상에 관한 것이다. 전환 상태가 4n 전자를 포함하면 뫼비우스 위상은 방향성이 있고 ü켈 위상은 반자동인 반면, 전환 상태가 4n + 2 전자를 포함하면 ü켈 위상은 방향성이 있고 뫼비우스 위상은 반자동이다. 전환 상태에서 위상 역전 횟수(아래에 자세히 설명됨)의 패리티에 따라 위상이 결정된다. 뫼비우스 위상은 홀수의 위상 역전을 수반하는 반면, 후켈 위상은 짝수의 위상 역전을 수반한다.
Woodward-Hoffmann 용어와 관련하여, 항타적 요소의 수와 위상 역전의 수는 항상 동일한 패리티를 가진다.[28] 결과적으로, 홀수 수의 안타르카닉 성분은 뫼비우스 위상(Topology)을 제공하는 반면 짝수 수는 뮐 위상(Hukel) 위상(Topology)을 제공한다. 따라서 방향족 전이 상태 이론의 결과를 우드워드와 호프만 언어로 다시 설명하기 위해, 4n 전자 반응은 그것이 홀수 수의 난인성 성분(즉 뫼비우스 위상)을 가진 경우에만 열적으로 허용된다. a(4n + 2) 전자 반응은 고른 수의 난인성 복합체를 가진 경우에만 열적으로 허용된다.nts(즉, 후켈 위상).
Dewar-Zimmerman 분석 절차(오른쪽 예시): 1단계. 순환 순환계의 일부인 모든 기본 궤도를 음영으로 표시한다. 음영이 임의일 수 있다. 특히 음영 처리에는 폴리엔 MO의 페이징을 반영할 필요가 없다. 각 기준 궤도에는 p 또는 sx 혼성 궤도인 경우 상반된 두 개의 단계 로브 또는 s 궤도인 경우 단 하나의 위상이 있어야 한다. 2단계. 전환 상태에서 상호작용하기 위해 기하학적으로 잘 분해된 기본 궤도의 로브 사이에 연결을 그린다. 연결은 전환 상태 토폴로지에 따라 달라진다.(예를 들어, 그림에서 서로 다른 연결은 con-turtive electrocyclation의 경우에 나타난다.) 3단계. 반대편 음영 로브 사이에 발생하는 연결 횟수를 계산하십시오. 각 연결은 위상 역전을 구성한다. 위상역전의 횟수가 짝수라면 과도상태는 후켈이고, 위상역전환이 홀수이면 과도상태는 뫼비우스다. 4단계. 전자 카운트가 4n + 2이고 전환 상태가 헉켈일 경우 또는 전자 카운트가 4n이고 전환 상태가 뫼비우스일 경우 순환 반응이 허용된다고 결론짓고, 그렇지 않을 경우 순환 순환 반응이 금지된다고 결론짓는다.
중요한 것은, 어떤 단일 궤도 위상을 뒤집으면 0 또는 ±2 위상이 총수에 짝수인 0 또는 ±2 위상이 추가되므로, 상대 위상을 기본 궤도에 할당하는 어떤 방식도 허용된다.
개념밀도기능이론을 이용한 재해석
최근 우드워드-호프만 규칙은 개념밀도기능이론(DFT)을 이용해 재해석되고 있다.[5][33] 이 분석에 그 핵심은 이중 설명자 기능, 크리스토프 모렐, 앙드레 그랜드와 알레한드로 Toro-Labbé[34]f((r))이 제안한 ∂ 2ρ(r)∂ N2{\displaystyle f^{(2)}(r)={\frac{\partial ^{2}\rho(r)}{\partial N^{2}}}}, 전자 밀도의 유도 함수.(r){\displaystyle \rho(r)ρ.} 전자 의 수에 관하여 전자 전달을 수반하는 두 성분의 A와 B의 반응이 전자 기증이나 수용에 대한 전자 밀도의 응답성, 즉 후쿠이 f( r)= ( )에 따라 달라지기 때문에 이 응답 함수는 중요하다. N 사실 단순한 관점에서 듀얼 설명자 함수는 분자의 다양한 영역의 전기영역성 또는 핵소독성에 대한 판독값을 제공한다. ( )> f의 경우 영역은 전기영역이고, () < 의 경우 영역은 핵영역학이다. 프런티어 분자 궤도 가정과 후쿠이 함수의 유한 차이 근사치를 이용하여, 이중 설명자를 다음과 같이 쓸 수 있다.
이는 마치 어떤 지역이 기부보다 전자를 더 잘 받아들이는 것처럼 직관적으로 이치에 맞는다. 그러면 LUMO가 지배해야 하고 이중 설명자 기능이 양성이 될 것이다. 반대로 한 지역이 전자 기부를 더 잘한다면 HOMO 용어가 지배할 것이고 서술자는 음수가 될 것이다. 위상과 궤도 개념은 단순히 전자 밀도의 개념으로 대체되지만, 이 기능은 여전히 양의 값과 음의 값을 모두 취한다는 점에 유의하십시오.
우드워드-호프만 규칙은 이중 설명자가 반대 기호를 갖는 전자 밀도 영역 간의 우호적인 상호작용을 일치시켜 이 제형을 사용하여 재해석한다. 이것은 예측 친화적인 상호작용을 최대화하고 혐오적인 상호작용을 최소화하는 것과 동등하다. [4+2] 사이클로어 추가의 경우, 왼쪽에 있는 최적의 Supra/supra 구성에서 이중 설명자 함수를 색상(빨간색=양색, 청색=음색)으로 하여 반응제의 단순화된 개략도가 표시된다. 이 방법은 순환 주기 반응의 주요 등급에 대한 WH 규칙을 정확하게 예측한다.
예외
'폭행'이라는 제목의 '궤도 대칭 보존' 12장에서 우드워드(Woodward)와 호프만(Hoffmann)은 다음과 같이 명기했다.
없어! 또한 위반은 최대 결합의 기본 원리를 기대할 수 없다.
이러한 선언에도 불구하고, 우드워드-호프만 규칙은 상대적 장벽 높이와 그에 따라 가능한 반응 메커니즘을 예측하기 위해 사용되며, 궤도 대칭의 보존 때문에 장벽만을 고려한다는 것을 인식하는 것이 중요하다. 따라서 WH 대칭 허용 반응이 실제로 쉬운 방식으로 발생한다고 보장되지 않는다. 반대로, 충분히 정력적인 입력에 의해 반우드워드-호프만 제품을 달성할 수 있다. 이는 특히 강직성 제약이 있는 시스템에서 보편적이며, WH-제품은 극복해야 할 강직성 장벽을 추가로 가지고 있다. 예를 들어 디메틸비시클로[0.2.3]헵텐 파생상품(1)의 전기순환 링 개방에서는 결과적인 각도 스트레인으로 인해 응축 메커니즘이 불가능하며 400o C에서 탈회 메커니즘을 통해 반응이 천천히 진행되어 사이클로헵타디엔 제품을 공급한다.[21] 열역학적 추진력이 매우 강한 경우에도 위반사항이 관찰될 수 있다. 예열대의 발광에 대한 역할로 유명한 이산화탄소의 두 분자에 대한 디옥세탄-1,2디온의 분해는 계산적으로 정밀하게 조사되어 왔다. 형광 투시자가 없을 때, 이 반응은 이제 공식적으로 우드워드-호프만 규칙을 위반하는 레트로[2+2]-사이클로 추가를 통해 결합(비동기식) 방식으로 진행되는 것으로 생각된다.[35]
마찬가지로, 최근의 한 논문은 어떻게 기계적인 스트레스가 우드워드-호프만 규칙을 위반하는 제품들로 이어질 수 있도록 화학 반응 경로를 재구성하는 데 사용될 수 있는지를 설명한다.[36] 본 논문에서는 초음파 조사를 이용하여 사이클로부틴 링에 부착된 링크기능성 고분자(link-functional polymer)에 대한 기계적 응력을 유도한다. 계산 연구에서는 중합체의 마찰로 인한 기계적 힘이 반비산성-사이클로부틴의 응축 메커니즘의 반응 좌표를 따라 결합이 길어지는 것을 유도하고, 구연-비산성-사이클로부틴의 불연성 메커니즘의 반응 좌표를 따라 결합을 유도한다고 예측하고 있다. 따라서, 동기화-bisbritised-cyclobutene에서는, 반WH 제품이 형성될 것으로 예측된다.
이 계산 예측은 아래 시스템에 대한 실험에 의해 뒷받침되었다. 링크 기능화된 중합체는 동기화 및 반정합성 모두에서 시스 벤조시클로부텐으로 결합되었다. 예측한 대로, 두 제품 모두 치환된 말레미드와의 입체 디엘-알데르 반응에 의해 결정되는 것과 동일한 (Z,Z) 제품을 주었다. 특히, 구연 대체 제품은 항 WH 제품을 제공했는데, 아마도 탈회 경로의 좌표를 따라 늘어지는 기계적인 스트레칭이 그 메커니즘을 편향할 정도로 탈회 경로 하에서의 반응의 장벽을 낮춘 것으로 추정된다.
논란
노벨상 수상자인 엘리아스 제임스 코리는 이 연구의 기초를 닦은 아이디어에 대해 자신이 책임감을 느끼고 있으며, 우드워드는 이번 발견에서 부당하게 자신을 신용하는 것을 소홀히 했다고 진술되어 있다. 2004년 회고록 저널 유기 Chemistry,[37]코리에서 발간된에 5월 4일 1964년에는, 내 동료 R.B. 우드워드에 대해 간단한 설명은 입체 선택성 cyclobutene의 냉정을 잃(HOMO)분자 궤도 함수 1,3-butadiene과 1,3,5-hexatriene cyclohexadi기 위해서는 대칭과 관련된 제안한 생각의 우선 순위에 그의 말을 한다에네 이러한 사상을 우드워드-호프만 규칙으로 더 발전시킬 수 있는 토대를 제공한 변환".
당시 35세였던 코리는 5월 4일 월요일 저녁까지 일을 하고 있었는데, 그와 다른 추진 화학자들이 종종 하던 대로였다. 오후 8시 30분쯤 우드워드의 사무실에 들렀고, 우드워드는 원자 사슬이 형성될 고리의 종류를 어떻게 예측하느냐는 질문을 던졌다. 몇 가지 논의 끝에 코리는 전자의 구성이 반응의 과정을 지배할 것을 제안했다. 우드워드는 그 해결책이 효과가 없을 것이라고 주장했지만, 코리는 그가 뭔가를 꾸미고 있다는 것을 확신하며 도면을 사무실에 남겨두었다.[38]
"나는 이것이 정말 흥미로운 발전이 될 것이라고 느꼈고, 일종의 공동 사업을 기대하고 있었다."라고 그는 썼다. 그러나 다음날 우드워드는 그와 동료가 점심을 먹기 위해 떠날 때 코리의 사무실로 날아와 코리의 아이디어를 자신의 아이디어로 제시한 후 떠났다. 코리는 아연실색했다.
로알드 호프만은 안젤완트 케미에 2004년 발표한 반박에서 1966년 우드워드의 강연에서 "나는 매우 분명하게 기억한다. 그리고 그것은 여전히 나를 다소 놀라게 한다"고 말한 것을 인용하며, 이러한 주장을 부인했다.[39] 느닷없이 부타디엔의 가장 많이 점유된 분자궤도를 나타내는 수학적 표현에서 단어의 계수는 반대 기호가 있는 반면, 헥사트리엔에 해당하는 표현은 같은 기호를 가지고 있다는 생각이 들었다. 여기서부터 그것은 기하학까지의 짧은 발걸음일 뿐이며, 보다 분명히 화학적으로 관련이 있는 관점은 디엔의 내부 사이클화에서는 한 단자 원자의 상면이 다른 단자 원자의 하면을 공격해야 하는 반면, 트리엔의 경우, 새로운 결합의 형성은 양쪽 단자 a의 상면(또는 파리 패스우, 하면)을 수반해야 한다는 것이다.톰스."
또한, 호프만은 1963년과[40] 1965년의 두 간행물에서 [41]코리가 디하이드로코스타놀라이드 화합물의 총합성을 기술했다고 지적한다. 비록 그들이 전기 순환 반응을 설명하지만, 코리는 합성의 입체성을 설명하는 것과 관련하여 제공할 것이 없다.
6 = 4×1 + 2 전자를 포함하는 이 광화학 반응은 현재 응결체로 인식되고 있다.
참고 항목
참조
- ^ 궤도 대칭 보존의 원리는 일반적으로 로버트 번스 우드워드(Robert Burns Woodward)와 로알드 호프만(Roald Hoffmann)이 전기순환 반응의 입체화학적 결과에 대한 설명으로 궤도 대칭 보존을 제안했기 때문이다(J. Am). Chem. Soc. 1965년, 87년, 395년)과 몇 년 후 완전 일반화된 순환 선택 규칙을 명확히 했다(Angew). 화학. 인트. 에드. 엥글 1969, 8, 781). 그러나 E. J. Corey는 1965년에 핵심 통찰력을 제안하는 데 우선순위를 주장하였다(아래 '논쟁' 섹션 참조). 더욱이 E. 하다는 이전에 타키스테롤이 활성화 모드(각각 광화학 또는 열)에 따라 전기적 또는 탈회전의 방식으로 순환 고리 폐쇄를 겪었다는 사실을 지적하고, 이 현상에 대한 궤도 대칭 설명을 L. J. 오오스터호프(Tetrahedron Let. 1961, 16, 146)에 귀속시켰다. 또한 H. E. Zimmerman(J. Am)에 의해 진전된 방향 전환 상태 이론. 화학. Soc. 1966, 88, 1564)과 M. J. S. 데워(Tetrahedron 1966, Supl. 8, 75)는 일반화된 통치에 대한 우드워드 및 호프만의 진술과 완전히 동일하지만 앞선 대안적 접근법으로 인정되어 왔다.
- ^ ene 반응은 종종 집단 전이 반응의 한 종류로 간주된다.
- ^ 첼레티방성 반응은 종종 사이클로어다이드의 한 종류로 간주된다.
- ^ Reetz, Manfred T. (1972-02-01). "Dyotropic Rearrangements, a New Class of Orbital-Symmetry Controlled Reactions. Type I". Angewandte Chemie International Edition in English. 11 (2): 129–130. doi:10.1002/anie.197201291. ISSN 1521-3773.
- ^ a b Geerlings, Paul; Ayers, Paul W.; Toro-Labbé, Alejandro; Chattaraj, Pratim K.; De Proft, Frank (2012). "The Woodward–Hoffmann Rules Reinterpreted by Conceptual Density Functional Theory". Accounts of Chemical Research. 45 (5): 683–95. doi:10.1021/ar200192t. hdl:10533/131820. PMID 22283422.
- ^ 1981년 노벨 화학상. Nobelprize.org.
- ^ 우드워드-호프만 규칙은 순환 과정 중 어느 한 방향에 적용된다. 사이클로부텐 유도체의 고유 링 변형률 때문에 사이클로부텐과 1,3부타디엔의 평형은 우측으로 멀리 놓여 있다. 따라서 열 조건에서 1,3-부타디엔에 대한 사이클로부텐의 링 개방은 열역학에서 강하게 선호된다. 한편, 자외선에 의한 조사에서는 특정 파장에서의 전방 및 역방향 반응의 흡광도와 양자 수율에 모두 의존하는 광전자 상태에 도달한다. 1,3부타디엔과 사이클로부텐의 서로 다른 결합도 때문에 다른 색소포체의 부재를 가정한 1,3부타디엔만이 더 높은 파장에서 상당한 흡광도를 가질 것이다. 따라서 그러한 파장에서 1,3-부타디엔을 조사하면 사이클로부틴으로 높은 변환을 초래할 수 있다.
- ^ Criegee, Rudolf; Noll, Klaus (1959). "Umsetzungen in der Reihe des 1.2.3.4-Tetramethyl-cyclobutans". Justus Liebigs Annalen der Chemie. 627: 1–14. doi:10.1002/jlac.19596270102.
- ^ 아래 그림은 양쪽 끝이 시계 방향으로 회전하는 것을 나타내지만 궤도 대칭은 같은 방향의 회전과 반대 방향(회전 대 회전)을 구별할 뿐이라는 것을 인식하는 것이 중요하다. 따라서 링 오프닝 1(양쪽 끝은 시계 반대 방향으로 회전)에서 (Z,Z) 등소체의 형성도 대칭성이 허용된다. (Z,Z) 이성질체가 관찰되지 않은 것은 내적으로 회전하는 메틸 그룹들 사이의 좋지 않은 강직 상호작용 때문일 가능성이 있다. (다른 경우, 시계 방향 또는 시계 반대 방향의 본드 회전에 대한 선호도는 스테레오 전자적 요인에 의해 제어될 수 있다: 토크율 참조)
- ^ Srinivasan, R. (1968-07-01). "Mechanism of the photochemical valence tautomerization of 1,3-butadienes". Journal of the American Chemical Society. 90 (16): 4498–4499. doi:10.1021/ja01018a080. ISSN 0002-7863.
- ^ Winter, Rudolph Ernst K. (1965-01-01). "The preparation and isomerization of cis- and trans-3,4-dimethylcyclobutene". Tetrahedron Letters. 6 (17): 1207–1212. doi:10.1016/S0040-4039(01)83997-6. ISSN 0040-4039.
- ^ 우드워드와 호프만이 내놓은 원문은 다소 더 정교하다. 지상 상태 주기적 변화는 (4q+2) s및 (4r)a 성분의 총 수가 홀수일 때 대칭이 허용된다. 그러나 여기서 주어진 진술은 수학적으로 동등하다. 자세한 내용은 https://archive.org/details/whdz_red을 참조하십시오.
- ^ a b c d e f g h i j k l m n o p q r s t u v Woodward, R. B.; Hoffmann, Roald (1969). "The Conservation of Orbital Symmetry". Angew. Chem. Int. Ed. 8 (11): 781–853. doi:10.1002/anie.196907811.
- ^ a b Zimmerman, H. E. (1966). "On Molecular Orbital Correlation Diagrams, the Occurrence of Möbius Systems in Cyclization Reactions, and Factors Controlling Ground- and Excited-State Reactions. I". Journal of the American Chemical Society. 88 (7): 1564–1565. doi:10.1021/ja00959a052.
- ^ Zimmerman, Howard E. (1971-08-01). "Moebius-Hueckel concept in organic chemistry. Application of organic molecules and reactions". Accounts of Chemical Research. 4 (8): 272–280. doi:10.1021/ar50044a002. ISSN 0001-4842.
- ^ Dewar, M.J.S. (1966-01-01). "A molecular orbital theory of organic chemistry—VIII: romaticity and electrocyclic reactions". Tetrahedron. 22: 75–92. doi:10.1016/S0040-4020(01)82171-2. ISSN 0040-4020.
- ^ Dewar, Michael J. S. (1971-11-01). "Aromaticity and Pericyclic Reactions". Angewandte Chemie International Edition in English. 10 (11): 761–776. doi:10.1002/anie.197107611. ISSN 1521-3773.
- ^ Fukui, Kenichi (1965-01-01). "Stereoselectivity associated with noncycloaddition to unsaturated bonds". Tetrahedron Letters. 6 (28): 2427–2432. doi:10.1016/S0040-4039(00)90203-X. ISSN 0040-4039.
- ^ Fukui, Kenichi (1982). "Role of Frontier Orbitals in Chemical Reactions". Science. 218 (4574): 747–754. Bibcode:1982Sci...218..747F. doi:10.1126/science.218.4574.747. JSTOR 1689733. PMID 17771019.
- ^ 더 정확히 말하면, 진정한 대칭을 가진 '대칭-포비덴' 시스템은 제품 항균 궤도와 상관관계가 있는 시작 재료 본딩 궤도를 가지고 있으며, 그 반대의 경우도 마찬가지다. 이와는 대조적으로 대체물이 대칭을 교란할 때, 이러한 수준 교차들은 (전환 상태 근처) 접근하지만 그 다음 갈라지는 에너지 수준에 의해 '완전히 회피'된다. 궤도 상관 다이어그램의 차이와 대조적으로 상태 상관 관계 다이어그램은 대칭이 "참"인지 또는 "대략"인지에 관계없이 항상 '완전히 회피된' 교차점을 가진다. 따라서 질적인 의미에서 상태 상관 도표는 변하지 않기 때문에 형식 대칭 원소를 교란시키는 단순한 대체물의 유무는 중요하지 않다. '절대 피한' 교차로에 접근함에 따라 지상 상태의 에너지가 상승하면 전환 상태에서 대칭으로 인한 에너지 장벽이 발생한다.
- ^ a b c Woodward, R. B.; Hoffmann, Roald (1965). "Stereochemistry of Electrocyclic Reactions". Journal of the American Chemical Society. 87 (2): 395. doi:10.1021/ja01080a054.
- ^ Longuet-Higgins, H. C.; Abrahamson, E. W. (1965). "The Electronic Mechanism of Electrocyclic Reactions". Journal of the American Chemical Society. 87 (9): 2045. doi:10.1021/ja01087a033.
- ^ Woodward, R. B.; Hoffmann, Roald (1971). The Conservation of Orbital Symmetry (3rd printing, 1st ed.). Weinheim, BRD: Verlag Chemie GmbH (BRD) and Academic Press (USA). pp. 1–178. ISBN 978-1483256153.
- ^ P. R. 벙커와 P. 젠센(2005) 분자 대칭의 기초(CRC Press) ISBN 0-7503-0941-5[1] 섹션 10.4 참조
- ^ a b c d e f g h i j k 캐롤, 펠릭스(1998) 유기 화학, 브룩스/콜레, 페이지 710–794, ISBN 0534249485의 구조와 메커니즘에 대한 관점
- ^ a b c Hoffmann, Roald; Woodward, R. B. (1965). "Selection Rules for Concerted Cycloaddition Reactions". J. Am. Chem. Soc. 87 (9): 2046. doi:10.1021/ja01087a034.
- ^ SO는2 직교형 단독쌍과 항응궤도(SO의2 아군처럼 항응궤도(Alignl 모양의 항응궤도(Antil like antibanting arbital)를 가지고 있기 때문에, 이들 궤도와 1,3-부타디엔의 교호작용은 별도로 분석해야 한다. 일반적으로, 이 첼레틱성 반응과 같은 복합 공정의 경우, 두 개의 개별 궤도 상호작용 모두 반응이 허용되도록 허용해야 한다. FMO 접근방식은 아마도 여기서 가장 직관적인 그림을 제공할 것이다.
- ^ a b 이것이 사실인 이유를 알기 위해, 우리는 항상 최대 한 위상 역전을 가진 데워-짐머만 분석을 생성하는 것이 가능하고 결과는 한족 성분 수의 동등성에 달려 있다고 주장한다. 우리는 임의로 어떤 성분의 첫 번째 궤도에서의 음영으로 시작하고 그 안에서 위상 역전이 일어나지 않도록 나머지 성분의 음영을 완성하는 것으로 시작한다. 각 성분의 본드 위상(supra 또는 antara)에 근거하여 성분의 상호간에 Dewar-Zimmerman 연결을 그린다. 이러한 연결을 사용하면 구성 요소 간에 또는 구성 요소 내에 반전되지 않도록 인접 구성 요소에 음영을 계속 적용할 수 있다. 이는 상호 작용하는 모든 궤도가 음영 처리될 때까지 계속되며 사이클을 완료하려면 최종 Dewar-Zimmerman 연결만 이루어지면 된다. 지금까지 어떤 위상 역전도 도입되지 않았다. 중요한 관찰: 황색(선행) 성분의 양 끝에서 이웃 구성 요소까지 확장되는 Dewar-Zimmerman 연결은 반대편(동일한) 음영의 로브를 연결한다. 따라서 홀수 수의 안타성 구성요소는 사이클을 완료하기 위해 단일 위상 역전을 강제하는 반면 짝수 수의 안타성 구성요소는 위상 역전이 없이 사이클을 완료할 수 있다. 궤도 페이싱과 관련하여 반전 횟수(modulo 2)가 불변하므로, 이 두 가지 가능성(홀수 또는 짝수 한 개의 한난자성분)은 우리가 각각 뫼비우스(한 개의 반전) 시스템을 가지고 있는지 후켈(반전 없음) 시스템을 가지고 있는지를 고정시킨다.
- ^ Yamabe, Shinichi; Kuwata, Kayoko; Minato, Tsutomu (1999). "Frontier-orbital analyses of ketene [2+2] cycloadditions". Theoretical Chemistry Accounts: Theory, Computation, and Modeling (Theoretica Chimica Acta). 102 (1–6): 139–146. doi:10.1007/s002140050484. S2CID 206899145.
- ^ Berson, Jerome A.; Nelson, George L. (1967-10-01). "Inversion of configuration in the migrating group of a thermal 1,3-sigmatropic rearrangement". Journal of the American Chemical Society. 89 (21): 5503–5504. doi:10.1021/ja00997a065. ISSN 0002-7863.
- ^ Zimmerman, H. E. (1966). "On Molecular Orbital Correlation Diagrams, Möbius Systems, and Factors Controlling Ground and Excited State Reactions. II". J. Am. Chem. Soc. 88 (7): 1566–156. doi:10.1021/ja00959a053.
- ^ Zimmerman, H. E. (2006). "Five decades of mechanistic and exploratory organic photochemistry". Pure Appl. Chem. 78 (12): 2193–2203. doi:10.1351/pac200678122193. S2CID 37436155.
- ^ Ayers, Paul W.; Morell, Christophe; De Proft, Frank; Geerlings, Paul (5 October 2007). "Understanding the Woodward–Hoffmann Rules by Using Changes in Electron Density". Chemistry: A European Journal. 13 (29): 8240–8247. doi:10.1002/chem.200700365. PMID 17639522.
- ^ Morell, Christophe; Grand, André; Toro-Labbé, Alejandro (1 January 2005). "New Dual Descriptor for Chemical Reactivity". The Journal of Physical Chemistry A. 109 (1): 205–212. Bibcode:2005JPCA..109..205M. doi:10.1021/jp046577a. hdl:10533/176692. PMID 16839107.
- ^ Farahani, Pooria; Baader, Wilhelm J. (2017-02-16). "Unimolecular Decomposition Mechanism of 1,2-Dioxetanedione: Concerted or Biradical? That is the Question!". The Journal of Physical Chemistry A. 121 (6): 1189–1194. Bibcode:2017JPCA..121.1189F. doi:10.1021/acs.jpca.6b10365. ISSN 1089-5639. PMID 28094939.
- ^ Hickenboth, Charles R.; Moore, Jeffrey S.; White, Scott R.; Sottos, Nancy R.; Baudry, Jerome; Wilson, Scott R. (2007). "Biasing reaction pathways with mechanical force". Nature. 446 (7134): 423–7. Bibcode:2007Natur.446..423H. doi:10.1038/nature05681. PMID 17377579. S2CID 4427747.
- ^ Corey, E. J. (2004). "Impossible Dreams". The Journal of Organic Chemistry. 69 (9): 2917–9. doi:10.1021/jo049925d. PMID 15104426.
- ^ 존슨, 캐롤린 Y. (2005년 3월 1일) 누구의 생각이었을까? 보스턴 글로브
- ^ Hoffmann, Roald (2004). "A Claim on the Development of the Frontier Orbital Explanation of Electrocyclic Reactions". Angewandte Chemie International Edition. 43 (48): 6586–90. doi:10.1002/anie.200461440. PMID 15558636.
- ^ Corey, E. J.; Hortmann, Alfred G. (1963). "Total Synthesis of Dihydrocostunolide". Journal of the American Chemical Society. 85 (24): 4033. doi:10.1021/ja00907a030.
- ^ Corey, E. J.; Hortmann, Alfred G. (1965). "The total synthesis of dihydrocostunolide". Journal of the American Chemical Society. 87 (24): 5736–42. doi:10.1021/ja00952a037. PMID 5845424.






 HOMO가 되고 반응 메커니즘이 불활성화되어야 한다.
HOMO가 되고 반응 메커니즘이 불활성화되어야 한다.