마들룽 합성
Madelung synthesis| 마들룽 인도레 합성 | |
|---|---|
| 이름을 따서 명명됨 | 발터 마들룽 |
| 반응형 | 링 형성 반응 |
| 식별자 | |
| RSC 온톨로지 ID | RXNO:0000511 |
마델룽 합성(Madelung resolation)은 고온에서 강한 염기를 이용하여 N-페닐아미드(N-phenylamides)의 분자 내 사이클화에 의해 인더(대체 또는 미분자)되는 화학 반응이다.마들룽 합성은 1912년 월터 마들룽이 N-벤조일-오 톨루이딘과 에토산화나트륨의 등가물 2개를 사용해 가열되고 공기가 없는 반응으로 합성했다고 보고한 바 있다.일반적인 반응 조건에는 헥산 또는 테트라하이드로푸란 용제의 베이스로 알카산화나트륨 또는 칼륨이 200~400°C의 온도에서 사용된다.합성에도 가수 분해 단계가 필요하다.마델룽 합성은 N-acyl-o-toluidine의 기저 촉매 열 사이클링으로부터 인돌을 생성하는 알려진 몇 안 되는 반응 중 하나이기 때문에 중요하다.마들룽 합성에 대한 전반적인 반응은 다음과 같다.
전체반응
이 방법은 기본적으로 활발한 반응 조건 때문에 2-알키니닐린돌레(전기영양 방향족 치환으로 쉽게 접근할 수 없음)의 준비에만 국한된다.마들룽 합성을 위한 상세한 반응 메커니즘은 다음과 같다.
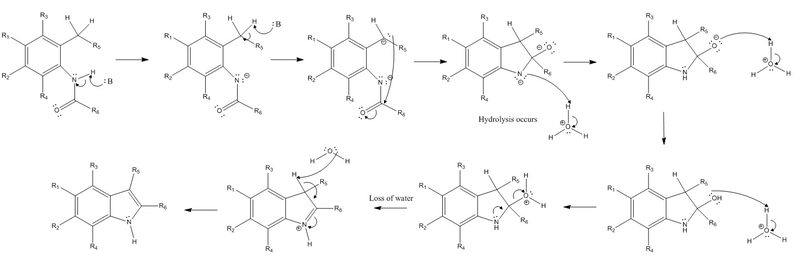
반응 메커니즘
그 반응은 아미드 대체물의 질소로부터 수소를 추출하고 대체된 정형외과에서 강한 베이스에 의한 아미드 대체물로 벤질릭 수소를 추출하는 것으로 시작된다.다음으로 벤질 수소 추출에 의한 카르바니온은 아미드 그룹의 전기영양성 카보닐 탄소에 핵폭발을 수행한다.이렇게 되면 아미드의 pi-bond는 한 쌍으로 변환되어 음전하 산소를 생성하게 된다.이러한 초기 단계 후에는 더 이상 튼튼한 기초가 필요하지 않으며 가수분해가 발생해야 한다.음전하 질소는 중성전하를 회복하기 위해 양성하고, 산소는 양전하를 수용하기 위해 두 번 양성하여 좋은 이탈군이 된다.질소로부터 외로운 쌍이 파이 본드를 형성하여 양전하를 띠는 이탈군을 내쫓고, 또한 질소가 양전하를 띠게 한다.반응의 마지막 단계는 제거 반응(특히 E2 반응)으로, 자전거 화합물이 형성되기 전, 한 때 벤질이었던 다른 수소의 추출과 관련된 것으로, 이 수소의 전자는 링 시스템에서 새로운 파이 본드로 변환된다.이를 통해 앞의 단계에서 질소에 의해 형성된 파이 본드를 다시 질소의 단독 쌍으로 변환하여 질소의 중성 전하를 회복시킬 수 있다.
반응 조건 개선의 진전
원하는 인도레 제품의 수율을 높이기 위해 다양한 기법이 적용되었다.방향족에 전자기증 대체물이 있을 때 더 높은 수율을 얻으며, 방향족에 전자기증 대체물이 있을 때는 그 반대다.[1]그러나 R5 대체재가 전자 인출 대체품일 때는 수율이 감소하는 대신 증가한다.또한, 반응의 효율성은 R6 대체물의 부피에 크게 좌우된다.이 집단이 많을수록 반응 효율이 떨어진다.마들룽 합성에 필요한 조건은 상당히 심각하다.다행히도, 앞에서 언급한 수정은 그 이후 그 실용성을 높이기 위해 적용되었고, 반응을 수행하는 데 필요한 온도를 낮추고 원하는 제품 수율을 증가시키기 위해 노력했다.예를 들어 N-페닐아미드의 방향족 링 위에 전자 기부를 놓고 R5에서 전자 인출 대체물을 대체하면 반응에 필요한 온도가 약 25 °C로 감소한다.[1]더욱 인상적인 것은, 연구자들이 마델룽 합성에 필요한 온도가 부틸리튬(BuLi)과 디이소프로필아미드(LDA) 베이스 사용 시, 그리고 테트라하이드로푸란을 용매로 사용했을 때 -20~25°C의 온도 범위로 감소한다는 것을 발견했다는 사실이다.[2]이러한 금속 매개 베이스 중 하나를 사용한 이 특별한 수정은 마들룽-훌리한 변화라고 불린다.[3]
합성 응용 프로그램
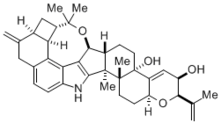
마들룽 합성은 화학, 생화학, 산업 화학에서 많은 중요한 응용분야를 가지고 있다.이 반응은 건축학적으로 복잡한 떨림성 뇌알칼로이드(----페니트렘 D)를 합성하는 데 유용하며, 이는 가축에 각종 근육 및 신경성 질환을 일으키는 에고트 균에 의해 자연적으로 생성되는 분자였다.[4]이 독소는 궁극적으로 축산업에 중대한 경제적 문제를 일으키기 때문에 알칼로이드(----페니트렘 D)를 합성해 쉽게 분해하는 방법을 이해하는 것이 매우 중요하다.그럼에도 불구하고 이렇게 복잡한 분자의 합성은 그 자체로 놀라운 위업이었다.
마델룽 합성이 유용한 또 다른 측면은 2,5-디페닐-1,5-디아자-1,5-디하이드로-s-indacene 2,5-디페닐-1,4-페닐렌디아민으로부터 2,6-디페닐-1,5-디하이드로-s-indacene의 합성에 있다.[5]
이 합성은 320~330 °C의 온도에서 에산화나트륨 염기를 사용하여 마델룽 합성을 수정하지 않고 수행되었다.이 인다센은 상업 산업에서 저비용 조명 디스플레이에 중요한 응용을 할 수 있는 유기 발광 다이오드로 밝혀졌다.
스미스 수정 마들룽 합성
스미스가 수정한 마들룽 합성은 스미스 세뇌 합성이라고도 불리며 1986년 아모스 스미스와 그의 연구팀에 의해 발견되었다.이 합성은 2알킬-N-트리메틸릴 아닐린에서 에스테르 또는 카르복실산에 의해 추출된 오가르늄 시약의 응축 반응을 이용하여 대체 인돌을 산출한다.[6]이 합성은 알킬, 메톡시, 할로겐화 그룹을 포함한 다양한 대체 아일린에 적용 가능한 것으로 입증되었으며, N-리티오케타민 중간 물질을 산출하기 위해 비인용 에스테르나 락톤과 반응할 수 있다.그리고 나서 이 중간체들은 인돌리닌을 생산하기 위해 분자 내 이질종인 Peterson olefination을 거치게 되고, 인돌리닌은 2개의 대체 인돌로 자동화된다.Smith selle 합성은 마들룽 합성에 대한 가장 중요한 수정 중 하나이다.
스미스보올 합성의 반응 메커니즘
Smith sentole 합성은 알킬 대체물과 질소 양쪽으로부터 수소를 추출하기 위해 유기석 시약(Orgorolium 시약은 매우 강한 기초로서)의 두 등가물을 사용하는 것으로 시작하여 양쪽 모두에 음의 전하를 초래한다.합성은 에스테르나 카르복실산의 전기영동 카보닐 탄소에 대한 카르바니온의 핵포밀 공격을 진행한다.이런 일이 일어나면 전기공학의 pi-bond는 산소의 외로운 쌍으로 전환된다.이 외로운 쌍들은 다시 파이본드로 되돌아가고, 그 결과 -OR 그룹이 추방된다.다음으로 음전하된 질소는 인접한 전기영양 카보닐 카보닐 카보닐 카보닐 탄소에 핵포필러 공격을 수행하여 다시 전기영양체의 pi-bond가 산소의 한 쌍으로 변환되도록 한다.그러면 이 음전하 산소는 트리메틸실릴(TMS) 그룹의 실리콘 원자에 핵포착 공격을 하여 삼사이클릭 화합물과 양전하 실리콘 원자와 중성 산소 원자를 발생시킨다.이 합성은 분자 내 이성분자 Peterson olefination을 통해 진행되며, 궁극적으로는 TMSO 그룹을 배출하고 질소 원자의 5-membed 링에서 pi-bond를 형성하는 제거 반응을 초래한다.그 후 케토에놀 토토머리즘이 발생하여 원하는 제품이 나오게 된다.
참조
- ^ a b Kurti, Laszlo; Czako, Barbara (2005). Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press. p. 270. ISBN 0-12-429785-4.
- ^ Houlihan, William; Parrino, Uike (7 May 1981). "Lithiation of N-(2-Alkylphenyl)alkanamides and Related Compounds. A Modified Madelung Indole Synthesis". Journal of Organic Chemistry. 46 (22): 4511–4515. doi:10.1021/jo00335a038.
- ^ Gribble, Gordon (23 March 2000). "Recent developments in indole ring synthesis—methodology and applications". Journal of the Chemical Society, Perkin Transactions 1. Perkin Transactions 1 (7): 5. doi:10.1039/A909834H.
- ^ Smith, Amos; Kanoh, Ishiyama; Minakawa, Rainier; Hartz, Cho; Cui, Moser (9 July 2003). "Tremorgenic Indole Alkaloids. The Total Synthesis of (-)-Penitrem D". Journal of the American Chemical Society. 125 (7): 8828–8837. doi:10.1021/ja034842k. PMID 12837093.
- ^ Chen; Xu Jin; Peng, Desseyn; Janssens, Heremans; Borghs, Geise (2 September 2003). "Synthesis, optical and electroluminescent properties of a novel Indacene". Synthetic Metals. 139 (2): 529–534. doi:10.1016/S0379-6779(03)00338-2.
- ^ Smith, Amos; Visnick; Haseltine; Sprengeler (1986). "Organometallic Reagents in Synthesis: A New Protocol for Construction of the Indole Nucleus". Tetrahedron. 42 (11): 2957–2969. doi:10.1016/S0040-4020(01)90586-1.